烟籽油成分分析及体内抗氧化作用研究
2016-09-26侯小东张怀宝张忠锋付秋娟毛新新杜咏梅
侯小东,张怀宝,张忠锋,梁 惠,傅 泳,付秋娟,毛新新,杜咏梅*
(1.中国农业科学院烟草研究所,青岛 266101;2.青岛大学公共卫生学院,青岛 266071)
烟籽油成分分析及体内抗氧化作用研究
侯小东1,张怀宝1,张忠锋1,梁 惠2,傅 泳2,付秋娟1,毛新新1,杜咏梅1*
(1.中国农业科学院烟草研究所,青岛 266101;2.青岛大学公共卫生学院,青岛 266071)
采用压榨的方法制取烟籽油,样品甲酯化和皂化后,GC-MS检测甲酯化产物和不皂化物。建立小鼠D-半乳糖氧化损伤模型,后给予不同剂量烟籽油进行干预,测定血清MDA,肝脏GSH、GSH-Px、蛋白质羰基的含量,评定其体内抗氧化功能。结果表明,烟籽油中包含2种饱和脂肪酸、3种不饱和脂肪酸、8种甾醇。不饱和脂肪酸的含量高达88.53%,总甾醇含量达到12.14 mg/g。抗氧化试验结果表明烟籽油能显著提高肝脏GSH含量和GSH-Px活性,降低血清MDA及肝脏蛋白质羰基的含量。烟籽油是一种很好的新食用油原料,且表现出显著抗氧化活性。
烟籽油;脂肪酸;甾醇;抗氧化活性
我国是植物油消费大国,根据美国农业部的资料统计2014年植物油消费量为3286万t。消费量的增长使得油料产品进口量逐年激增,贸易逆差逐渐扩大,据统计我国是大豆和豆油的第一大进口国;第二大棕榈油进口国;且从基本不进口菜籽和菜籽油的国家,逐渐成为全球第二大菜籽和菜籽油进口国,我国油料安全形势不容乐观。
烟籽油是通过压榨或提取方法从烟草种子中提取油料。研究发现烟籽含油量达到40%左右[1],且不饱和脂肪酸含量丰富[2]。相关毒理学研究表明,烟籽油无急性毒性、亚慢性毒性和遗传毒性,且有报道称烟籽油精炼后可以作为食用油[3]。我国是烟草种植大国,有悠久的种植历史,将烟草作为后备油料作物具有种质资源丰富,栽培种植技术成熟等优势。本试验对烟籽油的成分进行了分析并进行了体内抗氧化研究,为烟籽作为新食用油原料或天然抗氧化剂提供了参考。
1 材料与方法
1.1材料与试剂
1.1.1材料 烟草种子由中国农业科学院烟草研究所国家烟草种质资源平台提供。种植在中国农业科学院烟草研究所青岛即墨试验农场。植烟行距为1.2m,株距0.5m,植烟密度为1100株/667m2。烟籽成熟时收获,自然晾干,除去果皮,0~4 ℃冰箱保存,待用。
1.1.2试剂 丙二醛(MDA)测定试剂盒、蛋白质羰基测试盒、谷胱甘肽-过氧化物酶(GSH-PX)测试盒、还原性谷胱甘肽(GSH)测试盒由南京建成生物工程研究所出品。菜油甾醇、豆甾醇、β-谷甾醇标准品、内标物二十六烷由上海阿拉丁生化科技股份有限公司出品。氢氧化钠、甲醇、三氟化硼、异辛烷、正己烷、氢氧化钾、乙醇均为国药集团化学试剂有限公司生产,分析纯。
1.1.3试验用动物 昆明种健康小鼠,体重25~30 g,购自山东鲁抗医药集团有限公司。
1.1.4主要仪器与设备 ZYJ901榨油机,贝尔斯顿;BSA124S-CW电子天平,赛多利斯;7890A-5975C气象色谱/质谱联用仪,TDZ5-WS离心机,湖南湘仪仪器开发有限公司;RE-3000旋转蒸发仪,上海亚荣生化仪器厂;DHG-2240A电烘箱,杭州蓝天化验仪器厂。
1.2方法
1.2.1烟籽油榨取 通过榨油机榨取烟籽,出油粗料3000 r/min离心10 min,取上层油料过滤,氮气保护下4 ℃保存。
1.2.2烟籽油成分分析 (1)烟籽油脂肪酸组成测定:参照GB/T 17376—2008脂肪酸甲酯的制备[4],对烟籽油进行甲酯化,GC/MS(Agilent)测定。仪器条件为:色谱柱:Agilent 19091F-413FFAP,30 m ×320 μm×0.25 μm,载气为氦气,流速1.5 mL/min,进样口温度220 ℃,分流模式进样,进样量1 μL,分流比20:1,色谱柱温度:起始温度140 ℃保持1 min,然后以8 ℃/min升至200 ℃,保持4 min,离子源能量70 eV,温度230 ℃,四级杆温度150 ℃,面积归一化法计算不同脂肪酸的相对含量。
(2)参照GB/T 5535.2—2008动植物油脂不皂化物测定[5],对烟籽油进行皂化,皂化完成后,用GC/MS测定不皂化物中的甾醇。仪器条件为:色谱柱:HP-MS,30 m×250 μm×0.25 μm,载气为氦气,流速1.2 mL/min,进样口温度280 ℃,分流模式进样,进样量 1 μL,分流比 10:1,色谱柱起始温度210 ℃,保持3 min,然后以15 ℃/min升至280 ℃,保持20 min,离子源能量70 eV,温度230 ℃,四级杆温度150 ℃,根据样品NIST谱库检索结果以及标准品和样品色谱峰保留时间对照进行定性,内标法定量。
1.2.3烟籽油体内抗氧化活性 (1)试验方法 试验动物在湿度40%~70%,温度20~24 ℃,饲养3 d以适应环境(青岛大学医学院SPF级动物实验室)。除空白对照组外,其余动物用D-半乳糖40 mg~1.2 g/kg颈背部皮下注射造模,注射量为 0.1 mL/10g,每日1次,连续造模6周,取血测MDA,按MDA水平分组。随机分为1个空白对照组、1个模型对照组和烟籽油高、中、低剂量组。烟籽油各剂量组经口给予2.5、5、10 g/kg烟籽油灌胃,空白组及模型对照组给予2.5 g/kg生理盐水灌胃,在给受试各受试物的同时,模型对照组和各剂量组继续给予相同剂量D-半乳糖颈背部皮下注射,连续给药30 d[6]。
(2)样本采集及指标检测30 d后,于末次禁食不禁水12 h,摘眼球取血。取血后,迅速解剖取肝脏,称重后制成10%肝匀浆,3500 r/min离心10 min取上清待测。全血MDA及肝脏GSH-PX、SOD及蛋白质羧基的含量严格按照试剂盒说明操作。
(3)用SPSS 17.0统计学软件对试验数据进行处理,采用单因素方差分析、卡方检验和 q检验,所有试验数据均以(±S)表示,以P<0.05为有统计学意义。
2 结 果
2.1烟籽油成分分析
2.1.1脂肪酸 烟籽油中脂肪酸相对含量检测结果如图1、表1所示,烟籽油中饱和脂肪酸主要包括棕榈酸(7.71%)和硬脂酸(2.57%),总饱和脂肪酸相对质量分数为10.28%;不饱和脂肪酸主要包括油酸(12.42%)、亚油酸(75.36%)和亚麻酸(0.75%),总不饱和脂肪酸相对质量分数为89.38%。烟籽油的不饱和脂肪酸含量丰富,在所检测9种初榨油中仅次于核桃油(92.26%),与葡萄籽油相似(89.83%),较其他初榨油不饱和脂肪酸的含量高。烟籽油中亚油酸相对含量与葡萄籽油(75.57%)相当,远高于其他种子油的亚油酸的含量;油酸相对含量低于其他种子油;亚麻酸的相对含量与葡萄籽油(0.84%)相似,较茶油(-)、橄榄油(0.46%)、花生油(-)、玉米油(0.27%)的含量高,而远低于大豆油(6.15%)、核桃油(9.47%)、亚麻籽油(55.20%)。
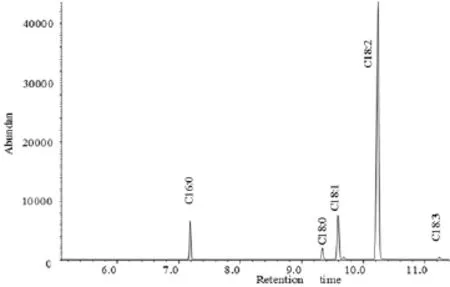
图1 烟籽油中脂肪酸色谱图Fig. 1 GC-MS chromatogram of fatty acids in tobacco seed oil
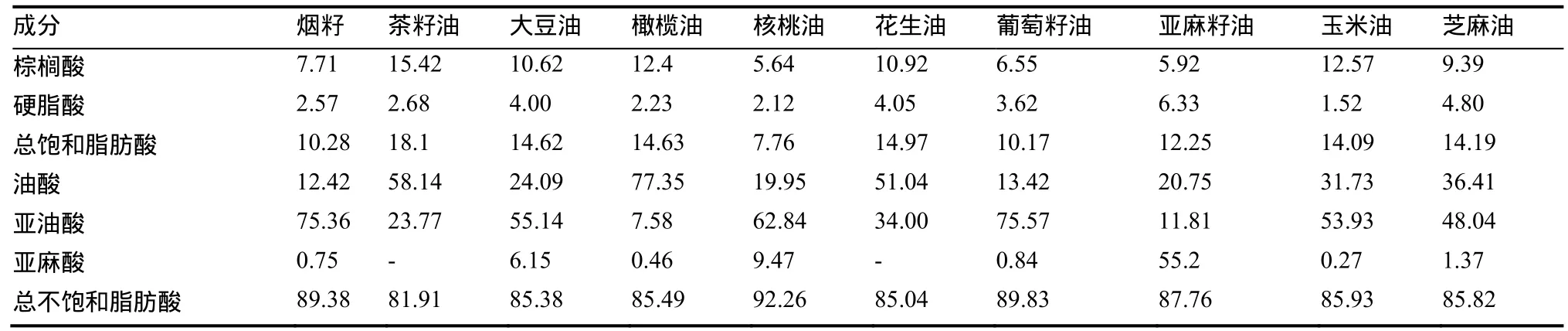
表1 烟籽油脂肪酸组成 %Table 1 The components of the fatty acids in tobacco seed oil %
2.1.2甾醇 如表2、图2所示,烟籽油中甾醇种类丰富,包括胆甾醇(0.3 mg/g)、菜油甾醇(0.57 mg/g)、4-甲基-7-烯胆甾烷醇(0.43 mg/g)、豆甾醇(0.63 mg/g)、β-谷甾醇(3.68 mg/g)、岩藻甾醇(2.09 mg/g)、环阿屯醇(2.65 mg/g)和α 1-谷甾醇(1.78 mg/g),总甾醇含量为12.14 mg/g,高于初榨玉米油(8.24 mg/g),远高于其他的初榨油的含量,与报道米糠油的含量[7]相当。烟籽油中含量最高的甾醇为β-谷甾醇,较初榨玉米油低(5 mg/g),远高于其他油。烟籽油中烟藻甾醇、环阿屯醇、α1-谷甾醇含量也较高,远高于其他初榨油。烟籽油中含有少量胆甾醇(0.31 mg/g),其他初榨油没有检测到。

表2 烟籽油植物甾醇组成 mg/gTable 2 The components of sterols in tobacco seed oil mg/g

图2 烟籽油中甾醇色谱图Fig. 2 GC-MS chromatogram of sterols in tobacco seed oil
2.2烟籽油体内抗氧化作用
2.2.1烟籽油对小鼠血清MDA含量的影响 对小鼠血清MDA含量检测结果如表3所示,3个烟籽油组 MDA含量与模型对照组相比,均显著降低(P<0.05),而与空白对照相当(P>0.05)。MDA是氧自由基损伤组织或细胞导致脂质过氧化的代谢产物,是衡量机体自由基代谢的敏感指标,测定体内MDA含量能客观地反映机体产生自由基,给予小鼠烟籽油后,血清中MD A含量降低,说明烟籽油可以减少细胞膜脂质过氧化[8]。
2.2.2烟籽油对小鼠肝脏 GSH含量和 GSH-PX活性影响 小鼠肝脏GSH含量和GSH-PX活性检测如表3所示,3个烟籽油组GSH的含量,GSH-PX的活性较模型对照组显著升高(P<0.05),而与空白对照组相当(P>0.05)。GSH是机体内一种重要抗氧化物质,其在谷胱甘肽过氧化物酶(GSH-PX)作用下变为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原成无毒的羟基化合物,同时促进 H2O2的分解。给氧化损伤小鼠烟籽油后,肝脏GSH-PX的活性提高,GSH含量也提高,说明烟籽油能够提高肝脏 GSH含量及GSH-PX的活性,增强机体清除自由基能力[9]。
2.2.3烟籽油对小鼠肝脏蛋白质羰基含量的影响小鼠肝脏蛋白质羰基含量检测结果如表3所示,中高剂量烟籽油小鼠肝脏蛋白质羰基含量较模型对照组显著降低(P<0.05),与空白对照相当(P>0.05),低剂量组小鼠肝脏蛋白质羰基含量与模型对照相当(P>0.05)。蛋白质羰基是蛋白质分子被自由基氧化修饰产物,测定羰基含量可判断蛋白质是否被氧化损伤。给予氧化损伤小鼠烟籽油后,肝脏蛋白质羰基含量降低,说明烟籽油可以减少蛋白质被自由基或活性氧氧化损伤[10]。

表3 烟籽油对D-半乳糖氧化损伤小鼠MDA、GSH-PX、还原型谷胱甘肽及蛋白质羰基水平的影响(x±s)Table 3 Changes of MDA, GSH-PX, GSH and protein carbonyl concentration in different groups of mice
3 讨 论
脂肪酸是植物油的主要成分,是植物油优劣的决定因素。植物油中饱和脂肪酸含量越高,营养价值越低;不饱和脂肪酸中油酸含量越高,且含有一定比例的亚油酸与亚麻酸,营养价值越高。目前市场上几种营养价值较高的食用油饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)的比值分别为:核桃油1:2.6:9.6;米糠油1:2.5:3.2;油茶籽油1:7.4:1.3[11]。烟籽油三者比例为1:1.2:7.4,与检测和报道的葡萄籽油[12]的脂肪酸构成比例相似,营养价值较高。研究表明不饱和脂肪酸,特别是多不饱和脂肪酸(PUFA)包括亚油酸、亚麻酸,具有一定体内抗氧化作用。杨小军等[13]研究发现,PUFA对肉仔鸡抗氧化指标有一定影响,日粮中添加鱼油和玉米油后使21日龄肉仔鸡脾脏中SOD活性得到提高。Prescott等[14]研究发现,孕妇食用PUFA可降低婴儿氧化应激反应。本研究发现烟草籽油对D-半乳糖氧化损伤的小鼠具有保护作用,具有较好抗氧化效果,其抗氧化作用与烟籽油中不饱和脂肪酸含量较高有直接关系。
植物甾醇是植物油中一种重要营养物质,研究发现植物甾醇具有多项生理功能,β-谷甾醇具有抗炎、降低胆固醇等作用,并可以作为化妆品的乳化剂[15];岩藻甾醇具有很强的抗氧化性和辅助抗氧化性,且具有诱导人早幼粒白血病HL-60细胞凋亡作用[16],环阿屯醇为其他植物甾醇合成过程中的前体物;其他甾醇大多有抗氧化、降血脂作用[17]。目前报道的植物甾醇最高的植物油为米糠油,而烟籽油植物甾醇含量为12.14 mg/g,与米糠油相当,高于目前植物甾醇提取主要原料—玉米,其油中植物甾醇含量为10.21 mg/g[18]。植物甾醇具有较强抗氧化活性,赵雁武等[19]研究发现苹果籽油中植物甾醇对DPPH·、OH·、O2-·具有明显清除作用。李万林等[20]研究发现大豆油粗甾醇具有清除羟自由基(·OH)的作用,且随质量浓度增加而增强。本研究发现烟籽油中的植物甾醇含量极其丰富,而高含量的植物甾醇将表现出较强的抗氧化活性。
4 结 论
烟籽油不饱和脂肪酸的含量丰富,相对含量达到88.53%,不饱和脂肪酸构成与葡萄籽油相似;油中甾醇种类繁多,总甾醇含量达到12.14 mg/g,与报道米糠油的含量相当,远高于其他油类。烟籽油对D-半乳糖氧化损伤的小鼠具有保护作用,可以显著提高D-半乳糖氧化损伤小鼠肝脏GSH的浓度和GSH-PX活性,降低血清MDA和肝脏蛋白质羰基浓度,具有良好的体内抗氧化活性。
[1] Rao P U. Nutrient composition of some less-familiar oil seeds [J]. Food Chemistry, 1994, 50(94): 379-382.
[2] Riemenschneider R W, Speck R M, Beinhart E G. Analysis and fatty acid composition of tobacco seed oils [J]. Oil Soap, 1945, 22(5): 120-122.
[3] Mattil K F, Norris F A, Swern D. Bailey’s Industrial Oil and Fat Products, 3rd edition[S]. New York: Interscience Publishers, 1964: 213.
[4] 国家粮食局. GB/T 17376—2008 动植物油脂 脂肪酸甲酯的制备[S]. 北京:中国标准出版社,2008.
[5] 国家粮食局. GB/T 5535.2—2008 动植物油脂 不皂化物测定[S]. 北京:中国标准出版社,2008.
[6] 秦红兵,杨朝晔,范忆江,等. D-半乳糖诱导衰老小鼠模型的建立与评价[J]. 中国组织工程研究与临床康复,2009,13(7):1275-1278.
[7] Adhikari P, Hu P. Enzymatic and chemical interesterification of rice bran oil, sheaolein, and palm stearin and comparative study of their physicochemical properties [J]. Journal of Food Science, 2012, 77(12): 1285-1292.
[8] 丁红秀,高荫榆,晁红娟,等. 毛竹叶多糖体内抗氧化作用研究[J]. 食品科学,2008,29(5):427-430.
[9] 葛霞,陈婷婷,蔡教英,等. 青钱柳多糖抗氧化活性的研究[J]. 中国食品学报,2011,11(5):59-64.
[10] 文镜,张春华,董雨,等. 蛋白质羰基含量与蛋白质氧化损伤[J]. 食品科学,2003,24(10):153-157.
[11] 唐永秀,易国勤. 食用植物油的营养和食品安全的几个问题[J]. 应用预防医学,2006,12(3):185-188.
[12] Sabir A, Unver A, Kara Z. The fatty acid and tocopherol constituents of the seed oil extracted from 21 grape varieties (Vitis spp.)[J]. Journal of the Science of Food and Agriculture, 2012, 92: 1982-1987.
[13] 杨小军,贺喜,何丽霞,等. 日粮多不饱和脂肪酸对肉仔鸡抗氧化指标的影响[J]. 动物营养学报,2008,20 (3):299-304.
[14] Prescott S L, Dunstan J A. Prenatal fatty acid status and immune development: The path ways and the evidence[J]. Lipids, 2007, 42: 801-810.
[15] 左玉. 植物甾醇研究与应用[J]. 粮食与油脂,2012,25 (7):1-4.
[16] 李盈,宋冬雪,汲晨锋,等. 岩藻甾醇诱导人早幼粒白血病HL-60细胞凋亡[J]. 哈尔滨商业大学学报:自然科学版,2011,27(6):788-793.
[17] 张喜春,韩振海,Х о д ж а й о в а Л Т,等. 植物体内甾醇的合成和生理作用[J]. 植物生理学通讯,2001,37(5):452-457.
[18] 方涛,杜雁冰,刘纪湘,等. 玉米油中植物甾醇的检测方法研究[J]. 粮食与食品工业,2015,22(2):90-93.
[19] 赵雁武,王宪伟,黄滢璋,等. 苹果籽油中植物甾醇抗氧化活性研究[J]. 西北农林科技大学学报:自然科学版,2012,40(9):221-226.
[20] 李万林,钟姣姣,冯巩,等. 大豆油中植物甾醇提取工艺及抗氧化活性研究[J]. 大豆科学,2014,33(5):731-734.
Analysis of Tobacco Seed Oil and Its Antioxidant Activities in vivo
HOU Xiaodong1, ZHANG Huaibao1, ZHANG Zhongfeng1, LIANG Hui2,FU Yong2, FU Qiujuan1, MAO Xinxin1, DU Yongmei1*
(1. Institute of Tobacco Research of CAAS, Qingdao 266101, China; 2. School of Public Health Qingdao University,Qingdao 266071, China)
The oil was prepared by screw press. The sample was methyl-esterificated and saponificated, and then was analyzed by GC-MS. The aging model of mice made by D-galactose was established, and then was fed with tobacco seed oil. The level of MDA in the blood, the levels of GSH and protein carbonylation and the activities of GSH-Px in the liver were measured. The results showed that the tobacco seed oil contained 2 saturated fatty acids, 3 unsaturated fatty acids, 8 sterols and squalene. UFA in the oil was as high as 88.53%, total sterol content was 12.14mg/g and squalene content was 0.24 mg/g. The tobacco seed oil significantly decreased MDA content in the blood and protein carbonyl content in the liver, and increased GSH content and GSH-Px activities in the liver. Our conclusion is that tobacco seed oil could be a very good raw material of edible oil, and has significant antioxidant activities.
tobacco seed oil; fatty acid; sterol; squalene; antioxidant activity
TS41+1
1007-5119(2016)04-0080-05
10.13496/j.issn.1007-5119.2016.04.014
侯小东,硕士,助理研究员,主要从事植物功能成分研究。E-mail:houxiaodong@caas.cn。*通信作者,E-mail:duyongmei@caas.cn
2016-01-19
2016-06-27
