小反刍兽疫病毒野毒与疫苗毒双重荧光RT-PCR鉴别检测方法的建立
2016-09-26何世成邹玖零王卫国王昌建唐小明鲁杏华邱立新
何世成,邹玖零,王卫国,王昌建,唐小明,林 源,鲁杏华,邱立新
(1.湖南省动物疫病预防控制中心,长沙 410014;2.永州市动物疫病预防控制中心,永州 425000)
·研究论文·
小反刍兽疫病毒野毒与疫苗毒双重荧光RT-PCR鉴别检测方法的建立
何世成1,邹玖零2,王卫国1,王昌建1,唐小明1,林 源1,鲁杏华1,邱立新1
(1.湖南省动物疫病预防控制中心,长沙 410014;2.永州市动物疫病预防控制中心,永州 425000)
对GenBank中的小反刍兽疫野毒(Peste des petits ruminants virus,PPRV)及疫苗毒株的基因序列进行分析,设计两对引物和两条特异探针,建立小反刍兽疫病毒野毒与疫苗毒株的双重荧光RT-PCR鉴别检测方法。特异性检测表明,建立的双重荧光RT-PCR方法,可特异检测野毒(FAM通道)和疫苗毒(VIC通道)。灵敏度实验表明,FAM通道可检测到10-5稀释度的RNA (3.576 ng/mL),VIC通道可检测到10-3稀释度的RNA(27.6 ng/mL)。重复性实验表明,该双重荧光RT-PCR方法重复性较好。用建立的二重荧光RT-PCR方法对20份组织样品进行检测,结果显示,该方法可以有效区分野毒和疫苗毒株,且野毒检测结果与实验室确诊阳性结果一致,可以用于临床检测。
小反刍兽疫病毒;野毒;疫苗毒;荧光RT-PCR;鉴别
小反刍兽疫(Peste des petits ruminants,PPR)是一种烈性、高度接触性传染病,该病危害严重,是需要采取强制预防、控制、封锁、扑杀的Ⅰ类动物疾病[1]。PPR由副粘病毒科、麻疹病毒属的小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起,主要感染小反刍兽,特别是绵羊和山羊,不感染人。PPR 可通过多种方式传播,排泄物、污染物、气溶胶等都可以成为传染源[2],发病率和死亡率分别可达到100%和90%,若继发感染其他疾病,死亡率可达到100%[3]。小反刍兽疫目前主要流行于非洲中西部、阿拉伯半岛、中东及南亚次大陆等。
PPRV是不分节段的单股负链RNA病毒,已公布的疫苗株长度为15 948 bp,编码8种蛋白[4,5]。根据PPRV F、H、N基因的序列变异情况,将其分为4个基因群[6],分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ型,我国流行的毒株均为Ⅳ型。目前该病毒仅有1个血清型。PPR主要通过疫苗免疫进行预防,而随着疫苗免疫的大面积推广运用,仅依靠血清学检测方法及通用型病原学检测方法不足于应对临床疫病诊断。目前关于小反刍兽疫野毒及疫苗毒株的相关鉴别诊断较少,因此有必要建立一种双重荧光RT-PCR方法,用以鉴别诊断小反刍兽疫野毒株与疫苗毒株。本研究设计了引物及探针,建立了可同时检测野毒和疫苗两种核酸的双重荧光RT-PCR方法。
1 材料与方法
1.1样品标准品 PPR临床阳性样品(PPR野毒)为经国家外来动物疫病研究中心确诊的病例样品;口蹄疫病毒(Foot and mouth disease virus,FMDV)标准品为灭活后的FMDV培养物,来自兰州兽医研究所;PPR弱毒苗(Nigeria75/1)为新疆天康畜牧生物技术股份有限公司产品;犬瘟热疫苗为法国梅里亚公司产品;羊口疮疫苗为山东泰丰生物技术有限公司产品。
1.2主要设备和试剂 ABI7500实时荧光PCR仪购自ABI公司;美国NanoVue超微量紫外分光光度计购自GE公司;核酸提取仪和核酸提取试剂盒(磁珠法)购自天隆科技公司;One Step PrimeScript RT-PCR Kit 购自TaKaRa公司;比较用PPRV荧光RT-PCR检测商用试剂盒分别来自北京世纪元亨动物防疫技术有限公司(PPR20150626P)和国家外来动物疫病研究中心(PPR20150612H)。
1.3临床样品 来自于湖南各市州的20份临床组织样品。
1.4病毒RNA提取 将组织样品及疫苗前处理后,用全自动核酸提取仪提取野毒和疫苗毒RNA,紫外分光光度计测RNA的浓度和纯度。将已知浓度的RNA,依次进行10倍梯度稀释,共8个梯度,-70℃保存备用。
1.5引物和探针的设计和合成 将基因库中已报道的PPR中国野毒株与疫苗毒株Nigeria75/1的基因序列进行分析比较结果见表1。分别选择野毒株和疫苗株的保守序列设计荧光定量RT-PCR引物和Taqman探针,Blast比对引物和探针特异性后,送由上海生工合成并标记,具体序列及扩增长度见表2。
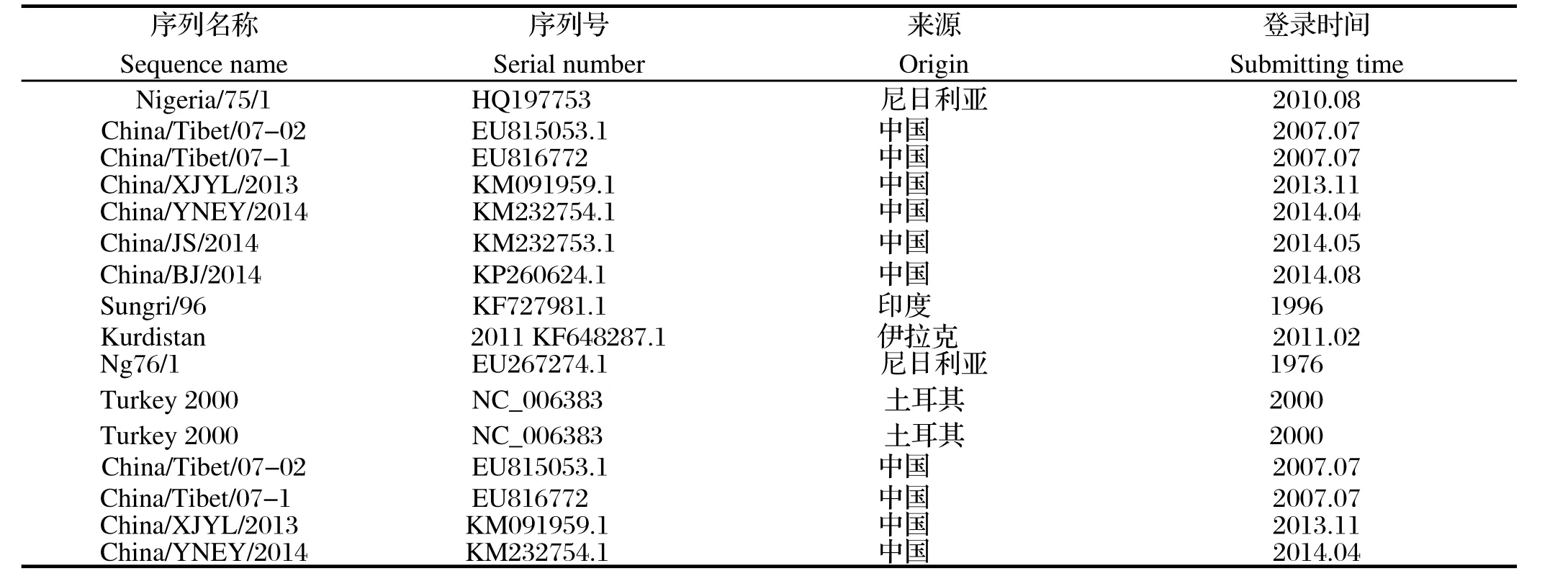
表1 本研究所用PPRV基因序列Table 1 Gene sequences of PPRV in this study

表2 荧光定量RT-PCR引物和探针序列Table 2 Primers and probes sequence of fl uorescence quantitative RT-PCR
1.6荧光定量RT-PCR检测方法的建立 参照TaKaRa One Step PrimeScript RT-PCR Kit说明书,以提取的2种RNA为模板在进行单项RT-PCR检测方法的基础上,将两种方法组装,建立双重荧光定量RT-PCR反应。反应体系:2×buffer 10 μL、ExTaqTMHS 0.4 μL、PrimeScript RT Enzyme MixⅡ0.4 μL、F-F2 (20 μmol/L)0.2 μL、F-R2(20 μmol/L)0.2 μL、F-P2(20 μmol/L)0.4 μL、N-F(20 μmol/ L)0.2 μL、N-R(20 μmol/L)0.2 μL、N-P(20 μmol/L)0.4 μL、50×ROX 0.4 μL、RNA模板各3 μL,补水至20 μL。反应条件:42℃,5 min;95℃,10 s;95℃,5 s,60℃,34 s,40个循环。
1.6.1反应条件优化 参照TaKaRa One Step Prime Script RT-PCR Kit说明书,以提取的RNA为模板进行双重荧光定量RT-PCR反应,对引物和探针浓度进行方阵实验筛选最优浓度。疫苗引物和探针浓度为:4、6、8 pmol/μL,野毒引物和探针浓度:6、8、10 pmol/μL。
1.6.2敏感性试验 将10倍梯度稀释的两种RNA,自高到低依次作为模板进行双重荧光定量RT-PCR反应,设立空白阴性对照,确定该方法的最低检测浓度。
1.6.3重复性试验 选取10-1梯度PPRV野毒株RNA,100梯度PPRV疫苗株RNA,在同一次反应中每个样重复6次,进行重复性实验,设阴性对照,并统计变异系数。
1.6.4特异性实验 将分别提取的PPR野毒、PPR疫苗毒、口蹄疫病毒、犬瘟热疫苗毒及羊口疮疫苗毒核酸作为模板进行特异性实验,同时设立阴性对照。1.6.5 临床样品的检测 对来自湖南省部分地区20份临床疑似PPR组织样品,提取RNA,运用本研究建立的双重荧光定量RT-PCR方法进行检测,并与2种商用试剂盒检测结果进行比较。
2 结果
2.1反应体系的优化 结果表明,当疫苗引物为4 pmol/μL、探针为8 pmol/μL时,CT值最小;当野毒引物为8 pmol/μL、探针为10 pmol/μL时,有最小CT值和最佳扩增曲线。优化后的反应程序:2×buffer 10 μL、Ex TaqTM HS 0.4 μL、PrimeScript RT Enzyme MixⅡ 0.4μL、F-F2(20 μmol/L)0.2 μL(4 pmol/μL)、F-R2(20 μmol/ L)0.2μL(4 pmol/μL)、F-P2(20 μmol/L)0.4 μL(8 pmol/μL)、N-F(20 μmol/L)0.4 μL(8 pmol/μL)、N-R(20 μmol/L) 0.4 μL(8 pmol/μL)、N-P(20 μmol/L)0.5 μL(10 pmol/ μL)、50×ROX 0.4 μL、RNA模板各3 μL,补水至20 μL。反应条件:42℃,5 min;95℃,10 s;95℃,5 s,60℃,34 s,40个循环。
2.2敏感性试验 提取的PPR疫苗RNA,测得浓度为27.6 μg/mL,提取的PPR野毒RNA测得浓度为357.6 μg/mL,分别10倍梯度稀释(100~10-7)后进行荧光定量RT-PCR反应。结果表明该双重荧光RT-PCR方法,可以检测到疫苗株的最低稀释度为10-3,相当于27.6 ng/mL的RNA;检测野毒株的最低稀释度为10-5,相当于3.576 ng/mL总RNA(图1)。
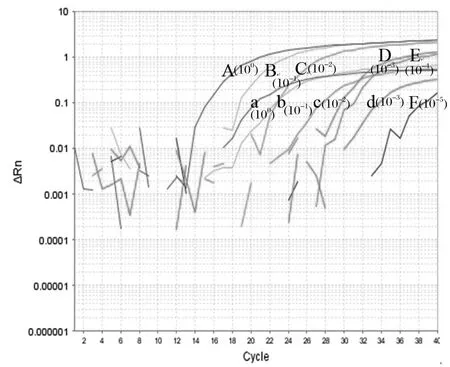
图1 双重荧光定量RT-PCR敏感性试验扩增曲线Fig. 1 Amplifi cation curve of sensitivity assay of dual fl uorescence RT-PCR
2.3重复性试验 阴性对照未出现特异性扩增,疫苗株变异系数为0.91%,野毒株变异系数0.38%,见表3,表明重复性很好,检测结果稳定、可靠。
2.4特异性试验 用建立的双重荧光定量RT-PCR方法对PPR野毒、PPR疫苗毒、口蹄疫病毒、犬瘟疫苗毒及羊口疮疫苗毒核酸进行检测,结果显示FAM通道只检出PPR野毒,VIC通道只对小反刍兽疫疫苗的检测出现特异性扩增曲线(图2),其他病毒及阴性对照的检测双通道均为阴性,表明本研究建立的方法特异性很好,可以用于PPR野毒和疫苗的鉴别诊断。
2.5临床样品的检测 采用建立的双重荧光RT-PCR方法与2种商用荧光RT-PCR检测试剂盒,对20份临床疑似PPR组织病料进行同时检测,结果显示,建立的双重荧光RT-PCR方法疫苗毒结果均为阴性,野毒检测结果有11个样品阳性,与2种商用的荧光RT-PCR检测试剂盒检测结果一致,符合率为100%。

表3 双重荧光定量RT-PCR重复性检测Table 3 Repetitive assay for dual fl uorescence RT-PCR
3 讨论
小反刍兽疫有4个基因型,1个血清型,我国主要流行的是Ⅳ系毒株[7],疫苗毒株也属于Ⅱ系。随着小反刍兽疫在我国的暴发和流行,控制小反刍兽疫在我国的传播应该从传染源、传播途径、易感动物三方面入手,其中保护易感动物的最有效措施是注射弱毒疫苗[8]。然而,疫苗的使用势必会使小反刍兽疫的流行病学调查、感染监测和评估变得愈发困难,因此有必要建立一种区分小反刍兽疫野毒和疫苗毒株的方法。
现有的小反刍兽疫诊断方法,如病毒分离、ELISA、RT-PCR等虽然能够检测出小反刍兽疫病毒,但在敏感性、特异性、时效性和结果判断等方面存在一定缺陷,同时也不能准确、特异的区别野毒株和疫苗株[9-11]。本研究在单一荧光RT-PCR的基础上,建立了鉴别诊断小反刍兽疫野毒和疫苗株的双重荧光RT-PCR方法。该方法特异性强、重复性好、灵敏度较高,可以同时检测到2种病毒,不仅节省了试剂和耗材,也缩短了检测过程,简化了实验流程。
在进行多重荧光RT-PCR反应时,因为多对引物和多种探针的混合存在,势必相互之间会发生一定的影响,因此需特别注意与反应有关的一些因素,包括引物和探针的设计、引物探针的浓度、退火温度等。首先,引物不能过长,一般20 bp左右,避免造成引物间相互缠绕,影响反应进行;其次,引物需具有特异性,且多重反应中各引物之间Tm值差距限制在2℃范围内,避免非特异性扩增,同时保证同一体系中各引物扩增效率。本研究设计的2对特异性引物的Tm值相差仅0.8℃,使得在同样退火温度下各目的片段都能够获得较好的扩增效率。在实验中还要注意引物浓度,引物浓度过低则不能扩增出特异的目的基因,引物浓度过高会抑制多重RTPCR反应[12]。探针要高度特异,纯度要高且稳定性要好。
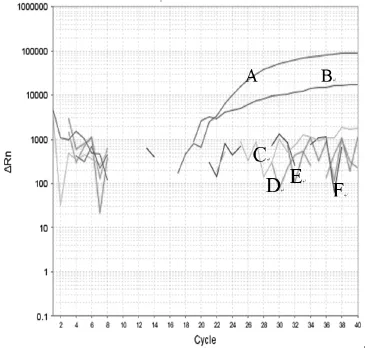
图2 双重荧光定量PCR特异性试验扩增曲线Fig. 2 Amplifi cation curve of specifi city assay of dual fl uorescence RT-PCR
建立的双重荧光RT-PCR对临床样品的检测中,野毒(FAM)通道有11个阳性,疫苗毒(VIC)通道无特异扩增,结合流行病学调查,该样品未注射疫苗,VIC通道应该为阴性,且与北京世纪元亨动物防疫技术有限公司和国家外来动物疫病研究中心2种商品化试剂盒的检测结果一致,说明检测结果是准确的。2种商品化试剂盒是标准化批量产品,各种组分已提前混合保存,配制过程方便快捷,质量较稳定,而本研究建立的双重荧光RT-PCR方法试剂组分较多,使用时的配制过程较繁琐,较易出错和受到外界干扰,但是该方法比2种商品化试剂盒的检测时间短,在1 h内就可以得到检测结果,成本也较低,且可以鉴别检测野毒和疫苗毒,在临床诊断中更适用、更便捷。
[1] Diallo A. Control of peste des petits ruminants and poverty alleviation[J]. Vet Med B Infect Dis Vet Public Health, 2006, 53(S1): 11-13 .
[2] 赵文姬. 小反刍兽疫病毒荧光定量RT-PCR检测方法的建立及F基因的分子特性研究[D]. 扬州: 扬州大学, 2009.
[3] Pronab D, Sreenivasa B P, Thomas B, et al. Recent epidemiology of peste des petits ruminants virus[J]. Vet Microbiol, 2002, 88(2): 153-159.
[4] 井波, 赵玉军, 袁远. 小反刍兽疫病毒研究进展[J]. 畜牧与兽医, 2004, 36(6): 40-43.
[5] 刘玉洪, 徐自忠, 花裙义, 等.小反刍兽疫病毒分子生物学研究进展[J]. 动物医学进展, 2006, 27(12): 1-6.
[6] Meyer G, Diallo A. The nucleotide sequence of the fusion protein gene of the peste des petits ruminants virus : the long untranslated region in the 5'- end of the F- protein gene of morbilliviruses seem to be specific to each virus[J]. Virus Res, 1995, 37(1): 23- 35.
[7] Wang Z, Bao J. Peste des petits ruminants virus in Tibet,China[J]. Emerg Infect Dis, 2009, 15(2): 299-301.
[8] 南文金, 王清华, 吴晓东, 等. 小反刍兽疫病毒分子生物学与疫苗研究进展[J]. 中国动物检疫, 2009, (1): 62-65.
[9] Xin A G, Yang R B, Xiang W B . Pested espetits ruminants research[J]. Chin Prev Vet Med, 2003, 25(2): 152-154.
[10] Sumption K J, Aradom G, Libeau G, et al. Detection of peste des petits ruminants virus antigen in conjunctival smears of goats by indirect imunofluorescence[J]. Vet Rec, 1998, 142(16): 421-424.
[11] Choi K S , Nah J J, Choi C U, et al. Monoclonal antibodybased competitive ELISA for simultaneous detection of rinderpest virus and peste des petits ruminants virus antibodies[J]. Vet Microbiol, 2003, 96(1): 1-16.
[12] Henegariu O, Heerema N A, Dlouhy S R, et al. Multiplex PCR: critical parameters and step-by-step protocol[J]. Biotechniques, 1997, 23(3): 504-511.
DEVELOPMENT OF DUAL FLUORESCENCE RT-PCR FOR DIFFERENTIATION OF WILD STRAIN AND VACCINE STRAIN OF PESTE DES PETITS RUMINANTS VIRUS
HE Shi-cheng1, ZOU Jiu-ling2, WANG Wei-guo1, WANG Chang-jian1, TANG Xiao-ming1, LIN Yuan1,LU Xing-hua1, QIU Li-xin1
(1. Animal Disease Prevention and Control Center of Hunan Province, Changsha 410014, China; 2. Animal Disease Prevention and Control Center of Yongzhou, Yongzhou 425000, China)
Two pairs of primers and two specifi c probes were designed based on the genome sequences of wild isolates and vaccine strain of Peste des petits ruminants virus (PPRV) published in GenBank. Subsequently, a dual fl uorescence RT-PCR assay was developed for differentiation of PPRV wild isolates and vaccine strain. The specifi city testing indicated that the dual fl uorescence RT-PCR assay revealed difference between wild isolate (FAM) and vaccine strain (VIC). The sensitivity test showed that its detection limits were 10-5dilution degrees (3.576 ng/mL) RNA in FAM channel and 10-3dilution degrees RNA (27.6 ng/mL) in VIC channel. Additionally, 20 tissue samples were examined using the dual fl uorescent RT-PCR assay. The positive samples were confi rmed through other laboratory tests. The results demonstrated the reliability of the assay to differentiate vaccinated animals from fi eld infected animals.
Peste des petits ruminants virus; wild isolate; vaccine strain; fl uorescence RT-PCR; differentiation
S852.659.5
A
1674-6422(2016)04-0031-05
2016-01-12
何世成,男,硕士,高级兽医师,主要从事动物疾病防控工作
邹玖零,E-mail:849108910@qq.com
