18氟-氟脱氧葡萄糖微型正电子发射断层扫描心肌代谢显像技术在大鼠扩张型心肌病模型评价中的应用
2016-09-26沈丽娟陆曙周永华邢清敏李岚杨敏周春刚
沈丽娟,陆曙,周永华,邢清敏,李岚,杨敏,周春刚
18氟-氟脱氧葡萄糖微型正电子发射断层扫描心肌代谢显像技术在大鼠扩张型心肌病模型评价中的应用
沈丽娟,陆曙,周永华,邢清敏,李岚,杨敏,周春刚
目的:探讨18氟-氟脱氧葡萄糖(18F-FDG)微型正电子发射断层扫描(Micro-PET)心肌代谢显像技术在大鼠扩张型心肌病(DCM)模型评价中的应用价值。
方法:选用雄性SD大鼠12只,随机分为对照组(n=6)和DCM组(n=6),DCM组腹腔注射阿霉素1.0 mg/kg(生理盐水稀释至1.0 mg/ ml),2次/周,对照组腹腔注射等量生理盐水,用药6周,停药观察2周。造模前后行超声心动图检查;造模过程中记录大鼠体重的变化及死亡情况,造模后行18F-FDG Micro-PET检查、血浆B型利钠肽(BNP)水平检测。实验结束后处死大鼠,观察心肌组织病理变化。
结果:DCM组造模后死亡1只,其余大鼠经超声心动图及病理检查证实造模成功。DCM组18F-FDG标准摄取率较对照组降低[(1.23±0.55)vs(6.65±0.41),P<0.01];18F-FDG标准摄取率与左心室舒张末期内径(R=-0.709,P=0.015)、左心室收缩末期内径(R=-0.924,P=0.000)、血浆BNP水平(R=-0.948,P=0.000)呈负相关关系,与左心室射血分数(R=0.968,P=0.000)和短轴缩短率(R=0.863,P=0.001)呈正相关关系。
结论:18F-FDG Micro-PET心肌代谢显像技术结合超声心动图、生化检测及病理学观察,可以作为评价DCM模型检验方法;该方法为小动物实验研究提供了一种无创、连续的活体评价工具。关键词氟脱氧葡萄糖F18;正电子发射断层显像术;心肌病,扩张型;模型
Abstract
Objective:To explore the application of18F-fluorodeoxyglucose (FDG) micro- positron emission tomography (PET)myocardial metabolism imaging for evaluating dilated cardiomyopathy model (DCM) in experimental rats.
Methods:A total of 12 male SD rats were randomly divided into 2 groups: DCM group,the rats received intraperitoneal injection of adriamycin at 1.0 mg/kg twice per week and Control group,the rats received intraperitoneal injection of normal saline,all animals were treated for 6 weeks followed by 2 weeks observation. n=6 in each group. Echocardiography was performed at pre- and post-modeling,18F-FDG micro-PET myocardial metabolism imaging was conducted after modeling and plasma level of BNP was examined as well. Finally,the rats were scarified to observe the pathological changes of myocardial tissue.
Results:1 rat died in DCM group and the rest were with successful modeling confirmed by echocardiography and pathology. Compared with Control group,DCM group showed decreased standard uptake value of18F-FDG (1.23 ± 0.55)vs (6.65 ± 0.41),P<0.01; the standard uptake value of18F-FDG was negatively related to left ventricular end diastolicdiameter (LVEDD) (R=-0.709,P=0.015),LVESD (R=-0.924,P=0.000) and plasma level of BNP (R=-0.948,P=0.000),while positively related to LVEF (R=0.968,P=0.000) and fractional shortening (R=0.863,P=0.001).
Conclusion:18F-FDG micro-PET myocardial metabolism imaging combining echocardiography,biochemical and pathological examinations may evaluate DCM modeling in rats,which provide a non-invasive and intravital tool for small animal experiment.
Key words18F-Fluorodeoxyglucose; Positron emission tomography; Cardiomyopathy,dilated; Model
(Chinese Circulation Journal,2016,31:802.)
扩张型心肌病(DCM)是一种以单侧左心室、右心室或双侧心室腔扩大、心肌收缩能力障碍为特征的心肌病,其临床表现以进行性充血性心力衰竭、各种心律失常、血栓栓塞事件甚至猝死为基本特征[1]。DCM是多种因素作用引起心肌损害的最终结果,是导致心力衰竭的第三位原因及心脏移植最常见原因[2]。DCM的发病机制尚未完全阐明[3],临床缺乏有效的治疗手段,目前主要以对症治疗为主[4]。故目前针对DCM的研究热点集中在其发病机制及治疗方法上,因为大鼠饲养简便,造价相对较低,大鼠模型应用广泛。目前大鼠DCM模型模型的评价主要依赖于超声心动图及病理改变等方法,从分子水平无创性、动态地评价心肌代谢情况的影像学技术目前应用相对较少。
正电子发射断层扫描(PET)是用解剖形态学方式进行功能、代谢和受体显像的影像学诊断技术[5],是评估心肌存活的金标准[6]。PET心肌代谢显像是通过测定不同的示踪剂在心肌组织的糖代谢、脂肪酸代谢情况来评价心肌的活性[7]。18氟-氟脱氧葡萄糖(18F-FDG)是葡萄糖的类似物,因其特殊的分子结构及体内代谢过程,可以反映心肌摄取利用葡萄糖的功能状况以及探测心肌缺血,但主要用于测定心肌存活[6]。
本研究拟运用18F-FDG微型PET(Micro-PET)心肌代谢显像联合超声心动图及病理检测,评价大鼠扩张型心肌病模型,为小动物实验研究提供一种无创、连续的活体评价工具。
1 材料与方法
实验动物:选用12只健康8周龄雄性SD大鼠[由江苏省血吸虫病防治研究所动物中心购于北京维通利华,实验动物质量合格证:SCXK(京)2012-0001,体重250~280g]。
仪器设备:Inveon型Micro-PET扫描仪(德国SIMENS公司);Matrx VMR型麻醉机(美国MATRX公司);CURIEMENTOR 3型活度计(德国PTW公司);AS210型电子天平(德国Sartorius公司);飞利浦CX50超声诊断仪及12MHz超声探头(美国PHILIPS公司);BM450A全自动组织包埋机(常州派斯杰医疗设备有限公司);LeicaRM2235切片机(北京中仪光科科技发展有限公司);JEOL-JEM-1230透射电子显微镜(日本电子株式会社);Elx-800酶联免疫分析仪(美国BioTek公司)。
试剂:显像剂18F-FDG由无锡第四人民医院核医学科提供,产品经TLC法测定放化纯(RCP),使用95%乙腈作为展开剂,薄层层析硅胶板GF254作为载体,比移值0.427处为18F-FDG,放化纯大于99%。异氟烷麻醉剂(美国MinradInc公司);氯化三苯基四氮唑(美国sigma公司);水合氯醛(青岛宇龙海藻药业有限公司);酶联免疫吸附试验(ELISA)试剂盒(上海蓝基生物科技有限公司);苏木素伊红(HE)染色试剂盒(上海碧云天生物技术有限公司)。
DCM造模方法:12只雄性SD大鼠被随机分为对照组(n=6)和DCM组(n=6)。阿霉素诱导DCM大鼠模型的建立参照文献[8]进行:注射用盐酸阿霉素用生理盐水稀释成1mg/ml,予DCM组大鼠腹腔注射阿霉素1mg/(kg·次),2次/周,连续6周,共12次,总量12 mg/kg。每次根据大鼠体重调整阿霉素剂量。对照组根据大鼠体重腹腔注射1ml/kg生理盐水,2次/周,连续6周,停药观察2周。实验过程中观察两组大鼠的体重、一般情况和死亡情况。
超声心动图检查:造模前后均行超声心动图检查,大鼠称重,腹腔注射10%水合氯醛(3 ml/kg)麻醉,麻醉成功后将大鼠腹部朝上固定,左胸前部脱毛,将探头放置于大鼠胸骨旁,获得满意的左室长轴切面、心脏四腔切面和M型超声心动图,测量后获得大鼠左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室射血分数(LVEF)、短轴缩短率(FS)等数据。
18F-FDG Micro-PET显像:扫描前大鼠禁食12h,称重记录,尾静脉注射18F-FDG [剂量(250±50)μCi,注射体积约0.2ml] 60 min后,俯位固定在扫描床上,静态扫描10min。Micro PET扫描参数为:层厚0.78 mm,矩阵128×128,采集时间10 min,采集能窗350~650 kev。扫描采集结束后,将扫描的图像用OSEM 3D迭代重建,迭代2次,重建后利用西门子扫描仪自带数据处理软件ASIProVM勾画心肌为感兴趣区域(ROI),然后计算ROI的最大标准化摄取值(SUV)。SUV=局部感兴趣区放射性活度(MBq/ ml)/注射放射性活度(MBq)/体重(g)。
大鼠血液、心肌标本的采集:提前禁食12 h,常规酒精消毒,操作人员带好橡胶无菌手套,用手术剪沿腹中线剪开腹腔,充分暴露下腔静脉,采取血液。取血后处死,取出心脏,用生理盐水冲洗,滤纸吸干水分,沿冠状沟剪去心房,再沿室间隔剪去室间隔和右心室,获取左心室心肌。取一块多聚甲醛固定,用于HE染色;取一块戊二醛固定,用于电镜检查。
大鼠血清B型利钠肽(BNP)水平检测:将采集的血液用离心机离心,1 800 g,离心15 min,吸取上清液,储存于EP管中,于-70℃冰箱保存后统一用ELISA法按照说明书测定大鼠血浆BNP水平。
统计学方法:所有数据采用SPSS 21.0软件进行统计学分析。计量资料以±s表示;两样本组间比较采用两样本t检验;相关性分析采用Pearson’s相关分析。以P<0.05为差异有统计学意义。
2 结果
两组大鼠的一般情况及死亡率:DCM组大鼠毛发凌乱,无光泽,活动度差,与对照组相比进食减少,第3周开始体重出现下降,第5周又呈上升趋势。DCM组3只(50%)大鼠腹水形成,1只(16.7%)大鼠死亡;对照组大鼠毛发柔顺,有光泽,精神、活动度、进食如常,体重稳定增长,均无腹水形成,无死亡。
两组大鼠超声心动图检查结果比较(表1、图1):第8周时,DCM组大鼠LVEDD和LVESD均大于对照组,LVEF和FS均小于对照组,差异均有统计学意义(P均<0.05)。
两组大鼠18F-FDG Micro-PET显像结果比较(图2):对照组大鼠心肌完整,葡萄糖代谢正常,心肌摄取18F-FDG均匀,整体SUV值为6.65±0.41。DCM组大鼠心肌糖代谢异常,部分心肌摄取18F-FDG明显降低,整体SUV值为1.23±0.55,明显低于对照组,差异有统计学意义(P<0.01)。
表1 两组大鼠超声心动图检查结果比较(±s)

表1 两组大鼠超声心动图检查结果比较(±s)
注:LVEDD:左心室舒张末期内径;LVESD:左心室收缩末期内径;LVEF:左心室射血分数;FS:短轴缩短率;DCM:扩张型心肌病;与对照组比较*P<0.05
组别 只数 LVEDD (mm)LVESD (mm) LVEF (%) FS (%)对照组 6 5.29±0.16 2.35±0.23 88.84±1.34 55.74±3.89 DCM组 5 6.43±0.61* 4.15±0.42*70.12±6.96*38.71±1.03*
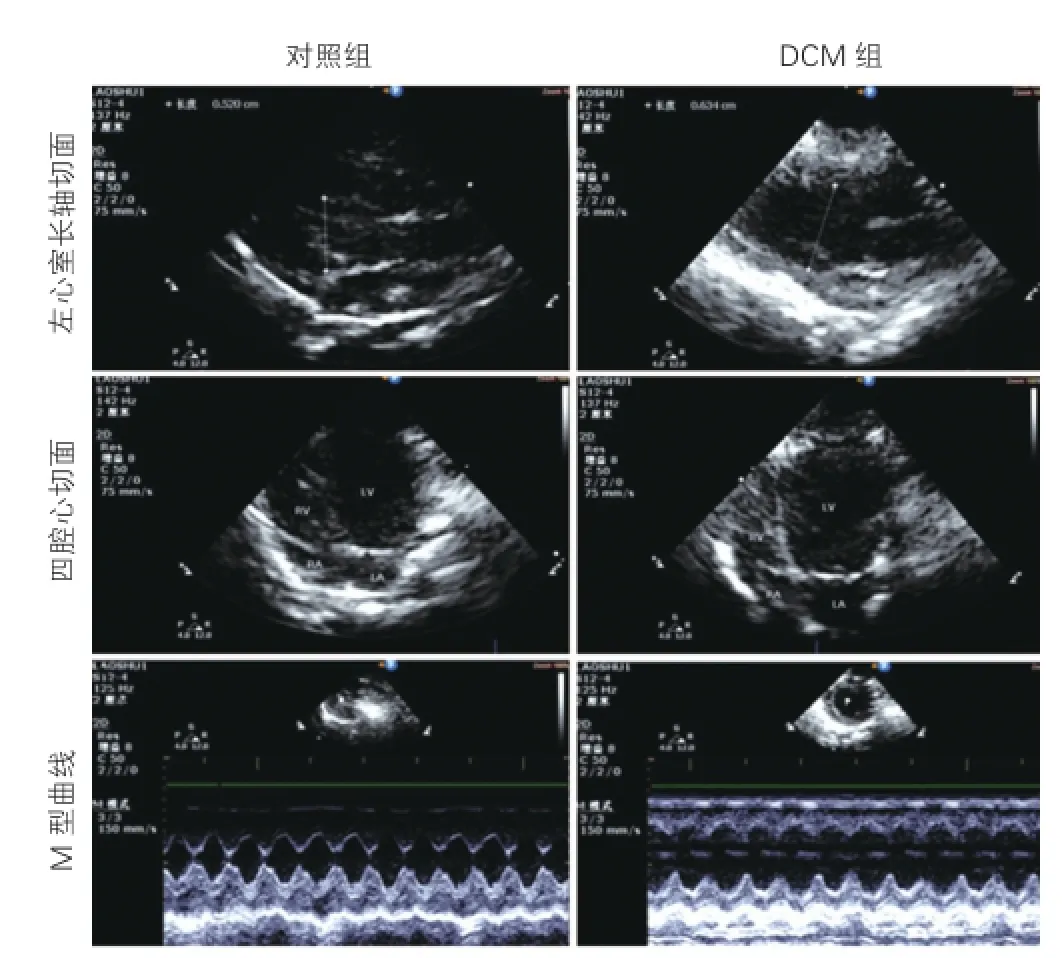
图1 两组大鼠超声心动图检查不同切面比较
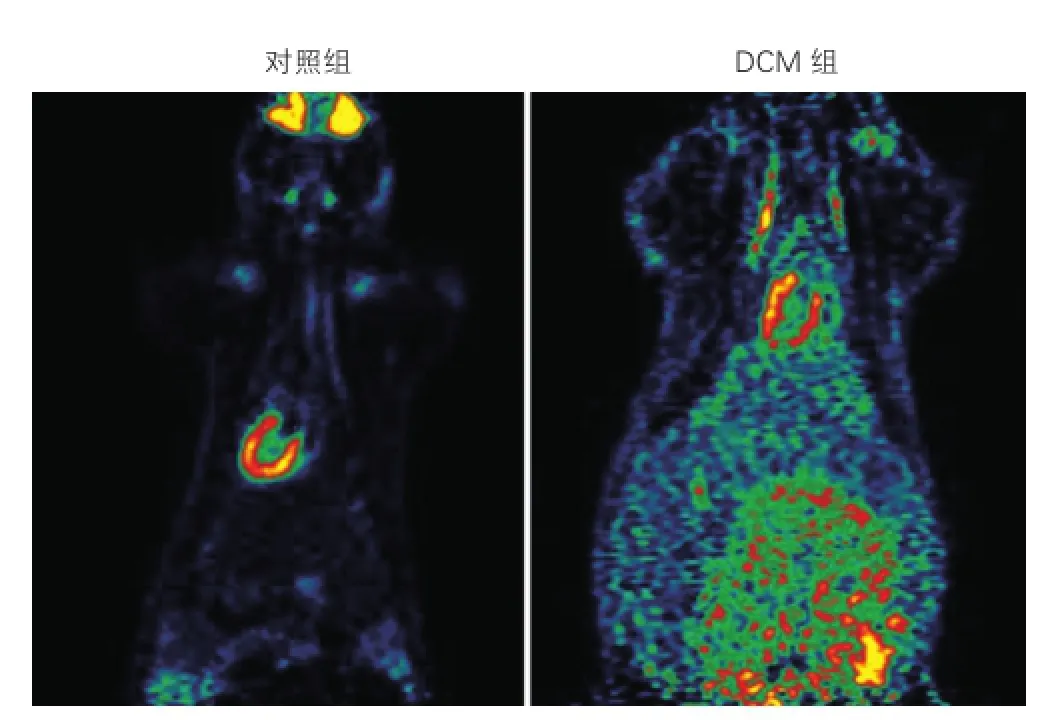
图2 两组大鼠18F-FDG Micro-PET显像图
两组大鼠血BNP水平比较:DCM组大鼠血浆BNP浓度明显高于对照组[(566.34±109.18)pg/ml vs(261.05±32.85)pg/ml,P<0.05]。
两组大鼠病理HE染色及电镜检查结果比较(图3):(1)HE染色:DCM组大鼠心肌细胞变性、坏死,心肌组织受损;细胞排列紊乱,组织间质纤维化,细胞间隙增宽,炎症细胞浸润,呈心肌病样改变。对照组大鼠心肌纤维无断裂,排列整齐,肌细胞胞质均匀丰富,无心肌细胞破坏;细胞排列整齐,无间质纤维化,细胞间隙正常。(2)电镜:DCM组心肌纤维断裂,线立体肿胀,空泡变性,嵴缺失。对照组心肌纤维排列整齐,线立体大小均匀,无肿胀,膜完整,内膜嵴正常。
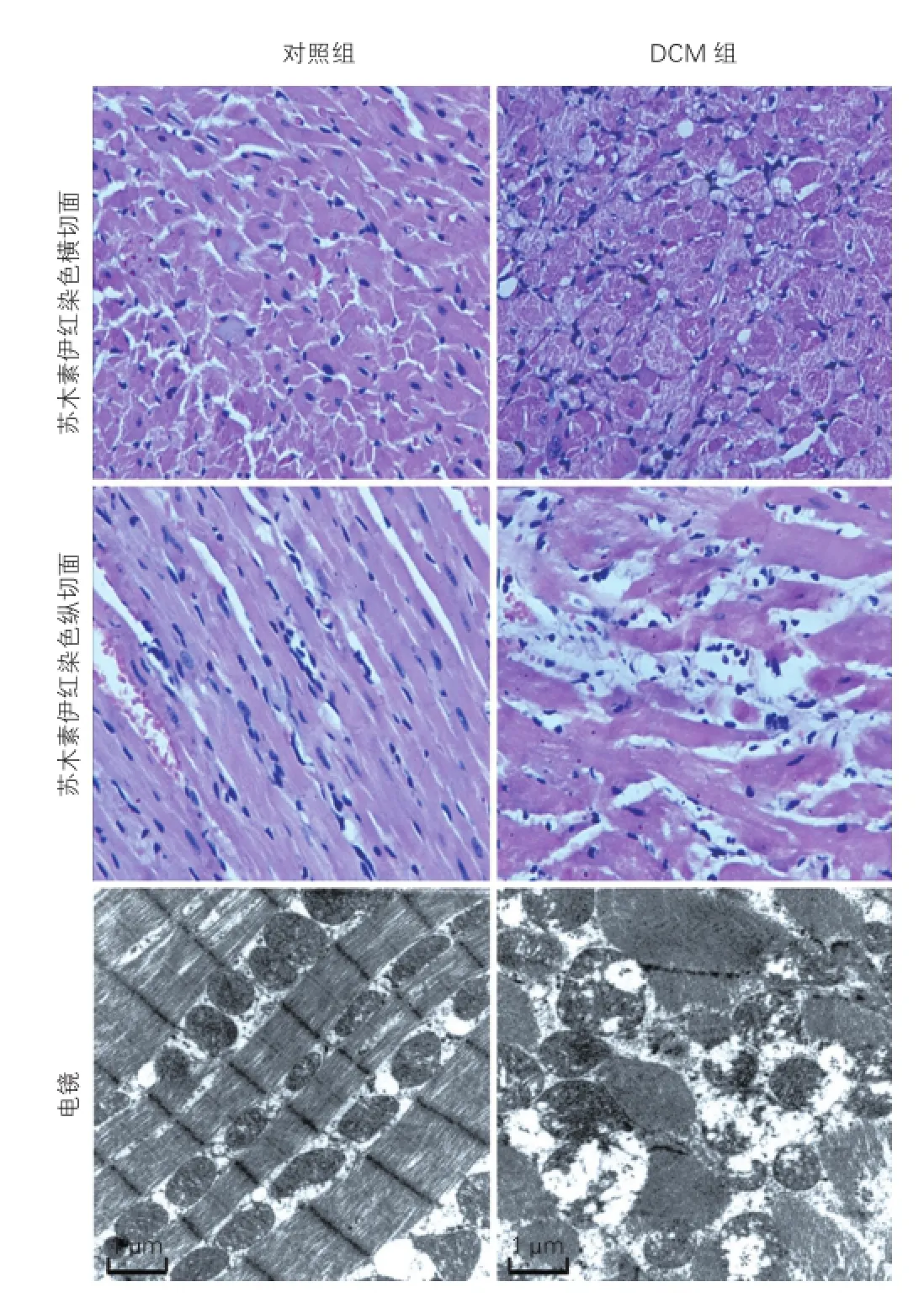
注:苏木素伊红染色:DCM组大鼠心肌细胞变性、坏死,心肌组织受损;细胞排列紊乱,组织间质纤维化,细胞间隙增宽,炎症细胞浸润,呈心肌病样改变。对照组大鼠心肌纤维无断裂,排列整齐,肌细胞胞质均匀丰富,无心肌细胞破坏;细胞排列整齐,无间质纤维化,细胞间隙正常。电镜:DCM组心肌纤维断裂,线立体肿胀,空泡变性,嵴缺失。对照组心肌纤维排列整齐,线立体大小均匀,无肿胀,膜完整,内膜嵴正常。DCM:扩张型心肌病
SUV与超声心动图各指标和血浆BNP水平的相关性分析:(1)SUV与超声心动图结果的相关性分析:SUV与 LVEDD(R=-0.709,P=0.015)、LVESD(R=-0.924,P=0.000)呈负相关关系,与LVEF (R=0.968,P=0.000)和FS(R=0.863,P=0.001)呈正相关关系。(2)SUV与血浆BNP水平的相关性分析:SUV与血浆BNP水平呈负相关关系(R=-0.948,P=0.000)。
3 讨论
DCM是一种以单侧左心室、右心室或双侧心室腔扩大、心肌收缩能力障碍为特征的心肌病,其临床表现以进行性充血性心力衰竭、各种心律失常、血栓栓塞事件甚至猝死为基本特征[1]。DCM的发病机制尚未完全阐明[3],临床缺乏有效的治疗手段[4]。目前针对DCM的研究热点集中在其发病机制及治疗方法上,大鼠DCM模型应用广泛。目前评价DCM动物模型主要依靠超声心动图及病理改变等方法。超声心动图易受到检测者人为因素的影响[9],而且评价模型成功需处死部分大鼠得到病理结果,无法在动物存活时准确判断有无病理改变的发生,这就给针对这些改变的一些基础研究及疗效研究造成很大的困难。
PET是分子代谢学与解剖形态学完美结合的显像的技术[5],具有空间分辨率高、敏感性高、准确性高、显像对比度好以及能进行定量分析等特点[10]。PET代谢显像剂包括葡萄糖、氨基酸、蛋白质、磷脂和核酸代谢显像剂[7]。常用葡萄糖代谢显像剂有18F-FDG、11C葡萄糖、11C甲基D葡萄糖等,其中18F-FDG是目前应用最广泛的正电子显像剂。18F-FDG是葡萄糖的类似物,它在血及组织中的转运与葡萄糖类似,都被相同的酶催化成18F-FDG-6-磷酸(FDG-6-P),带负电荷的18F-FDG-6-P不能自由通过细胞膜,同时脑、心肌、肿瘤等细胞中缺乏葡萄糖-6-磷酸酶,使得FDG-6-P去磷酸化后变成FDG的速度降低,所以进入体内的FDG最终以FDG-6-P的形式停留在上述细胞内而显影[7]。
PET心肌代谢显像是从分子水平活体评价心肌代谢情况的影像学技术,是评估心肌存活的金标准[6]。PET葡萄糖心肌代谢显像在纵向多途径活体实验研究方面具有可行性和可重复性[11]。既往大量应用于冠心病心肌梗死后存活心肌的检测[12-14],以及预测血运重建后左心室功能的恢复情况[13]。18F-FDG PET应用于DCM的实验研究相对较少,应用18F-FDG Micro-PET评价大鼠DCM模型目前暂未见公开报道。本研究尝试用此法评价大鼠DCM模型,研究显示成功的DCM模型大鼠心肌细胞出现变性、坏死,心肌组织受损,18F-FDG Micro-PET心肌代谢显像显示SUV明显下降,心肌糖代谢异常,同样存在心肌细胞坏死,同时SUV下降情况与心腔大小及心功能呈现相关性,提示18F-FDG Micro-PET可以用于DCM模型的评价,其优点是可以活体检测模型的心肌存活情况,也可以用于评价某些治疗方法的疗效。但是18F-FDG Micro-PET显像技术也有一定的局限性,很多因素都可以影响葡萄糖的代谢,比如空腹血糖水平及胰岛素水平等[15,16]。由于实验经费的关系,本研究进行18F-FDG Micro-PET显像的大鼠样本量偏小,可能影响研究结果的准确性,我们将在以后的实验中尽可能完善。另外,本研究造模观察总时间为8周,相对较短,随着模型观察时间延长,大鼠心室腔扩张及心功能减退可能更明显。我们将在以后的实验中将延长观察时间,以期得到更充足的证据。
总之,与传统的超声心动图及病理分析相比,18F-FDG Micro-PET显像技术不仅可以从分子学水平、功能代谢方面评价心肌活性,提高了评价方法的精准度,而且可实现无创、连续、动态、活体评价。在未来科研中,18F-FDG Micro-PET显像技术凭借其独特的优势在评价DCM模型方面具有广阔的应用前景。
[1]Iwata Y,OhtakeH,Suzuki O,et al. Blockade of sarcolemmal TRPV2 accumulation inhibits progression of dilated cardiomyopathy. Cardiovasc Res,2013,99: 760-768.
[2]Zipes DP,Camm AJ,Borggrefe M,et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death-executive summary: A report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines.Eur Heart J,2006,27:2099-2140.
[3]Hershberger RE,Siegfried JD. Update 2011: clinical and genetic issues in familial dilatedcardiomyopathy.J Am Coll Cardiol,2011,57:1641-1649.
[4]Gupta A,Goyal P,Bahl A. Frequency of recovery and relapse in patients with nonischemic dilated cardiomyopathy on guidelinedirected medical therapy.Am J Cardiol,2014,114: 883-889.
[5]Lammertsma AA. PET/SPECT: functional imaging beyond flow. Vision Res,2001,41:1277-1281.
[6]Todica A,Brunner S,Böning G,et a1. 68Ga-Albumin-PET in the monitoring of left ventricular function in murine models of ischemic and dilated cardiomyopathy: comparison with cardiac MRI. Mol Imaging Biol,2013,15: 441-449.
[7]Frans CV. Imaging of cardiac metabolism using radiolabelled gloucose,fatty acids and acetate. Coron Artery Dis,2001,12:s12-s18.
[8]GavaFN,ZaccheE,Ortiz EM,et a1.Doxorubicin induced dilated cardiomyopathy in a rabbit model:An update. Res Vet Sci,2013,94:115-121.
[9]Tanaka N,Dalton N,Mao L,et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation,1996,94:1109-1117.
[10]Kumar A,Chugani HT. Functional imaging: PET. Handb Clin Neurol,2013,111:767-776.
[11]Handa N,Magata Y,Mukai T,et al. Quantitative FDG-uptake by positron emission tomography in progressive hypertrophy of rat hearts in vivo.Ann Nucl Med,2007,21:569-576.
[12]Uebleis C,Hellweger S,Laubender RP,et al. The amount of dysfunctional but viable myocardium predicts long-term survival in patients with ischemic cardiomyopathy and left ventricular dysfunction. Int J Cardiovasc Imaging,2013,29:1645-1653.
[13]Brunner S,Todica A,Böning G,et al. Left ventricular functional assessment in murine models of ischemic and dilated cardiomyopathy using 18FFDG-PET: comparison with cardiac MRI and monitoring erythropoietin therapy.EJNMMI Res,2012,2:43-51.
[14]刘秀杰. 梗塞区内存活心肌识别方法:(1)~(18)F—氟脱氧葡萄糖心肌正电子发射断层显像术对检测存活心肌的意义.中国循环杂志,2000,15:3.
[15]Ding HJ,Shiau YC,Wang JJ,et al. The influences of blood glucose and duration of fasting on myocardial glucose up take of18Ffluorodeoxy-D-glucose.Nucl Med Commun,2002,23:961-965.
[16]MartinWH,Jones RC,De lbeke D,et al. A simplified intravenous glucose loading protocol for 18F fluorodeoxyglucose cardiac single -photo emission tomography.Eur J Nucl Med,1997,24:1291-1297.
Application of18F-FDG Micro-PET Myocardial Metabolism Imaging for Evaluating Dilated Cardiomyopathy Model in Experimental Rats
SHEN Li-juan,LU Shu,ZHOU Yong-hua,XING Qing-min,LI Lan,YANG Min,ZHOU Chun-gang.
Intensive Care Unit,Wuxi Hospital of traditional Chinese Medicine,Wuxi (214071),Jiangsu,China
Corresponding Author: LU Shu,Email: panda55007@163.com
2015-10-27)
(编辑:朱柳媛)
无锡市医管中心科研项目(YGZXM14047)
214071江苏省,无锡市中医医院(沈丽娟、陆曙、邢清敏、李岚、周春刚);江苏省血吸虫病防治研究所(周永华);江苏省原子医学研究所(杨敏)
沈丽娟主治医师博士研究生主要从事心肌病研究Email: panda55@163.com通讯作者:陆曙Email: panda55007@163.com
R54
A
1000-3614(2016)08-0802-05
10.3969/j.issn.1000-3614.2016.08.018
