大熊猫粪便中纤维素降解菌的鉴定与作用机理
2016-09-26曹涵文潘双子吴珑韬甘乾福石神炳梁学武
曹涵文, 潘双子, 吴珑韬, 甘乾福, 石神炳, 梁学武
(1.国家菌草工程技术研究中心,福建 福州 350002;2.福建农林大学动物科学学院,福建 福州 350002;3.建阳市吉翔牧业有限公司,福建 南平 354200)
大熊猫粪便中纤维素降解菌的鉴定与作用机理
曹涵文1,2, 潘双子2, 吴珑韬2, 甘乾福2, 石神炳3, 梁学武1,2
(1.国家菌草工程技术研究中心,福建 福州 350002;2.福建农林大学动物科学学院,福建 福州 350002;3.建阳市吉翔牧业有限公司,福建 南平 354200)
从大熊猫粪便中分离到4株纤维素降解菌,分别命名为NC016612、NC012914、NC021171和NC020990.通过形态学观察、生理生化试验和16S rDNA鉴定,分离的菌株分别为克雷伯菌、类芽孢杆菌、芽孢杆菌和白色链霉菌.采用3,5-二硝基水杨酸显色法对菌株产酶条件进行研究,结果表明,克雷伯菌、类芽孢杆菌、芽孢杆菌和白色链霉菌的酶活性分别为18.642、9.234、23.125和24.732 U·μg-1,类芽孢杆菌、芽孢杆菌和白色链霉菌对纤维素的降解具有协同作用.
熊猫; 纤维素降解菌; 筛选; 鉴定; 降解机理
纤维素是自然界中广泛存在的一类结构性碳水化合物,每年通过陆生及海洋藻类的光合作用,可产生0.85×1011t纤维素,相当于世界总能值消耗的4倍,是地球上蕴藏最为丰富的可再生资源之一.纤维素是植物细胞壁的主要成分,由D-葡萄糖以β-1,4糖苷键组成的链状高分子化合物.天然的纤维素结构复杂,主要由原纤维压缩、聚合而成[1],有序的结晶区域和无序的不定区域组成纤维素结构单元原纤维[2].在有序的结晶区域中,分子排列整齐,延展性强.在纤维素中不仅存在着分子内氢键,还存在着分子间氢键,在秸秆中纤维被半纤维素和木质素包裹并且通过结晶结构与之相连,从而导致纤维素的水解与糖化受到显著的抑制作用[3].影响纤维素水解的因素还包括原材料的多孔性、纤维的结晶度、木质素和半纤维素的含量.当今,随着全球能源与粮食资源的大量消耗,人们迫切希望找到一种将纤维素加以利用的新方法.
大熊猫虽为肉食动物,但其食物多以竹笋和竹叶为主,平均每只成年大熊猫每日进食竹子量可达12.5 kg.大熊猫除消化竹子中90%以上的蛋白质和脂肪等营养物质外,还能利用8%的纤维素和27%的半纤维素[4].黄河等[5]研究表明:大熊猫以竹叶为食时,对粗蛋白、粗脂肪和半纤维素的消化率分别为61.5%、50.3%和23.3%;而以竹笋为食时,消化率分别达71.9%、61.5%和29.6%,大熊猫对竹笋中营养物质的利用率高于竹叶.大熊猫虽然有着草食性哺乳动物的进食特点,却拥有典型的肉食性哺乳动物的消化系统.从2010年公布的大熊猫基因组序列[6]中可以找到编码与肉食性动物消化系统相关酶的基因,但编码纤维素酶的相关基因却没有被发现,因此,大熊猫对纤维素的消化必然要依赖肠道菌群的作用.孙飞龙等[7]研究了不同时期大熊猫肠道的菌群种类及分布,证明了其肠道对纤维素的消化需要依靠菌群的协作.本试验对大熊猫粪便中的纤维素降解菌进行分离鉴定,并对其产酶特性进行研究,旨在探索大熊猫肠道中能够高效利用纤维素的菌株.
1 材料与方法
1.1样品的采集
大熊猫粪便采集于福州动物园,采集时去除表面杂质,装入自封袋中并编号.取样在灭菌的超净工作台上进行,将粪样用灭菌的刀片剖开,于中心位置取样,剩余粪样置-20 ℃保存.
1.2纤维素降解菌的培养及筛选
纤维素降解菌采用察克贝氏培养基[8]培养,以羧甲基纤维素作为唯一碳源,其主要成分有10 g羧甲基纤维素、0.2 g MgSO4·7H2O、1 g K2HPO4、1 g NH4NO3、0.05 g FeCl3·6H2O、0.02 g CaCl2.将粪样加到液体培养基中恒温振荡培养3 d,将菌液分别稀释至10-6、10-7和10-8,并涂布在平板上,于25 ℃倒置培养3 d.取纯化后的菌液20 μL滴加到培养基中,待菌落长出后,用刚果红染色1 h,然后用1 mol·L-1无菌生理盐水浸泡1 h.根据菌落产生透明水解圈直径的大小,评定菌株的产酶能力.
1.3酶活性的检测
取10只洗净并烘干的10 mL试管,按表1所示加入低温保藏的葡萄糖标准液,并对应加入不同体积的柠檬酸缓冲液,得到不同含量的葡萄糖柠檬酸混合液.加入1.5 mL DNS试剂,沸水浴6 min后流水冲洗冷却,加入1.5 mL蒸馏水定容至5 mL.在波长540 nm处以1号管(空白对照)为基准,调仪器零点,测定不同葡萄糖含量的光密度(D),结果如表1所示.以葡萄糖含量为纵坐标,对应的D为横坐标,绘制葡萄糖标准曲线用于后续酶活性的测定.将发酵液于8 000 r·min-1、4 ℃条件下离心20 min,所得到的上清液即为粗酶液.分别以羧甲基纤维素和中性滤纸作为底物进行培养,采用3,5-二硝基水杨酸显色法[9]测定羧甲基纤维素酶(carboxymethyl cellulose enzyme, CMCase)和滤纸酶(filter paper enzyme, FPase)的活性. 酶促反应在25 ℃,pH为7的条件下进行.酶活性单位(U)定义为:在pH为7,温度为25 ℃的条件下, 每分钟产生相当于1 μmol葡萄糖的还原糖所需的酶量为1个酶活性单位.将初筛得到的 27 株菌株接种至20 mL的试管中制成菌悬液,然后接种到液体培养基中发酵培养,于25 ℃、150 r·min-1培养 3 d后测定发酵液的酶活性.
1.4菌落和细胞形态学观察
形态学观察包括细胞形态鉴定和菌落形态鉴定两类.菌落形态鉴定主要是了解菌落大小、形态、颜色、光泽度、透明度、质地、隆起形状和边缘特征等.细胞形态鉴定主要是通过革兰氏染色[10],借助显微镜对细胞的大小、结构、排列方式以及芽孢、鞭毛、细胞膜等进行观察[11].
1.5菌株的生理生化试验
参照《伯杰氏细菌鉴定手册》[12]的方法对细菌的生理生化特性进行测定,测定内容主要包括糖醇的发酵试验、淀粉的水解试验、V-P试验、甲基红试验、明胶液化试验、氧化酶试验、过氧化氢酶试验(接触酶试验)、硝酸盐还原反应和pH耐受试验等[13].
1.616S rDNA序列分析
采用试剂盒提取菌液中的DNA,利用微生物的16S rDNA通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-TAGGGTTACCTTGTTACGACTT-3′)[14]对其16S rDNA序列进行扩增.PCR产物回收纯化后与pMD19-T相连接,连接产物转化E.coliJM109感受态细胞.挑取转化子并提取质粒后进行PCR验证[15],经验证确定转入外源细菌16S rDNA片段的单菌落,最后将转化子质粒送至上海英骏生物技术有限公司测序,将测序结果与GenBank中的已有序列进行比对.用NCBI建立遗传进化树,确定所选菌株的种属[16].
1.7菌株产酶条件的测定
取适量的菌液和液体培养基置于250 mL锥形瓶中进行液体发酵,在培养温度、初始pH、接种量和装液量不变的条件下,设置不同的培养时间作为梯度,测定菌液CMCase活性,并通过正交试验得出最佳的培养时间.同样的方法可以得出,在单因素中达到最大酶活性时所需的培养温度、pH、接种量和装液量[17].
2 结果与分析
2.1纤维素降解菌的筛选结果
从初筛的菌落中选取大而明显的水解圈所对应的37株菌落,纯化后接种在平板上,通过刚果红染色及1 mol·L-1NaCl浸泡,发现有27株具有明显的透明圈.透明圈效果如图1所示.
2.2CMCase和FPAase活性的测定结果
2.2.1葡萄糖标准曲线的绘制以葡萄糖含量为纵坐标,对应的D为横坐标,绘制的标准曲线如图2所示.
2.2.2酶活性的测定结果CMCase和FPase活性的测定结果如表2所示.初筛所得到的菌株,能够在以羧甲基纤维素为碳源的平板上产生透明圈,但一部分菌株不能很好地利用纤维素这种天然物质.根据CMCase和FPAase的活性,选择生长旺盛、产酶能力较强的菌株进行传代培养.菌株经过多次的传代培养,其产酶能力依然稳定,没有呈现出退化迹象.
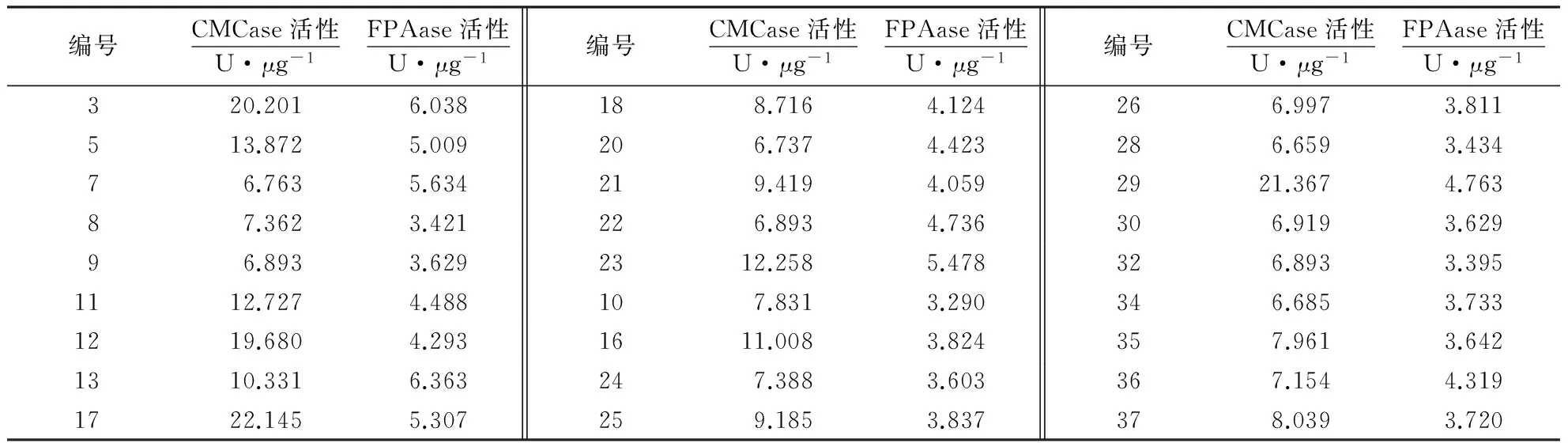
表2 产纤维素酶菌株的CMCase和FPase活性
2.3菌株的形态学观察
分别将菌株NC016612、NC012914、NC021171和NC020990接种到羧甲基纤维素钠平板上于30 ℃培养72 h,菌落形态及革兰氏染色效果如图3~6所示.
菌株NC016612菌落呈椭圆形,直径0.3~6 μm,呈乳白色,边缘整齐,表面不光滑,中凸,有光泽;革兰氏染色鉴定呈阴性,短链状排列(图3).菌株NC012914菌落呈圆球状,白色,表面不光滑呈毛状分布,边缘不整齐,湿润,无可溶性色素;革兰氏染色鉴定呈阴性,细胞呈杆状(图4).菌株NC021171菌落呈圆球状,乳白色,直径0.5~10 μm,边缘不规则,表面不光滑,中凸,无光泽;革兰氏染色鉴定呈阳性,呈对或链状排列,具有方端或圆端(图5).菌株NC020990菌落呈团状,乳白色,边缘不整齐,外沿透明度较高,且呈现丝状交错排列,能够产生水溶性和脂溶性色素;该菌株为放线菌目,有较长的孢子丝,孢子不运动,外鞘上常有刺状或毛发等状饰(图6).
2.4菌株的生理生化特性
2.4.1菌株NC016612的生理生化特性菌株NC016612有荚膜,不运动,属于兼性厌氧菌,同时存在呼吸和发酵两种代谢类型,最适生长温度为35~37 ℃,最适pH约为7.2.由表3可知:菌株NC016612除不能利用卫矛醇外,棉籽糖、麦芽糖、海藻糖、纤维二糖、蜜二糖、乳糖和蔗糖都可作为其生长繁殖的碳源;能够很好地利用葡萄糖产酸、产气,且可以利用葡萄糖作为唯一碳源;氧化酶反应呈阴性,V-P反应呈阳性,能够利用间-肌醇并能与尿素发生水解反应,不产生鸟氨酸脱羧酶,硫化氢反应呈阴性.初步鉴定该菌株为克雷伯菌.

表3 菌株NC016612的生理生化特性1)
1)+表示≥90%的菌株呈阳性;-表示≥90%的菌株呈阴性.
2.4.2菌株NC012914的生理生化特性菌株NC012914周生鞭毛,运动,属于兼性厌氧菌或严格好氧菌.由表4可知:菌株NC012914能够利用各种糖类产酸,接触酶反应呈阳性,而氧化酶反应则呈阴性,不能产生吲哚,硝酸盐反应呈阴性,不能利用柠檬酸盐、琥珀酸盐,但能利用乙酸盐;不能利用淀粉和尿素,酪酸反应呈阳性;在pH为5.6的条件下,菌株能够生长;在50 ℃高温条件下菌株死亡;耐盐性较好,溶菌酶反应呈阴性.初步鉴定该菌株为类芽孢杆菌.
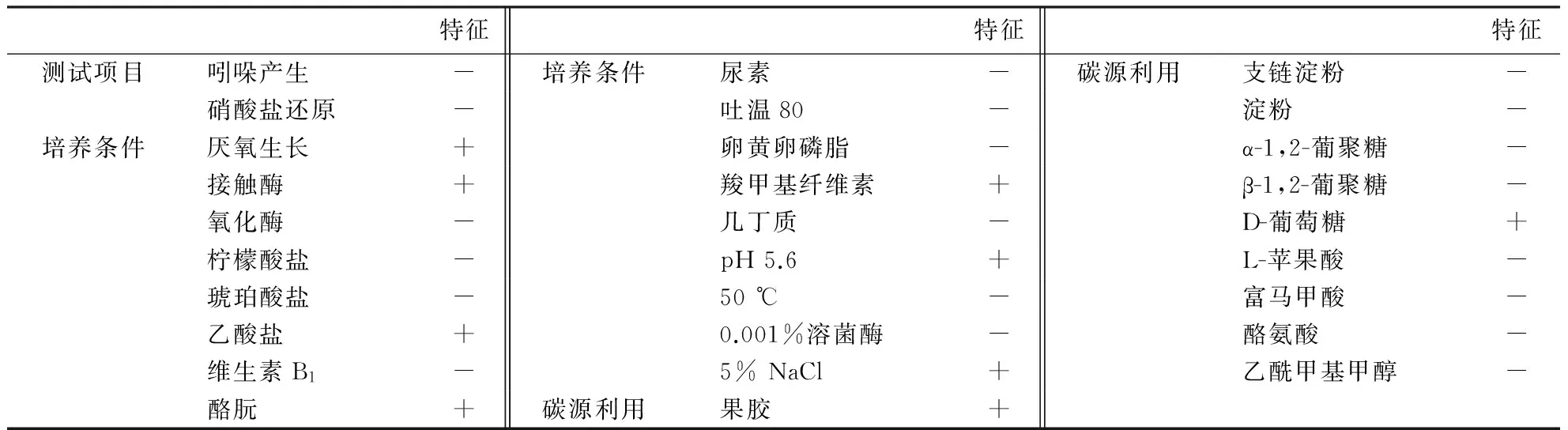
表4 菌株NC012914的生理生化特性1)
1)+表示≥90%的菌株呈阳性;-表示≥90%的菌株呈阴性.
2.4.3菌株NC021171的生理生化特性菌株NC021171能够产生芽孢,周生鞭毛,运动,属于化能异养菌,具有发酵或呼吸两种代谢类型.由表5可知:菌株NC021171能够利用D-葡萄糖,但不产气;能够利用酪朊、明胶和淀粉,不能利用柠檬酸盐和丙酸盐;酪氨酸水解反应、苯丙氨酸脱氨酶和卵黄卵磷脂酶反应均呈阴性;硝酸盐还原反应呈阳性;生长、繁殖的温度为10~30 ℃,在高于30 ℃的条件下,该菌株生长受限;接触酶和V-P反应均呈阳性.初步鉴定该菌株为芽孢杆菌.
2.4.4菌株NC020990的生理生化特性菌株NC020990属于放线菌,其最适生长温度为25~44 ℃,耐碱不耐酸.由表6可知,从碳源的利用情况来看,菌株NC020990能够利用D-葡萄糖、D-木糖、D-果糖、D-半乳糖、D-甘露醇和蔗糖,能够使明胶液化,但不能水解淀粉,分解葡萄糖不产酸.初步鉴定该菌株为链霉菌.

表5 菌株NC021171 的生理生化特性1)
1)+表示≥90%的菌株呈阳性;-表示≥90%的菌株呈阴性.

表6 菌株NCNC020990的生理生化特性1)
1)+表示≥90%的菌株呈阳性;-表示≥90%的菌株呈阴性.
2.5菌株的遗传进化树
采用试剂盒提取菌株DNA,以27F和1492R引物进行PCR扩增,菌株NC016612、NC012914、NC021171和NC020990通过PCR扩增16S rDNA片段的长度均约为1 500 bp(图7).采用临近序列分析法构建菌株的遗传进化树,每个菌株均选取亲缘关系最近的20个菌株序列进行比较.结果(图8)显示,菌株NC016612属于克雷伯菌属,与克雷伯菌菌株KCTC染色体的同源性为98%;图9显示,菌株NC012914属于类芽孢杆菌属,与类芽孢杆菌菌株JDR-2的同源性为96%;图10显示,菌株NC021171属于芽孢杆菌属,与芽孢杆菌菌株INLA3E的同源性为97%;图11显示,菌株NC020990属于白色链霉菌,与白色链霉菌菌株A3(2)的同源性为99%.
2.6纤维素降解菌的酶活性
在最适的培养条件下,4株纤维素降解菌的CMCase活性如表7所示.
3 讨论
大熊猫以竹叶等高纤维物质为食,却具有典型的肉食类动物的消化系统,近年来也报道过大熊猫捕捉小型哺乳动物为食的案例,但肉食动物的消化系统对高纤维类物质难以消化利用.Zhu et al[18]对野生大熊猫肠道菌群的宏观基因组进行了研究,发现编码纤维素和半纤维素酶的基因,该研究结果在分子水平上为大熊猫利用肠道微生物消化竹子中的纤维素和半纤维素提供了证据.
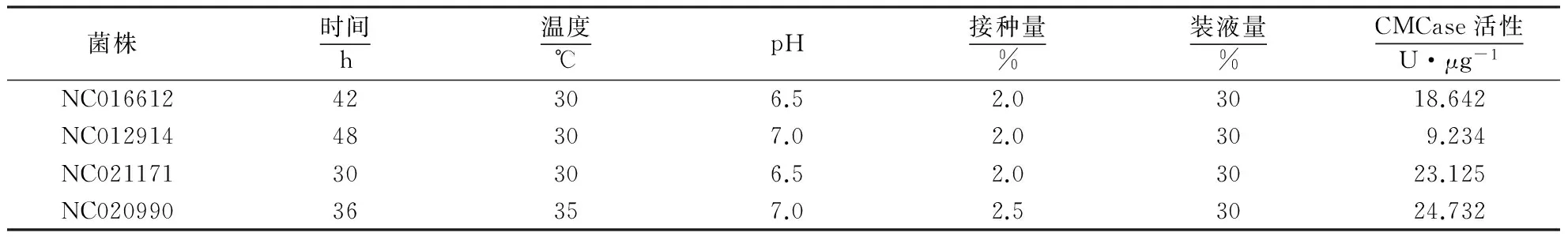
表7 最适培养条件下菌株的CMCase活性
研究发现,大熊猫肠道菌群主要由厚壁菌门的芽胞杆菌纲和梭菌纲细菌组成.大熊猫消化道短、进食时间长、肠道蠕动快等原因造成其肠道内环境氧成分含量较高,目前国内外对大熊猫肠道菌群的研究主要集中在克雷伯杆菌、大肠埃希氏菌和空肠弯曲杆菌等致病菌[19]以及这些致病菌对大熊猫生理和病理方面的影响.Zhu et al[18]通过富集培养的方法获得了具有降解纤维素能力的梭菌属菌株PD-2,该研究在菌种筛选时,专一性地采用了厌氧培养的方式,发现以梭菌属为代表的厌氧纤维素分解菌对纤维素底物具有较强的粘附作用,并且能够发酵纤维素和纤维二糖生成乙醇、乙酸、H2和CO2等产物,但由于大熊猫肠道较短,含氧量比其他哺乳动物高的实际生理环境下[20],严格厌氧细菌的生长和定植受到限制,从而有利于以芽胞杆菌属为代表的好氧或兼性厌氧菌的定植.
本试验从福州熊猫基地健康大熊猫的粪便中分离到4株纤维素降解菌,其中,菌株NC020990(白色链霉菌)、NC021171(芽孢杆菌)、NC016612(克雷伯菌)和NC012914(类芽孢杆菌)在最适培养条件下的CMCase活性分别为24.732、23.125、18.642和9.234 U·μg-1,并首次从大熊猫粪便中筛选出白色链霉菌,其具有较强的降解纤维类物质的能力.
[1] FAN L T, LEE Y H, BEARDMORE D H. Major chemical and physical features of cellulose materials as substrates for enzymatic hydrolysis [J]. Adv Biochem Eng Biotech,1980,14:101-105.
[2] 雷恒毅,王春铭.城市污泥堆肥高温菌群的筛选、特性与应用研究[D].广州:中山大学,2006.
[3] MCMILLAN J D. Pretreatment of lignocellulosic biomass [M]∥HIMMEL M E, BAKERJ O, OVEREND R P. Enzymatic Conversion of Biomass for Fuels Production. Washington, DC: American Chemical Society, 1994:292-324.
[4] 樊程,李双江,李成磊,等.大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J].微生物学报,2012,52(9):1 113-1 121.
[5] 黄河,张志和,侯蓉.粪样在大熊猫研究上的应用[J].动物学杂志,2012,47(6):156-163.
[6] LI R Q, FAN W, TIAN G, et al. The sequence anddenovoassembly of the giant panda genome [J]. Nature, 2010,463:311-317.
[7] 孙飞龙,刘敬贤,席丹,等.大熊猫肠道疾病致病菌[J].经济动物学报,2002,6(2):20-23.
[8] 付丽丽.作物秸秆纤维素降解菌的分离与筛选[D].杭州:浙江大学,2012.
[9] 胡国全,邓宇,徐恒,等.极端嗜热厌氧纤维素菌的分离、鉴定、系统发育分析及其酶学性质的研究[J].应用与环境生物学报,2004,10(2):197-201.
[10] 孙纪全,黄星,何健,等.异丙隆降解菌Y57的分离鉴定及其降解特性[J].中国环境科学,2006,26(3):315-319.
[11] 周生飞.高效降解棉酚菌种筛选、降解机理及固体发酵工艺研究[D].兰州:甘肃农业大学,2011.
[12] 布坎南 R E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1988.
[13] 解林奇.多菌灵降解菌系筛选、组成分析及其降解效果[D].北京:中国农业科学院,2012.
[14] BAKER G C, SMITH J J, COWAN D A. Reviewandre-analysis of domain-specific 16S primers [J]. Journal of Microbiological Methods, 2003,55(3):541-555.
[15] 吕莉华.瘤胃纤维素降解菌Real-Time PCR荧光定量方法的建立及其初步应用[D].呼和浩特:内蒙古农业大学,2007.
[16] 孙一博.高效纤维素降解菌的筛选鉴定及特性研究[D].哈尔滨:东北农业大学,2013.
[17] 张晓辉,郭春华,江晓霞.饲用木聚糖酶生产菌株的筛选及部分酶学性质的研究[J].兽药与饲料添加剂,2007,12(2):4-6.
[18] ZHU L F, WU Q, DAI J Y, et al. Evidence of cellulose metabolism by the giant panda gut microbiome [J]. PNAS, 2011,108:17 714-17 719.
[19] SUN F L, LIU J X, XI D, et al. Pathogens of intestinal diseases in giant panda [J]. J Econ Anim, 2002,6(2):20-23.
[20] 张志和,何光昕,王行亮,等.大熊猫肠道正常菌群的研究[J].兽类学报,1995,15(3):170-175.
(责任编辑:施晓棠)
Identification and mechanism of cellulose-degradation bacteria from panda′s excrement
CAO Hanwen1,2, PAN Shuangzi2, WU Longtao2, GAN Qianfu2, SHI Shenbing3, LIANG Xuewu1,2
(1.National Engineering Research Center of Juncao Technology, Fuzhou, Fujian 350002, China; 2.College of Animal Science and Technology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002,China; 3.Jixiang Graziery Limited Company in Jianyang, Nanping, Fujian 354200, China)
To screen intestinal bacteria that effectively digest high-cellulose foodstuff that the giant panda routinely feed on, 4 kinds of bacteria were isolated from the excrements, and were tentatively named as NC016612, NC012914, NC021171, NC020990. Subsequent morphology observation, physiological and biochemical analysis, and 16S rDNA identification indicated that 4 strains belonged to klebsiella, paenibacillus, bacillus, streptomyces albus, respectively. Then enzyme activities of strains under optimal production condition were detected by 3, 5-2 nitro salicylic acid method. The results showed that the enzyme activities were 18.642, 9.234, 23.125, 27.732 U·μg-1for klebsiella, paenibacillus, bacillus, streptomyces albus, respectively, and paenibacillus, bacillus, streptomyces albus interacted synergistically to degrade cellulose.
the giant panda; cellulose-degradation bacteria; screening; identification; degradation mechanism
2015-05-24
2015-07-04
福建省2011计划项目(K80DN8002);国家科技支撑计划项目(2014BAD15B01).
曹涵文(1989-),男,硕士研究生.研究方向:反刍动物营养.Email:751261399@qq.com.通讯作者梁学武(1960-),男,研究员,硕士生导师.研究方向:反刍动物营养与现代奶(肉)牛生产.Email:faulxw2000@163.com.
Q93-3
A
1671-5470(2016)03-0302-08
10.13323/j.cnki.j.fafu(nat.sci.).2016.03.011
