HIF-α、IL-10、Ki-67在老年子宫内膜样腺癌组织中的表达及临床意义
2016-09-24张伟,李盛
张 伟,李 盛
(江汉大学附属医院妇产科,湖北 武汉 430015)
HIF-α、IL-10、Ki-67在老年子宫内膜样腺癌组织中的表达及临床意义
张伟,李盛
(江汉大学附属医院妇产科,湖北 武汉 430015)

子宫内膜样腺癌;缺氧诱导因子-α;白细胞介素-10;Ki-67抗原
[Key words]endometrial adenocarcinoma; hypoxia inducible factor α (HIF-α); interleukin-10 (IL-10); Ki-67
子宫内膜癌是女性生殖系统常见的恶性肿瘤之一,随着社会生活变化,其发病率逐年增加。研究结果表明80%以上的子宫内膜癌病灶位于子宫体内,患者5年生存率较高,手术治疗预后较好,但少数患者出现转移侵袭性较强,患者预后效果较差等现象,用现有的理论难以充分解释[1-2]。因此,掌握肿瘤转移侵袭性强弱以及分化转移程度差异,从而有助于临床医生对患者预后情况加以判断,针对性给予治疗。本研究主要针对缺氧诱导因子-α(hypoxia-induciblefact α,HIF-α)、白细胞介素-10(interleukin 10,IL-10)以及Ki-67抗原(Ki-67)3项指标在老年子宫内膜样腺癌组织中的表达状况,探究其临床意义,明确三者与子宫内膜样腺癌相关性大小,从而为临床工作提供指导。
1材料与方法
1.1一般资料
将2010年2月至2014年10月期间内在江汉大学附属医院妇产科进行子宫内膜肿瘤的手术治疗患者作为研究对象,年龄均大于60岁,在所有研究对象中,经病理指标确诊为子宫内膜腺癌标本为40例(A组),子宫内膜不典型增生患者标本32例(B组),同时,将正常子宫肌瘤增生期患者的子宫内膜诊刮标本36例设定为对照组(C组)。其中A组患者年龄60~75岁,平均年龄(63.59±5.31)岁;肿瘤采用国际妇产科协会(federation internationale of gynecologie and obstetrigue,FIGO)分期方式[3],包含Ⅰ期患者18例,Ⅱ期患者14例,Ⅲ期8例;在肿瘤分化程度方面,G1级患者17例,G2级患者13例,G3级患者10例;存在淋巴结转移患者11例。B组患者平均年龄(62.68±3.42)岁,C组患者平均年龄(63.26±4.64)岁。所有纳入本次研究患者在1年内无宫内置节育环史,以及未服用性激素类药物。3组间基本资料对比,差异无显著性(均P>0.05)。
1.2方法
所有纳入本研究的组织样本均采用40g/L甲醛固定,石蜡包埋,切片厚度4μm的连续切片,染色采用苏木精-伊红进行,HIF-α、Ki-67等采用免疫组化S-P方法进行检测,IL-10采用酶联免疫吸附实验进行测定,并进行全自动酶分析仪进行测定。
1.3结果判断
在光学显微镜下对切片标本进行观察,阳性标准为胞膜、胞浆或是核内棕黄色颗粒,粗细一致,Ki-67的阳性颗粒主要位于细胞核内,而HIF-α主要分布在细胞浆和细胞核内,黄色颗粒较大。在400倍光学显微镜下随机选取10个视野内细胞,参考染色细胞数量将阳性细胞分4等级,阳性细胞数目低于10%,即为0分;阳性细胞数目为10%~24%记为1分;阳性细胞25%~49%为2分,阳性细胞≥50%为3分,还根据染色深浅不同进行分类,不显色、淡黄色、桔黄色和棕黄色各计为0、1、2、3分,两者相加,阴性为0~1分,阳性为2~3分,强阳性为超过3分[4]。对样本切片选择5个高倍视野(×40物镜,×10目镜), 同等曝光条件一次拍摄完成,采用相关图像分析软件对照片进行分析,校正光密度后,分析高倍视野内的积分光密度(integrated option density,IOD),以五高倍视野的IOD平均值作为该样本IOD值。
1.4统计学方法

2结果
2.1缺氧诱导因子-α和Ki-67抗原免疫组织化学染色结果
对正常子宫组织,子宫内膜不典型增生组织,及子宫内膜癌组织进行免疫组织化学染色检测HIF-α和Ki-67的表达,HIF-α主要分布在细胞浆和细胞核内,Ki-67的阳性颗粒主要位于细胞核内,HIF-α与Ki67的着色深度正常组织,子宫内膜不典型增生、子宫内膜腺癌组织中逐渐加深。代表性结果如图1所示。
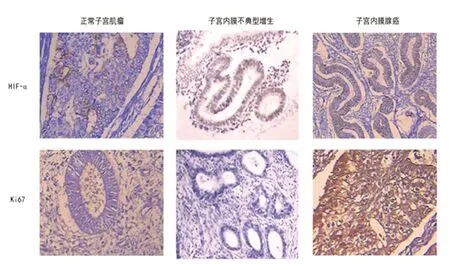
图1不同类型子宫内膜病变HIF-α与Ki-67的表达
Fig.1Expressions of HIF-α and Ki-67 in different types of endometrial lesions
2.2 各组患者相关指标比较
3组HIF-α和Ki-67阳性表达率有显著性差异(χ2值分别为36.925、34.645,均P<0.05),IL-10水平有显著性差异(F=188.544,P<0.05),A组HIF-α和Ki-67阳性表达率、IL-10水平均最高,见表1。
2.3不同临床类型中3项指标的表达情况对比
HIF-α、Ki-67表达阳性率随着临床分期增加而增高,数据比较存在统计学意义(P<0.05),肌层浸润程度越高,存在淋巴转移的患者,其上述两项指标的阳性率高,数据差异有统计学意义(均P<0.05),在病理分级比较中无统计学差异(P>0.05)。在IL-10的IOD指标对比中,临床分期高、病理分级高、肌层浸润、淋巴转移均与IOD高值相匹配,数据比较存在统计学意义(均P<0.05),见表2、表3和表4。
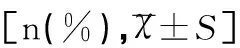

Table 1 Comparison of expressions of HIF-α, IL-10 and Ki-67 among different endometria ±S]
表2子宫内膜样腺癌在不同临床病理状态下HIF-α水平(n)

Table 2 Levels of HIF-α in different clinical pathology status of endometrial adenocarcinoma(n)
表3 子宫内膜样腺癌在不同临床病理状态下Ki-67水平[n(%)]
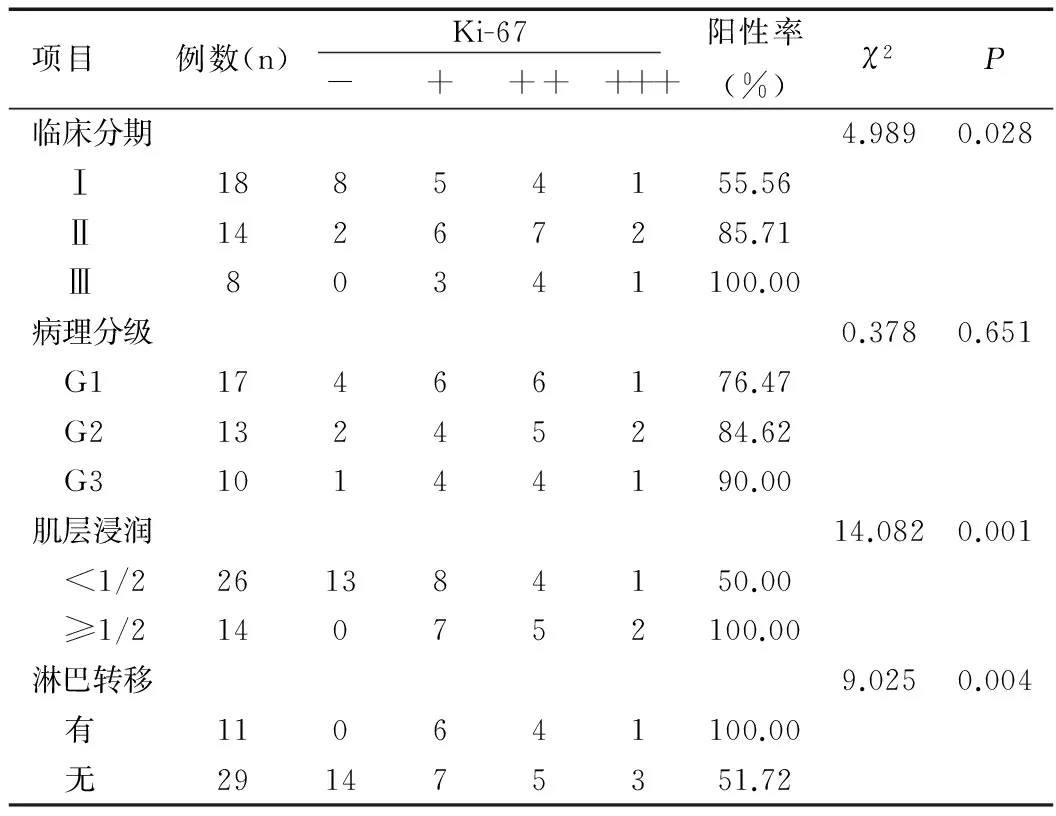
Table 3 Levels of Ki-67 in different clinical pathology status of endometrial adenocarcinoma [n(%)]
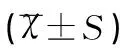

项目例数(n)IL-10(pg/mL)tP临床分期-25.3460.000 Ⅰ188131.30±642.13 Ⅱ+Ⅲ2213764.22±742.32病理分级-29.6510.000 G1177984.26±425.60 G2+G32312693.35±542.34肌层浸润-23.1050.000 <1/2268944.46±352.66 ≥1/21411843.51±423.82淋巴转移-26.9620.000 有119149.42±523.32 无2913523.63±432.5
3讨论
3.1缺氧诱导因子-α在老年子宫内膜样腺癌组织中的意义
HIF是机体内氧平衡维持的重要转录基因,主要由α、β亚基组成,HIF-α主要发挥调节和活性亚基作用,是机体内惟一发挥氧调节的基因亚单位,对HIF活性有重要影响,在机体内外多种因素剌激下活化,对细胞的生长、分化、存活及凋亡等生物学过程产生重要影响,发挥体内生理、病理调节作用。近年来,有相关研究结果表明多项肿瘤的检测报告中,发现HIF-α有过度表达的现象,且还与肿瘤转移侵袭能力存在相关性,能够影响肿瘤对治疗的敏感性,与预后效果存在密切关系,在肿瘤细胞内发现HIF-α表达,而在肿瘤组织基质细胞及相邻正常组织细胞内未出现HIF-α表达,肿瘤坏死病灶区域及浸润边缘,HIF-α表达水平较高[5]。
本研究结果显示,随着子宫内膜恶性程度增加,HIF-α表达水平提高,分析该研究结果可知子宫内膜腺样癌变过程中,细胞增殖速度加快,胞内存在缺氧现象,使得细胞内HIF-α转录激活,HIF-α高表达,并介导内膜细胞能量代谢模式变化,使得缺氧情况下也能迅速增殖。本研究结果表明,在不同指标如临床分期、肌层浸润以及淋巴结转移情况下,HIF-α表达不同,且随病情严重,肿瘤分化,表达呈显著上升趋势,因此,可知HIF-α表达水平较高,在子宫内膜癌症早期以及恶性进展期等过程均存在,与肿瘤细胞转移、侵袭等存在密切关系。
3.2 Ki-67抗原在老年子宫内膜样腺癌组织中的意义
Ki-67抗原主要发挥识别GO晚期外细胞周期核抗原的作用,其特点在于抗原半衰期短,在于细胞周期脱离后,快速降解,能够对增殖分裂的细胞发挥快速识别的作用,是一种应用最为广泛的增殖细胞标记之一[6]。在宫颈炎、上皮内瘤变以及宫颈癌中,Ki-67呈表达逐步增加的水平,且随着子宫颈癌的分化效果越差,其相关表达的指数越高,增殖旺盛的细胞,其表现的转移侵袭性越强。因此,在多项研究中,Ki-67也主要用于评价肿瘤细胞的增殖活性、生长、浸润情况,并对其复发、转移及侵袭情况进行判定[7]。
本研究结果表明,Ki-67阳性率分别在不同子宫内膜状态下表达水平不同,且在正常增生期子宫内膜、不典型增生及内膜样腺癌组织中,阳性率逐渐提高,A组样本中Ki-67的高水平表达,且高于另外两组,A、B组样本中的阳性表达水平对比,数据无显著统计学差异,这一结果进行分析可知,细胞过度增殖与子宫内膜样腺癌发生、发展存在密切关系,这一过程从子宫内膜不典型增生开始,因此,不典型增生子宫内膜中Ki-67过度表达,Ki-67可作为评价子宫内膜样腺癌细胞增殖、分化状态的重要指标,可用于判断肿瘤的侵袭能力。
3.3.白细胞介素-10在老年子宫内膜样腺癌组织中的意义
IL-10是由机体内多种免疫细胞,如巨噬细胞、单核细胞以及活化的B细胞以及Th2细胞分泌产生多功能细胞因子合成抑制因子,有研究结果表明,IL-10能够调节机体内炎症、免疫、肿瘤细胞等,因此,能够对机体炎症、感染及自身免疫性疾病等能够发挥重要作用[8-9]。在IL-10的IOD指标对比中,临床分期高、病理分级高、肌层浸润、淋巴转移均与IOD高值相匹配,随着子宫内膜恶性程度增加,IL-10表达水平提高,分析该研究结果可知子宫内膜腺样癌变过程中,刺激机体内炎症、免疫系统,细胞分泌激活,IL-10分泌增多。因此,子宫内膜癌症早期以及恶性进展期等过程均存在高水平IL-10表达,其与肿瘤细胞转移、侵袭均存在一定的关系。
综上所述,HIF-α、IL-10及Ki-67在子宫内膜癌组织内高表达,则表明子宫内膜样腺癌组织浸润性较强,有转移、侵袭性,应当在临床上加以重视,因此在临床上需推广检测指标,有助于手术方式的确定和预后判断。
[1]蒲杰,梁家智.饮食与子宫内膜癌风险的研究进展[J].中国妇幼健康研究,2011,22(6):852-855.
[2]李林,程矗,段瑞岐,等.IL-10、IL-17在子宫内膜癌中的表达及意义[J]. 四川大学学报:医学版,2014,45(5):793-796.
[3]李林,程矗,段瑞岐,等. 白细胞介素-10,-17及叉状/翼状螺旋转录因子,维甲酸相关孤儿受体-γt在子宫内膜癌中的表达及意义[J].中华妇幼临床医学杂志(电子版),2013,9(5):599-603.
[4]黄敬皓.免疫组化标记物在子宫内膜样腺癌与宫颈腺癌诊断中的表达及临床意义[J].检验医学与临床,2015,12(6):778-779,782.
[5]Snell C E, Turley H, McIntyre A,etal. Proline-hydroxylated hypoxia-inducible factor 1α (HIF-1α) upregulation in human tumours[J]. PLoS One, 2014, 9(2):e88955.
[6]Ghoneim F M, Khalaf H A, Elsamanoudy A Z,etal.Protective effect of chronic caffeine intake on gene expression of brain derived neurotrophic factor signaling and the immunoreactivity of glial fibrillary acidic protein and Ki-67 in Alzheimer's disease[J]. Int J Clin Exp Pathol, 2015, 8(7): 7710-7728.
[7]邢海燕,薛凤华,秦晓敏,等.HIF-1α、VEGF和MMP-9在子宫内膜样腺癌中的表达及临床意义[J].山东大学学报:医学版,2013,51(4):77-80,86.
[8]陈芳,刘文臻,刘云香.子宫内膜样腺癌组织Twist和HIF-1α及E-cadherin表达的临床意义[J].中华肿瘤防治杂志,2015,22(11):858-862.
[9]张佩,黄星原,徐木珍.IL-10对CVB3病毒性心肌炎治疗作用的研究[J].中国妇幼健康研究,2011,22(5):576-578.
[专业责任编辑:安瑞芳]
Expression and clinical significance of HIF-α, IL-10 and Ki-67 in endometrial adenocarcinoma of the aged
ZHANG Wei, LI Sheng
(Department of Obstetrics and Gynecology, Affiliated Hospital of Jianghan University, Hubei Wuhan 430015, China)
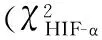
2015-08-22
张伟(1980-),女,主治医师,主要从事妇科肿瘤的研究。
李盛,副主任医师。
10.3969/j.issn.1673-5293.2016.02.016
R711.7
A
1673-5293(2016)02-0194-04
