黄芪甲苷提取方法优化
2016-09-23李焕娟
李焕娟, 张 聪, 郝 洁
(国家兽用药品工程技术研究中心/洛阳惠中兽药有限公司,河南洛阳 471000)
黄芪甲苷提取方法优化
李焕娟, 张 聪, 郝 洁
(国家兽用药品工程技术研究中心/洛阳惠中兽药有限公司,河南洛阳 471000)
[目的]优化黄芪药材中黄芪甲苷提取方法。[方法]采用单因素试验对提取方式、提取溶剂、提取次数进行考察,采用HPLC-ELSD法测定黄芪甲苷含量。[结果]黄芪药材中黄芪甲苷最优提取方法为每次用50倍的50%甲醇加热回流提取2次,每次1 h。[结论]该试验所建立的方法操作简单、准确可靠、重现性好,为黄芪饮片及制剂中黄芪甲苷的提取及含量测定提供参考。
黄芪;黄芪甲苷;提取方法;优化
黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge. var.mongholicus(Bge.) Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.) Bge.的干燥根[1]。黄芪甲苷是黄芪药材及其制剂质量控制的重要指标[2]。研究发现,黄芪药材中以原形形式存在的黄芪甲苷含量很低,在对其进行制剂研究时,以黄芪甲苷为母核的皂苷类成分极易转化成黄芪甲苷[3]。另外,由于药材的处理方法不同,所测得的黄芪甲苷含量也有很大的不同。《中国药典》2010年版所用样品前处理方法耗时较长,测得含量偏低[4]。一些学者对黄芪中黄芪甲苷的提取方法进行了研究,但结果仍不太理想[5-7]。该研究采用单因素试验对提取方式、提取溶剂、提取次数进行考察,优化黄芪药材中黄芪甲苷提取方法,并采用HPLC-ELSD法测定黄芪甲苷含量,为黄芪药材及制剂中黄芪甲苷的检测提供科学依据。
1 材料与方法
1.1 材料
1.1.1 仪器。Waters高效液相色谱仪(型号Alliance e2695)、蒸发光散射检测器(型号2424),美国沃特世公司;Kromasil 100-5C18柱(5 μm,4.6 mm×150 mm),瑞典NOBEL公司;AB265-S型电子分析天平,瑞士梅特勒托利多公司;HH-WO型智能数显多功能水浴锅、SHZ-D(Ⅲ)型循环水式真空泵,巩义予华仪器有限责任公司;JK-3200B型超声清洗器,合肥金尼克机械制造有限公司;TQ-2000Y型高速多功能粉碎机,永康市天祺盛世工贸有限公司。
1.1.2试药。3批黄芪饮片,购自洛阳康鑫中药饮片有限公司,产地及批号分别为山西20140421、河北20140912、山西20150416;黄芪甲苷对照品(批号110781-200613,含量100%),中国食品药品检定研究院;正丁醇(AR,批号20140916)、甲醇(AR,批号20150605),天津富宇精细化学品有限公司;氨水(AR,批号20140306),烟台市双双化工有限公司;乙腈(色谱纯,批号151124),天津市四友精细化学品有限公司;水为纯化水和超纯水,自制。
1.2方法
1.2.1对照品溶液的制备。精密称取黄芪甲苷10.79 mg,置25 mL量瓶,甲醇超声溶解并稀释至刻度,摇匀,0.45 μm微孔滤膜过滤,取续滤液,即得。
1.2.2供试品溶液的制备。
1.2.2.1提取方式考察。
(1)索氏提取。取黄芪中粉约2 g,精密称定,置索氏提取器中,加100 mL甲醇,加热回流4 h,提取液减压回收溶剂至干,残渣加10 mL水溶解,用水饱和的正丁醇振摇提取4次,每次40 mL,合并正丁醇液,用氨试液洗涤2次,每次40 mL,弃去洗液,正丁醇液蒸干,残渣用适量甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得[1]。
(2)回流提取。取黄芪中粉约2 g,精密称定,置具塞锥形瓶中,加100 mL甲醇加热回流1 h,抽滤,滤渣和滤饼加入100 mL甲醇加热回流1 h,共提取2次,合并滤液,减压回收溶剂至干,残渣加10 mL水溶解,其余步骤同“1.2.2.1”中索氏提取。
(3)超声提取。取黄芪中粉约2 g,精密称定,置具塞锥形瓶中,加100 mL甲醇超声1 h,抽滤,滤渣和滤饼加入100 mL甲醇超声1 h,共提取2次,合并滤液,减压回收溶剂至干,残渣加10 mL水溶解,其余步骤同“1.2.2.1”中索氏提取。
1.2.2.2提取溶剂考察。取黄芪中粉约2 g,精密称定,置具塞锥形瓶中,分别加100 mL甲醇、100 mL水、100 mL 50%甲醇加热回流1 h,抽滤,滤渣和滤饼分别加100 mL甲醇、100 mL水、100 mL 50%甲醇加热回流1 h,共提取2次,合并滤液,减压回收溶剂至干,残渣加10 mL水溶解,其余步骤同“1.2.2.1”中索氏提取。
1.2.2.3提取次数考察。取黄芪中粉约2 g,精密称定,置具塞锥形瓶中,加100 mL 50%甲醇,加热回流1 h,每个样品分别共提取1、2、3次,抽滤,分别合并滤液,减压回收溶剂至干,残渣加10 mL水溶解,其余步骤同“1.2.2.1”中索氏提取。
1.2.2.4供试品溶液的制备。取黄芪中粉2 g,精密称定,置具塞锥形瓶中,加100 mL 最优溶剂采用最优提取方式提取1 h,抽滤,滤渣和滤饼加入100 mL 最优溶剂采用最优提取方式提取1 h,共提取最优次数,合并滤液,减压回收溶剂至干,残渣加10 mL水溶解,用水饱和的正丁醇振摇提取4次,每次40 mL,合并正丁醇液,用氨试液洗涤2次,每次40 mL,弃去洗液,正丁醇液蒸干,残渣用适量甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得。
1.2.3色谱分析条件。色谱柱为Kromasil 100-5C18柱(5 μm,4.6 mm×150 mm),流动相为乙腈-水(35∶65),柱温30 ℃,Waters 2424 ELSD检测条件,增益50 LSU,漂移管温度60 ℃,氮气压力25 Psi,雾化器温度36 ℃。
1.2.4方法学考察。
1.2.4.1线性关系的考察。分别精密吸取黄芪甲苷对照品溶液3、5、8、10和15 μL注入液相色谱仪,以对照品峰面积对数(y)为纵坐标、进样量对数(x)为横坐标绘制标准曲线,计算得回归方程。
1.2.4.2 精密度试验。按“1.2.2”方法制备供试品溶液,连续进样6次,每次进样10 μL,测得黄芪甲苷峰面积,计算RSD值,要求该值小于3%。
1.2.4.3 稳定性试验。取“1.2.2”方法制备供试品溶液,于室温下放置,分别于0、2、4、8、12、24 h进样,每次进样10 μL,测得黄芪甲苷峰面积,计算RSD值,要求该值小于3%。
1.2.4.4重复性试验。取同一黄芪中粉2 g,按“1.2.2”方法平行制备供试品溶液6份,每次进样10 μL,测得黄芪甲苷含量,计算RSD值,要求该值小于3%。
1.2.4.5加样回收率试验。取已知含量的同一黄芪中粉1 g,精密称定,加入黄芪甲苷对照品溶液(0.431 6 mg/mL)5 mL,平行6份,按“1.2.2”方法制备供试品溶液,进样10 μL,测得黄芪甲苷含量,计算加样回收率和RSD。
1.2.5样品含量测定。取市售3批黄芪药材样品,按“1.2.2”方法制备供试品溶液,按照“1.2.3”色谱分析条件,测定黄芪甲苷的峰面积,计算含量。
2 结果与分析
2.1供试品溶液的制备方法按“1.2.2.1”方法操作,结果显示,索氏提取、回流提取和超声提取测得黄芪甲苷含量分别为0.178%、0.180%和0.159%,表明回流提取所得黄芪甲苷含量较高。按“1.2.2.2”方法操作,100 mL甲醇、100 mL水和100 mL 50%甲醇作为溶剂进行加热回流提取,测得黄芪甲苷含量分别为0.179%、0.203%和0.236%,表明提取溶剂为50%甲醇时所得黄芪甲苷含量较高。按“1.2.2.3”方法操作,结果显示,提取次数分别为1、2和3次所测得黄芪甲苷含量分别为0.197%、0.242%和0.235%,表明提取2次即可将黄芪中的黄芪甲苷提取完全。由此可见,黄芪药材中黄芪甲苷最优提取方法为每次用50倍的50%甲醇加热回流提取2次,每次1 h。
2.2色谱条件及系统适应性试验从图1可以看出,在相同的色谱条件下,供试品与对照品在相同的保留时间(7.7 min)出峰,且分离度较大,说明此条件适合该样品测定黄芪甲苷。
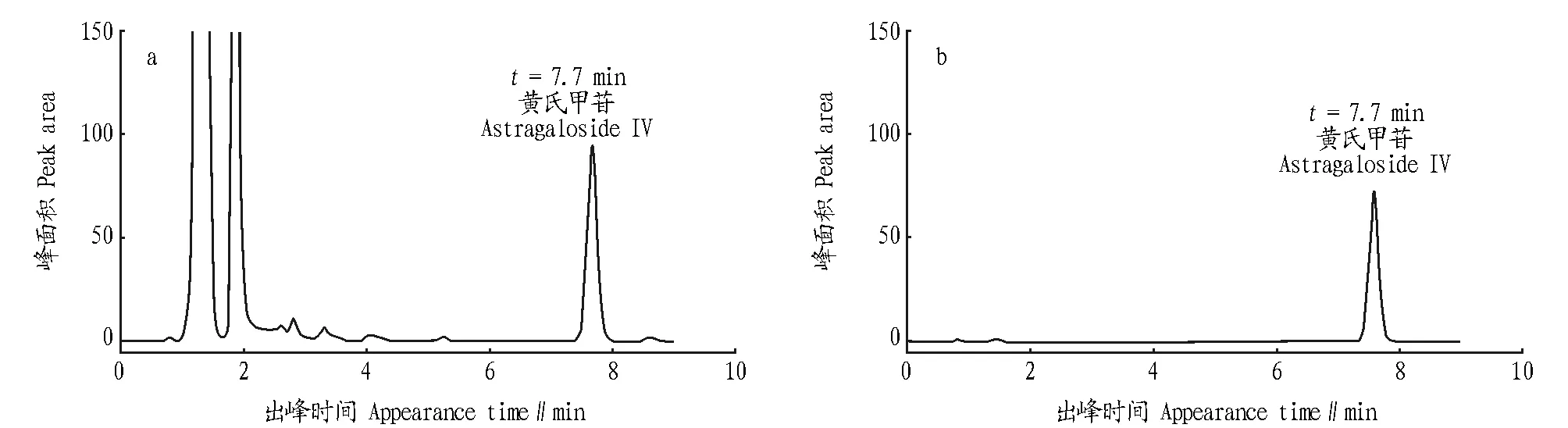
图1 供试品溶液(a)和对照品溶液(b)的HPLC图谱Fig. 1 HPLC of tested solution (a) and reference solution (b)
2.3方法学考察
2.3.1线性关系的考察。以对照品峰面积对数(y)为纵坐标、进样量对数(x)为横坐标绘制标准曲线,计算得回归方程为Y=1.571 9x+5.407 9(r=0.999 5),表明黄芪甲苷进样量在1.26~6.31 μg范围内进样量对数与峰面积对数呈良好的线性关系。
2.3.2精密度试验。按“1.2.4.2”方法操作,计算得峰面积的RSD为1.3%,表明精密度良好。
2.3.3稳定性试验。按“1.2.4.3”方法操作,计算得峰面积的RSD为2.0%,表明供试品溶液在24 h内稳定。
2.3.4重复性试验。按“1.2.4.4”方法操作,计算得平均含量为0.242%,RSD为2.1%,表明重复性良好。
2.3.5加样回收率试验。由表1可见,平均回收率为99.4%,RSD为2.2%,表明该方法准确、可靠,可用于黄芪药材中黄芪甲苷的含量测定。
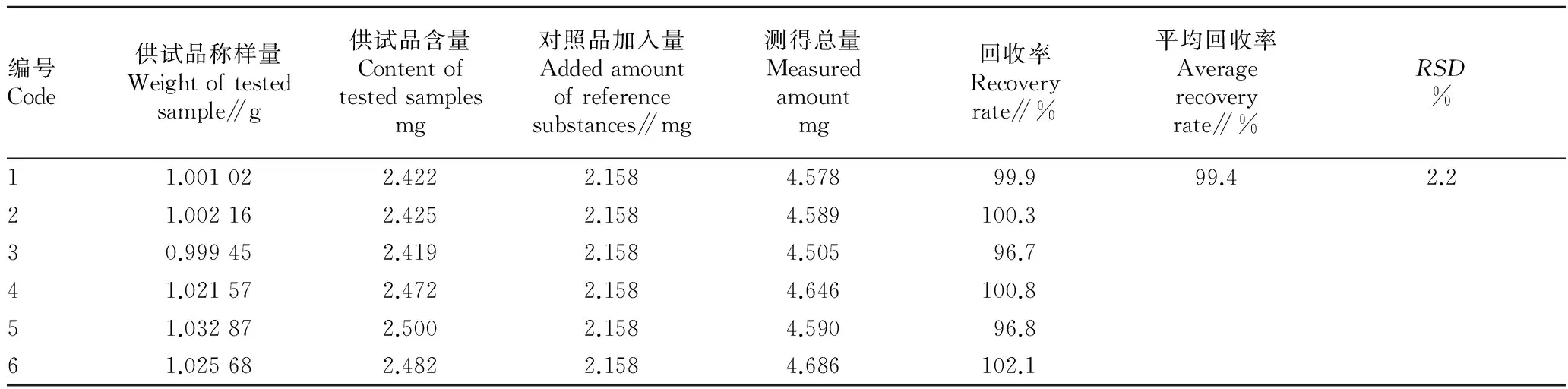
表1 加样回收率试验结果
2.4样品含量测定方法确定并验证后,取市售3批黄芪药材样品进行药材中的黄芪甲苷含量测定。由表2可见,3批黄芪药材中黄芪甲苷含量分别为0.242%、0.118%和0.209%,其含量均远大于《中国药典》2010年版中黄芪药材中的黄芪甲苷含量标准(0.040%)。

表2 3批样品含量测定结果(n=3)
3 小结
(1)通过对提取方式、提取溶剂、提取次数3个因素进行考察,黄芪药材中黄芪甲苷最优提取方法为每次用50倍的50%甲醇加热回流提取2次,每次1 h。
(2)与《中国药典》2010年版相比,改进后的方法,简化了样品的制备过程,简便、省时,可作为黄芪药材及其制剂中黄芪甲苷的检测方法。该试验采用的方法测得黄芪甲苷的含量高于药典方法,若以此法测定黄芪中黄芪甲苷的含量,其含量限度的制订尚待进一步深入研究。
[1] 国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社, 2010:283-284.
[2] 段立军,孙博航.黄芪甲苷的研究进展[J].沈阳药科大学学报,2011,28 (5):410-416.
[3] 王春怡,叶雪兰,李卫民,等.黄芪总皂苷提取物的质量标准研究[J].时珍国医国药, 2012,23(1):94-96.
[4] 潘细贵,汪洋,雷湘,等.大孔吸附树脂纯化黄芪总皂昔的提取工艺研究[J].中国医院药学杂志, 2005,25(11):1029-1030.
[5] 刘浩文,刘嘉仪,杨妙荣,等.黄芪药材中黄芪甲苷含量测定的两种方法的比较研究[J].中药新药与临床药理,2011,22(6):659-662.
[6]丁如贤,李霞,李一珺,等.黄芪药材、饮片中黄芪甲苷含量测定方法的改进[J].世界中医药,2013,8(6):669-671.
[7] 姜丽丽,张传领,苏丽娟,等.HPLC-UV法测定黄芪干燥根中黄芪甲苷的含量[J].安徽农业科学,2014,42(22):7381-7383.
Improvement in Extraction Method of Astragaloside IV
LI Huan-juan, ZHANG Cong, HAO Jie
(National Research Center for Veterinary Medicine / Luoyang Huizhong Animal Medicine Co. , Ltd., Luoyang, Henan 471000)
[Objective] The aim was to improve the extraction method of astragaloside IV from Astragali Radix. [Method] Three factors including extraction method, extraction solvent and extraction times were studied through single-factor test. HPLC-ELSD method was adopted to analyze the determination results of astragaloside IV. [Result] The best extraction method of astragaloside IV in Astragali Radix was as follows: 50 times of 50% methanol was added, heated reflux extraction was adopted for two times with 1 hours for each extraction. [Conclusion] The improved method is simple, accurate and reproducible, which can supply a reference for extraction and determination of Astragali Radix.
Astragali Radix; Astragaloside IV; Extraction method; Optimization
李焕娟(1989- ),女,河南平顶山人,硕士,从事中药制剂工艺研究。
2016-06-24
S 567
A
0517-6611(2016)22-125-03
