阳极氧化制备TiO2纳米管阵列的生长特性
2016-09-23邹俭鹏唐宁馨李红超杨洪志潘一峰
邹俭鹏,唐宁馨,李红超,杨洪志,肖 平,潘一峰
阳极氧化制备TiO2纳米管阵列的生长特性
邹俭鹏1,唐宁馨1,李红超1,杨洪志1,肖 平2,潘一峰2
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 中南大学 湘雅医院,长沙 410008)
基于TiO2纳米管薄膜的广泛应用前景,采用阳极氧化的方法制备高度规则排列的TiO2纳米管阵列,研究外加电压、阳极氧化时间、电解液(NH4F+乙二醇)浓度、电解液体系对纳米管阵列生长特性的影响。结果表明:随着外加电压从10 V增大到30 V,纳米管的管径和管壁逐渐由22 nm和4.5 nm分别增至82 nm和10 nm,而纳米管密度由2240 μm−2降至200 μm−2。纳米管阵列出现的临界阳极氧化时间为5 min,且随着氧化时间延长,纳米管的长度随之增加,当氧化时间增至2 h时,纳米管长度增至4 μm,此后,纳米管长度不再增长。在含F−的有机电解液体系中可制备规则的纳米管阵列,当电解液(NH4F+乙二醇)浓度增加到0.2 mol/L后,出现清晰的纳米管管状结构,这是由于F−和乙二醇的存在对于TiO2纳米管阵列的形成具有至关重要的作用,F−与Ti4+形成的[TiF6]2−能延缓钛箔阳极的氧化进程,促使钛箔表面形成微孔;而乙二醇则有助于提高电解液的黏度,降低F-的扩散速率,保证TiO2纳米管阵列的稳定生长。
TiO2;阳极氧化法;纳米管阵列;生长特性
二氧化钛是一种重要的无机功能材料,由于其具有无毒、气敏、湿敏、介电效应、光电转换、光致变色及催化活性高、稳定性好等优点[1−3]而被广泛应用于自洁材料、介电材料、催化剂载体、传感器、光催化太阳能电池、光裂解水制氢以及光催化降解大气和水中污染物等领域[4−5]。TiO2纳米管具有较大的比表面积,因此,其光电性、吸附性、光催化性以及与其他纳米物质的复合等方面的性能都比一般的TiO2粉优越。例如TiO2纳米管对染料活性艳红X-3B的光催化脱色活性比原料TiO2的提高2.1倍(以半衰期作比较,TiO2纳米管的半衰期为20 min,原料TiO2的半衰期为62 min),这与比表面积的增大倍数相当[10]。如果能在管中填充更小的无机、有机、金属或磁性纳米颗粒形成一维复合纳米材料,将会大大改善TiO2的光电、电磁、催化及抗菌等性能。
目前,对TiO2纳米管薄膜及掺杂改性的纳米TiO2复合材料的制备、结构相变及其应用已进行了较多研究。其中,二氧化钛纳米管的制备方法主要有3种:水热法、模板法、阳极氧化法[11−12]。其中,阳极氧化法由于能制备性能良好、排列整齐的TiO2纳米管阵列而受到广泛关注[13−15],其管壁、管径适宜,具有半导体特性,通常为无定形态,由于TiO2纳米管生长在Ti基体上,易制备为器件,有利于回收。
TiO2纳米管的形貌可通过制备参数来控制,其晶型与退火温度密切相关,阳极氧化法制备的TiO2纳米管经热处理后为纳米晶结构,平均晶粒尺寸随着退火温度升高而增大,氮气气氛下退火可拓宽TiO2由锐钛矿型向金红石型结构转变的热处理温度范围,在纯Ti表面一步制得原位生长的自组织TiO2纳米管阵 列[16−17]。 通过研究TiO2纳米管的结构特性和阳极氧化参数之间的关系,获得了大直径纳米管的制备工艺,且其可见光催化降解染料的去除率大幅提高[18−19]。采用简单快速的方法制备长度为23 μm、直径为29 nm、不含表面纳米纤维层的高度规则排列的TiO2纳米管,这种新型形貌的关键控制因素是搅拌速率和电解液温度[20]。这些研究结果表明:阳极氧化电压、电解液种类、电解液浓度、生长时间、退火温度会影响纳米管的管径、管壁厚度、密度、管长、晶型等生长特性,从而影响纳米管薄膜的性能。本文作者在这些研究的基础上,对TiO2纳米管的生长特性进行系统研究,通过设置不同的阳极氧化参数值,获得TiO2纳米管不同的微观结构和物理特征和各种参数对二氧化钛纳米管薄膜生长特性的影响规律,为TiO2纳米管的实际应用提供理论指导。
1 实验
1.1 实验材料
钛箔(购自Good Fellows Co.,USA,纯度99.99% (质量分数))表面光滑平整,不需要另外进行打磨抛光等机械加工,以免受到机械加工的损伤而影响实验结果。在每次实验之前,钛片需要依次用丙酮、无水乙醇、去离子水在超声浴下分别清洗10 min。阳极氧化过程采用双电极体系,处理好的钛片为阳极,铂片作为阴极。由于NH4F在乙二醇中的溶解度不高,所以所配制的电解液需要在每次实验前静置24 h以促进溶解。
1.2 实验方法
分别从电压(5、10、15、20、25、30 V)、氧化时间(5 s、30 s、5 min、10 min、 30 min、1 h、2 h和4 h)、NH4F浓度(0、0.1、0.2、0.3、0.4、0.5和1 mol/L)、电解质种类(NH4F+H2O、NH4F+乙二醇、NH4NO3+乙二醇)等4个参数进行对照试验(见表1)。制备得到的样品用去离子水清洗,然后在无水乙醇中超声5 min,用吸水纸吸干。采用场发射扫描电镜(FESEM)和能谱仪(EDAX)对试样进行表征。
2 结果与分析
2.1 电解液为NH4F+乙二醇时外加电压对TiO2纳米管阵列的影响
不同电压下阳极氧化制备的TiO2纳米管阵列放大10万倍的照片如图1示,所用电解液为0.27 mol/L的NH4F+乙二醇溶液(其中加入2%(体积分数)的去离子水)。在电压为5 V时(见图1(a)),TiO2薄膜层已经形成,但仅观察到垂直生长的无序纳米纤维结构,不能观察到清晰的管状结构,即TiO2纳米管阵列还未形成。在含F-的电解液中TiO2纳米管的形成过程大致分为3个阶段:第一阶段,初始氧化膜的形成。当施加电压的瞬间,阳极电流增大,阳极钛快速溶解,迅速反应在阳极表面形成致密的高阻值初始氧化膜(阻挡层)[21−23]。第二阶段,多孔氧化膜的形成。在阻挡层形成后,膜层承受的电场强度急剧增大,电场的极化作用削弱了氧化膜中Ti—O键的结合力,由于膜层的成分、膜层中的应力与结晶等因素的影响,使得膜层的表面能量分布不均,引起溶液中的F-在高能部位聚集并强烈溶解该处氧化物,氧化膜表面变得凹凸不平,氧化膜溶解形成孔核,孔核又因持续进行的场致和化学溶解过程而扩展为微孔,从而形成多孔氧化膜结 构[23−24];第三阶段,以微孔为核,规则排列TiO2纳米管阵列稳定匀速生长。因此,5 V电压下不能形成TiO2纳米管阵列的可能是由于5 V电压所能提供的能量过小,只能在第二阶段形成孔径非常小的微孔,从而使TiO2纳米管以此微孔为核生长时,纳米管间连成比较模糊的一片,没有清晰的界面,无法辨识管径、壁厚等。
当外加电压增加到10 V时(见图1(b)),TiO2纳米管阵列的管状结构逐渐变得清晰,纳米管直径很小,外径约为22 nm,管壁约为4.5 nm,单位面积的纳米管密度约为2240 μm−2。外加电压为15 V时(见图1(c)),薄膜管状结构较10 V时更加清晰,外径约为32 nm,管壁约为6 nm,密度约为1030 μm−2。当外加电压增至20 V时(见图1(d)),TiO2纳米管生长成排列规整、分布均匀、界面清楚可测的阵列,此时,外径约为55 nm,管壁约为7 nm,密度约为370 μm−2。当电压为25 V时(见图1(e)),管状结构则更加规整,外径更大,约为64 nm,管壁约为8 nm,密度更小,约为250 μm−2。当电压为30 V时(见图1(f)),外径约为82 nm,管壁约为10 nm,密度约为200 μm−2。

图1 电解液为NH4F+乙二醇时不同电压下阳极氧化4 h制备的TiO2纳米管阵列的FESEM像
电解液为NH4F+乙二醇时外加电压对TiO2纳米管阵列生长特性的影响如图2所示。由图2可知,阳极氧化电压对TiO2纳米管的管径、壁厚、密度均有影响,随着电压增加,纳米管的管径随之增加,壁厚增大,密度减小。TiO2纳米管制备时阳极氧化电压一般控制在25~30 V。这是由于太小的电压不易形成TiO2纳米管结构,而过大的电压又容易形成海绵多孔结 构[19, 21]。

图2 电解液为NH4F+乙二醇时外加电压对TiO2纳米管阵列生长特性的影响
2.2 电解液为NH4F+乙二醇时氧化时间对TiO2纳米管薄膜的影响
不同阳极氧化时间制备的TiO2纳米管阵列薄膜FESEM形貌如图3所示(氧化电压均为30 V),所用电解液仍为0.27 mol/L的NH4F的乙二醇溶液(其中加入2%(质量分数)的去离子水)。由图3(a)和(b)可知,阳极氧化5 s和30 s时,尚未得到纳米管阵列,而是疏松多孔状的薄膜。在图3(b)中的插图中,观察到在疏松孔状结构下面有一层很薄的类管状结构的薄膜,厚度大约是120 nm。阳极氧化5 min和10 min后(见图3(c)和(d)),规则排列管状结构TiO2纳米管阵列已基本形成,但疏松多孔层结构仍然存在。阳极氧化30 min后(见图3(e)),纳米管上方生长出一层与疏松多孔状结构不一样的纳米纤维,呈纵横交错网络状结构。阳极氧化1 h后(见图3(f)),网络结构纳米纤维层出现。阳极氧化2 h后(见图3(g)),纳米纤维继续生长,纤维网络特征显著。阳极氧化4 h后(见图3(h)),纤维网络结构变化不大,基本稳定。

图3 电解液为NH4F+乙二醇时不同氧化时间制备的TiO2纳米管薄膜FESEM像
电解液为NH4F+乙二醇时阳极氧化不同时间所得TiO2纳米管长度如图4所示,阳极氧化时间5 s、30 s、5 min、10 min、30 min、1 h、2 h、4 h相应的纳米管长度分别为84 nm、105 nm、300 nm、500 nm、1.5 µm、2.5 µm、4 µm、4 µm。随着氧化时间的延长,纳米管的长度(薄膜的厚度)不断增加[21],但在制备时间2 h后,纳米管的长度基本稳定在4 µm。由于随着氧化进程的推进,由于电解液中F−浓度不断降低,纳米管中物质的传质过程不断减慢,因此纳米管的生长速度不断减小。当纳米管的生长速度与TiO2的腐蚀速度相等时,纳米管的溶解速度与生长速度达到平衡,此时纳米管的长度达到极限值[20]。
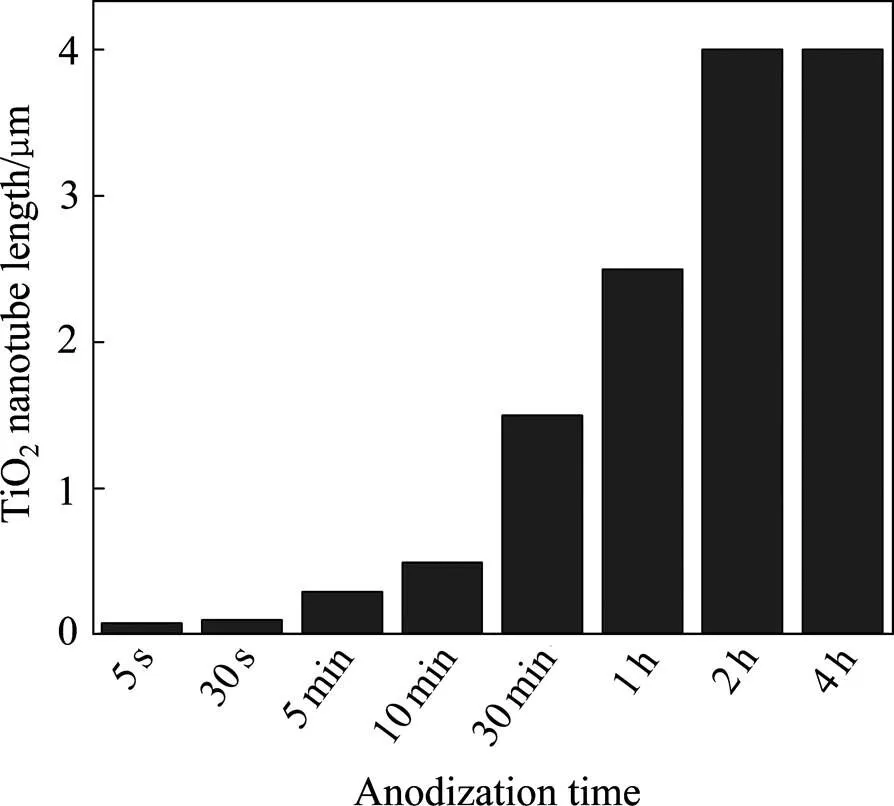
图4 电解液为NH4F+乙二醇时阳极氧化时间对TiO2纳米管长度的影响
阳极氧化法制备的TiO2纳米管薄膜随着纳米管长度不断增加,在纳米管顶部生成一层网络结构纳米纤维层[21−24]。纳米纤维层产生的原因是由于当TiO2纳米管生长到一定长度时,要保持高度规则阵列的能量很大,体系逐渐变得不稳定,纳米管以竹子撕裂的方式裂开形成纳米纤维,并最终形成一层网络结构纳米纤维层以释放能量,使整个体系的能量降低,维持薄膜体系能量的稳定[25−26]。
2.3 电解液为NH4F+乙二醇时电解液浓度对TiO2纳米管薄膜的影响
电解液为NH4F+乙二醇时不同NH4F浓度下所制备的纳米管阵列的形貌如图5所示(阳极氧化电压30 V、氧化时间2 h)。当NH4F浓度为0 mol/L时,即电解液仅为98%乙二醇+2%H2O(质量分数)的混合液,不能制备TiO2纳米管结构(见图5(a)),由此说明F−在TiO2纳米管生长过程中具有重要作用,主要通过将TiO2部分溶解于含F−的电解质及与大部分在电场力作用下溅射到电解液中的Ti4+(大于85%)反应来发挥作用,见式(1)、(2)和(3)。

