葡萄中白藜芦醇合成的影响因素
2016-09-22李海山袁军伟
李海山,谭 鑫,袁军伟
(1.河北省农林科学院,河北 石家庄 050031;2.石家庄市科技信息研究所,河北 石家庄 050051;3.河北省农林科学院昌黎果树研究所,河北 昌黎 066600)
葡萄中白藜芦醇合成的影响因素
李海山1,谭鑫2,袁军伟3*
(1.河北省农林科学院,河北石家庄050031;2.石家庄市科技信息研究所,河北石家庄050051;3.河北省农林科学院昌黎果树研究所,河北昌黎066600)
白藜芦醇是葡萄中一类重要的酚类化合物,在人类抗肿瘤、控制血糖疾病、预防心血管疾病、抗炎和保护神经系统等方面发挥着重要作用。其合成的主要影响因素包括内在因素和外在因素2种,其中,内在因素主要是基因控制、葡萄品种及其发育期,外在因素则包括紫外线辐射以及水杨酸、茉莉酸甲酯、多糖或寡聚糖类物质等诱导。在自然条件下葡萄中白藜芦醇的合成量很少,要想使得葡萄内白藜芦醇的合成量足够大并满足市场需求,就必须辅以外界的诱导因素,因此,研究葡萄生长发育过程中白藜芦醇合成的影响因素具有重要意义。
葡萄;白藜芦醇;白藜芦醇合成酶
白藜芦醇是一类重要的酚类化合物(图1),在人类抗肿瘤、控制血糖疾病、预防心血管疾病、抗炎和保护神经系统等方面发挥着重要作用。天然白藜芦醇以游离态和糖苷结合态存在,包括顺式和反式,其中,反式异构体的抗氧化功能强于顺式。20世纪70年代,人们首次发现葡萄中含有白藜芦醇,且含量较高,可达到50~100 mg/kg,其中多是结构和生物活性较为稳定的反式异构体——3,5,4’-三羟基反式芪。
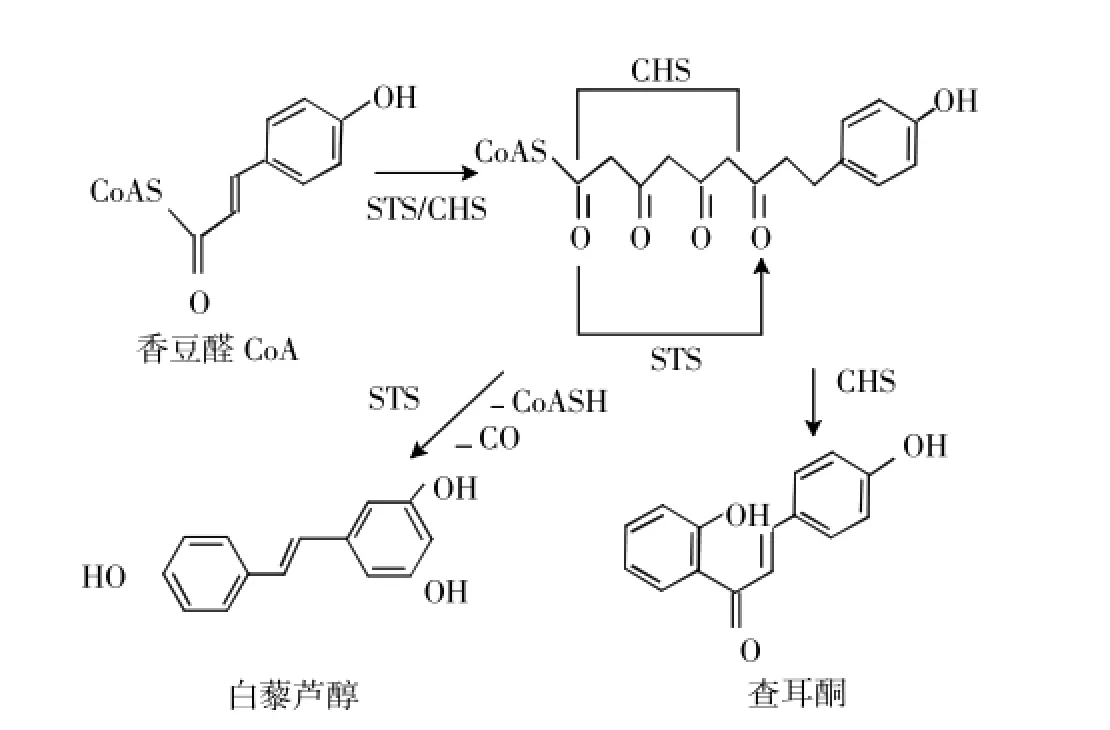
图1 白藜芦醇的生物合成[1]Fig.1 The biosynthesis of reveratrol
1 影响白藜芦醇合成的内在因素
1.1白藜芦醇合成酶
白藜芦醇合成酶(Stilbene synthase,STS)基因的调控是影响葡萄白藜芦醇合成最关键的内在因素。葡萄中的STS基因早在1994年即被克隆[2],STS是白藜芦醇合成的关键酶[1],亚细胞定位于葡萄果皮细胞的内质网、细胞核、叶绿体和细胞壁上[3]。随着葡萄果实成熟,果皮细胞的STS减少,直接导致白藜芦醇含量减少[4]。
1.2品种及发育期
葡萄品种及其发育期是影响葡萄中白藜芦醇合成的主要内在因素。葡萄品种及其发育期不同,葡萄果皮和种子的白藜芦醇含量也不一样。如,种间杂交砧木品种果皮和种子的白藜芦醇含量明显高于其他品种,尤其甜山葡萄×河岸葡萄有2个杂交后代果皮和种子的白藜芦醇含量分别超过了100 μg/g(FW)和20 μg/g(FW),欧亚种和欧美杂种大部分栽培品种果皮和种子的白藜芦醇含量低于2 μg/g(FW),有核品种的白藜芦醇含量显著高于无核品种,酿酒品种高于鲜食品种,红色品种高于绿色品种。‘北红’和‘北全’果皮的白藜芦醇含量在始熟前变化幅度小且处于一个较低的水平,自始熟后开始迅速增加,并在成熟时达到最高含量水平;而‘红瑞宝’和‘井川1055’果皮的白藜芦醇含量在整个果实发育过程中始终保持较低水平[5~7]。
2 影响白藜芦醇合成的外在因素
白藜芦醇是植物产生的一种抗毒素,多由外来病菌侵入、紫外线照射等不利因素诱导而产生。葡萄植株受到胁迫时,引起植株体内某些信号分子或多糖、寡糖类物质的改变,进一步诱导白藜芦醇的合成。影响葡萄白藜芦醇合成的外在因素很多,其中,非生物胁迫主要包括紫外线辐射以及水杨酸、茉莉酸甲酯、多糖或寡聚糖类物质、乙烯利等诱导,生物胁迫主要包括真菌侵染。
2.1非生物胁迫
2.1.1紫外线诱导日光中的紫外线分为A波段
(UV-A,波长320~400 nm)、B波段(UV-B,波长290~320 nm)和C波段(UV-C,波长200~290 nm)3个波段,其中,UV-B和UV-C均能诱导葡萄白藜芦醇含量的增加,且UV-C对葡萄白藜芦醇的诱导效果显著高于UV-B[8,9]。而日光中的UV-C在穿过地球大气层时几乎被全部吸收,所以,葡萄在自然日光下并不能大量合成白藜芦醇[10]。因此,要想使得葡萄花、叶、果实的白藜芦醇含量显著增加,必须使用外源UV-C处理。目前UV-C处理已经广泛应用于诱导白藜芦醇等植物次生代谢产物的合成,以提高果蔬的采后品质[11]。
2.1.2水杨酸诱导水杨酸是植物响应逆境胁迫的重要信号分子,通常通过诱导增加植物抗性物质含量来提高植物的抗逆性。白藜芦醇作为葡萄中的一种抗性物质,也同样受到水杨酸的诱导。采用水杨酸处理葡萄悬浮细胞体系后,胞内外的白藜芦醇含量均可显著增加[12]。
2.1.3茉莉酸甲酯诱导茉莉酸甲酯是茉莉酸的甲基化衍生物,具有更高的活性,在植物受到胁迫时会诱导多种次生代谢产物合成。采用茉莉酸甲酯处理‘巴贝拉’葡萄悬浮细胞体系,发现胞内外反式白藜芦醇和顺式白藜芦醇含量均显著增加[13]。
2.1.4多糖或寡聚糖类物质诱导常见的用于诱导葡萄白藜芦醇合成的多糖或寡聚糖类物质主要包括壳聚糖、环状糊精以及来源于褐藻的昆布多糖等。用壳聚糖处理‘巴贝拉’葡萄悬浮细胞,可使胞内反式白藜芦醇含量显著增加,同时胞外反式白藜芦醇含量降低[14]。二甲基环状糊精也可诱导悬浮细胞体系胞内外反式白藜芦醇含量的显著增加,且与茉莉酸甲酯表现出较强的协同作用[15~17]。
2.2真菌侵染
当葡萄受到真菌侵染时,体内的STS表达量显著增加,从而促使白藜芦醇大量合成[18]。另外,当葡萄受到真菌激发子诱导时,STS表达量也会显著上调[19]。
3 发展前景
葡萄及其加工产品是食物和药品中白藜芦醇的主要来源,自然条件下常用葡萄品种的白藜芦醇合成量很少,利用砧木品种进行种间杂交或人工诱导的方法培育果实产量高、白藜芦醇含量高的葡萄新品种,才能使得葡萄体内的白藜芦醇含量提升。另外,在分子水平上研究白藜芦醇合成的基因表达,也有助于利用基因工程促进葡萄白藜芦醇的合成与提升。以满足巨大的市场需求。
[1]Tropf S,Kärcher B,Schröder G,Schröder J.Reaction mechanismsofhomodimericplantpolyketidesynthases(stilbene and chalcone synthase)[J].Journal of Biological Chemistry,1995,270(14):7922-7928.
[2]Sparoli F,Martin C,Scienza A,Gaazzi G,Tonelli C. Cloningandmolecularanalysisofstructuralgenesinvolved in flavonoid and stilbene biosynthesis in grape(Vitis vinifera L.)[J].Plant Molecular Biology,1994,24(5):743-755.
[3]Wang W,Tang K,Yang Hr,Wen Pf,Zhang P.Distribution of resveratrol and stilbene synthase in young grape plants(Vitis vinifera L.cv.Cabernet Sauvignon)and the effect of UV-C on its accumulation[J].Plant Physiology Biochemistry,2010,48(2-3):142-152.
[4]Fornara V,Onelli E,Sparvoli F,Rossoni M,Aina R. Localization of stilbene synthase in Vitis vinifera L.during berry development[J].Protoplasma,2008,233(1-2):83-93.
[5] Versari A,Parpinello Gp,Tornielli Gb,Ferrarini R,Giulivo C.Stilbene compounds and stilbene synthase expression during ripening,wilting and UV treatment in grape cv.Corvina[J].Journal of Agricultural&Food Chemistry,2001,49(11):5531-5536.
[6]Li XD,Wu BH,Wang LJ,LI SH.Extractable amounts of trans-resveratrol in seed and berry skin in Vitis evaluated at the germplasm level[J].Journal of Agricultural& Food Chemistry,2006,54(23):8804-8811.
[7]Pamela G,Urska V,Jost M,Cinzia S,Chiara R.Ripening and genotype control stilbene accumulation in healthy grapes[J].Journal of Agricultural&Food Chemistry,2008,56(24):11773-11785.
[8] CantosE, García-VigueraC,Pascual-TeresaSD,Tomás-Barberá FA.Effect of postharvest ultraviolet irradiation on resveratrol and other phenolics of cv.Napoleon table grapes[J].Journal of Agricultural&Food Chemistry,2000,48(10):4606-4612.
[9]Li XD,Zheng XB,Yan ST,Li SH.Effects of salicylic acid(SA),ultraviolet radiation(UV-B and UV-C)on trans-resveratrol inducement in the skin of harvested grape berries[J].Frontiers of Agriculture in China,2008,2(1):77-81.
[10]Langcake P,Pryce RJ.The production of resveratrol and the viniferins by grapevines in response to ultraviolet irradiation[J].Phytochemistry,1977,16(8):1193-1196.
[11]Cote S,Rodoni L,Miceli E,Concellón A,Civello PM. Effect of radiation intensity on the outcome of postharvest UV-C treatments[J].Postharvest Biology&Technology,2013,89:83-89.
[12]Vuong Tv,Franco C,Zhang W.Treatment strategies for high resveratrol induction in Vitis vinifera L.cell sus pension culture[J].Biotechnology Reports,2014,(1-2):15-21.
[13]Tassoni A,Fornalè S,Franceschetti M,Musiani F,Michael Aj,Perry B,Bagni N.Jasmonates and Na-orthovanadate promoteresveratrolproductioninVitisviniferacv. Barbera cell cultures[J].New Phytologist,2005,166(3):895-905.
[14]Ferri M,Tassoni A,Franceschetti M,Riqhetti L,Naldrett MJ,Baqni N.Chitosan treatment induces changes of protein expression profile and stilbene distribution in Vi tis vinifera cell suspensions[J].Proteomics,2009,9(3):610-624.
[15] Almagro L,Gutierrez J,Pedreňo MA,Sottomayor M. Synergistic and additive influence of cyclodextrins and methyl jasmonate on the expression of the terpenoid indole alkaloid pathway genes and metabolites in Catharanthusroseus cell cultures[J].Plant Cell,Tissue and Organ Culture,2014,119(3):543-551.
[16] Sabater-Jara AB,Onrubia M,Moyano E,Bonfill M,Palazon J,Pedreńo MA.Synergistic effect of cyclodextrins and methyljasmonate on taxane production in Taxus×me diacellcultures[J].PlantBiotechnologyJournal,2014,12(8):1075-1084.
[17]Lijaetzky D,Almagro L,Belchi-Navarro S,Martínez-Zapater JM,Bru I.Synergistic effect of methyljasmonate and cyclodextrin on stilbene biosynthesis pathway gene expressionandreseratrolproductioninMonastrell grapevinecellcultures[J].BMCResearchNotes,2008,(1):132.
[18]Timperio Am,D’Alessandro A,Fagioni M,Magro P,Zolla L.Production of the phytoalexins trans-resveratrol and delta-viniferin in two economy-relevant grape culturesuponinfectionwithBotrytiscinereainfield condi tions[J].PlantPhys iologyandBioche mistry,2012,50:65-71.
[19]Ramírez-Suero M,Bénard-Gellon M,Chong J,Laloue H, StempienE, Abou-MansourE, FontaineF,Lariqnon P,Mazet-Kieffer F,Farine S,Bertsch C.Extracellular compounds produced produced by fungi associated with Botryosphaeria dieback induce differential defence gene expression patterns and necrosis in Vitis inifera cv. Chardonnay cells[J].Protoplasma,2014,251(6):1417-1426.
Influence Factors on Resveratrol Synthesis in Grape
LI Hai-shan1,TAN Xin2,YUAN Jun-wei3*
(1.Hebei Academy of Agriculture and Forestry Sciences,Shijianzhuang 050031,China;2.Shijiazhuang Institute of Scientific&Technical Information,Shijiazhuang 050051,China;3.Changli Institute of Pomology,Hebei A-cademy of Agriculture and Forestry Sciences,Changli 066600,China)
Resveratrol is a kind of important phenolic compounds in grape,and plays an important role in resisting human tumor,controlling blood glucose,preventing cardiovascular disease,resisting inflammation and protecting the nervous system etc..The main factors affecting the synthesis include internal factors and external factors.The internal factors are genetic control,grape varieties and development period,the external factors include ultraviolet radiation,salicylic acid,methyl jasmonate,polysaccharides or oligosaccharides etc.Under natural conditions,there is little resveratrol in grape,to want to make more resveratrol to meet the needs of the market,it must be supplemented by external induced factors.Therefore, study the influence factors on resveratrol synthesis in grape growth and development process has important significance.
Grape;Resveratrol;Stilbene synthase(STS)
S663.1
A
1008-1631(2016)03-0067-03
2016-01-25
李海山(1980-),男,河北昌黎人,副研究员,主要从事农业科研管理工作。E-mail:lhsky@163.com。
袁军伟(1981-),男,河南焦作人,助理研究员,硕士,主要从事葡萄育种研究。E-mail:junweiyuan@126.com。
