粉末活性炭吸附-双水相萃取法提纯藻蓝蛋白工艺研究
2016-09-21盛晶梦张发宇袁梦媛汪家权
盛晶梦,张发宇,袁梦媛,汪家权
合肥工业大学资源与环境工程学院,安徽 合肥 230009
粉末活性炭吸附-双水相萃取法提纯藻蓝蛋白工艺研究
盛晶梦,张发宇,袁梦媛,汪家权*
合肥工业大学资源与环境工程学院,安徽 合肥230009
采取粉末活性炭吸附-双水相萃取的工艺方法,以巢湖新鲜蓝藻藻泥为原料提纯藻蓝蛋白,在考虑煤质粉末活性炭添加量的基础上,探究粉末活性炭纯化藻蓝蛋白的效果。通过单因素和正交试验,确定粉末活性炭吸附-双水相萃取法纯化藻蓝蛋白的最优工艺条件:PEG分子量为4 000做高聚物,PEG浓度为4%,磷酸钾盐浓度为16%,体系pH为7.0。验证试验结果表明,经过优化工艺纯化后藻蓝蛋白纯度可达到3.461 7,组合工艺回收率为63%。与传统方法相比,该工艺具有设备小、成本低、周期短等特点。
粉末活性炭;双水相;提取纯化;藻蓝蛋白
巢湖的富营养化进程加剧、蓝藻滋生,成为全国富营养化最为严重的淡水湖泊之一[1-3]。蓝藻的资源化利用已经成为巢湖蓝藻重点研究的课题[4]。目前,国内外对蓝藻处理的研究主要集中在无害化处理和资源化利用方面,以制作有机肥料和发酵制沼气为主[5-6]。但这2种方法的经济效益较低,产品附加值不高,难以市场化推广。近年来,利用蓝藻生产高附加值产品——藻蓝蛋白成为研究重点。
藻蓝蛋白是一种重要的藻胆蛋白,呈蓝色粉末状,无毒,溶于水。研究表明,藻蓝蛋白具有抗氧化性[7-8]、抗癌性[9]、抗炎性[10]、抗衰老性[11]、免疫荧光性[12-13]等特点。藻蓝蛋白纯度的高低决定了其应用和价值,纯度越高,售价越高,根据藻蓝蛋白纯度的不同可将其分为食品级(纯度>0.7)和试剂级(纯度>4.0)[14]。
国内外对藻蓝蛋白的提取纯化工艺的研究有很多[15-20],在细胞破碎和粗提阶段多采用反复冻融法、超声波破碎法或者二者相结合来破碎藻细胞,再用硫酸铵盐析沉淀出粗蛋白;在精制阶段,多为2种以上色谱技术的联用或重复多次使用。这些工艺在推广到实际工业化生产过程中往往具有操作步骤复杂、产量损失大、能耗高、周期长等问题[21]。粉末活性炭吸附法具有效果稳定、成本低等特点,多用于水处理工艺中,有关活性炭及与其他方法联合应用纯化藻蓝蛋白的研究却很少[22]。而双水相萃取技术作为近年来发展较快的新技术,在生物质纯化过程中应用较多[21]。笔者采用粉末活性炭粗提-双水相萃取的组合工艺提纯藻蓝蛋白,该方法具有操作简单、试验周期短、藻蓝蛋白纯化效率高的特点,对于藻蓝蛋白规模化生产具有十分重要的借鉴意义。
1 材料与方法
1.1材料与试剂
蓝藻原料采用实验室冷柜中储存的巢湖新鲜蓝藻藻泥,取自西湖区水华表层20 cm水体处,含水量约为96.2%,采集日期为2015年8月4日,室外温度37~38 ℃。
试剂:煤质粉末活性炭(广州市鸿生炭业化工有限公司)、盐酸(HCl,上海博河精细化学品有限公司)、氢氧化钠(NaOH,西陇化工股份有限公司)、聚乙二醇1000(PEG 1000,上海凌峰化学试剂有限公司)、聚乙二醇2000(PEG 2000,天津市致远化学试剂有限公司)、聚乙二醇4000(PEG 4000,天津市光复精细化工研究所)、聚乙二醇6000(PEG 6000,西陇化工股份有限公司)、磷酸钾盐(KH2PO4和K2HPO4,天津市致远化学试剂有限公司;KH2PO4与K2HPO4的质量比为1∶1.85)。
1.2仪器与设备
1.3分析方法
粉末活性炭粗提后藻蓝蛋白存在于上清液中,双水相萃取后藻蓝蛋白富集于体系上相高聚物中。将藻蓝蛋白溶液在波长为200~700 nm下进行紫外光谱扫描,藻蓝蛋白的纯度参考Herrera等[23]推荐的公式,藻蓝蛋白的浓度参考Soni等[24]推荐的公式。并计算出上清液中藻蓝蛋白的回收率和双水相上相中藻蓝蛋白的得率。
藻蓝蛋白纯度(P)=A620A280
藻蓝蛋白浓度(C)=(A620-0.7×A650)7.38
藻蓝蛋白回收率(Y活)=(CtVtC0V0)×100%
双水相上相中藻蓝蛋白得率(Y双)=
CAVA(CAVA+CBVB)×100%
式中:A280、A620和A650分别为波长280、620和650 nm处的吸光度;Ct为上清液中的藻蓝蛋白浓度;C0为粗提液中的藻蓝蛋白浓度;CA为双水相上相中藻蓝蛋白浓度;CB为双水相下相中藻蓝蛋白浓度;Vt为样品溶液的体积;V0为粗提液的体积;VA为双水相上相溶液的体积;VB为双水相下相溶液的体积。
1.4制备藻蓝蛋白粗提液
取-4 ℃下冷冻保存的巢湖新鲜蓝藻藻泥在室温(25 ℃)下融解,完成一次冻融破壁。重复该过程3次,将解冻后的蓝藻溶液用4层普通纱布过滤去除藻渣,所得溶液于4 ℃、8 000 rmin下离心20 min后取上清液,即得到藻蓝蛋白粗提液。
1.5藻蓝蛋白提纯
室温(25 ℃)条件下,取藻蓝蛋白粗提液20 mL,将适量粉末活性炭与粗提液充分搅拌10 min,离心取上清液,测定并计算溶液中藻蓝蛋白的纯度和回收率。将粉末活性炭处理后的上清液移入烧杯中置于磁力搅拌器上,向烧杯中逐步加入适量PEG和磷酸钾盐,并用去离子水调节,使双水相体系总质量为30 g,充分搅拌均匀使PEG和磷酸钾盐全部溶解后将溶液移入离心管,在4 ℃、6 000 rmin下离心1 min以加速体系分层,分别吸取双水相体系上下相,测定上下相体积、上下相中藻蓝蛋白纯度与浓度,计算藻蓝蛋白回收率和双水相体系分配系数。
1.6藻蓝蛋白光谱分析
分别将藻蓝蛋白粗提液和纯化后的藻蓝蛋白溶液用去离子水稀释至25倍,用紫外可见分光光度计在波长为200~700 nm进行全波段扫描。
2 结果与讨论
2.1粉末活性炭粗提藻蓝蛋白条件优化
前期试验发现,粉末活性炭添加量对其纯化藻蓝蛋白的效果影响最为显著,因此在前期试验的基础上,重点研究粉末活性炭添加量对藻蓝蛋白纯化效果的影响,结果如图1所示。
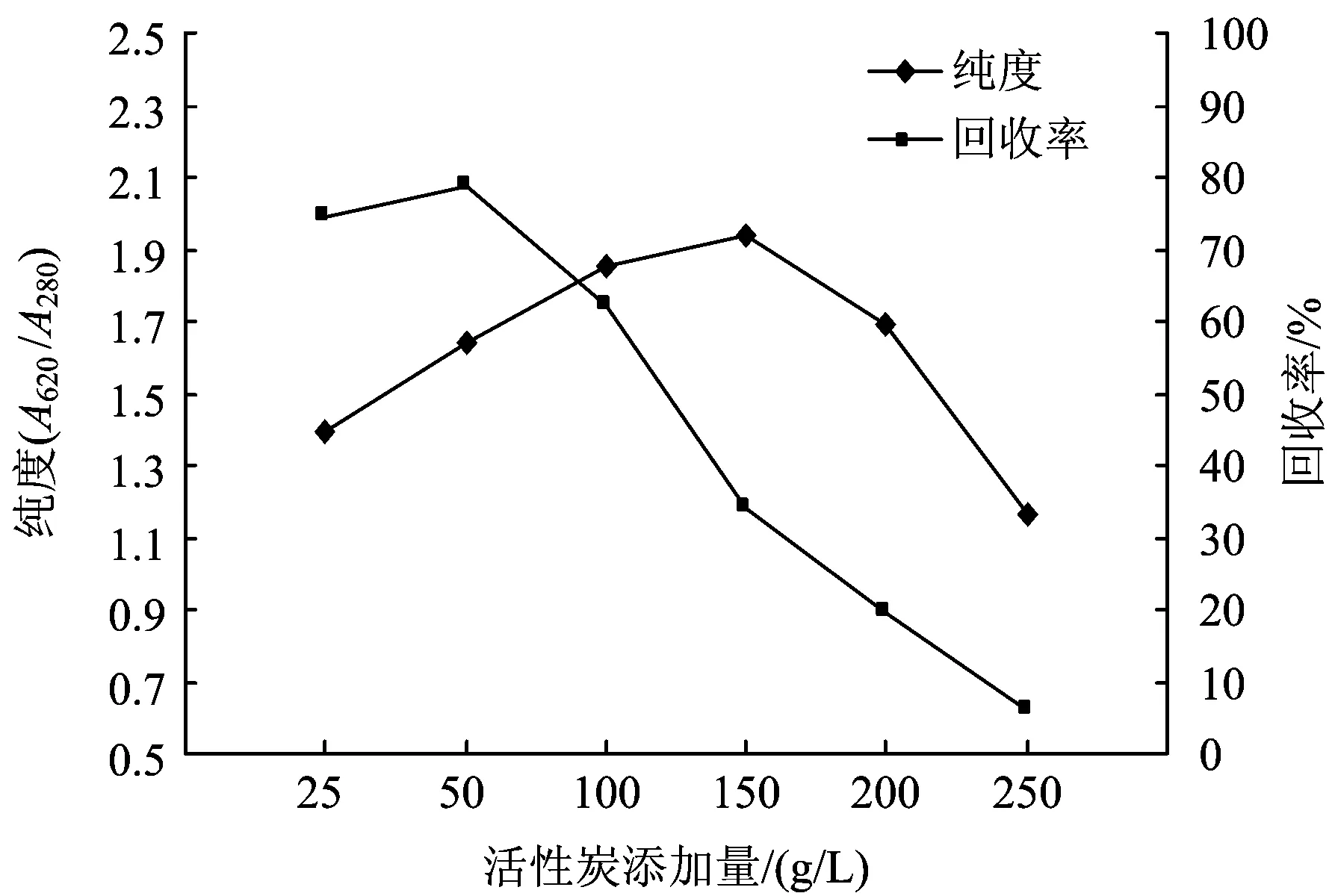
图1 粉末活性炭添加量对藻蓝蛋白纯度和回收率的影响(25 ℃)Fig.1 Effect of powered activated carbon dosage on C-phycocyanin purity and recovery(25 ℃)
由图1可知,随着粉末活性炭添加量的增加,藻蓝蛋白的纯度先增加后减少,而回收率则持续下降。这可能是由于随着粉末活性炭添加量的增加,中孔和大孔的比例增加、容积增大,对藻蓝蛋白的不可逆吸附逐渐增强,从而使藻蓝蛋白的损失量逐渐大于粉末活性炭对杂质蛋白的吸收量。综合考虑纯度和回收率,粉末活性炭的添加量定为100 gL,此时藻蓝蛋白的纯度为1.849 4,回收率为62%,溶液呈清亮的蓝色。
2.2双水相萃取藻蓝蛋白条件优化
2.2.1高聚物分子量的确定
设定磷酸钾盐浓度为20%,体系pH为7.0,PEG浓度为10%,取分子量分别为1 000、2 000、4 000、6 000的PEG进行双水相萃取试验,测定上下相体积、上下相中藻蓝蛋白纯度与浓度,计算藻蓝蛋白回收率和双水相体系分配系数,结果见图2。
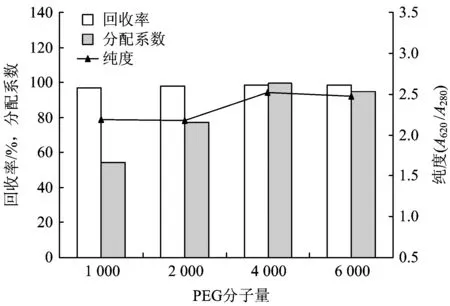
图2 PEG分子量对藻蓝蛋白萃取效果的影响Fig.2 The effect of PEG formula weight on C-phycocyanin extraction
由图2可知,随着PEG分子量的增加,藻蓝蛋白的纯度、回收率和分配系数均先增加后减少。藻蓝蛋白的纯度和回收率在PEG分子量为4 000时达到最大值,而分配系数则在PEG分子量为2 000时达到最大值。原因可能是随着PEG分子量的增加,上相的疏水性也增加,亲水性的藻蓝蛋白便转向下相。综合考虑回收率、分配系数和纯度3项指标,选取PEG分子量为4 000作为双水相萃取最优条件之一。
2.2.2PEG浓度的确定
设定磷酸钾盐浓度为20%,体系pH为7.0,PEG分子量为4 000,PEG浓度为2%~14%进行双水相萃取试验,结果如图3所示。
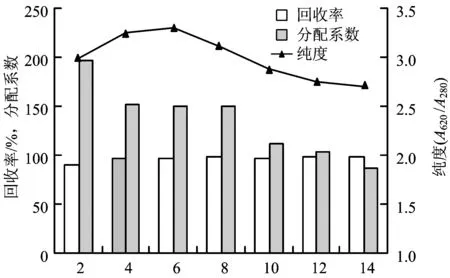
图3 PEG 4000浓度对藻蓝蛋白萃取效果的影响Fig.3 The effect of PEG 4000 concentration on C-phycocyanin extraction
由图3可知,随着PEG浓度的增加,藻蓝蛋白的纯度和分配系数缓慢下降,回收率一直处于较高水平且保持稳定。这是由于随着PEG浓度的增加,上相的黏稠度也逐渐增加,分子阻力增大,导致藻蓝蛋白越难以进入上相。综合考虑回收率、分配系数和纯度3项指标,选取PEG浓度为6%作为双水相萃取最优条件之一。
2.2.3磷酸钾盐浓度的确定
设定PEG 4000浓度为6%,体系pH为7.0,磷酸钾盐浓度为12%~24%进行双水相萃取试验,结果见图4。
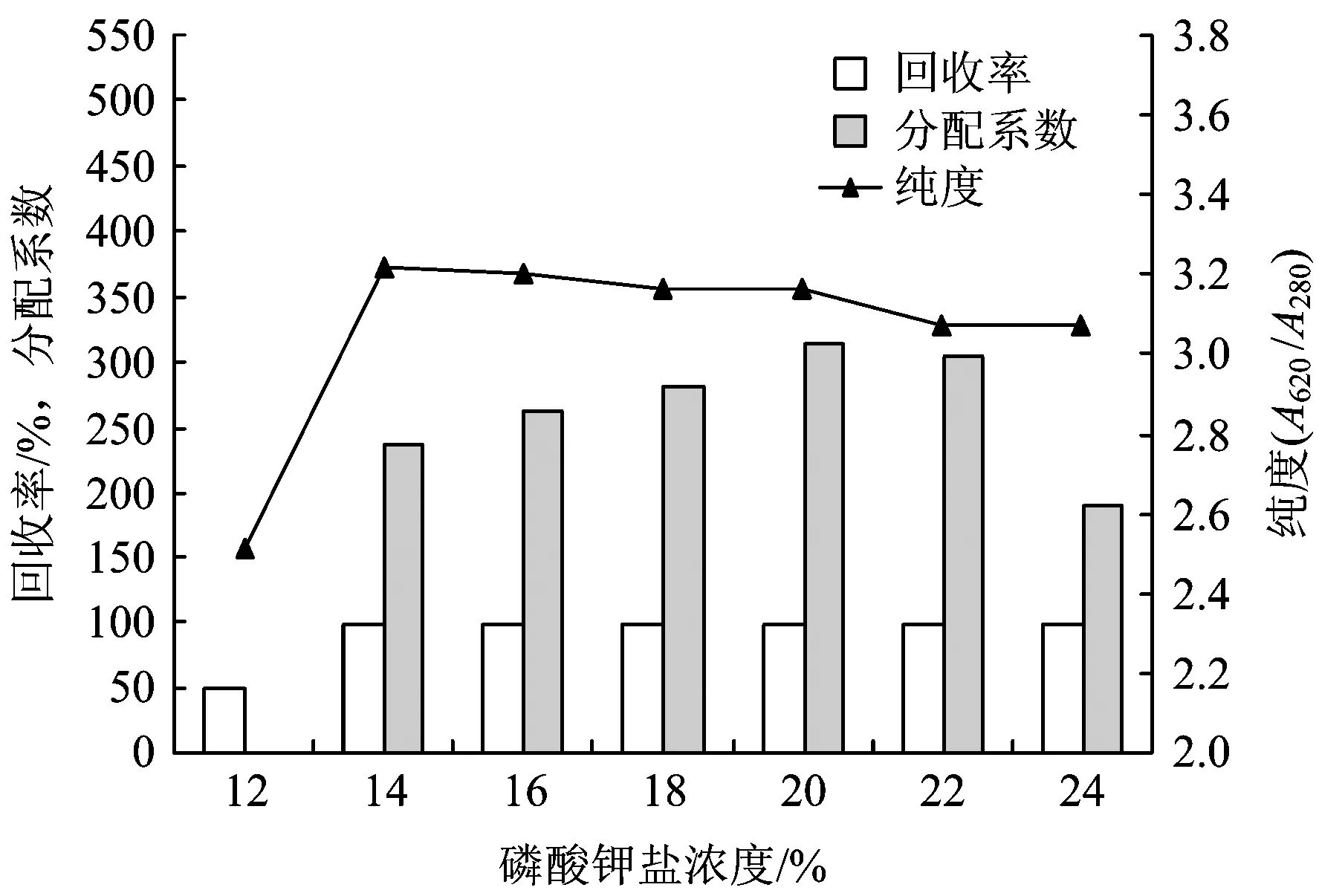
图4 磷酸钾盐浓度对藻蓝蛋白萃取效果的影响Fig.4 The effect of potassium phosphate concentration on C-phycocyanin extraction
由图4可知,随着磷酸钾盐浓度的增加,藻蓝蛋白的纯度缓慢下降,分配系数缓慢提高然后降低,回收率一直处于较高水平且保持稳定。这可能是由于随着磷酸钾盐浓度的升高,下相盐析的作用增加,藻蓝蛋白及其他杂蛋白向上相迁移;而当磷酸钾盐浓度过高时,藻蓝蛋白被部分或全部析出,上相分配系数下降。综合考虑回收率、分配系数和纯度3项指标,选取磷酸钾盐浓度为16%作为双水相萃取最优条件之一。
2.2.4体系pH确定
设定PEG 4000浓度为6%,磷酸钾盐浓度为16%,分别调节体系pH为5.0、6.0、7.0、8.0、9.0进行双水相萃取试验,结果见图5。

图5 pH对藻蓝蛋白萃取效果的影响(25 ℃)Fig.5 The effect of pH on C-phycocyanin extraction
由图5可知,随着体系pH的增加,藻蓝蛋白的纯度和分配系数先增后减,在pH为7.0时均达到最大值;藻蓝蛋白的回收率则一直保持在较高水平且基本不变。这是由于pH会改变藻蓝蛋白分子、成相分子和相界面的电性,从而改变藻蓝蛋白在上下相的分配;当体系pH为7.0时,藻蓝蛋白表面所带的静电荷几乎为0,与PEG之间的作用最强。综合考虑藻蓝蛋白的纯度、分配系数和回收率3项指标,选择体系pH为7.0作为双水相萃取的最优水平之一。
2.2.5双水相萃取正交试验
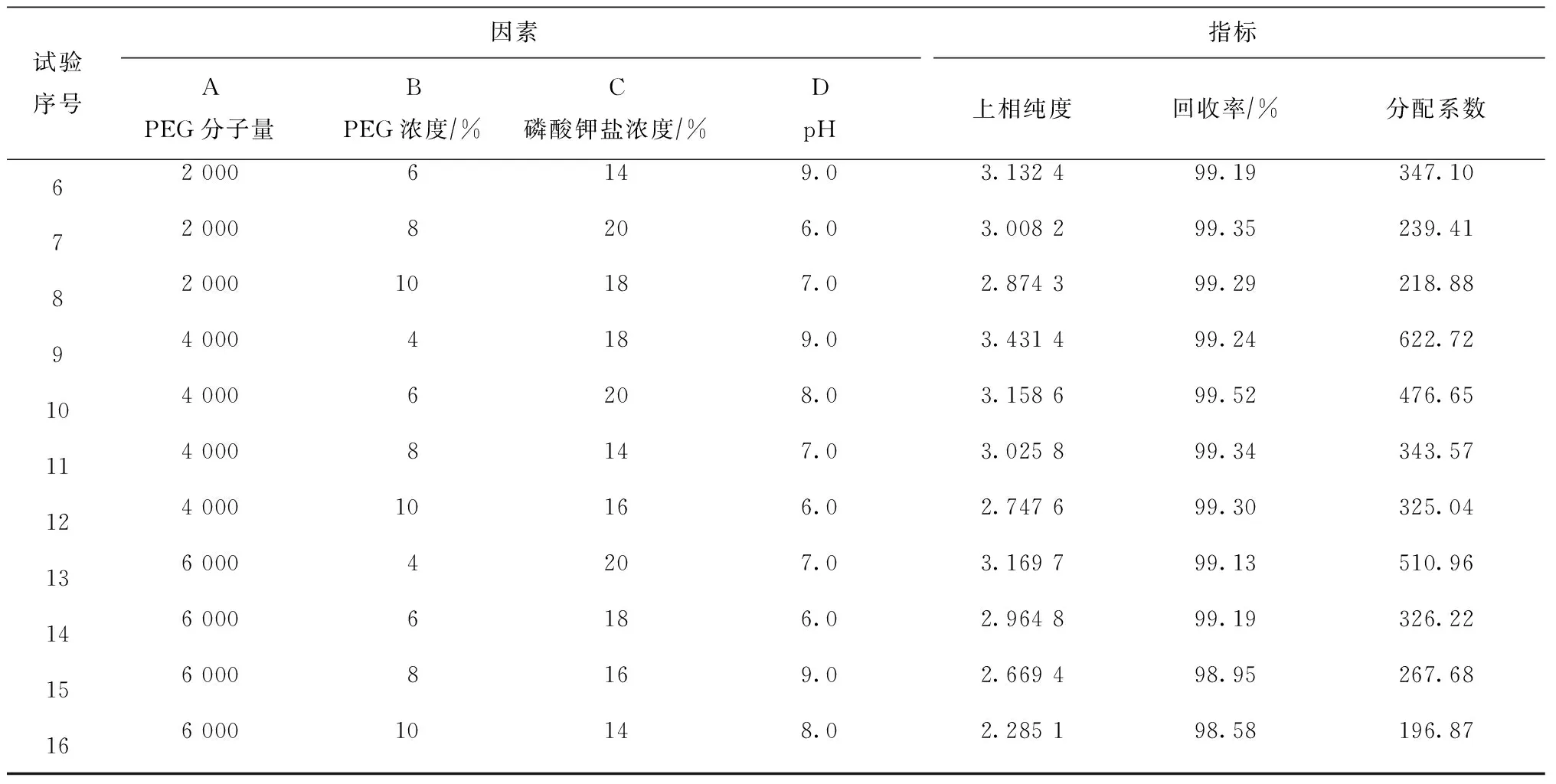
以PEG分子量、PEG浓度、磷酸钾盐浓度和体系pH为正交试验的4个因素,根据之前单因素试验的结果来确定每个因素合适的4个水平,按照L16(44)建立正交试验表进行试验,试验水平设置和结果见表1,直观分析结果见表2。

表1 双水相萃取正交试验结果
(续表1)
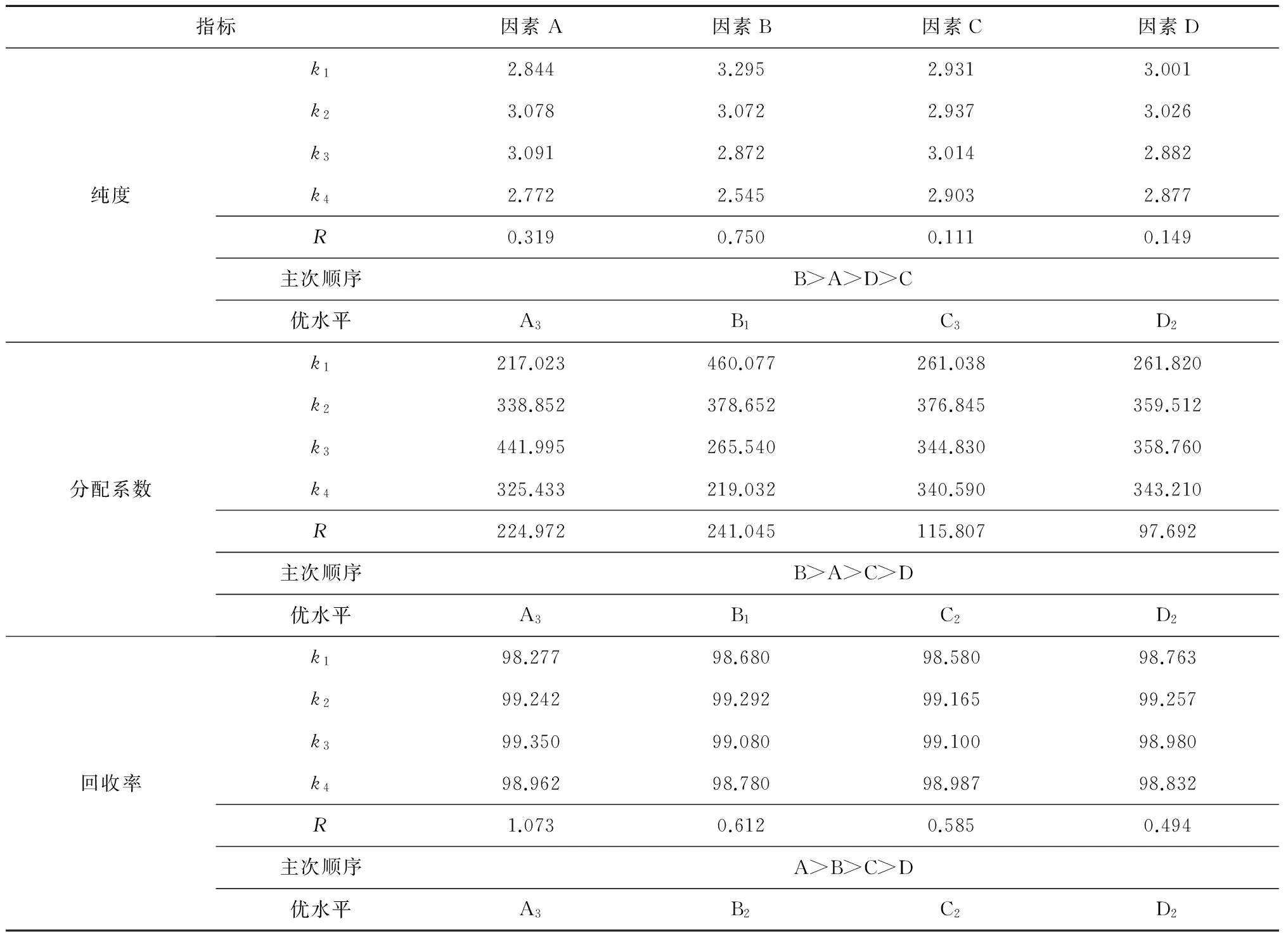
表2 双水相萃取正交直观分析
根据表2可知,因素A、D关于3个指标的优水平是一致的,所以可以直接作为最优水平;而因素B对于纯度和分配率2个指标的影响次序均为第一、优水平均为B1,对于回收率指标的影响次序为第二、优水平为B2,考虑试验指标k值减少最小原则,B因素的优水平确定为B1;同样,C因素的优水平确定为C2。综合衡量评价所有指标优组合,最终确定双水相萃取藻蓝蛋白最优工艺条件为A3B1C2D2。
在优化条件下验证试验结果表明:双水相萃取后,藻蓝蛋白的纯度为3.461 7,组合工艺综合回收率为63%。丙潇潇[25]用PEG 1000与硫酸铵组成的双水相体系纯化藻蓝蛋白粗提液,藻蓝蛋白的纯度仅能由0.57升至1.00,回收率为97.2%。由此可见,本研究所得粉末活性炭粗提-双水相萃取工艺具有设备小、成本低、操作周期短等特点,对藻蓝蛋白市场化推广具有实际指导意义。
3 结论
采用粉末活性炭吸附-双水相萃取法提纯藻蓝蛋白,通过对粉末活性炭添加量和双水相萃取条件进行优化试验,得出最优工艺条件:粉末活性炭添加量为100 gL,PEG 4000浓度为4%,磷酸钾盐浓度为16%,双水相体系pH为7.0。在最优工艺条件下,纯化后的藻蓝蛋白纯度可达3.461 7,提纯效果远好于仅使用双水相萃取藻蓝蛋白粗提液。由此可见,将粉末活性炭吸附法与双水相萃取法联合应用能够达到进一步纯化藻蓝蛋白的目的,且操作简单,纯化效率高。
[1]张民,孔繁翔.巢湖富营养化的历程、空间分布与治理策略:1984—2013年[J].湖泊科学,2015,27(5):791-798.
ZHANG M,KONG F X.The process, spatial and temporal distributions and mitigation strategies of the eutrophi-cation of Lake Chaohu:1984-2013[J].Journal of Lake Sciences,2015,27(5):791-798.
[2]王书航,姜霞,金相灿.巢湖水环境因子的时空变化及对水华发生的影响[J].湖泊科学,2011,23(6):873-880.
WANG S H,JIANG X,JIN X C.Spatial-temporal variations of aquatic environmental factors and their influences to algal blooming in Lake Chaohu[J].Journal of Lake Sciences,2011,23(6):873-880.
[3]安徽省环境保护厅.2012年安徽省环境状况公报[R].合肥:安徽省环境保护厅,2013.
[4]金相灿,屠清瑛.湖泊富营养化调查规范[M].北京:中国环境科学出版社,1990.
[5]沈银武,刘永定,吴国樵,等.蓝藻有机无机复混肥对几种作物的增效试验[J].水生生物学报,2005,29(4):399-405.
SHEN Y W,LIU Y D,WU G Q,et al. Efficiency test on organic and inorganic fertilizes with cyanobacteria(Microcystis) in several crops[J].Acta Hydrobiologica Sinica,2005,29(4):399-405.
[6]翟志军,马欢,李军,等.巢湖蓝藻产沼气的试验研究[J].安徽农业科学,2008,36(12):5084-5087.
ZHAI Z J,MA H,LI J,et al.Study on the production biogas with blue algae from Chaohu Lake[J].Journal of Anhui Agricultural Sciences,2008,36(12):5084-5087.
[7]汪兴平,谢笔均,潘思轶,等.葛仙米藻蓝蛋白抗氧化作用研究[J].食品科学,2007,28(12):458-461.
WANG X P,XIE B J,PAN S Y,et al. Study on antioxidation activities of phycocyanin fromNostocsphaeroidsKutz[J].Food Science,2007,28(12):458-461.
[8]杨立红,王晓洁,钟旭升,等.鱼腥藻藻蓝蛋白的抗氧化作用[J].食品科学,2006,27(12):208-212.
YANG L H,WANG X J,ZHONG X S,et al.Detecting the anti-oxidative effect of anabaena phycocyanin[J].Food Science,2006,27(12):208-212.
[9]王勇,钱峰,钱凯先,等.藻蓝蛋白抗癌活性研究[J].浙江大学学报(工学版),2001,35(6):672-675.
WANG Y,QIAN F,QIAN K X,et al.Anticancer activity of phycocyanin[J].Journal of Zhejiang University(Engineering Science),2001,35(6):672-675.
[10]ROMAY C,GONZALEZ R,LEDON N,et al.C-phycocyanin:a biliprotein with antioxidant,anti-inflammatory and neuroprotective effects[J].Current Protein and Peptide Science,2003,4(3):207-216.
[11]赵艳景,汤云成.条斑紫菜藻蓝蛋白的分离纯化及其抗衰老作用研究[J].食品科学,2012,33(17):94-97.
ZHAO Y J,TANG Y C. Separation, purification and anti-aging activity of phycocyanin fromPorphyrayezoensis[J].Food Science, 2012,33(17):94-97.
[12]李济平.藻蓝蛋白对免疫系统的活性的研究[J].中国公共卫生,2000,16(7):647-648.
[13]吴萍.藻胆蛋白与荧光免疫分析[J].生理科学进展,2000,31(1):82-84.
[14]RITO-PALOMARES M,NUNEZ L,AMADOR D.Practical application of aqueous two-phase systems for the development of a prototype process for C-phycocyanin recovery fromSpirulinamaxima[J].Journal of Chemical Technology and Biotechnology,2001,76(12):1273-1280.
[15]张发宇,赵冰冰,蔡静,等.盐析法纯化新鲜蓝藻中藻蓝蛋白工艺条件的研究[J].环境工程技术学报,2015,5(6):499-503.
ZHANG F Y,ZHAO B B,CAI J,et al.Research on technology conditions of purifying phycocyanin from fresh algae using salt precipitation[J].Journal of Environmental Engineering Technology,2015,5(6):499-503.
[16]蔡春尔,何培民.高速离心对藻胆蛋白提取纯化的影响[J].中国医药杂志,2006,6(8):844-847.
[17]MORAES C C,KALIL S J.Strategy for a protein purification design using C-phycocyanin extract[J].Bioresource Technology,2009,12:5312-5317.
[18]沈强,沈银武,刘永定,等.滇池水华蓝藻藻蓝蛋白的分离纯化与毒性研究[J].环境化学,2009,28(4):497-500.
SHEN Q,SHEN Y W,LIU Y D,et al.Studies on purification and toxicity of phycocyanin from waterbloom forming cyanobacteria in Dianchi Lake[J].Environmental Chemistry,2009,28(4):497-500.
[19]郝俊,王建中,呼晓妹.超声波辅助提取螺旋藻藻胆蛋白的工艺探讨[J].食品工业科技,2007,28(2):170-172.
[20]林红卫,覃海错,伍正清,等.钝顶螺旋藻中藻蓝蛋白的提取纯化新工艺[J].精细化工,1998,15(1):18-20.
LIN H W,QIN H C,WU Z Q,et al.A new extraction and purification method for phycocyanins from Spirulina[J].Fine Chemicals,1998,15(1):18-20.
[21]冯维希,岳岑,黄文.双水相技术分离纯化藻胆蛋白的研究进展[J].食品研究与开发,2010,31(12):246-249.
FENG W X,YUE C,HUANG W.Research progress on auqeous two phase extraction for purification of phycobiliprotein[J].Food Research and Development,2010,31(12):246-249.
[22]廖晓霞,张学武.高效分离藻蓝蛋白新方法[J].食品工业科技,2011,32(6):273-280.
[23]HERRERA A,BOUSSIBA S,NAPOLENONE V,et al.Recovery of phycocyanin from the cyanobacteriumSpirulinamaxima[J].Journal of Applied Phycology,1989,1(1):325-331.
[24]SONI B,KALAVADIA B,TRIVEDI U,et al.Extraction,purification and characterization of phycocyanin formOscillatoriaquadripunctulata-isolate form the rocky shores of Bet-Dwarka,Gujarat,India[J].Process Biochemistry,2006,41(9):2017-2023.
[25]丙潇潇.藻胆蛋白的双水相绿色提取技术[D].哈尔滨:哈尔滨工业大学,2010. ▷
何绪文,王宇翔,房增强,等.铅锌矿区土壤重金属污染特征及污染风险评价[J].环境工程技术学报,2016,6(5):476-483.
HE X W, WANG Y X, FANG Z Q, et al.Pollution characteristics and pollution risk evaluation of heavy metals in soil of lead-zinc mining area[J].Journal of Environmental Engineering Technology,2016,6(5):476-483.
Study on Extraction and Purification of C-phycocyanin by Combined Use of Powdered Activated Carbon Treatment and Aqueous Two-phase Extraction from Cyanobacteria
SHENG Jingmeng, ZHANG Fayu, YUAN Mengyuan, WANG Jiaquan
School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China
Extraction and purification of C-phycocyanin were performed by the combined use of powdered activated carbon (PAC) treatment and aqueous two-phase extraction from fresh Cyanobacteria mud in Chaohu Lake. Firstly, the effects of PAC on purification of C-phycocyanin were studied by considering the dosage of powdered activated carbon. Then, the single factor and orthogonal experiments were conducted to determine the optimum conditions in the PAC treatment and aqueous two-phase purification, which were PEG 4000 as polymer, the PEG 4000 concentration 4%, the potassium phosphate concentration 16% and pH 7.0. The verification test showed that after the purification by the optimized process, the purity and recovery rate of C-phycocyanin could reach to 3.461 7 and 63%, respectively. It was with less equipment requirements, lower cost and shorter time, etc., compared with traditional methods.
powdered activated carbon; aqueous two-phase extraction; extraction and purification; C-phycocyanin
2016-02-27
国家水体污染控制与治理科技重大专项(2012ZX07103-004)
盛晶梦(1991—),女,硕士研究生,研究方向为环境污染控制工程,abbylw2015@163.com
*责任作者:汪家权(1957—),男,教授,研究方向为水处理技术,jiaquan.wang@163.com
X703
1674-991X(2016)05-0469-07
10.3969j.issn.1674-991X.2016.05.069
