热刺激对大鼠下丘脑神经损伤相关因子作用研究*
2016-09-21康欣欣唐志鹏王立娟刘琳琳吴中华上海中医药大学中医文献研究所上海010上海中医药大学附属龙华医院脾胃病研究所上海000上海交通大学医学院附属第九人民医院北院上海01999上海中医药大学科技实验中心上海010
康欣欣唐志鹏王立娟刘琳琳吴中华(1.上海中医药大学中医文献研究所,上海 010;.上海中医药大学附属龙华医院脾胃病研究所,上海 000;.上海交通大学医学院附属第九人民医院北院,上海 01999;.上海中医药大学科技实验中心,上海 010)
2.1 一般情况观察 实验前,两组动物活动、饮食正常;实验过程中,相较正常组,热刺激组大鼠兴奋度增高,对外界刺激易激动,反应激烈,进食量及饮水增加,大小便同时增多。两组每日平均体质量走势如图1所示,热刺激组与正常组相比,体质量较轻,且差距逐渐加大(P<0.05),但体质量增速无明显差异。
·实验报告·
热刺激对大鼠下丘脑神经损伤相关因子作用研究*
康欣欣1,2唐志鹏2△王立娟2刘琳琳3吴中华4
(1.上海中医药大学中医文献研究所,上海 201203;2.上海中医药大学附属龙华医院脾胃病研究所,上海 200032;3.上海交通大学医学院附属第九人民医院北院,上海 201999;4.上海中医药大学科技实验中心,上海 201203)
目的 观察热刺激后,下丘脑瞬时电位感受器阳离子通道V1子类(TRPV1)、α-CGRP、β-CGRP、生长阻滞和DNA损伤基因(Gadd45a)及生长相关蛋白43(Gap43)的mRNA含量,探讨外周热刺激状况下,神经中枢的应答状况。方法 20只Wistar大鼠随机分为正常组与热刺激组,热刺激组用热的辣椒乙醇溶液灌胃及热烘饲养法饲养2周,观察大鼠活动、饮食及大小便状况,体视显微镜及HE染色法观察大鼠胃黏膜病理改变。同时用RT-PCR法检测两组下丘脑的TRPV1、α-CGRP、β-CGRP、Gadd45a及GAP43的mRNA表达情况。结果 热刺激组大鼠兴奋度增高,饮食及大小便都增加,但体质量增长减缓,体视显微镜及病理切片观察显示胃黏膜充血水肿,5种mRNA含量均明显升高(P<0.05)。结论 外周热刺激不但引发末梢感受器的组织损伤,也引发了下丘脑的神经细胞损伤,同时中枢产生活跃的组织修复活动,并增加神经递质的分泌,加强对温度调控信号的传递。
热刺激 TRPV1 CGRP Gadd45a GAP43
【Abstract】Objective:To observe the concentration of TRPV1,α-CGRP,β-CGRP,Gadd45a and GAP43 in hypothalamus after thermal stimulation,and to investigate the response of nerve centers to peripheral hot stimulus.Methods:20 Wistar rats were randomly divided into 2 groups:the normal group and the thermal damage group.The thermal damage group was fed in warm condition for two weeks by stomach tube with a hot mixed solution made by ethanol and peppers.After that,the conditions of movement,eating and drinking,urine and stool of the rats were observed.Then the Wistars's gastric mucosal lesions were also studied with stereo microscope and HE staining method.At the same time,the mRNA expression condition of TRPV1,α-CGRP,β-CGRP,Gadd45a and GAP43 in hypothalamus were measured with the Real time-PCR method.Results:The rats′excitement level,diet amount,urine and stool were all enhanced.However,their weight increasing rate was reduced.Stereo microscope observation and Pathological examination all showed a mucosal hyperemia and edema.The concentrations of 5 mRNAs all significantly increased(P<0.05).Conclusion:The peripheral thermal stimulus damage not only the outer issues,but also the nerve cells in the hypothalamus.At the same time,the nerve centers result in an active issue recovery,and increase the output of neurotransmitter to enhance the transmission of thermoregulation.
【Key words】Thermal stimulus;TRPV1;CGRP;Gadd45a;GAP43
维持体温的相对恒定是机体一切生理活动的基础。经典的体温调节模式是:致热源或者致冷源刺激温度感受器,传入神经将刺激信息传入体温调节中枢,中枢发出降温或升温的调控指令,该指令经过传出神经进入外周效应器,引起内分泌腺、骨骼肌、皮肤血管和汗腺等组织、器官活动的改变,从而调整产热和散热的过程,诸如:毛孔扩张或收缩、汗液分泌增加、肌肉收紧、血流加速或减缓等反应[1]。引起温度升高的热刺激中有外周环境温度、湿度,饮入热性食物、化学药物、炎症感染等多种因素。人们通过截断下丘脑以上脑组织及下丘脑以下脑组织的方法,确定下丘脑为体温调节的中枢。传统认为,温度的刺激能引发外周的组织损伤,而中枢对于温度刺激的应答机制尚不清楚。辣椒被认为是一种热性食物,引发人体的热性改变,因此可以作为一种内源性热刺激源[2]。由于热刺激引起的中枢应答机制缺乏实验数据支持,基于此,本实验尝试对大鼠进行热的辣椒乙醇溶液刺激,以此模拟内源性的热刺激,同时将大鼠至于热烘环境中,模拟外源性的热刺激,病理观察胃黏膜损伤,并用realtime-PCR方法检测大鼠下丘脑的瞬时电位感受器阳离子通道V1子类(TRPV1)、α-CGRP、β-CGRP、生长阻滞和DNA损伤基因(Gadd45a)与生长相关蛋白43(Gap43)的mRNA表达,研究大鼠下丘脑对热刺激之后的应答机制,以探讨体温中枢在热刺激之后的反应机理。现报告如下。
1 材料与方法
1.1 动物
选用清洁级雄性健康wistar大鼠20只,体质量(180±20)g,购自北京维通利华实验动物有限公司,动物许可证号:SCXK(京)2012-0001。大鼠为同一批繁殖并在实验观察期间严格控制在同一饲养环境和条件下。在上海中医药大学实验动物中心(SXYK沪2009-0069)清洁级动物房适应性喂养3 d后开始实验,实验期间大鼠自由摄食饮水,饲养室光照12 h,黑暗12 h,室温22~24℃,湿度45%~65%。
1.2 仪器
Adventurer Ohaus AR1140/C型电子分析天平(美国奥豪斯公司);Sonics超声细胞破碎仪(美国SONICS &MATERIALS公司);台式高速冷冻离心机Centrifuge 5417R(德国EPPENDORF公司);实时荧光定量PCR 仪7500 fast(美国ABI);紫外分光光度计752(上海第三分析仪器厂)高压蒸汽消毒器YXQ.SGH.280(上海医用核子仪器厂);低温冰箱MDF-292(SANYO CO.)体视显微镜;DV4 quotation。
1.3 试剂
DEPC,DEPC处理水(天根生化科技公司);异丙醇,氯仿,75%预冷乙醇(国药集团化学试剂有限公司)及70%、10%乙醇(自配);Trizol液,反转录试剂盒,荧光定量PCR试剂盒(takara)。0.5 mL DEPC加于500 mL双蒸水中,室温下摇床过夜,加热消毒后密封保存。
1.4 实验药物
干辣椒(茄科植物,辣椒属,簇生椒,Capsicum annuumvar.fasciculatum),购自上海禾煜贸易有限公司。将干辣椒50℃烘干,烘干至衡重,即称重。粉碎成细末,过80目筛。将粉碎后的辣椒干以70%酒精水浴70℃浸泡3次,每次时间为1 h,料液比为1∶12。将萃取液减压水浴蒸馏,蒸馏温度为60℃,得油状物。将蒸馏后的提取物以10%乙醇溶解,并定容至料液比为0.3 g/mL。将辣椒油密封置于4℃冷藏备用。
1.5 试验方法
1.5.1 分组与处理 将20只Wistar大鼠随机数字表达法分成两组,正常组、热刺激组各10只,适应性喂养3 d后,开始灌胃。灌胃剂量为0.02 mL/g。正常组予0.9%氯化钠注射液,饲养环境温度为室温22~24℃,湿度45%~65%。热刺激组予10%乙醇的辣椒溶液(60℃),每日1次,保持饲养环境温度30℃,湿度45%~65%。造模灌胃热烘共7 d,再恢复正常饲养7 d,制成热刺激模型。观察大鼠行为、体质量、饮水进食、大小便量、性状。自贲门处至幽门处切除大鼠胃,并沿胃大弯剪开,以0.9%氯化钠注射液冲洗内容物后,以10%甲醛固定,以苏木精-伊红(HE)染色法制备病理切片。术前禁食不禁水24 h,以CO2窒息法处死大鼠,摘取大鼠下丘脑,置-70℃保存。
1.5.2 mRNA抽提 取组织50 mg,加入1 mL Trizol液,充分匀浆;22℃,静置5 min;加入氯仿0.2 mL,颠倒混匀15 s;22℃,静置3 min;4℃,14000 r/min离心15 min。取上清液0.5 mL;加入0.5 mL异丙醇,混匀;22℃,静置10 min;4℃,14000 r/min离心10 min。弃上液,加入1 mL 4℃75%乙醇,充分混匀;4℃,10000 r/min离心5 min。弃上液,真空干燥5 min;用40 μL DEPC处理水溶解,-80℃保存备用。
1.5.3 RT-PCR 1)分光光度计检测RNA的浓度。取样本5μL加入石英比色杯内,加入双蒸水1 mL,充分混匀。与双蒸水对照。读260 nm和280 nm测得值,当260 nm与280 nm的比值在1.8与2.0之间时,表示样本RNA纯度较高,并记录。计算:OD260为1时,为40 μg RNA。所以计算如下:样品总RNA含量 (μg/μL)= OD260×稀释倍数×40/1000;样本RNA含量 (μg/μL)= OD260×200×40/1000=OD260×8。2)反转录合成DNA。在20 μL反应体系中分别加入组织总RNA 2 μg、5XRT master mix 4 μL加水至20 μL。混匀,离心,孵育37℃15 min,85℃5 s,-20℃保存。3)PCR扩增。所用引物序列为:TRPV1 Forward 5′-AGTAACTGCCAGGA GCT GGA-3′,Reverse 5′-GTGTCATTCTGCCATTGTG-3′;α-CGRP Forward 5′-GCTGCATTGGTGCAGAACTA-3′,Reverse 5′-GTGGGCACAAAGTTGTCCTT-3′;β-CGRP Forward 5′-CCCAGAAGAGATCCTGCAAC-3′,Reverse 5′-GTGGGCACAAAGTTGTCCTT-3′;Gadd 45a Forward 5′-TAACTGTCGGCGTGTACGAG-3′,Reverse 5′-GCAACAGAAAGCACGAATGA-3′;Gap43 Forward 5′-GGCTCTGCTACTACCGATGC-3′,Reverse 5′-GACGGCGAGTTATCAGTGGT-3′。在20 μL反应体系中分别加入反转录产物2 μL、Sybrgreen 10 μL、上游引物(5 μmol/L)1 μL、下游引物(5 μmol/L)1 μL、RoxDye(Ⅱ)0.4 μL,加水至20 μL。PCR扩增条件为:(1)95℃30 s;(2)95℃3 s,60℃30 s,40个循环;(3)扩增产物分析:数据采用仪器自带软件ABI 7500 fast Software v2.0分析。TRPV1、α-CGRP、β-CGRP、Gadd45a 与GAP43表达水平以它们与actin的相对表达量来计算。
1.6 统计学处理 应用SPSS19.0统计软件处理。计量资料以(±s)表示,两组间比较,若符合方差齐性和正态分布,采用独立样本t检验;若不符合方差齐性和正态分布,则采用非参数检验的Wilcoxon检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况观察 实验前,两组动物活动、饮食正常;实验过程中,相较正常组,热刺激组大鼠兴奋度增高,对外界刺激易激动,反应激烈,进食量及饮水增加,大小便同时增多。两组每日平均体质量走势如图1所示,热刺激组与正常组相比,体质量较轻,且差距逐渐加大
(P<0.05),但体质量增速无明显差异。
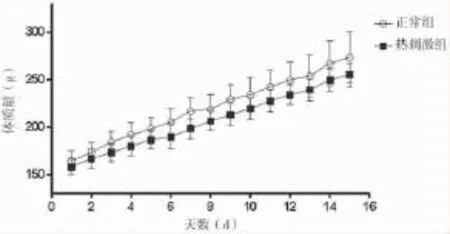
图1 两组体质量变化趋势
2.2 两组胃病理组织体视显微镜观察 见图2。正常组大鼠胃体色淡红,隐约可见少量脉络,质软有弹性。热刺激组大鼠胃体色鲜红,有明显暗红色瘀斑,黏膜下血管清晰可见,质略硬而有紧实感。
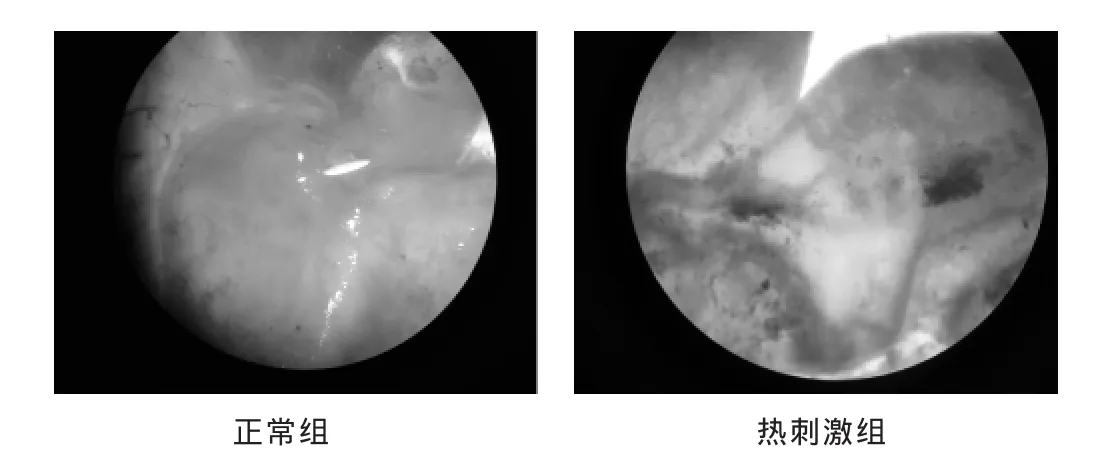
图2 两组胃体病理组织(HE染色,12倍)
2.3 两组胃病理切片 见图3。正常组大鼠胃黏膜绒毛柱状上皮细胞排列整齐,腺体形态规则,肌层纹理清晰,黏膜下血管无血细胞充盈。热刺激组大鼠胃黏膜上皮细胞排列尚整齐,部分核体增大,染色加深,肌层变薄,黏膜下血管充盈,淤积大量红细胞,并出现黏膜下水肿。
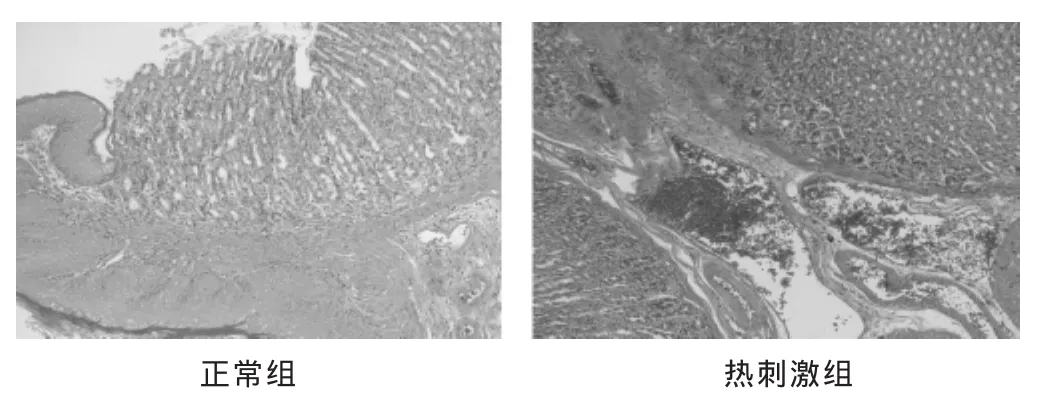
图3 两组胃黏膜病理组织(HE染色,100倍)
2.4 两组mRNA表达比较 见表1。5种mRNA的表达,热刺激组均高于正常组,其中TRPV1、Gadd45a与Gap43有极明显差异 (P<0.01),α-CGRP与β-CGRP有较明显差异(P<0.05)。
表1 各组小鼠5种mRNA表达的比较(±s)
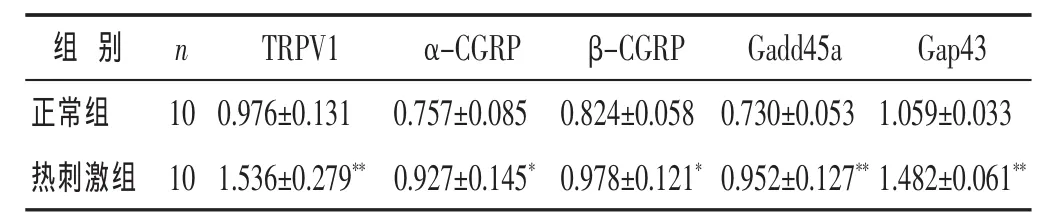
表1 各组小鼠5种mRNA表达的比较(±s)
与正常组比较,*P<0.05,**P<0.01。
组别 n β-CGRP Gadd45a Gap43正常组 10 0.824±0.058 0.730±0.053 1.059±0.033热刺激组 10 0.978±0.121*0.952±0.127**1.482±0.061**TRPV1 α-CGRP 0.976±0.131 0.757±0.085 1.536±0.279**0.927±0.145*
3 讨 论
热邪是中医学外邪致病理论中十分重要的一个致病因素,同时热证也是重要的证型之一,而关于热邪与热证的本质目前尚处于探讨阶段。热刺激对于机体产生的影响以往多集中于与刺激源接触的刺激末端,而对于中枢的热回馈研究较少。本实验从温度感受器、神经信号传导因子、神经损伤修复因素的角度探讨热刺激对神经中枢的影响机制。
TRPV1是一个典型的温度敏感型通道,当温度>43℃时即被激活[3]。通道开放,引起细胞外Ca2+内流和胞内Ca2+库的释放,升高胞内Ca2+浓度,进而激活一系列细胞内信号,形成动作电位,使中枢产生烧灼样疼痛等不适感[4]。本实验中,60℃辣椒乙醇溶液的内刺激及30℃饲养环境的外刺激,使得大鼠接收热刺激的感应器将信号传递至中枢,引发中枢的“热感受”,其表现即为下丘脑的TRPV1含量升高。
降钙素基因相关肽(CGRP)神经信号传递中重要的一种生物多肽,广泛分布于脑内及与体表感觉有关的脊髓背角和初级传入纤维,特别是感觉神经元的胞体和末梢内[5],通常分为2类:α-CGRP和β-CGRP或者CGRP1和CGRP2。它参与多种生理活动,如嗅觉、听觉、学习、摄食、自主神经功能、运动活动、伤害性感觉的形成与维持及血管扩张等。当加载损害性刺激时,如:炎症介质、缺氧、甲状腺素等皆可促进CGRP从神经末梢的释放,营养神经的神经生长因子(NGF)[6]和胶质源性神经营养因子(GDNF)[7]也可以提高神经的CGRP表达,这种现象常见于神经的损伤修复反应中,表明CGRP表达增加是神经细胞活性提高的表现。本实验证实了由外周的热刺激,以及内在的辣椒乙醇溶液促进了作为温度调节中枢的下丘脑的CGRP的释放,提示CGRP是传导外来热刺激及伤害性刺激的神经递质,同时也是机体对这类刺激的产生应答的结果,即机体通过增加CGRP的分泌来传递信号,调控外周效应器对刺激产生应答。
Gadd45a,又名DNA损伤诱导基因(DDIT1),它在调控细胞凋亡中具有重要作用,能通过G1-S期的控制参与维持基因组的稳定性[8],也能诱导细胞G2-M期的阻滞。Gadd45a在多种损伤因素如:电离辐射、紫外线照射、烷化剂、二甲基苯蒽、血清饥饿、各种化疗药物等的作用下表达迅速上调[9]。因此,Gadd45a表达增加是细胞损伤和修复的信号。本实验经过热刺激之后,Gadd45a明显升高,表明外周的细胞损伤已经出现,并进而影响到中枢神经产生修复性的应答。
Gap43是一种分子量为43 kDa的膜相关蛋白,主要分布于轴突生长锥以及突触前膜。它是一种轴突出芽和突触再生的标志性蛋白[10],又是一种能与钙调蛋白(CaM)结合的磷酸化蛋白,具有调节钙缓冲和钙调蛋白效力的功能[11]。一般在神经元内Ca2+浓度较低,GAP-43与CaM紧密结合,并将CaM隔离于膜区域[12],当神经元受到外界刺激时引起Ca2+内流。虽然Ca2+内流可以促进神经元的兴奋和递质的释放,但Ca2+过度内流可诱导GAP-43与CaM解离,随即GAP-43磷酸化[13]。活化的GAP-43与细胞骨架成分相互作用,为神经元轴突的修复和再生提供了营养支持,轴突内的GAP-43含量增加,待建立起完整的突触联系后,GAP-43去磷酸化并与CaM重新结合,GAP-43水平才急剧下降,从而形成一个反馈环[14],因此在发育成熟的中枢神经系统中,GAP-43的表达可作为评估轴突损伤和再生反应的一个可靠指标[15]。本实验中GAP43含量明显升高,表明热刺激已经引发神经中枢的损伤,且这种修复活动正进入活跃状态。
本实验热刺激动物模型给予内外双重热刺激,符合中医学嗜食辛辣或感受温热外邪的热证成因。热刺激1周,再消除外界刺激,恢复正常喂养,以检测前期热刺激对大鼠体质形成较稳定的影响。该模型依据病因造模,符合热因素致病的机理。实验中,大鼠予热刺激之后,情绪活跃,代谢加速,出现易激好动,饮食增加,大小便增加的现象,同时体视显微镜观察和病理切片显示大鼠胃受到物理和化学的热刺激,黏膜下血管明显充血水肿。因此证明,通过60℃辣椒乙醇溶液的热刺激,大鼠体温调控系统的外周感应器环节出现了组织损伤。
本实验结果支持以下结论,内外热刺激损伤触及外周末梢组织,而且通过分布于外周的温度感应器将热信号传递到神经中枢,引发中枢神经细胞的TRP通道打开,胞外Ca2+内流,胞内Ca2+在CGRP作用下进入胞质内,引发胞内Ca2+浓度升高,造成神经中枢的损伤,并进而引发GAP43与CaM解离,GAP43磷酸化之后,与细胞骨架成分相互作用,为神经元细胞的修复再生提供营养支持,引发相应的损伤修复行为。同时CGRP进入神经元细胞的突出末端,将神经中枢对热刺激的应答信号传递到外周效应器,引发相应的温度调控和适应过程。
因此,可以初步认为,过量的热刺激不但引发末梢组织细胞的损伤,同样也会通过体温调控轴,造成下丘脑神经中枢的损伤修复反应。至于不同量热刺激引发的机体反应以及下丘脑的具体反应部位及机制则需要进一步实验证明。同时,以上指标也可以为热本质研究提供参考。
[1] 朱大年,王庭槐.生理学[M].北京:人民卫生出版社,2013:235-237.
[2] 杨万斌,文彬,张凌杭,等.大鼠胃热证模型造模方法研究[J].中国中药杂志,2015,40(18):3644-3649.
[3] Caterina MJ,Schumacher MA,Tominaga M,et al.The capsaicin receptor:a heat-activated ion channel in the pain pathway[J].Nature,1997,389(6653):816-824.
[4] Tiruppathic,Ahmmed GU,Vogel SM,et al.Ca2+signaling,TRP channels,and endothelial permeability[J].Microcirculation,2006,13(8):693-708.
[5] Ma W,Chabot JG,Powell KJ,et al.Localization and modulation of calcitonin gene-related peptide-receptor component protein-immunoreactive cells in the rat central and peripheral nervous systems[J].Neuroscience,2003,120(3):677-694.
[6] Hannila SS,Kawaja MD.Distribution of central sensory axons in transgenic mice overexpressing nerve growth factor and lacking functional p75 neurotroph in receptor expression[J].Eur J Neurosci,2003,18(2):312-322.
[7] Ramer MS,Bradbury EJ,Michael GJ,et al.Glial cell linederived neurotrophic factor in creases calciton in gene-related peptide immunoreactivity in sensory and motoneurons in vivo[J].Eur J Neurosci,2003,18(10):2713-2721.
[8] Hollander MC,Philburnrt,Pattersonad,et al.Genomic instability in Gadd45a-/-cells is coupled with S-phase checkpoint defects[J].Cell Cycle,2005,4(5):704-709.
[9] 李云峰,钱海利,林晨.Gadd45a的表达调控与功能[J].医学分子生物学杂志,2007,4(5):434-438.
[10]CarmichaelST.Plasticityofcorticalprojectionsafter stroke[J].Neuroscientist,2003,9:64-75.
[11]Gerendasy D.Homeostatic tuning of Ca2+signal transduction by members of the calpacitin protein family[J].J Neurosci Res,1999,58:107.
[12]刘玲,陈燕惠,陈达光.神经生长相关蛋白在脑损伤修复中的作用[J].中国病理生理杂志,2004,20(9):1739-1742.
[13]Trejo O,Reed JA,Prieto VG.Atypical cells in human cutaneous reexcision scars for melanoma express p75NGFR,C56/ N-CAM and GAP-43:evidence of early Schwann cell differentiation[J].Cutan Pathol,2002,29:397.
[14]Mosevitsky MI.Nerve Ending “Signal”proteins GAP-43,MARCKS,and BASP1[J].Int Rev Cytol,2005,24:245.
[15]Dijk F,Bergen AA,Kamphuis W.GAP-43 expression is upregulated in retinal ganglion cells after ischemia/reperfusioninduced damage[J].Exp Eye Res,2007,84:858-867.
Study on the Effect of Thermal Stimulation on the Related Factors of Hypothalamic Nerve Injury in Rats
KANG Xinxin,TANG Zhipeng,WANG Lijuan,et al.Institute of Traditional Chinese Medicine Literature,Gastroenterology department in Longhua Hospital Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China.
·实验报告·
R338.2+7 文献标志码:A
1004-745X(2016)08-1543-05
10.3969/j.issn.1004-745X.2016.08.027
上海中医药大学横向课题“温胃方、清胃方防治胃寒证和胃热证的实验研究”支持(编号:778)
(电子邮箱:zhipengtang@sohu.com)
2016-03-14)
