心肌细胞电位传感器在海洋生物毒素检测中的研究*
2016-09-19方佳如黎洪波苏凯麒潘宇祥
方佳如,王 琴,黎洪波,苏凯麒,潘宇祥,王 平
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027)
心肌细胞电位传感器在海洋生物毒素检测中的研究*
方佳如,王琴,黎洪波,苏凯麒,潘宇祥,王平*
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州310027)
目前海洋毒素对人类健康的威胁越加严重,尤其是麻痹性毒素。提出了一种基于细胞电位传感器检测贝类的生物毒性的新方法,采用心肌细胞与微电子加工技术的微阵列芯片(MEA)相结合,构建了新型的心肌细胞电位传感器。通过心肌细胞与MEA芯片的紧密耦合,实现了实时监测心肌细胞电位的变化,输出稳定和一致性好的胞外场电位信号。通过检测海洋中危害较大的石房蛤麻痹性毒素(STX),分析细胞的信号特征参数,实验结果表明,STX毒素对心肌细胞的电生理活动有明显的抑制作用,对脉冲幅值和脉冲频率有明显的浓度依赖性抑制作用。常规标准的生物毒性检测方法小鼠生物法的检出限为40 g/100 g,而心肌细胞电位传感器可检测的下限为1.004 ng/mL,检测范围为25 nmol/L~1 600 nmol/L,通过对比表明该方法具有较好的检出限且检测方法相对简单,易于规范化和标准化。通过进一步的完善,该方法在海洋毒素的快速检测应用方面具有良好的发展前景。
细胞传感器;微电极阵列;海洋毒素;心肌细胞电位检测;胞外场电位信号
随着现代化工农业的迅猛发展,近年来海洋污染的状况越发严重。有害赤潮的频繁发生和规模的不断扩大,造成了巨大的经济损失,并严重威胁着人类的身体健康[1]。所谓的海洋生物毒素,主要是由赤潮藻类产生的有毒生物活性物质,这些有毒微藻产生的毒素通过食物链在贝类或鱼类体内富集,若人类误食了这种有毒的贝类或鱼类,则会引起食物中毒,甚至导致死亡[2-3]。根据毒素所引发的中毒症状的不同,海洋毒素可分为五类:麻痹性贝类毒素PSP(Paralytic Shellfish Poisoning)、腹泻性贝类毒素DSP(Diarrhetic Shellfish Poisoning)、神经性贝类毒素NSP(Neurotoxic Shellfish Poisoning)、记忆缺失性贝类毒素ASP(Amnestic Shellfish Poisoning)和西加鱼毒素CFP(Ciguatera Fish Poisoning),其中麻痹性贝类毒素是目前为止分布最广、危害最大的一类海洋毒素[4-6],而在PSP中,石房蛤毒素STX(Saxitoxin)占了总PSP的85%以上,是PSP中毒素最强的毒素[7]。PSP在贝类毒素中毒事件中属最严重,因其剧烈毒性,经常造成消费者中毒死亡事件,摄入1 mg 的PSP就可致人死亡。该类毒素选择性作用于电压门控钠离子通道,阻断钠离子内流,从而抑制动作电位的产生和电兴奋传播[8]。因此,对STX毒性进行检测在人类健康和环境安全上是十分重要的。
目前,最常见的毒素检测方法为小鼠生物法[9-10],但因种种局限难以满足海洋毒素监测的需要。常规的基于化学结构的高效液相色谱分析法(HPLC)[11-13],由于所需设备昂贵且技术操作复杂,也难以完全取代小鼠生物法。近年来,一些基于功能活性的细胞检测法陆续发展起来。
细胞电位传感器[14-16]是一种常用的细胞传感器,用于检测具备电生理特性的细胞的电生理活动,因其无损、高灵敏、实时动态检测等优势而备受国内外研究者的关注[17]。麻痹性贝类毒素作用心肌细胞后,会引起细胞膜离子通道的功能发生紊乱,从而影响心肌细胞动作电位的发放和电兴奋的传播。而心肌细胞电位传感器[18]可以检测毒素引起的胞外场电位的变化,胞外场电位的变化程度可以反映毒素的毒性大小。心肌细胞电位传感器在这类毒素的毒性研究中具有一定的应用价值。本文选择稳态性强的电兴奋心肌细胞作为敏感元件,并将心肌细胞电位传感器应用于海洋毒素的检测分析。
1 材料和方法
1.1材料
明胶(Gelatin,Sigma)、平衡盐溶液 HBSS (Hanks’Balanced Salt Solution,Gibco)、胰蛋白酶(Trypsin,Gibco)、胶原蛋白酶(Collagenase Type II,Gibco)、高糖培养基DMEM(Dulbecco’s Modified Eagle Medium,Hyclone)、胎牛血清FBS(Fetal Bovine Serum,Gibco);手术剪:大镊子、眼科剪、眼科弯镊;解剖板;5 mL玻璃瓶;10 mL、50 mL离心管;200目细胞筛;细胞培养瓶;60mm培养皿细胞;细胞计数板;EP管。
1.2心肌细胞电位传感器理论基础及芯片设计
细胞电位传感器是一种用来无损、长时记录细胞外场电位的细胞传感器,敏感元件可采用具备电兴奋特性细胞,如心肌细胞等。其中基于平面微电极阵列MEA(Microelectrode Array)[19-21]的细胞电位传感器是目前最常用的胞外电位记录手段。它可以实时检测和记录具备电兴奋特性细胞的电生理信号。
微电极阵列芯片[22-24]是目前常用的细胞电传感器芯片(如图1(a)和1(b))。MEA芯片表面积为2 cm×2 cm,MEA呈6×6阵列排布,包括32个工作电极(记录电极),单个圆形电极直径大小为30 μm,电极间距为300 μm;4个参考电极,排布在芯片四角。MEA的基本结构包括三部分:绝缘基底,金属层电极阵列,钝化层。它的加工制作采用标准的微电子加工技术。
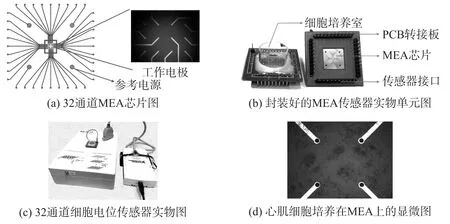
图1 心肌细胞电位传感器
心肌细胞培养在MEA芯片上(如图1(d)),通过一层薄的电解液同芯片的电极相耦合。心肌细胞和MEA耦合在一起后,具有电兴奋特性的心肌细胞会产生动作电位,可选择性开启和闭合的离子通道引起胞内外离子浓度的变化。胞外场电位便是由跨膜电压变化和离子电流所引起。因此,通过检测胞外的场电位变化,可有效地记录心肌细胞的电生理信号(即胞外场电位信号)。
1.3心肌细胞传感器优化实验
选取清洁级健康24 h内新生SD大鼠(Sprague Dawley,购于浙江省医学科学院),消毒,取心脏心尖部,置于预冷的高糖培养基中,去除心房和血管等组织。转移心肌组织于HBSS溶液中,剪成约1mm3的小块,弃上清,加入消化液(含0.07%胰蛋白酶和0.05%II型胶原酶),消化多次,直至心肌组织呈现疏松状态。向心肌组织加入含10%FBS的培养基,轻轻吹打组织,收集单细胞悬浮液。离心重悬细胞、过滤,收集细胞悬液到培养瓶中进行差速贴壁2次。差速贴壁后,进行活细胞计数,心肌细胞按不同细胞密度(8×04/cm2~16×104/cm2)接种在预先用明胶进行表面修饰的MEA芯片上,培养1 d后开始检测胞外场电位信号,每隔12 h检测一次,每次检测5 min,持续检测1周。每个密度设置6个平行组。
1.4心肌细胞电位传感器检测海洋毒素的方法
1.4.1毒素样品准备
标准毒素样品的配制:海洋生物毒素的标准品(STX)购自加拿大公司,STX的标准品为粉剂。STX储存液的配制:将STX粉剂溶于0.05 mmol/L的醋酸溶液中,配制成100 μmol/L的STX储存液,再用过滤器将其进行过滤除菌-80℃保存。使用之前,用细胞培养液对毒素储存液进行稀释,配制成一系列浓度梯度的标准品工作液。
贝肉实际样品PSP毒素的提取:①将采集的贝肉样品用纯水清洗干净沥干后,称取20 g贝肉于50 ml烧杯中,加20 mL 0.18 mol/L的盐酸溶液充分搅拌;②均质,调节pH在2.0~4.0范围内;③将混合物加热,并煮沸5 min;④冷却至室温,离心,取上清液备用;⑤上清液过滤后方可用于细胞分析。
STX加标毒素样品的配制:用PSP毒素提取液对STX标准品的储存液进行稀释,配制成一系列浓度梯度的加标样品工作液。
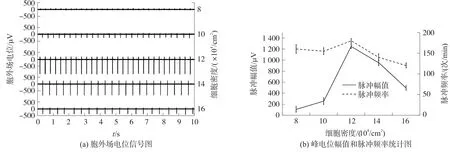
图2 72 h后不同细胞密度下信号记录与统计
1.4.2毒素检测流程
原代心肌细胞按合适的细胞密度接种在预先用明胶铺被的MEA芯片上,细胞培养48 h后,开始检测胞外场电位信号,每隔12 h检测一次,每次检测2 min。一旦电位传感器出现成熟的胞外场电位信号模式,即可进行毒素干预。毒素添加前,先进行细胞换液,换液2 h后,将MEA芯片连接到电位检测仪上,开始检测信号5 min,这段数据作为加度素前的信号基线。接着向实验组的MEA细胞培养孔里加入10 μL毒素标准溶液(或毒素加标溶液)。毒素添加完毕立即开始检测信号,记录数据30 min。对照组加入等量的细胞培养液,实验组和对照组分别设置6个平行组。
1.4.3数据分析
采用Matlab编写的程序对心肌细胞电位传感器的胞外场电位原始信号进行滤波处理、特征参数的提取及特征参数的归一化。在数据分析中,主要提取了2个具有代表性的胞外场电位信号参数,脉冲幅值SA(Spike Amplitude)、脉冲频率FR(Firing Rate),对麻痹性贝类毒素进行毒性评价。
2 结果与讨论
2.1细胞密度对心肌细胞和芯片耦合的影响
合适的细胞密度是细胞和MEA芯片耦合紧密的一个重要因素,两者耦合度越高,检测到的信号就越强,越稳定。因此我们研究了不同细胞密度(8×104/cm2、10×104/cm2、12×104/cm2、14×104/cm2、16× 104/cm2)下构建的心肌细胞电位传感器的信号特征。图2(a)为第4天(大约培养72 h后)不同细胞密度下记录到的胞外场电位信号。从图中可以明显观察到,当细胞密度为12×104/cm2时,心肌细胞传感器输出的信号峰电位幅值最大,脉冲频率最高。而当细胞密度过低或过高时,心肌细胞传感器输出的信号脉冲幅值大幅度下降,而且脉冲频率也明显减慢。
从原始信号中提取了两个典型的特征参数脉冲幅值和脉冲频率进行了统计分析。图2(b)表示不同细胞密度下信号的脉冲幅值和脉冲频率的统计结果。结果表明,当细胞密度为12×104/cm2时,心肌细胞传感器输出的信号脉冲幅值最大,脉冲频率最高,且信号的重复性(SDSA<40 μV,SDFR<10次/ min,SD为标准方差)最好。按细胞密度12×104/cm2构建的心肌细胞传感器从第2天开始就能检测到微弱的信号,之后信号幅度快速增强,到第4天信号幅度达到最大,且可维持2 d~3 d的信号平台期(如图3)。而细胞密度过低或过高所构建的心肌细胞传感器,信号幅度都比较微弱,而且维持时间短。
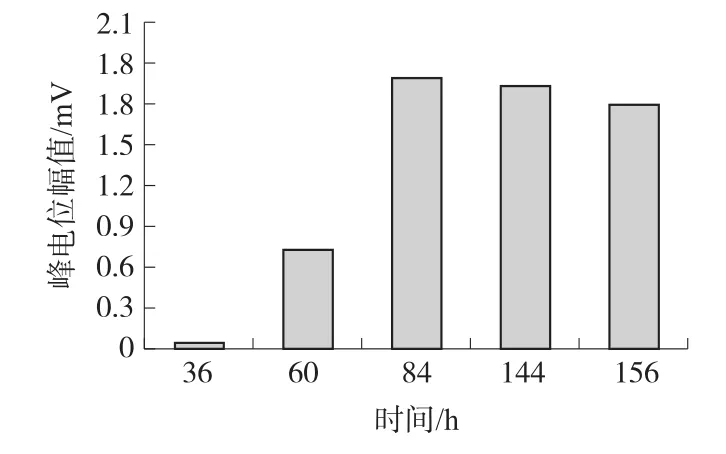
图3 细胞密度为12×104/cm2构建的心肌细胞传感器时脉冲幅值随时间的变化
以上研究结果表明,合适的细胞密度可使心肌细胞在MEA上快速生长分化,形成一片均匀分布、高度融合、同步搏动的单细胞层,心肌细胞最佳的种植密度为12×104/cm2。而细胞密度过低,会使细胞生长缓慢,密度过高会使细胞提前死亡,影响信号发放而无法记录得到胞外场电位信号。
2.2石房蛤毒素(STX)的标准样品检测及分析
如图4(a)所示为不同浓度STX(25 nmol/L、100 nmol/L、400 nmol/L、1 600 nmol/L)作用5 min后,心肌细胞电位传感器记录到的胞外场电位信号变化。从图中可以观察到心肌细胞电位传感器对STX的响应模式呈现出浓度依赖性,即STX浓度越大,胞外场电位信号的电位幅值越小,脉冲频率越慢。实验结果可说了STX对心肌细胞的电活动有明显的抑制作用。
从所测信号中,提取2个特征参数脉冲幅值、脉冲频率。把添加毒素前的基线信号作为参照点,对特征参数进行数据归一化处理,再进行数据统计分析。图4(b)为不同浓度STX作用5 min,胞外场电位信号2个特征参数的统计分析结果。图中显示了25 nmol/L STX组的脉冲幅值与对照组相比有显著性下降(p<0.001,n=6),STX对特征参数脉冲幅值和脉冲频率有明显的浓度依赖性抑制作用,且呈现出了不同的浓度敏感性。

图4 胞外场电位信号图
心肌细胞电位传感器的脉冲频率对STX较敏感,图5为脉冲频率抑制率对STX浓度对数的线性关系图。在低浓度范围,STX对脉冲频率的抑制作用微弱,随着作用浓度的增大,STX对脉冲频率的抑制作用不断增强,且呈现出一定的线性规律。当浓度达到1600 nmol/L时,脉冲频率几乎被STX完全抑制。通过线性拟合分析,得出脉冲频率对STX响应的线性范围为1.39 log STX(nmol/L)~3.2 log STX (nmol/L),即25 nmol/L~1 600 nmol/L,经计算求得该电位传感器对STX的检出限为1.004 ng/mL。

图5 STX作用5 min,脉冲频率抑制率对STX浓度对数的线性关系
2.3贝肉实际样品检测
从市场和贝类养殖场(由浙江大学海洋学院佟老师提供)一共采集了6份贝肉样品,对贝肉中的PSP毒素进行检测。检测前,采取PSP毒素提取方法对贝肉进行前处理。PSP毒素提取液经HPLC方法检测后,发现6份样品均不含毒素,因此采用加标的方式(向贝肉提取液中添加毒素标准品),以此来模拟实际染毒样本。将配置好的STX加标毒素样品溶液按照不同的添加量加入到心肌细胞中,并进行检测。按照3.2所述的方法建立标准曲线并计算出所测加标样品的检出量。根据公式回收率=检出量/添加量×100%,可得出加标样品的回收率。从表1中可以看出,5份加标样本所测得的回收率较好(86%~108.2%),说明了麻痹性贝类毒素可用心肌细胞电位传感器方法进行检测。
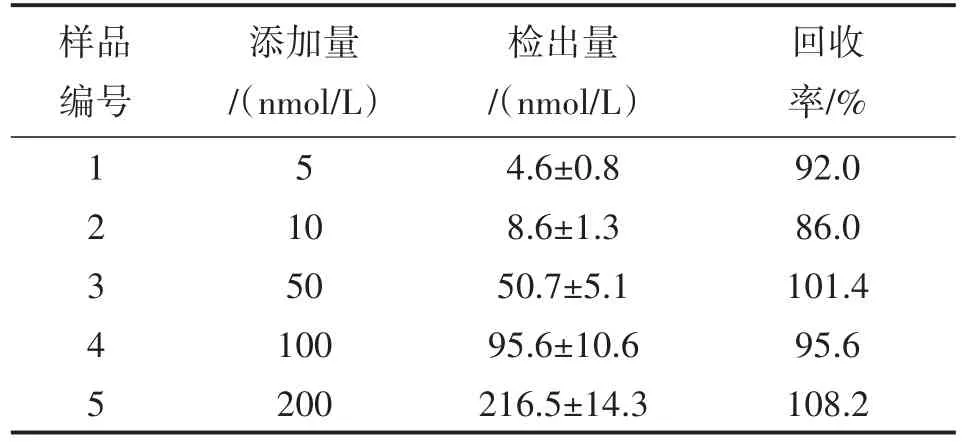
表1 心肌细胞传感器检测STX加标样本
在上述实验中,实验结果表明了该电位传感器对STX敏感,有良好的线性度和灵敏的检出限,而且其检出限均远小于标准小鼠生物法的检出限[25](40 μg/100 g)。说明了心肌细胞电位传感器可以用于STX的检测。贝肉实际样品的检测结果也可说明了该心肌细胞传感器具有较好的实际应用前景。
心肌细胞电位传感器为毒素检测提供了多元化的胞外场电位信号参数,可以用于分析毒素的毒性作用。心肌细胞电位传感器可长期稳定记录细胞外场电位信号且具备一致性,为毒素提供了较宽裕的检测时间。因此心肌细胞电位传感器有望成为新型麻痹性贝类毒素的检测平台。
3 结论
随着海产品安全问题的加剧,对海洋生物毒素的检测和分析工作越来越受到人们的关注和重视。目前标准的小鼠生物法和常规的HPLC法已难以满足海洋毒素日常监测的需要。心肌细胞电位传感器具备实时动态分析、无需专业人员等优点,是一项很有发展潜力的毒素检测技术。
心肌细胞电位传感器应用于STX的检测分析。研究结果表明心肌细胞电位传感器对这种毒素能做出了快速(5 min)而灵敏的响应。该电位传感器成功实现了对STX的快速高灵敏检测。而且通过贝肉实际样品的检测也验证了该方法具有较好的实际应用效果。总之,心肌细胞电位传感器检测法具有简便快速、检出限低、重复性好等的优点。
综上所述,心肌细胞电位传感器检测法,不仅具备了标准小鼠生物法的优势:操作简单、可以检测某一类毒素的毒性,还从一定程度上克服了小鼠生物法的缺陷,具有检出限低、重复性好等优势。再者,心肌细胞传感器高度稳定性可做于分析,。因此心肌细胞电位传感器在麻痹性贝类毒素检测分析中具有很大的应用前景,有望取代小鼠生物法。
[1]Vale P,Botelho M J,Rodrigues S M,et al.Two Decades of Marine Biotoxin Monitoring in Bivalves from Portugal(1986-2006):A Review of Exposure Assessment[J].Harmful Algae,2008,7(1):11-25.
[2]Hinder S L,Hays G C,Brooks C J,et al.Toxic Marine Microalgae and Shellfish Poisoning in the Britishisles:History,Review of Epidemiology,and Future Implications[J].Environmental Health,2011,10(1):54.
[3]Fleming L E,Jerez E,Stephan W B B,et al.Evaluation of Harmful Algal Bloom Outreach Activities[J].Marine Drugs,2007,5(4):208-219.
[4]Yan T,Zhou M J.Environmental and Health Effects Associated with Harmful Algal Bloom and Marine Algal Toxins in China[J].Biomedical and Environmental Sciences,2004,17(2):165-176.
[5]Jiang T,Xu Y,Li Y,et al.Seasonal dynamics of Alexandrium Tamarense and Occurrence of Paralytic Shellfish Poisoning Toxins in Bivalves in Nanji Islands,East China Sea[J].Marine and Freshwater Research,2014,65(4):350-358.
[6]Lin C,Liu Z S,Tan C Y,et al.Contamination of Commercially Available Seafood by Key Diarrhetic Shellfish Poisons along the Coast of China[J].Environmental Science and Pollution Research,2015,22(2):1545-1553.
[7]Jahnke H G,Steel D,Fleischer S,et al.A Novel 3D Label-Free Monitoring System of hES-Derived Cardiomyocyte Clusters:A Step forward to in vitro Cardiotoxicity Testing[J].PloS One,2013,8(7):e68971.
[8]John E H,Flynn K J.Modelling Changes in Paralytic Shellfish Toxin Content of Dinoflagellates in Response to Nitrogen and Phosphorus Supply[J].Marine Ecology Progress Series,2002,225:147-160.
[9]Ledoux M,Hall S.Proficiency Testing of Eight French Laboratories in Using the AOAC Mouse Bioassay for Paralytic Shellfish Poisoning:Interlaboratory Collaborative Study[J].Journal of AOAC International,2000,83(2):305-310.
[10]Mons M,Speijers G.Paralytic Shellfish Poisoning:A Review[J]. Journal of the American Veterinary Medical Association,1978,171(11):1178-1180.
[11]Campas M,Prieto IM N B,MARTY J-L.Biosensors to Detect Marine Toxins:Assessing Seafood Safety[J].Talanta,2007,72(3):884-895.
[12]Oshima Y.Postcolumn Derivatization Liquid Chromatographic Method for Pralytic Shellfish Toxins[J].Journal of Aoac International,1995,78(2):528-532.
[13]van de Riet J M,Gibbs R S,Chou F W,et al.Liquid Chromatographic Post Column Oxidation Method for Analysis of Paralytic Shellfish Toxins in Mussels,Clams,Scallops,and Oysters:Single-Laboratory Validation[J].Journal of AOAC International,2009,92(6):1690-1704.
[14]Aravanis A M,Debusschere B D,Chruscinski A J,et al.A Genetically Engineered Cell-Based Biosensor for Functional Classification of Agents[J].Biosensors and Bioelectronics,2001,16(7):571-577.
[15]Kim S B,Bae H,Cha J M,et al.A Cell-Based Biosensor for Real-Time Detection of Cardiotoxicity Using Lensfree Imaging[J].Lab on A Chip,2011,11(10):1801-1807.
[16]王天星,黎洪波,苏凯麒,等.基于细胞电阻抗传感器的细胞多生理参数分析系统设计[J].传感技术学报,2014,27(12):1589-1595.
[17]Wang B,Barahona M,Buck M.A Modular Cell-Based Biosensor Using Engineered Genetic Logic Circuits to Detect and Integrate Multiple Environmental Signals[J].Biosensors and Bioelectronics,2013,40(1):368-376.
[18]Yeung C-K,Sommerhage F,Wrobel G,et al.To Establish a Pharmacological Experimental Platform for the Study of Cardiac Hypoxia Using the Microelectrode Array[J].Journal of Pharmacological and Toxicological Methods,2009,59(3):146-152.
[19]Xu B,Jacquir S,Laurent G,et al.Phase Space Reconstruction of an Experimental Model of Cardiac Field Potential in Normal and Arrhythmic Conditions;Proceedings of the Engineering in Medicine and Biology Society(EMBC),2013 35th Annual International Conference of the IEEE,F,2013[C].IEEE.
[20]徐莹,余辉,张威,等.基于MEMS技术的微电极阵列细胞传感器[J].自然科学进展,2007,17(9):1265-1272.
[21]Kaneko T,Nomura F,Hattori A,et al.Improvement of Electrical Stimulation Protocol for Simultaneous Measurement of Extracellular Potential With on-Chip Multi-Electrode Array System[J].Japanese Journal of Applied Physics,2012,51(6S):06FK02.
[22]Xiao L,Hu Z,Zhang W,et al.Evaluation of Doxorubicin Toxicity on Cardiomyocytes Using a Dual Functional Extracellular Biochip [J].Biosensors and Bioelectronics,2010,26(4):1493-1499.
[23]Meyer T,Boven K-H,G Nther E,等.Micro-Electrode Arrays in Cardiac Safety Pharmacology[J].Drug Safety,2004,27(11):763-772.
[24]胡靓,秦臻,王琴,等.海马神经细胞网络传感器及其记录5-HT对网络活动的作用[J].传感技术学报,2015,(7):947-952.
[25]于兵,曹际娟,尤永莉,等.ELISA与小白鼠生物法检测贝类中麻痹性贝毒的比较[J].检验检疫科学,2005,15(1):32-35.

方佳如(1991-),女,浙江大学,硕士研究生,主要研究方向为细胞生物传感器与免疫传感器,cnjrfang@zju.edu.cn;

王平(1962-),男,浙江大学,教授,博士生导师,主要研究方向为传感器与检测技术、生物芯片与生物电子学、人工嗅觉与人工味觉等,cnpwang@zju.edu.cn。
Study on Marine Toxins Detection of Cardiomyocyte Potential Sensor*
FANG Jiaru,WANG Qin,LI Hongbo,SU Kaiqi,PAN Yuxiang,WANG Ping*
(Biosensor National Laboratory,Key Laboratory of Biomedical Engineering of Education Ministry,Department of Biomedical Engineering,Zhejiang University,Hangzhou 310027,China)
With the rapid development of modern industry,the threat from marine toxins to human health has become increasingly serious,especially the paralytic biological poison.This paper presents a new method of cellbased potential sensor to detect shellfish toxicity.The cardiomyocyte combined with microelectrode array(MEA)by microelectronic processing technique which construct a novel cardiomyocyte potential sensor.The sensor can not only real-time monitoring,but also could output good extracellular field potential signal with stability and consistency,which cardiomyocytes seeded on the MEA high-closely.By testing saxitoxin(STX)and analyzing the characteristics of signal parameters,the experimental results illustrate the STX have obvious inhibitory effect for electrical activity of cardiomyocyte.And the peak potential amplitude and frequency have obvious inhibition of concentration dependence,and presented the different concentration sensitivity.The LOD(limit of detection)of conventional standard laboratory toxicity detection on mouse bioassay method is 40 μg/100 g,while the LOD and detection range of cardiomyocyte potential sensor is 1.004 ng/mL and 25 nmol/L~1 600 nmol/L,respectively.By comparative experiments,this method has great LOD and the detection is relatively simple and easy to fit standardization.With further improvement,the method has good prospects for development on detection rapidly toxicity of marine toxins.
cell-based biosensor;microelectrode array;marine toxins;cardiomyocyte potential detection;cell field potential signal
R318
A
1004-1699(2016)08-1127-06
EEACC:7230J10.3969/j.issn.1004-1699.2016.08.001
项目来源:海洋公益项目(201305010)
2015-12-16修改日期:2016-03-26
