从“脑心同病”探讨急性脑缺血引发心肌损伤的动态变化
2016-09-19刘雪梅陶冶傅晨王凤丽郑宏张允岭
刘雪梅 陶冶 傅晨 王凤丽 郑宏 张允岭
·论著·
从“脑心同病”探讨急性脑缺血引发心肌损伤的动态变化
刘雪梅陶冶傅晨王凤丽郑宏张允岭
目的观察脑缺血不同时间引发心肌损伤的变化,明确“脑心同病”的生物学基础。方法电凝法致大脑中动脉闭塞建立急性脑缺血诱发心肌损伤大鼠模型,随机分为正常组、假手术组、缺血6小时模型组、缺血12小时模型组和缺血24小时模型组,每组9只,记录心电图分析心率变异性,ELISA法测定血清肌酸激酶同工酶(creatine kinase MB isoenzyme,CK-MB)活性、心肌肌钙蛋白I(cardiac troponinI,cTnI)含量,HE染色法观察脑、心组织形态学变化,HBFP染色法观察心肌纤维形态学变化。结果急性脑缺血明显降低中频段、高频段、总频段,中频段与高频段比值随缺血时间延长呈逐渐上升趋势;随脑缺血时间延长,CK-MB、CTnI呈现先升高后降低趋势,在缺血6小时达高峰;脑缺血6小时出现神经细胞肿胀、结构不清,部分胞核缩小并深染等缺血改变,随脑缺血时间延长逐渐加重,至脑缺血24小时神经细胞数目明显减少,结构形态破坏严重。心肌细胞胞浆着色不均,心肌嗜酸性变;脑缺血6小时心肌纤维广泛、弥漫亲复红染色,心肌发生早期病变,随脑缺血时间延长心肌病变逐渐缩小、程度减轻。结论急性脑缺血能够引发心肌损伤,心肌发生早期病变,心肌酶谱发生异常,可增加心肌酶活性、cTnI含量,在脑缺血6小时达到高峰,证实了脑心同病的生物学基础。
急性脑缺血;心肌损伤;脑心同病
在中老年人群中,脑、心缺血性疾病普遍存在,且往往同时或先后发生而集于一身,可称之为脑心同病。目前临床发现缺血性脑卒中伴发无症状冠心病的患者比率高达16.7%[1];急性心梗并发脑卒中的发病率从1.0%~8.6%不等[2],可见脑心同病在临床是较为常见的现象,在治疗上常采取相同的治疗方法,达到了良好的治疗效果。研究发现心脑血管疾病发病部位虽然不同,但有着诸多相同的危险因素或相似的发病机制。本研究采用电凝致大脑中动脉闭塞方法,建立急性脑缺血大鼠模型,在此基础上动态检测血清心肌酶活性,观察心率变异性及心肌细胞、纤维病理形态学改变,以证实急性脑缺血对心肌的损伤作用,明确脑心同病的发病机制。
1 材料与方法
1.1实验动物
清洁级健康雄性SD大鼠45只,体质量(220±20) g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。
1.2主要试剂、仪器。
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)购自FLUKA;CK-MB、cTnI试剂盒购自RB公司。
电凝器(AESCULAP tb50)、双极电凝镊(TIMESCO)、自动脱水机及石蜡包埋机、切片机(LEICA)、正置显微镜(OLYMPUS)、多导电生理记录仪(Biopac Systems)、酶标仪(Bio-Teck ELx800)。
1.3动物分组及局灶性脑缺血模型造模方法
实验大鼠随机分为正常组、假手术组、缺血6小时模型组、缺血12小时模型组、缺血24小时模型组,共5组,每组9只。手术前12小时禁食、不禁水。
参照Tamura方法[3]并做相应改进,开颅电凝大鼠大脑中动脉,制备局灶性急性脑缺血模型。将大鼠腹腔注射10%水合氯醛麻醉(3.5 mL/kg),左侧卧位固定大鼠于手术台,右颞入路,沿颧弓下缘做一1.5 cm长的皮肤切口,钝性分离颞肌,切除少许下颌骨冠突,暴露鳞状骨、上颌骨,小骨钻钻孔,打开2×4 mm2骨窗,划开硬脑膜,清晰暴露右侧大脑中动脉近侧段。电凝嗅束与大脑下静脉之间的大脑中动脉主干近侧段,造成供血相关区梗塞灶,记录梗塞开始时间。假手术组除不电凝大脑中动脉外,其他操作与模型组相同。
1.4观测指标
1.4.1心率变异性分析各组大鼠在各时间点麻醉,大鼠右上、左下、右下肢皮下分别插入与MP100生理仪相连的不锈钢针形电极,记录心电图信号。连续记录ECG信号120秒,获取低频段(low frequency band,LF,0.04~0.20 Hz)、中频段(midium frequency band,MF,0.21~0.60 Hz)、高频段(high frequency band,HF,0.61~3.00 Hz)、总功率(total power,TP,0.04~3.00 Hz),并计算中频段与高频段比值(MF/HF)。
1.4.2血清肌酸激酶同工酶(creatine kinase MB isoenzyme,CK-MB)活性、肌钙蛋白I(cardiac troponinI, cTnI)含量测定各组大鼠腹主动脉取血,4℃ 3500 rpm离心10分钟取上清。采用ELISA法,按试剂盒说明书进行操作。
1.4.3脑组织形态学观察各组大鼠心脏灌注固定后取出大脑,浸泡于4%多聚甲醛溶液中进行固定。常规酒精脱水,二甲苯透明,浸蜡,石蜡包埋,制成4 μm厚度的石蜡切片。切片进行二甲苯脱蜡,梯度酒精脱水,苏木素染色,1%盐酸酒精分化,0.5%伊红复染,酒精脱水,二甲苯透明,中性树胶封片。光镜下观察大脑皮层缺血区及其周围组织病理形态学变化。
1.4.4心肌组织形态学观察各组大鼠麻醉后快速摘取心脏,置于4%多聚甲醛中固定。心肌组织脱水、包埋、HE染色方法同上。光镜下观察心肌组织的病理学变化。
1.4.5心肌纤维形态学观察心肌组织固定、脱水、包埋及切片等步骤同HE染色。常规脱蜡水化处理后,明矾苏木素染色,流水冲洗返蓝,0.1%碱性复红染色,纯丙酮脱水,0.1%苦味酸丙酮分化,纯丙酮脱水,酒精脱水,二甲苯透明,中性树胶封片。光镜下观察心肌组织的病理学变化。
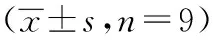
表1 大鼠心率变异性变化
注: 与假手术组比较,aP<0.01。
1.5统计学处理
2 结果
2.1脑缺血不同时间对心率变异性分析
假手术组与正常组相比差异无统计学意义(P>0.05);与假手术组相比,脑缺血6小时、12小时、24小时模型组MF、HF、TF均明显下降(P<0.01),缺血各组之间差异无统计学意义。LF、MF/HF值各组间差异无统计学意义(P>0.05),但随脑缺血时间延长MF/HF比值存在逐渐上升趋势。见表1。
2.2脑缺血不同时间对CK-MB活性和cTnI含量变化
CK-MB活性变化:假手术组与正常组相比差异无统计学意义(P>0.05);与假手术组相比,脑缺血6小时模型组CK-MB活性明显增强(P<0.01);脑缺血12小时模型组较缺血6小时模型组CK-MB活性有所降低,但仍高于假手术组(P<0.01);脑缺血24小时模型组CK-MB活性接近假手术组基础值水平,但差异无统计学意义(P>0.05)。见表2。
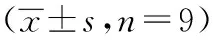
表2 大鼠血清CK-MB活性、cTnI含量变化
注: 与假手术组比较,aP<0.01。
cTnI含量变化:假手术组与正常组相比差异无统计学意义(P>0.05);与假手术组相比,脑缺血6小时模型组cTnI含量明显升高(P<0.01);脑缺血12小时、24小时模型组cTnI含量接近假手术组水平,与假手术组间差异无统计学意义(P>0.05)。见表2。
2.3脑缺血不同时间对神经细胞形态学变化
正常及假手术组:神经细胞数目多,形态结构清楚,胞浆丰富,胞核呈蓝色,核仁清晰可见;脑缺血6小时、12小时、24小时模型组的神经细胞均可见不同程度的肿胀,细胞间隙增宽,出现细胞水肿现象,缺血12小时出现神经细胞数目减少,核仁消失,至缺血24小时时神经细胞形态结构显著破坏,脱失严重,核固缩,核仁不可见。见图1。
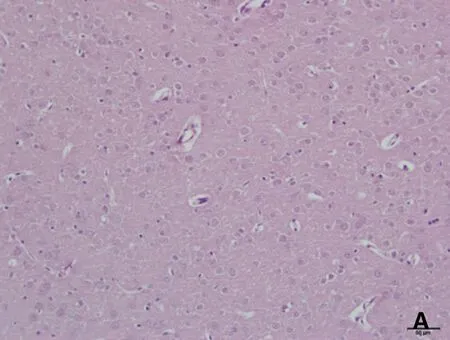
A.假手术组
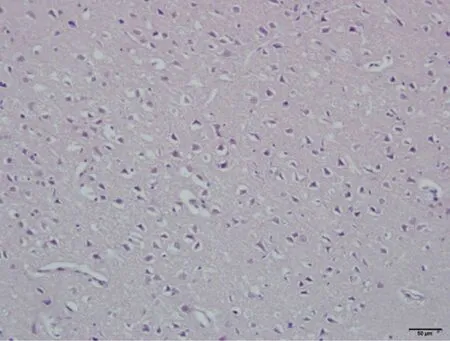
B.脑缺血6小时模型组

C.脑缺血12小时模型组
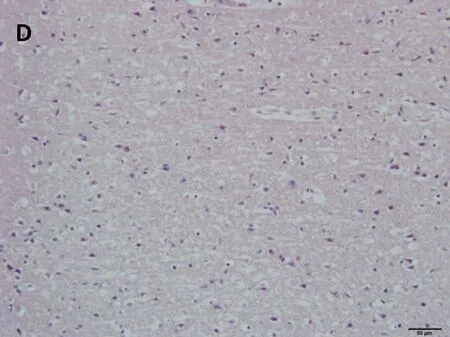
D.脑缺血24小时模型组
图1脑缺血不同时间大鼠脑组织形态学改变(HE染色,×200)
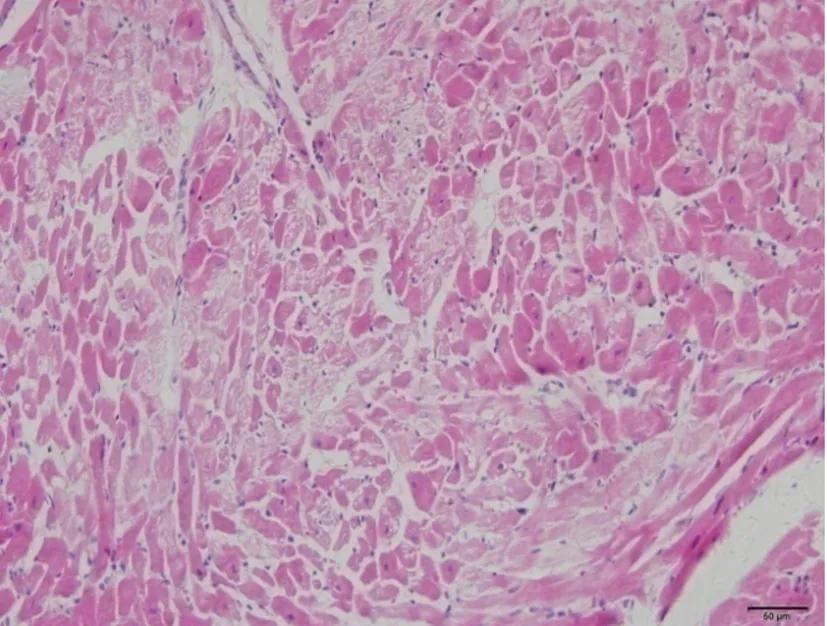
2.4脑缺血不同时间对心肌细胞形态学变化
正常及假手术组:心肌细胞形态正常,肌原纤维排列有序,染色鲜艳均一,脑缺血6小时、12小时、24小时模型组的细胞胞浆着色不均,心肌嗜酸性改变,小部分心肌细胞胞核轻微固缩,出现凝固性坏死;可见收缩带、波状纤维。缺血24小时较缺血6小时、12小时胞浆着色不均范围减少。见图2。
2.5脑缺血不同时间对心肌纤维形态学变化
正常组及假手术组心肌纤维呈金黄色,心肌细胞胞核呈蓝色,心肌细胞间质中红色点状颗粒为红细胞;脑缺血6小时、12小时、24小时模型组均可见心肌纤维亲复红染色呈不同程度红色,其中缺血6小时心肌纤维亲复红染色广泛、弥漫分布,色深红,提示大量的心肌组织发生了早期病理改变;随着脑缺血时间延长,心肌纤维亲复红染色逐渐变淡,提示早期病变的心肌组织随着脑缺血时间延长而开始部分恢复。见图3。
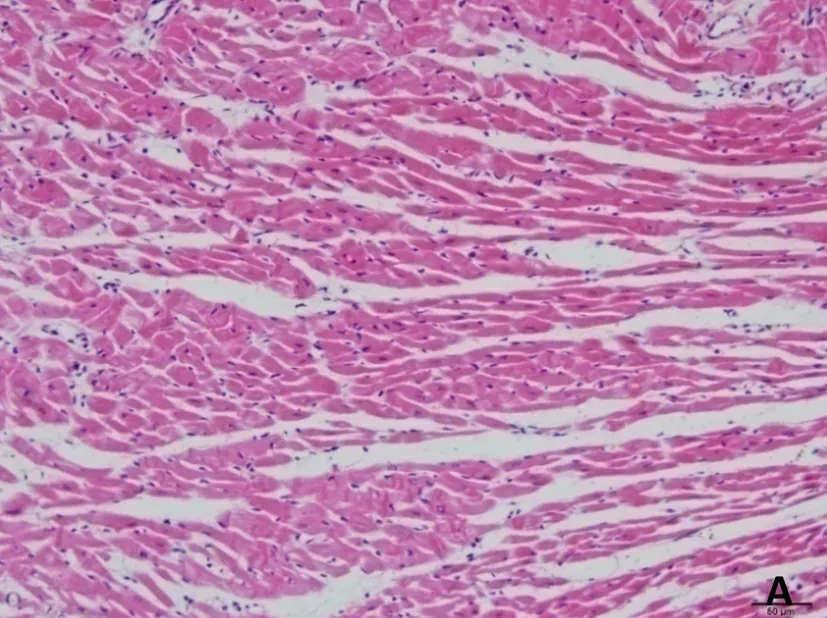
A.假手术组
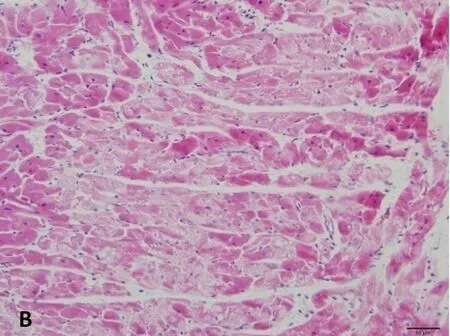
B.脑缺血6小时模型组
C.脑缺血12小时模型组

D.脑缺血24小时模型组
图2脑缺血不同时间心肌组织形态学改变(HE染色,×200)
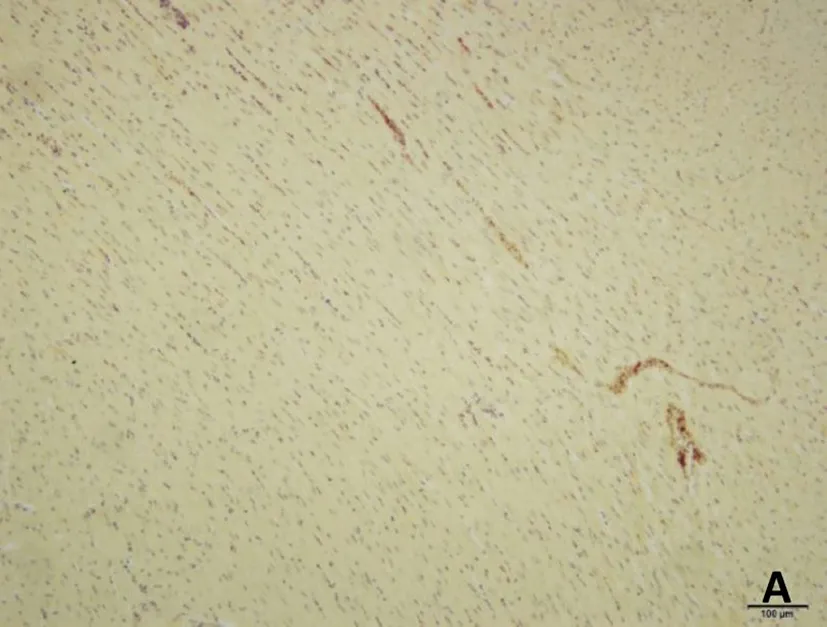
A.假手术组
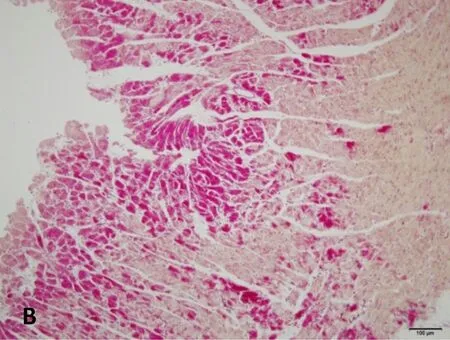
B.脑缺血6小时模型组
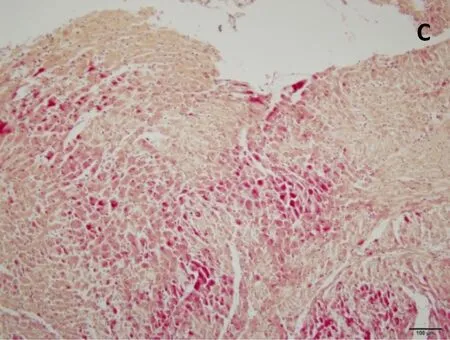
C.脑缺血12小时模型组
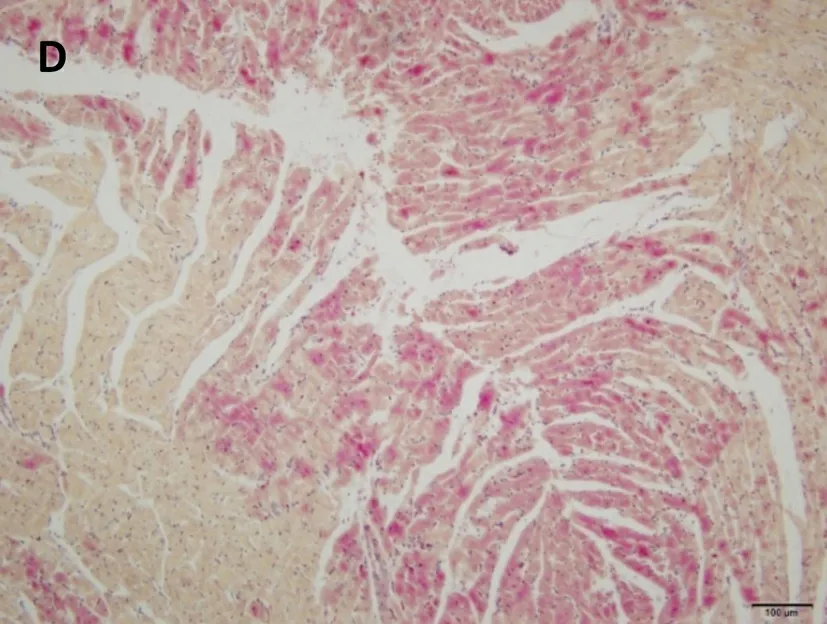
D.脑缺血24小时模型组
图3脑缺血不同时间心肌组织形态学改变(HBFP染色,×200)
3 讨论
心率变异性(heart rate variability,HRV)是指窦性心律在一定时间内周期性改变的现象,可定量评估心脏交感神经、迷走神经的张力以及两者的均衡性对心血管活动的影响[4],其降低可作为心律失常和心源性猝死的独立预报指标[5-6]。HRV由LF、MF和HF三个谱峰组成,MF受心脏交感与副交感神经活动的双重影响;HF是检测心脏副交感神经活性的定量指标;MF/HF比值反映心脏交感和副交感神经活动的平衡。本实验结果显示,脑缺血后6~24小时MF、HF波段功率明显降低,且随缺血时间延长下降愈明显,说明交感、副交感神经功能受损。随脑缺血时间延长植物神经功能受损越严重,心脏可能因此发生继发性损伤。既往临床、实验研究也证实大脑中动脉阻塞患者表现出MF、HF降低,MF/HF比值升高的现象[7-8]。
肌钙蛋白是心肌损伤的特异性和敏感性指标[9],具有高度的心肌特异性;肌酸激酶同工酶为心肌特异性酶,在评判心肌损伤上有较好的灵敏度。本研究采用cTnI与CK-MB联合评价心肌的损伤程度,结果显示脑缺血早期心肌酶活性增强,说明在脑缺血超早期心肌损伤已明确存在。在形态学上同时发现脑缺血后心肌细胞出现间质水肿,心肌纤维受损。提示脑缺血早期容易造成心肌损伤,随着脑缺血时间延长心肌病变减轻。这与文献报道亦一致,急性脑卒中后肌钙蛋白水平增加并有心肌缺血的心电图改变,而且增加死亡危险性,其机制可能与血液循环中儿茶酚胺水平增加有关[10]。
课题组认为脑、心缺血性疾病的直接病变部位是络脉。中风、胸痹或因年老体衰,或因久病气血亏损,脑络、心络失养;瘀血或痰饮内停,而致脑络、心络阻滞不通;情志、瘀血或痰饮郁而化火,进一步损伤脑络、心络,脑络损伤发为中风,心络损伤发为胸痹[11]。本实验发现急性脑缺血大鼠出现不同程度的神经功能缺损症状,梗死周围区神经细胞水肿、胞浆稀疏淡染,胞核固缩;心肌组织出现缺血缺氧早期病变,心肌酶谱异常,证实了脑络损伤进而损伤心络。脑络损伤,脑功能受损、形质败坏,局部正气愈虚、邪气愈盛,炽盛之邪以络脉网络为通道横窜心络,引起心功能损伤、甚至结构变化。脑、心损伤皆以络脉损伤为起始,以功能、结构改变为终点结局,病络机制是脑心同病的共性机制,急性脑缺血诱发心肌损伤的发生发展、相互影响的时空动态过程体现了病络机制的演变规律和脑心同病的发病机制。
[1]Truelsen T,Gronbaek M,Schnohr P,et al.Stroke case fatality in Denmark from 1977 to 1992:the Copenhagen City Heart Study[J].Neuroepidemiology,2002,21(1):22-27.
[2]Komrad MS,Coffey CE,Coffey KS,et al.Myocardhial infarction and stroke[J].Neurology,1984,34(11):1403-1409.
[3]Tamura A,Graham DI,Culloch J, et al.Focal cerebral ischemia in the rat description of technique and early neuropathological consequences following middle cerebral artery occlusion[J].Cereb Blood Flow Metab,1981,1(1):53-60.
[4]Ramadoss M, Ramanathan G, Subbiah AJ, et al. Heart Rate Changes in Electroacupuncture Treated Polycystic Ovary in Rats[J]. J Clin Diagn Res, 2016, 10(3):1-3.
[5]Deng X, Feng X, Li S, et al. Influence of the hypothalamic paraventricular nucleus (PVN) on heart rate variability (HRV) in rathearts via electronic lesion[J]. Biomed Mater Eng, 2015, 26 (S1):487-495.
[6]Haddadian Z, Eftekhari G, Mazloom R, et al. Effect of endotoxin on heart rate dynamics in rats with cirrhosis[J]. Auton Neurosci, 2013 ,177(2):104-113.
[7]蔡紫峰,雷霆,金英雄,等.大鼠局灶性脑缺血对自主神经系统的影响[J].天津医药,2006,34(2):101-104.
[8]洪少勇,雷奕祺,袁明远.缺血性脑卒中患者心率变异性及左室射血分数对照研究[J].武警医学,2008,19(1):69-70.
[9]He H, Zhao ZH, Han FS, et al.Overexpression of protein kinase C ε improves retention and survival of transplanted mesenchymal stem cells in rat acute myocardial infarction[J]. Cell Death Dis, 2016 , 7(1):2056.
[10]刘元生.急性脑卒中的临床表现[J].临床心电学杂志,2014,23(4):241-249.
[11]娄金丽,张允岭,路广林,等.心脑相关理论初探[J].北京中医药大学学报, 2008, 31(11):727-729.
(本文编辑: 禹佳)
Dynamic change from the “Naoxin Tongbing” on myocardial injury induced by acute cerebral ischemia
LIUXue-mei,TAOYe,FUChen,etal.
DongfangHospitalofBeijingUniversityofChineseMedicine,Beijing100078,China
Correspondingauthor:ZHANGYun-ling,E-mail:yunlingzhang2004@163.com
ObjectiveTo observe the dynamic change of myocardial injury induced by cerebral ischemia, and determine the biological basis of “Naoxin Tongbing”. MethodsRat model of middle cerebral artery occlusion was established by electro-coagulation technique. Rats were randomly divided into five groups: normal group, sham group, ischemia 6 h, 12 h, 24 h model groups. Heart rate variability was recorded by ECG; Creatine kinase MB isoenzyme(CK-MB) activity, cardiac troponinI(cTnI) content was detected by ELISA; Morphological changes of cerebral tissue was observed by HE staining and HBFP staining. ResultsAcute cerebral ischemia could decrease MF, HF and TF, MF/HF has an increased tendency. Serum CK-MB activity and cTnI content was increased at first and then decreased,which peaked at 6 h of ischemia. HE staining in the cerebral tissues showed the phenomena of disorganization,neurons edema, quantity decreased and nuclear condensation. The cardiac tissue of HE staining showed chromatosis light, mild coagulation necrosis; 6 hours after cerebral ischemia, myocardial fibers were extensive and diffuse, and the early pathological changes were gradually reduced, and the extent of myocardial lesions decreased with the time of ischemia. ConclusionAcute cerebral ischemia could cause myocardial injury and lead to early myocardial change, increased serum CK-MB activity and cTnI content, which peaked at 6h of cerebral ischemia. It was confirmed the biological basis of “Naoxin Tongbing”.
Acute cerebral ischemia;Cardiac injury;Naoxin Tongbing
国家重点基础研究发展计划(973计划)(2012CB518406);国家国际科技合作专项(2015DFA31130);国家自然科学基金(81173233)
100078北京中医药大学东方医院实验中心[刘雪梅、陶冶、傅晨、王凤丽、郑宏、张允岭]
刘雪梅(1979- ),女,博士,副研究员。研究方向:中西医结合脑病基础研究。E-mail:liuxuemei04@126.com
张允岭(1963- ),博士,教授,博士生导师。研究方向:中医脑病临床与机制研究。E-mail:yunlingzhang2004@163.com
R542.2
A
10.3969/j.issn.1674-1749.2016.09.004
2016-05-10)
