人脑胶质瘤组织中CPEB4的表达及与细胞迁移和侵袭的关系*
2016-09-19刘志军周海存陈小兵刘红林王贵聪
刘志军,周海存,陈小兵,刘红林#,王贵聪
1)河南大学淮河医院神经外科 开封 475500 2)永城市人民医院急诊科 商丘 476600
人脑胶质瘤组织中CPEB4的表达及与细胞迁移和侵袭的关系*
刘志军1),周海存2),陈小兵1),刘红林1)#,王贵聪1)
1)河南大学淮河医院神经外科 开封 4755002)永城市人民医院急诊科 商丘 476600
CPEB4;胶质瘤;侵袭;迁移
目的:探讨CPEB4在人脑胶质瘤组织中的表达及其与细胞迁移和侵袭能力的关系。方法:收集30例人脑胶质瘤患者的新鲜胶质瘤组织和瘤旁正常组织标本,应用Western blot法检测CPEB4的表达;分析CPEB4表达与患者临床病理特征的关系;分别应用siRNA基因干扰系统和质粒过表达系统下调和上调人脑胶质瘤细胞SKMG-4和T98中CPEB4表达;应用Transwell实验检测细胞的侵袭和迁移能力;应用Western blot检测差异表达CPEB4后MMP2和MMP9的表达。结果:30例患者中,22例患者的胶质瘤组织中CPEB4表达高于瘤旁正常组织;CPEB4在脑胶质瘤组织中的高表达与KPS评分和病理分级有关(P<0.05);下调SKMG-4细胞CPEB4表达后,siCPEB4#2组迁移细胞数和侵袭细胞数均高于siControl组(P<0.001),且MMP2和MMP9表达降低;上调T98细胞CPEB4表达后,CPEB4过表达组迁移细胞数和侵袭细胞数均低于对照组(P<0.05),且MMP2和MMP9表达增高。结论:CPEB4在脑胶质瘤组织中呈高表达;CPEB4可通过调控MMP2和MMP9表达影响脑胶质瘤细胞的侵袭和迁移能力。
脑胶质瘤是中枢神经系统常见的原发恶性肿瘤之一[1]。脑胶质瘤常呈浸润性生长,可累及重要的神经结构,且与正常脑组织无明确界限,以至于肿瘤难以彻底切除并较容易复发。胞质多聚腺苷酸化元件结合蛋白4(cytoplasmic polyadenylation element-binding protein 4,CPEB4)是具有序列特异性的RNA结合蛋白,在信使RNA的翻译过程中起着重要的调控作用。近年来研究[2]发现,CPEB4在胰腺癌组织中呈高表达,且与肿瘤的发生发展有关。该研究中,作者应用Western blot和qRT-PCR法检测CPEB4在人脑胶质瘤和正常脑组织中的表达情况,并分析其表达与肿瘤侵袭和转移的关系。
1 材料与方法
1.1组织标本收集30例在河南大学淮河医院神经外科诊治的脑胶质瘤患者的新鲜组织标本,包括胶质瘤原发灶和瘤旁正常脑组织,储存于-80 ℃超低温冰箱中备用。患者均签署知情同意书。其中年龄≤55岁22例,>55岁8例;男8例,女22例;KPS评分≤80分者13例,>80分者17例;肿瘤直径≤3 cm者15例,>3 cm者15例;WHO病理分级Ⅰ级8例,Ⅱ级9例,Ⅲ级6例,Ⅳ级7例。
1.2主要材料 鼠抗人CPEB4单克隆抗体购于美国Abcam公司,兔抗人MMP2、MMP9和GAPDH抗体购于武汉三鹰生物科技公司。 Transwell小室购于南京凯基生物科技公司。Matrigel生物胶购于美国Sigma公司。RNA提取和qRT-PCR检测试剂购于日本TaKaRa公司。转染试剂Lipo-2000购于美国Invitrogen公司。CPEB4过表达质粒购于上海和元生物科技公司,siRNA购于广州锐博生物科技公司。
1.3人脑胶质瘤和正常脑组织、细胞中CPEB4表达的Western blot检测应用蛋白裂解液提取组织或细胞蛋白;应用BCA法检测蛋白浓度后进行配平以保证蛋白浓度一致;应用蛋白干煮器在95 ℃静置7 min,使蛋白变性;配制电泳液和转膜液,以电压80 V行电泳2 h;应用湿转法将蛋白转至PVDF膜上;转膜后应用50 g/L脱脂奶液进行封闭1 h;封闭后将相关条带置入抗体稀释液中,4 ℃孵育24 h;回收抗体后,将条带置入TBST洗膜液中洗膜3次,每次5 min;二抗孵育1~2 h;TBST洗膜3次,每次5 min;配制ECL发光液,应用Image曝光仪进行曝光显影。根据曝光强度评判CPEB4蛋白表达情况,将CPEB4在脑胶质瘤组织中表达高于正常组织的病例归为高表达组,将CPEB4在脑胶质瘤组织中表达低于正常组织的病例归为低表达组。
1.4过表达质粒和siRNA转染选取脑胶质瘤细胞SKMG-4和T98进行细胞实验,应用siCPEB4#1、siCPEB4#2、siCPEB4#3和siControl序列干预细胞筛选转染条件。SKMG-4细胞设siControl组和siCPEB4#2组,T98细胞设pcDNA3.1-Control组和pcDNA3.1-CPEB4组。预先将6孔板中培养基弃去,PBS洗2~3次,加入1.5 mL Opti-MEM培养基;配制A溶液:0.25 mL/孔Opti-MEM培养基+5 μL/孔Lipo-2000试剂,静置5 min;配制B溶液:0.25 mL/孔Opti-MEM培养基+pcDNA3.1-Control质粒或pcDNA3.1-CPEB4质粒1.0 μg/孔或siRNA 5 nmol/孔,静置5 min;混合A液和B液,静置20 min;按0.5 mL/孔AB混合液加入6孔板中,置入培养箱中4~6 h后更换为FBS。常规转染48 h后收集细胞进行相关实验。
1.5细胞迁移实验取胶质瘤细胞培养至70%~80%融合,胰蛋白酶消化后1 000 r/min离心,弃上清,体积分数1% FBS重悬细胞,充分吹打后进行细胞计数;按5万个/孔、200 μL/孔配制细胞悬液。于24孔板里加入700 μL含体积分数10% FBS的培养基后,架上Transwell小室,将细胞种植于小室上层(无需铺置Matrigel),注意不要产生气泡;细胞培养箱中培养16 h;取出培养板,向下室中加入1 mL多聚甲醛,将小室置于其中固定15 min;加入1 mL结晶紫,室温下15 min;自来水洗3遍;风干,注意避光;倒置显微镜下观察,选取5个视野进行计数。每组3个复孔。
1.6细胞侵袭实验取出冻存于-20 ℃的Matrigel生物胶,在4 ℃冰箱中过夜融化,置于冰盒中于超净台外备用;取Matrigel生物胶100 μL与预冷的RPMI 1640 400 μL,在EP管(1.5 mL)中充分混匀。向每个小室中加入40 μL,防止产生气泡,然后将Transwell板放入细胞培养箱中4 h使Matrigel聚集成胶。 其他步骤同1.5。
1.7统计学处理采用SPSS 18.0进行数据分析。人脑胶质瘤组织中CPEB4表达情况与临床病理特征的关系采用χ2检验或精确概率法进行分析,2组间细胞穿透数的比较采用两独立样本的t检验。检验水准α=0.05。
2 结果
2.1人脑胶质瘤和正常脑组织中CPEB4蛋白的表达Western blot结果见图1。CPEB4蛋白在73.33%(22/30)的胶质瘤组织中呈高表达。

N:正常脑组织;T:脑胶质瘤组织。图1 人脑胶质瘤和正常脑组织中CPEB4蛋白的表达
2.2人脑胶质瘤组织中CPEB4表达与临床病理特征的关系结果见表1。由表1可知,脑胶质瘤组织中CPEB4的表达与KPS评分和病理分级有关,而与年龄、性别和肿瘤直径无关。
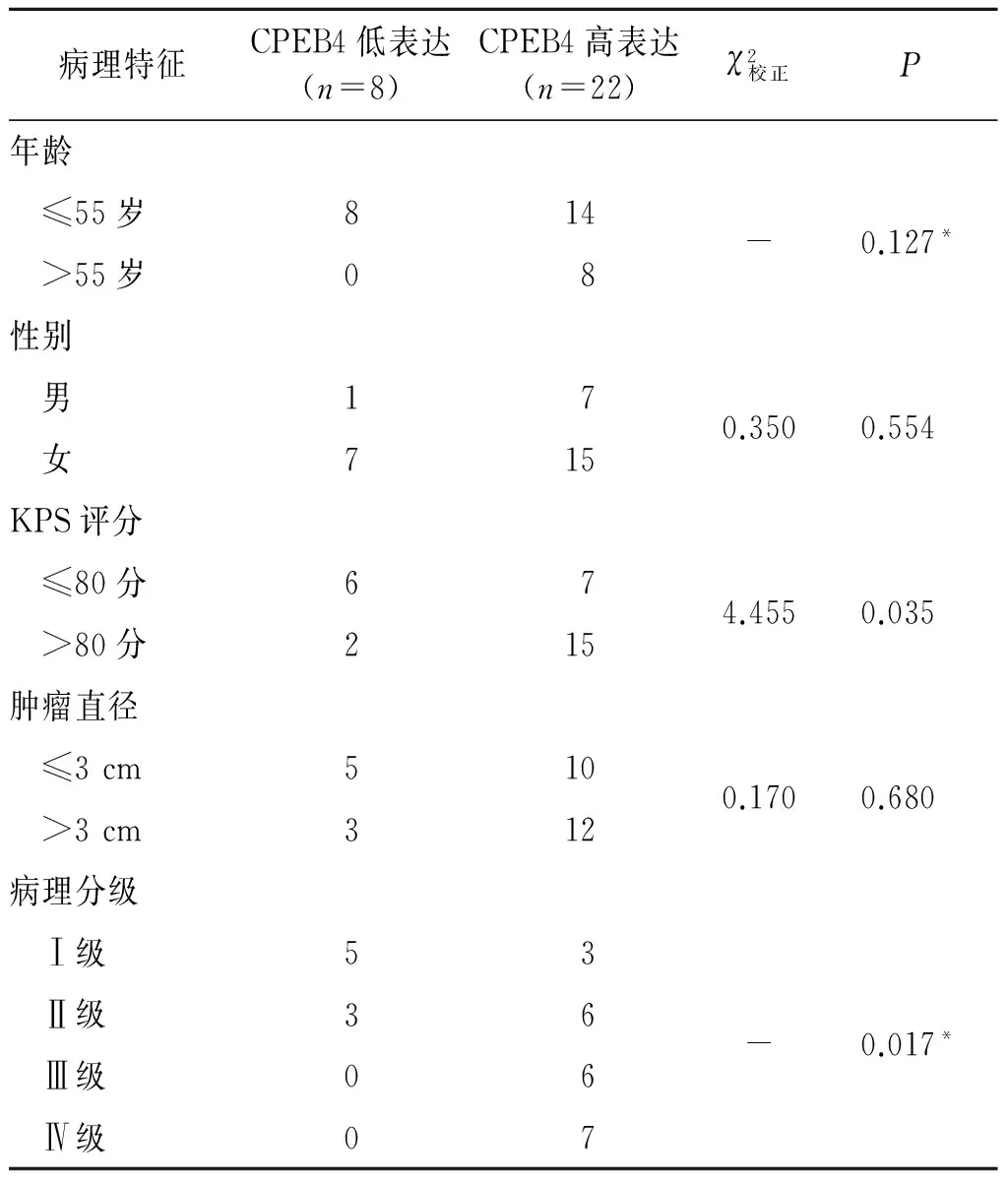
表1 CPEB4表达与脑胶质瘤患者临床病理特征的关系 例
*:精确概率法。
2.3下调CPEB4表达抑制胶质瘤细胞SKMG-4迁移和侵袭能力Western blot检测结果显示,CPEB4在SKMG-4胶质瘤细胞中呈高表达,而在T98细胞中表达程度较低(图2A)。应用siCPEB4和siControl序列干预细胞后发现,3条siRNA序列均可有效下调CPEB4表达(图2B),因此应用siCPEB4#2进行后续研究。Western blot结果显示,下调CPEB4后MMP2和MMP9表达降低(图2C)。细胞迁移和细胞侵袭实验结果见表2。
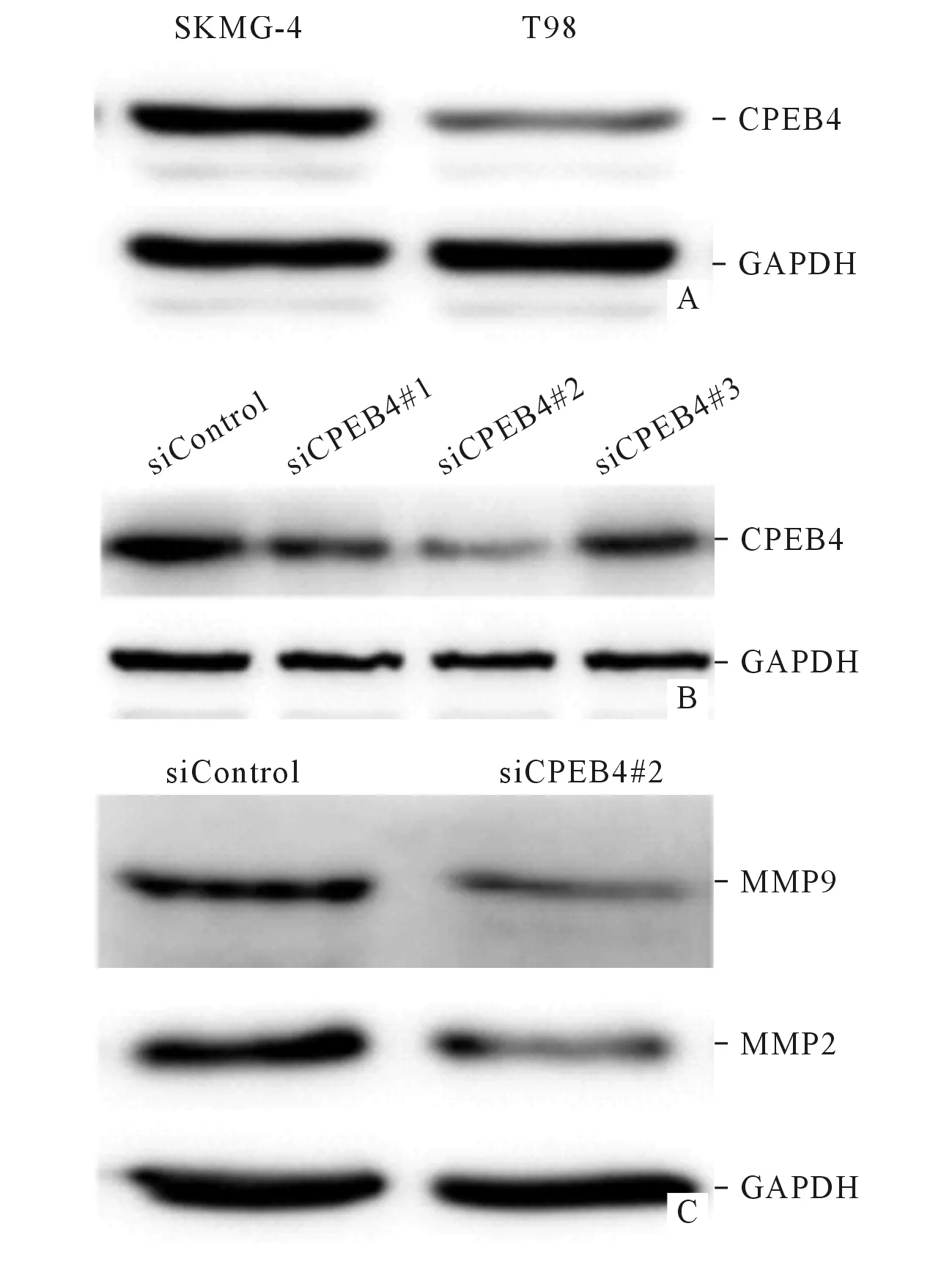
A:CPEB4在脑胶质瘤细胞SKMG-4和T98中的表达;B:siRNA下调SKMG-4细胞中CPEB4的表达;C:下调CPEB4表达后对MMP9和MMP2蛋白表达的影响。图2 各组SKMG-4细胞中CPEB4蛋白的表达

表2 下调胶质瘤细胞SKMG-4CPEB4的表达对细胞迁移和侵袭能力的影响
2.4上调CPEB4表达促进胶质瘤细胞T98迁移和侵袭能力应用CPEB4过表达质粒上调胶质瘤细胞T98中CPEB4表达后,应用Western blot法检测CPEB4蛋白,结果见图3A。Western blot检测结果显示,上调CPEB4后MMP2和MMP9表达增高(图3B)。细胞迁移和细胞侵袭实验结果见表3。
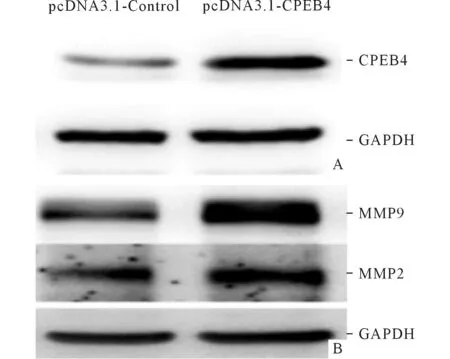
A:过表达质粒上调T98细胞中CPEB4的表达;B:过表达质粒上调CPEB4表达后对MMP9和MMP2蛋白表达的影响。图3 各组T98细胞中CPEB4蛋白的表达

表3 上调胶质瘤细胞T98CPEB4的表达对细胞迁移和侵袭能力的影响
3 讨论
脑胶质瘤是最常见的中枢神经系统恶性肿瘤,占所有神经系统肿瘤的30%,占所有恶性脑肿瘤的80%[3]。CPEB4与肿瘤发生发展有关。近年来研究[4-9]发现,CPEB4在多种恶性肿瘤组织中呈高表达,且与肿瘤的侵袭和转移等生物学功能有一定的相关性。CPEB4在胶质瘤组织中呈高表达,随着病理分级的增高,CPEB4的表达逐渐增高;且CPEB4在胶质瘤组织中的高表达提示胶质瘤患者的预后较差[10-11]。作者发现,CPEB4在脑胶质瘤组织中的高表达提示患者有更高的KPS评分和更差的病理分级。
在针对脑星形细胞瘤的研究[8]中发现,下调CPEB4表达可明显抑制细胞的增殖、侵袭和迁移能力,其机制可能是抑制肿瘤细胞上皮间质转化。此外,在结肠癌和肝癌的研究[6,11]中发现,CPEB4可受到miR-203和miR-550a的直接调控,进而影响肿瘤的增殖、凋亡、周期、侵袭和转移等。该研究结果提示在脑胶质瘤组织中,CPEB4呈现较为明显的高表达。当应用siRNA下调SKMG-4胶质瘤细胞中CPEB4的表达后,细胞侵袭和迁移实验中的穿透细胞数较对照降低,MMP2和MMP9表达降低;而上调T98细胞中CPEB4表达后,穿透细胞数增多,MMP2和MMP9表达增高;其结果提示CPEB4可通过影响MMP2和MMP9等的表达影响胶质瘤细胞的侵袭和转移能力。 在慢性肝炎的研究[12]中发现,细胞中存在CPEB4自我增益的级联反应环路。因此,对CPEB进行深入研究,有助于针对慢性肝炎或恶性肿瘤等疾病的新靶向药物的开发。该课题组将在后续研究中探讨CPEB4是否在胶质瘤中也存在相似的机制。
综上所述,CPEB4在胶质瘤组织中呈明显的高表达;且其高表达可促进胶质瘤细胞的侵袭和转移,而低表达可抑制细胞的转移,其机制可能是影响MMP2和MMP9的表达。
[1]TORRE LA,BRAY F,SIEGEL RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87
[2]ORTIZ-ZAPATER E,PINEDA D,MARTNEZ-BOSCH N,et al.Key contribution of CPEB4-mediated translational control to cancer progression[J].Nat Med,2011,18(1):83
[3]GOODENBERGER ML,JENKINS RB.Genetics of adult glioma[J].Cancer Genet,2012,205(12):613
[4]D′AMBROGIO A,NAGAOKA K,RICHTER JD.Translational control of cell growth and malignancy by the CPEBs[J].Nat Rev Cancer,2013,13(4):283
[5]CHANG YT,HUANG CS,YAO CT,et al.Gene expression profile of peripheral blood in colorectal cancer[J].World J Gastroenterol,2014,20(39):14463
[6]XU H,LIU B.CPEB4 is a candidate biomarker for defining metastatic cancers and directing personalized therapies[J].Med Hypotheses,2013,81(5):875
[7]TIAN Q, LIANG L, DING J, et al.MicroRNA-550a acts as a pro-metastatic gene and directly targets cytoplasmic polyadenylation element-binding protein 4 in hepatocellular carcinoma[J].PloS One,2012,7(11):e48958
[8]CHEN W,HU Z,LI XZ,et al.CPEB4 interacts with Vimentin and involves in progressive features and poor prognosis of patients with astrocytic tumors[J].Tumour Biol,2016,37(4):5075
[9]SUN HT,WEN X,HAN T,et al.Expression of CPEB4 in invasive ductal breast carcinoma and its prognostic significance[J].Onco Targets Ther,2015,8(8):3499
[10]HU W,YANG Y,XI S,et al.Expression of CPEB4 in human glioma and its correlations with prognosis[J].Medicine (Baltimore),2015,94(27):e979
[11]ZHONG X,XIAO Y,CHEN C,et al.MicroRNA-203-mediated posttranscriptional deregulation of CPEB4 contributes to colorectal cancer progression[J].Biochem Biophys Res Commun,2015,466(2):206
[12]CALDERONE V,GALLEGO J,FERNANDEZ-MIRANDA G,et al.Sequential functions of CPEB1 and CPEB4 regulate pathologic expression of vascular endothelial growth factor and angiogenesis in chronic liver disease[J].Gastroenterology,2016,150(4):982
(2016-03-15收稿责任编辑姜春霞)
Expression of CPEB4 in human brain glioma tissue and its relationship with cell invasion and migration
LIUZhijun1),ZHOUHaicun2),CHENXiaobing1),LIUHonglin1),WANGGuicong1)
1)DepartmentofNeurosurgery,HuaiheHospital,HenanUniversity,Kaifeng4755002)DepartmentofEmergency,YongchengPeople′sHospital,Shangqiu476600
CPEB4;glioma;invasion;migration
Aim: To explore the expression of CPEB4 in human brain glioma tissue and its relationship with cell invasion and migration.Methods: A total of 30 paired fresh tissue were obtained from the resection specimens of glioma patients. The expression of CPEB4 in tumor and adjacent normal tissue was detected by Western blot. CPEB4 expression was upregulated and downregulated by overexpressing plasmid and siRNA in glioma cell lines SKMG-4 and T98. The cell invasion and migration was detected by Transwell assay.MMP2 and MMP9 expressions were detected by Western blot. Results: The expression of CPEB4 was higher in 22 cases of tumor tissue than that in adjacent normal brain tissue. CPEB4 expression was related with pathological grade and KPS score(P<0.05).When downregulating CPEB4 expression in SKMG-4 cells by siRNA, pierced cells in siCPEB4#2 group were significantly less than those in siControl group(P<0.001), and the expressions of MMP2 and MMP9 were also reduced. When upregulating CPEB4 expression in T98 cells by pcDNA-3.1 plasmid, pierced cells in control group were significantly more than those in pcDNA-3.1-CPEB4 group(P<0.05), and the expressions of MMP2 and MMP9 were also increased. Conclusion: The expression of CPEB4 is higher in brain glioma tissue. CPEB4 could regulate glioma cell invasion and migration ability by regulating the expression of MMP2 and MMP9.
10.13705/j.issn.1671-6825.2016.05.017
*河南省科技发展计划项目162102310162
,男,1972年10月生,硕士,副主任医师,研究方向:神经系统肿瘤,E-mail:13592116850@139.com
R730.264