水稻斑马叶突变体zebra1349的表型鉴定及基因精细定位
2016-09-18郭国强孙学武孙平勇尹建英袁定阳邓华凤1袁隆平1
郭国强 孙学武 孙平勇 尹建英 何 强 袁定阳,* 邓华凤1,,* 袁隆平1,,*
1湖南农业大学农学院, 湖南长沙 410128;2湖南杂交水稻研究中心杂交水稻国家重点实验室, 湖南长沙 410125;3衡阳市农业科学研究所, 湖南衡阳 421001
水稻斑马叶突变体zebra1349的表型鉴定及基因精细定位
郭国强1,2,3孙学武2孙平勇2尹建英3何强2袁定阳2,*邓华凤1,2,*袁隆平1,2,*
1湖南农业大学农学院, 湖南长沙 410128;2湖南杂交水稻研究中心杂交水稻国家重点实验室, 湖南长沙 410125;3衡阳市农业科学研究所, 湖南衡阳 421001
从恢复系育种材料[R128//(R318/R1025)F1] F6中获得一个新的斑马叶突变体zebra1349, 突变体秧苗期如果不移栽, 与野生型一样表现绿色, 移栽后5 d新抽出的叶片包括叶鞘会呈现出与叶脉垂直的黄绿相间的条纹, 移栽后30 d抽出的叶片又表现正常绿色, 成熟期主要农艺性状与野生型无明显差异。与野生型相比, 突变体六叶期斑马叶黄区部位的总叶绿素、叶绿素a、叶绿素b和类胡萝卜素的含量分别下降了55.86%、61.02%、39.34%和47.03%。透射电镜(TEM)观察表明, 突变体斑马叶绿区部位叶绿体发育正常; 黄区部位叶肉细胞中叶绿体结构异常, 类囊体膜退化和分解严重, 类囊体基粒片层数量明显减少, 片层间距拉大, 排列疏松。对zebra1349与正常叶色品种杂交F1、F2代的遗传分析表明该性状受1对隐性核基因调控。利用1192株zebra1349/02428 F2隐性定位群体, 最终把ZEBRA1349基因定位在水稻第12染色体InDel标记indel39和indel44之间, 其遗传距离分别为0.04 cM和0.17 cM, 根据日本晴基因组序列推测, 两标记之间的物理距离约为89 kb。本研究为ZEBRA1349基因的图位克隆和功能研究以及分子标记辅助育种奠定了基础。
水稻(Oryza sativa L.); 斑马叶突变体; 叶绿体; 基因精细定位
叶色突变是一种表型比较明显、易于鉴别、相对容易获得的突变性状, 有关叶色突变的研究早在20世纪30年代就有报道, 迄今已在水稻、拟南芥、小麦、大豆、大麦、玉米、番茄、烟草、油菜等多种植物中被报道。叶色突变通常在苗期表达, 根据苗期叶色表型可分为白化、黄化、浅绿、绿白、白翠、黄绿、绿黄、条纹8种类型[1]。而其中的条纹突变体又可分为两类, 一类为与叶脉平行的条纹叶,另一类为与叶脉垂直的条纹, 俗称“斑马叶”。叶色突变体如今已广泛应用于叶绿素生物合成途径[2]、光合作用[3]、光形态建成[4]、激素生理[5]、质-核基因互作及信号传导途径[6]等光合系统结构、功能及其调控机制的研究。另外把叶色标记应用到水稻不育系中, 对保证水稻不育系繁殖和杂交制种纯度具有重要的意义[7]。
对水稻叶色突变体的遗传分析和基因定位, 国内外已有较多报道, 目前已发现近134个水稻叶色突变体, 这些突变基因分布在水稻所有12条染色体上[8]。水稻叶色突变体性状大多受1对隐性核基因控制[9], 而由细胞质基因或显性基因控制的叶色突变体很少[10-11]。叶色突变的机制主要有: (1)叶绿素生物合成途径相关基因突变; (2)血红素生物合成途径中的基因突变; (3)编码其它叶绿体蛋白的基因突变; (4)与光合系统无直接关系的基因突变等。目前被子植物中拟南芥的叶绿素生物合成从谷氨酰-tRNA到叶绿素a, 叶绿素a再经叶绿素酸酯a加氧酶氧化形成叶绿素b, 整个反应过程需要15步, 所有控制这15步反应的酶基因都已被成功克隆。水稻中也成功克隆了一些叶色相关基因, 如编码Mg2+-螯合酶3个亚基的OsChlH、OsChlD和OsChlI基因[12-13], 编码叶绿素合酶的YGL1基因[14], 编码叶绿素酸酯a加氧酶的OsCAO1和OsCAO2基因[15],编码鸟苷酸激酶的基因virescent2[16], 编码核糖核苷酸还原酶大亚基蛋白RNRL1和小亚基蛋白RNRS1的基因Virescent3和Stripe1[17], 三角状五肽重复蛋白基因OsPPR1[18], 持绿突变体基因SGR[19], 叶绿素b还原酶基因NYC1[20]及其同源基因NYC1-LIKE[21],以及编码联乙烯还原酶的OsDVR基因[22], 但这些基因主要是集中在编码叶绿素合成与降解途径中的酶基因, 水稻叶色变化过程和调控机制还远未阐明。因此有必要发掘、鉴定一些新的水稻叶色突变体, 进行基因定位、克隆和功能分析等方面的研究,对于补充和完善叶绿体发育机理及叶绿素合成代谢途径具有重要的意义。
本课题组从恢复系育种材料[R128//(R318/ R1025)F1]F6中获得一个斑马叶突变体zebra1349,该突变体秧苗期如果不移栽, 叶色和正常的秧苗一样表现绿色, 移栽后5 d, 新出的叶片包括叶鞘出现与叶脉垂直的黄绿相间斑马叶性状, 以后又逐渐转绿, 其突变性状与目前已报道的叶色突变体性状均不相同, 是一份新的叶色突变材料。本研究对其主要农艺性状、叶绿素含量和叶绿体超微结构等进行了研究, 同时构建了zebra1349×02428 F2群体, 对突变基因进行遗传分析和利用分子标记对突变基因进行精细定位, 旨在为相关基因的克隆、基因功能研究及育种应用奠定基础。
1 材料与方法
1.1实验材料
斑马叶突变体zebra1349经10代连续自交观察,其斑马叶表型性状在湖南衡阳、湖南长沙、海南三地都能稳定遗传。以野生型亲本R1349为对照。
1.2zebra1349表型特征及主要农艺性状调查
2014年在湖南省衡阳市农业科学研究所试验田种植斑马叶突变体zebra1349和野生型亲本R1349。5月10日播种, 四叶期移栽, 单本植, 株行距20 cm× 20 cm, 采用随机区组设计, 田间种植3次重复, 每个小区5行, 每行12株, 按育种小材料田进行田间肥水管理, 及时防治病虫害。观察实验材料在不同时期的叶色变化, 成熟期分别取斑马叶突变体和野生型亲本各10株, 考察生育期、株高、剑叶长、单株有效穗数、穗长、每穗总粒数、千粒重、结实率等主要农艺性状。以t测验分析突变型与野生型的相关性状是否存在显著差异。
1.3 zebra1349不同时期叶绿素含量分析
从斑马叶突变体zebra1349与其野生型亲本R1349群体中, 分别取三叶期(未移栽前)、六叶期(移栽后斑马叶典型期)、九叶期(复绿后)植株的第一叶,去中脉, 分别剪碎混匀, 参照Lichtenthaler[23]的方法测定光合色素含量。
1.4zebra1349叶绿体超微结构观察
取自然条件下突变体zebra1349斑马叶黄区部位和绿区部位叶片及复绿叶片, 先用3%的戊二醛和1%的四氧化锇双重固定, 接着用0.2 mol L–1的磷酸缓冲液漂洗, 再用50%、70%、80%、95%和100%的乙醇梯度脱水, 最后用环氧化树脂包埋, 超薄切片, 经醋酸铀-柠檬酸铅双染色后, 在透射电子显微镜下观察叶绿体超微结构, 并拍照。
1.5zebra1349的遗传分析
2013年夏用斑马叶突变体zebra1349分别与正常叶色野生型亲本R1349、粳型广亲和材料02428正反交得到F1, 其中R1349/zebra1349、zebra 1349/02428两个组合同年冬季在海南三亚加代获得F2, 2014年在衡阳市农业科学研究所试验基地同时种植F1、F2, 5月10日播种, 5月30日移栽, 单本植,移栽后, 当植株长至五至六叶期, 观察各植株的叶色, 同时统计两个组合F2群体中突变表型和正常表型的植株数, 计算分离比, 根据孟德尔遗传规律,进行遗传分析, 并进行χ2测验, 推断zebra1349的遗传模式。
1.6zebra1349的基因定位
用zebra1349与粳型广亲和材料02428杂交产生的F2作为定位群体, CTAB法[24]提取亲本及F2群体中叶色突变单株的基因组DNA。先用实验室均匀分布于水稻12条染色体上的550对分子标记(引物由上海生工生物工程有限公司合成)进行亲本多态性分析, 然后采用Michelmore等[25]提出的近等基因池分析法, 将F2群体中10株正常绿叶和10株斑马叶单株DNA等量混合, 构建正常池和突变池。用在两亲本间具有多态性的标记分别对亲本和突变体DNA混池进行电泳分析, 根据多态性引物在亲本和突变池的基因型, 初步找到目的基因所在的连锁群, 再用179株F2群体中的斑马叶单株进行重组分析和连锁验证, 确定目的基因在染色体上的大概区段, 最后在目标基因附近开发新的SSR标记和InDel标记进行进一步精细定位。
PCR扩增总体系为10 μL, 包括1.0 μL模板DNA, 5.0 μL 2×Easy Taq PCR SuperMix (TRAN SGEN, 中国), 3.0 μL ddH2O, 1.0 μL引物。PCR程序为94℃预变性3 min; 94℃变性30 s, 53~60℃退火35s, 72℃延伸1 min, 35个循环; 最后再72℃后延伸5 min。扩增产物经8%的非变性聚丙烯酰胺凝胶电泳和硝酸银染色后观察。

图1 突变体zebra1349与其野生型亲本R1349在不同时期的表型Fig. 1 Phenotype of the zebra1349 mutant and its wild-type parent R1349 at the different stagesA: 苗期, 移栽前; B: 移栽后5 d, 斑马叶出现; C: 移栽后30 d,斑马叶复绿; D: 成熟期; WT: 野生型; M: 突变体。A: seedling stage, before transplanting; B: at five days (d) after transplanting, zebra leaves appeared; C: at thirty days (d) after transplanting zebra leaves disappeared; D: mature stage. WT: wild type; M: mutant.
2 结果与分析
2.1zebra1349的表型特征及主要的农艺性状
通过对zebra1349的叶色观察, 发现其叶色转变过程为正常绿色—斑马叶色—正常绿色。秧苗期,如果不移栽, zebra1349与野生型一样表现绿色, 不会出现叶色的变化(图1-A); 移栽后5 d左右, 新出的叶片包括叶鞘会呈现出与叶脉垂直的黄绿相间条纹(图1-B), 这种性状在六叶期表现最为明显, 以后斑马叶片上的黄色条纹逐渐消失, 移栽后30 d, 从第九叶开始及以后抽出的叶片表现正常绿色(图1-C)。突变体zebra1349成熟后(图1-D), 与野生型相比在株高、剑叶长度、穗长、每穗总粒数上略有减少, 而生育期、有效穗数、结实率、千粒重有不同程度的增加(表1), 但t测验表明, 突变体zebra1349与野生型亲本R1349在所有调查的主要农艺性状上差异不显著。由上可知, zebra1349移栽后出现的斑马叶表型对其后期的主要农艺性状几乎没有影响。

表1 突变体zebra1349与野生型(WT)亲本主要农艺性状比较Table 1 Comparison of major agronomic traits between the zebra1349 mutant and its wild-type (WT) parent
2.2突变体与野生型叶绿素含量的差异
三叶期zebra1349叶绿素和类胡萝卜素的含量与野生型差异均不显著, 六叶期zebra1349斑马叶黄区部位的色素含量极显著低于野生型, 其总叶绿素、叶绿素a、叶绿素b和类胡萝卜素的含量分别下降了55.86%、61.02%、39.34%和47.03%。而zebra1 349转绿后, 其叶绿素和类胡萝卜素的含量与野生型差异又均不显著, 说明zebra1349转绿后, 叶片的色素合成也随之恢复正常。

图2 zebra1349和野生型(WT)不同发育时期叶片中色素含量分析Fig. 2 Pigment content in leaves of zebra1349 mutant and wild type (WT) at different growth stages**表示野生型与突变体在0.01水平上差异显著。**Represent significant difference between zebra1349 mutant and the wild type at the 0.01 probability level.
2.3突变体叶绿体超微结构观察
超微结构观察显示, 野生型叶肉细胞中叶绿体数目多, 形状呈椭圆型, 基质浓厚, 基粒丰富, 片层垛叠排列紧密、厚实(图3-A)。zebra1349斑马叶片绿区部位叶肉细胞中叶绿体发育正常(图3-B); 黄区部位叶肉细胞中叶绿体类囊体膜系统退化和分解严重, 类囊体基粒片层数量明显减少, 片层间距拉大,排列疏松(图3-C)。复绿后的叶片叶肉细胞中叶绿体结构恢复正常, 类囊体膜系统重建(图3-D)。说明zebra1349的叶色变异与类囊体结构发育异常有关。

图3 突变体zebra1349和野生型叶肉细胞中叶绿体显微结构Fig. 3 Ultrastructures of chloroplasts in the mesophyll cell of the zebra1349 mutant and WTA、B、C、D分别为野生型、zebra1349斑马叶绿区部位和黄区部位及复绿叶片的叶绿体结构。P: 原片层体; G: 基粒;O: 嗜锇粒。A, B, C, D represent chloroplasts of the wild type, the green parts,the yellow parts and green leaves of the zebra1349 mutant, respectively. P: prolamellar body; G: granum; O: osmiophilic globule.
2.4zebra1349的遗传模式
zebra1349分别与正常叶色野生型亲本R1349、粳型广亲和材料02428正反交, 4个F1杂交植株叶片均表现为正常绿色, R1349/zebra1349、zebra1349/ 02428 F2群体中正常绿苗植株与斑马叶突变植株分离十分明显, 经χ2检验均符合3∶1的理论比(表2),表明zebra1349的斑马叶性状由1对隐性核基因控制。
2.5zebra1349的基因精细定位
利用550对分子标记对亲本zebra1349和02428的基因组进行多态性分析, 共筛选到225对在两亲本间呈现多态性的引物, 多态性检出率为39.57%。选取186对扩增效果好、均匀分布于水稻12条染色体的多态性引物分别扩增2个亲本和2个基因池,发现第12染色体上的RM3103、RM1986、RM235、RM17和SFP-12-3标记与目标基因是连锁的, 随后用第12染色体上的6个多态性标记IRO5399、RM27 809、RM101、Zm12-5、CS1215和RIO5415进一步对F2群体中179个具斑马叶表型的单株进行验证,发现这6个标记的交换单株数依次为22、15、1、0、11和36, 进一步说明该基因位于第12染色体上, 遗传连锁分析表明, 斑马叶基因位于RM101和CS1215之间, 遗传距离分别为0.3 cM和2.9 cM, 而介于这2个标记之间的Zm12-5没有检测出交换单株,推断目标基因在Zm12-5标记附近。
为进一步精细定位该斑马叶基因, 在Zm12-5标记附近设计了一系列SSR、InDel标记(表3), 利用这些标记对F2群体的1192株突变单株进行连锁分析, 发现indel39有1个交换株, indel44有4个交换株, indel40标记与目标基因共分离, 因此将目标基因定位在indel39和indel44之间, 遗传距离分别为0.04 cM和0.17 cM。根据日本晴序列, 两标记之间的物理距离约为89 kb, 位于一个BAC克隆OJ1194_E11上(图4)。MSU (http://rice.plantb iology.m su.edu/)网站提供的基因注释信息, 在定位区域内包含12个预测基因(表4)。

表2 zebra1349与野生型亲本R1349和02428杂交F2斑马叶分离情况Table 2 Segregation of F2population in the crosses of R1349 and 02428 with zebra1349
3 讨论
有关水稻斑马叶突变体, 早在20世纪80年代Iwata等[26]就报道过, 迄今为止国内外发现的水稻斑马叶突变体至少有34个[8], 己定位到染色体上的有15个(z1~z15) (http://www.shigen.nig.ac.jp/rice /oryzabase/), 精细定位的2个(z15[27]和zebra524[28]),克隆的2个(zn[29]和z2[30])。它们分别位于水稻第1、第2、第3、第4、第5、第6、第7、第8和第11染色体上。目前在ZEBRA1349所定位的第12染色体上只定位了3个叶色突变基因(http://www.grame ne.org/rice_mutant), 即ETL2[31](已克隆)、TCML2[32]和YGL6[33], ETL2和YGL6为控制水稻黄化的叶绿素缺乏突变基因, ETL2位于水稻第12染色体短臂147 kb和209 kb的范围内, etl2全生育期叶片呈黄色;YGL6位于水稻第12染色体着丝粒区域Indel标记Ind23和Ind37之间143 kb范围内, ygl6在苗期叶片为黄绿色, 到拔节期叶色变成淡绿色。TCML2为一个控制水稻温敏感失绿的基因, 位于水稻第12染色体长臂上分子标记ID21199和ID21436之间的237 kb区域内, tcml2在20℃条件下第2、第3幼叶失绿, 第4叶开始完全转绿, 而24℃以上条件其表型与野生型一致, 呈正常绿色。本研究所鉴定的叶色突变体zebra1349秧苗期如果不移栽, 与野生型一样表现绿色, 移栽后5 d新出的叶片包括叶鞘会呈现出与叶脉垂直的黄绿相间条纹, 移栽后30 d抽出的叶片又表现正常绿色, 其叶色变异特征和以往报道的斑马叶色突变体完全不同, 并且其基因位于水稻第12染色体短臂靠近着丝粒InDel标记indel39和indel44之间,因此无论是从叶色的表型上还是基因在染色体的位置上都可推断ZEBRA1349是一个新的叶色基因。

表3 ZEBRA1349基因的连锁标记Table 3 Sequence of markers linked with ZEBRA1349
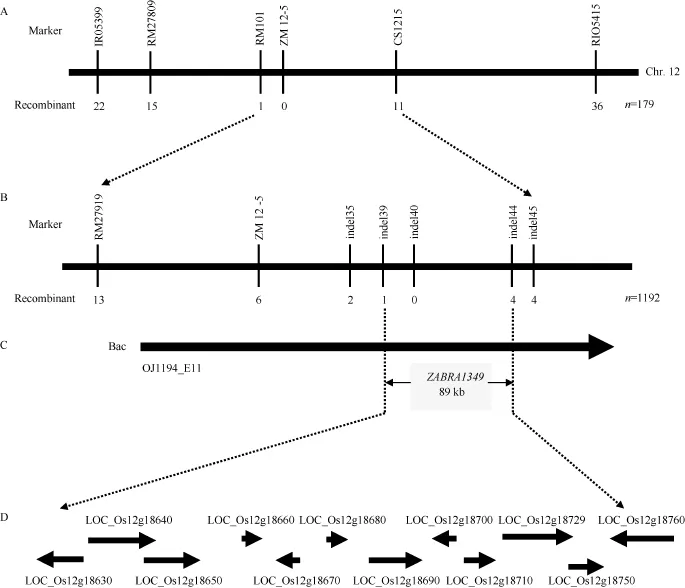
图4 ZEBRA1349基因在第12染色体上的精细定位Fig. 4 Fine mapping of ZEBRA1349 on chromosome 12A: ZEBRA1349被定位到第12染色体RM101与CS1215之间; B: ZEBRA1349被精细定位在InDel标记indel39与indel44之间;C: ZEBRA1349被定位在BAC克隆OJ1194_E11 89 kb范围内; D: 定位区间预测的基因。A: ZEBRA1349 was positioned between RM101 and CS1215 on chromosome 12; B: ZEBRA1349 was fine mapped between two InDel markers indel39 and indel44; C: ZEBRA1349 was located in a BAC of OJ1194_E11 within 89 kb; D: putative genes in the target interval.
叶绿体是光合作用的场所, 其发育调控机制一直是植物生理和分子生物学研究的热点。Kusumi等[34]将水稻叶绿体发育在分子水平上分为3个时期: (1)与叶绿体发育和分裂相关的基因(如OsPOLP1和FtsZ)大量表达; (2)依赖核基因编码的RNA聚合酶(NEP)转录的质体编码的RNA聚合酶(PEP)基因, 如OsRpoTp、v2、rpoA等基因大量表达; (3)与光合作用相关的核编码和质体编码的基因大量表达。zebra1349是一个由移栽等机械损伤引起叶色变异的新材料,其调控叶色变异的分子机制可能不同于以往叶色突变体, 该突变体的发现可能会成为研究高等植物叶绿体发育机理的理想材料。本研究将ZEBRA1349基因定位在水稻第12染色体短臂靠近着丝粒InDel标记indel39和indel44之间, 分别距其0.04 cM和0.17 cM, 根据日本晴序列可知物理距离约为89 kb。利用MSU网站对该区域内的12个预测基因分析, 发现2个与叶色有关的基因, 1个是LOC_Os12g18630, 该基因表达蛋白与质体发育有关; 另一个是LOC_ Os12g18640, 该基因编码一个三角状五肽蛋白(pentatricopeptide repeat protein)。近年来的研究表明,PPR基因在植物中大量存在, 水稻基因组中有650个, PPR蛋白基因由细胞核控制, 亚细胞定位大多数定位在叶绿体或线粒体上, PPR蛋白基因对这些细胞器基因的表达具有重要的调控作用[35], 许多植物失绿突变体与PPR蛋白有关[36], 生物信息学方法分析表明PPR的基因结构有一个显著特点, 其基因序列几乎不含内含子[35], 而据水稻基因组信息, LOC_ Os12g18640只有一个内含子, 其转录子全长2028 bp,说明LOC_Os12g18640编码典型的PPR蛋白。但要最终确定哪个基因是ZEBRA1349, 还需对野生型和突变体全长基因进行克隆、测序, 并对候选基因进行互补验证, 相关研究正在进行当中。

表4 水稻第12染色体定位区间内基因及其推测功能Table 4 Gene names and their putative functions in the target interval
近年来, 叶色标记在育种中的应用愈来愈受到关注, Shu等[37]经多年研究认为, 作为叶色标记应具备以下4个条件: (1)标记性状明显, 易鉴别; (2)标记性状稳定, 不易受环境因素影响; (3)标记性状无显著负效应; (4)标记性状受隐性核基因控制。由于叶色突变往往直接或者间接影响叶绿素的合成降解, 导致光合效率下降, 造成植株生长发育不正常而减产,在迄今发现的水稻叶色突变体中, 绝大多数由于农艺性状欠佳难以在育种上利用。zebra1349遗传行为简单、由1对隐性核基因控制, 叶色标记明显、易于识别, 同时成熟期主要农艺性状与野生型相比差异均不显著, 说明突变性状对植株的生长发育没有产生不利影响, 因此ZEBRA1349作为叶色标记基因在水稻遗传育种中具有更大的应用前景。
4 结论
从恢复系育种材料[R128//(R318/R1025)F1]F6中获得一个斑马叶突变体zebra1349, 该突变体秧苗期如果不移栽, 叶色和正常的秧苗一样表现绿色, 移栽后5 d, 新出的叶片包括叶鞘会出现斑马叶性状,从第九叶开始及以后抽出的叶片表现正常绿色, 成熟期主要农艺性状与野生型相比没有明显的差异。斑马叶片黄区部位中的叶绿素和类胡萝卜素含量显著下降, 叶绿体结构异常, 绿区部位叶绿体结构正常。突变性状由1对隐性核基因控制, 该基因位于第12染色体短臂靠近着丝粒InDel标记indel39和indel44之间, 遗传距离分别为0.04 cM和0.17 cM,物理距离约为89 kb, 尚未见该区段内有叶色突变体的报道。zebra1349是一个新的水稻叶色突变体, 为水稻叶色变异机制的研究提供了理想材料, 本研究为下一步该基因的克隆和功能分析奠定了基础。
References
[1] Awan M A, Konzak C F, Rutger J N, Nilan R A. Mutagenic effects of sodium azide in rice. Crop Sci, 1980, 20: 663-668
[2] 黄晓群, 赵海新, 董春林, 孙业盈, 王平荣, 邓晓建. 水稻叶绿素合成缺陷突变体及其生物学研究进展. 西北植物学报,2005, 25: 1685-1691 Huang X Q, Zhao H X, Dong C L, Sun Y Y, Wang P R, Deng X J. Chlorophyll-deficit rice mutants and their research advances in biology. Acta Bot Boreali-Occident Sin, 2005, 25: 1685-1691 (in Chinese with English abstract)
[3] Fambrini M, Castagna A, Dalla Vecchia F, Degl’innocenti E,Ranieri A, Vernieri P, Pardossi A, Guidi L, Rascio N, Pugliesi C. Characterization of a pigment-deficient mutant of sunflower(Helianthus annuus L.) with abnormal chloroplast biogenesis,reduced PSII activity and low endogenous level of abscisic acid. Plant Sci, 2004, 167: 79-89
[4] Parks B M, Quail P H. Phytochrome-deficient hy1 and hy2 long hypocotyl mutants of Arabidopsis are defective in phytochrome chromophore biologysynthesis. Plant Cell, 1991, 3: 1177-1186
[5] Agrawal G K, Yamazaki M, Kobayashi M, Hirochika R, Miyao A,Hirochika H. Screening of the rice viviparous mutants generated by endogenous retrotransposon tos17 insertion. Tagging of a zeaxanthin epoxidase gene and a novel OsTATC gene. Plant Physiol,2001, 125: 1248-1257
[6] Stern D B, Hanson M R, Barkan A. Genetics and genomics of chloroplast biogenesis: maize as a model system. Trends Plant Sci, 2004, 9: 293-301
[7] 沈圣泉, 舒庆尧, 吴殿星, 陈善福, 夏英武. 白化转绿型水稻三系不育系白丰A的选育. 杂交水稻, 2005, 20(5): 10-11 Shen S Q, Shu Q Y, Wu D X, Chen S F, Xia Y W. Breeding of new rice CMS line Baifeng A with a green-revertible albino leaf color marker. Hybrid Rice, 2005, 20(5): 10-11 (in Chinese with English abstract)
[8] 邓晓娟, 张海清, 王悦, 舒志芬, 王国槐, 王国梁. 水稻叶色突变基因研究进展. 杂交水稻, 2012, 27(5): 9-14 Deng X J, Zhang H Q, Wang Y, Shu Z F, Wang G H, Wang G L. Research advances on rice leaf-color mutant genes. Hybrid Rice,2012, 27(5): 9-14 (in Chinese with English abstract)
[9] 谭炎宁, 孙学武, 袁定阳, 孙志忠, 余东, 何强, 段美娟, 邓华凤, 袁隆平. 水稻单叶独立转绿型黄化突变体grc2的鉴定与基因精细定位. 作物学报, 2015, 41: 831-837 Tan Y N, Sun X W, Yuan D Y, Sun Z Z, Yu D, He Q, Duan M J,Deng H F, Yuan L P. Identification and fine mapping of green-revertible chlorina gene grc2 in rice (Oryza sativa L.). Acta Agron Sin, 2015, 41: 831-837 (in Chinese with English abstract)
[10] 钱前, 朱旭东, 曾大力, 张小惠, 严学强, 熊振民. 细胞质基因控制的新特异材料白绿苗的研究. 作物品种资源, 1996, (4): 11-12 Qian Q, Zhu X D, Zeng D L, Zhang X H, Yan X Q, Xiong Z M. The study on a new special material, white-green rice which controlled by plasma gene. J Crop Resour, 1996, (4): 11-12 (in Chinese)
[11] 李贤勇, 王楚桃, 李顺武, 何永歆, 陈世全. 一个水稻高叶绿素含量基因的发现. 西南农业学报, 2002, 15(4): 122-123 Li X Y, Wang C T, Li S W, He Y Y, Chen S Q. The discovery of a high chlorophyll content gene in rice. Southwest China J Agric Sci, 2002, 15(4): 122-123 (in Chinese)
[12] Jung K H, Hur J, Ryu C H, Choi Y, Chung Y Y, Miyao A, Hirochika H, An G. Characterization of a rice chlorophyll-deficient mutant using the T-DNA gene-trap system. Plant Cell Physiol,2003, 44: 463-472
[13] Zhang H T, Li J J, Yoo J H, Yoo S C, Cho S H, Koh H J, Seo H S,Paek N C. Rice chlorina-1 and chlorina-9 encode ChlD and ChlI subunits of Mg-chelatase, a key enzyme for chlorophyll synthesis and chloroplast development. Plant Mol Biol, 2006, 62: 325-337[14] Wu Z M, Zhang X, He B, Diao L P, Sheng S L, Wang J L, Guo X P, Su N, Wang L F, Jiang L, Wang C M, Zhai H Q, Wan J M. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis. Plant Physiol, 2007,145: 29-40
[15] Lee S, Kim J H, Yoo E S, Lee C H, Hirohika H, An G. Differential regulation of chlorophyll a oxygenase genes in rice. Plant Mol Biol, 2005, 57: 805-818
[16] Sugimoto H, Kusumi K, Tozawa Y, Yazaki J, Kishimoto N, Kikuchi S, Iba K. The virescent-2 mutation inhibits translation of plastid transcripts for the plastid genetic system at an early stage of chloroplast differentiation. Plant Cell Physiol, 2004, 45:985-996
[17] Yoo S C, Cho S H, Sugimoto H, Li J, Kusumi K, Koh H J, Koh I,Paek N C. Rice virescent3 and stripe1 encoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development. Plant Physiol, 2009, 150: 388-401
[18] Gothandam K M, Kim E S, Cho H J, Chung Y Y. OsPPR1, a pentatricopeptide repeat protein of rice is essential for the chloroplast biogenesis. Plant Mol Biol, 2005, 58: 421-433
[19] Park S Y, Yu J W, Park J S, Li J, Yoo S C, Lee N Y, Lee S K,Jeong S W, Seo H S, Koh H J, Jeon J S, Park Y I, Paek N C. The senescence-induced stay green protein regulates chlorophyll degradation. Plant Cell, 2007, 19: 1649-1664
[20] Kusaba M, Ito H, Morita R, Iida S, Sato Y, Fujimoto M, Kawasaki S, Tanaka R, Hirochika H, Nishimura M, Tanaka A. Rice NON-YELLOW COLORING1 is involved in light-harvesting complex II and grana degradation during leaf senescence. Plant Cell, 2007, 19: 1362-1375
[21] Yutaka S, Ryouhei M, Susumu K, Minoru N, Ayumi T, Makoto K. Two short-chain dehydrogenase/reductases, NON-YELLOW COLORING 1 and NYC1-LIKE, are required for chlorophyll b and light-harvesting complex II degradation during senescence in rice. Plant J, 2009, 57: 120-131
[22] Wang P R, Gao J X, Wan C M, Zhang F T, Xu Z J, Huang X Q,Sun X Q, Deng X J. Divinyl chlorophyll(ide) a can be converted to monovinyl chlorophyll(ide) a by a divinyl reductase in rice. Plant Physiol, 2010, 153: 994-1003
[23] Lichtenthaler H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. Methods Enzymol, 1987, 148: 350–382
[24] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucl Acids Res, 1980, 8: 4321–4326
[25] Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations. Proc Natl Acad Sci USA, 1991, 88: 9828–9832
[26] Iwata N, Omura T, Sato H. Linkage studies in rice (Oryza sativa L.) on some mutants for physiological leaf spots. Fac Agric Kushu Univ, 1978, 22: 243–251
[27] Wang Q S, S C, Ling Y H, Zhao F M, Yang Z L, Li Y F, He G H. Genetic analysis and molecular mapping of a novel gene for zebra mutation in rice (Oryza sativa L.). J Genet Genomics, 2009,36: 679–684
[28] 李燕群, 钟萍, 高志艳, 朱柏羊, 陈丹, 孙昌辉, 王平荣, 邓晓建. 水稻斑马叶突变体zebra524的表型鉴定及候选基因分析.中国农业科学, 2014, 47: 2907–2915 Li Y Q, Zhong P, Gao Z Y, Zhu B Y, Chen D, Sun C H, Wang P R,Deng X J. Morphological characterization and candidate gene analysis of zebra leaf mutant zebra524 in rice. Sci Agric Sin,2014, 47: 2907–2915
[29] Li J J, Pandeya D, Nath K, Zulfugarov I S, Yoo S C, Zhang H T,Yoo J H, Cho S H, Koh H Jon, Kim D S, Seo H S, Kang B C, Lee C H, Paek N C. ZEBRA-NECROSIS, a thylakoid-bound protein,is critical for the photoprotection of developing chloroplasts during early leaf development. Plant J, 2010, 62: 713–725
[30] Chai C L, Fang J, Liu Y, Tong H N, Gong Y Q, Wang Y Q, Liu M,Wang Y P, Qian Q, Cheng Z K, Chu C C. ZEBRA2, encoding a carotenoid isomerase, is involved in photo protection in rice. Plant Mol Biol, 2011, 75: 211–221
[31] Mao D H, Yu H H, Liu T M, Yang G Y, Xing Y Z. Two complementary recessive genes in duplicated segments control etiolation in rice. Theor Appl Genet, 2011, 122: 373–383
[32] Dong Y J, Lin D Z, Mei J, Su Q Q, Zhang J H, Ye S H, Zhang X M. Genetic analysis and molecular mapping of a thermo-sensitive chlorosis mutant in rice. Mol Plant Breed, 2013, 11: 1–7
[33] Shi J Q, Wang Y Q, Guo S, Ma L, Wang Z W, Zhu X Y, Sang X C,Ling Y H, Wang N, Zhao F M, He G H. Molecular mapping and candidate gene analysis of a yellow-green leaf 6 (ygl6). Crop Sci,2014, 55: 669-680
[34] Kusumi K, Chono Y, Shimada H, Gotoh E, Tsuyama M, Iba K. Chloroplast biogenesis during the early stage of leaf development in rice. Plant Biotechnol, 2010, 27: 85–90
[35] Lurin C, Andres C, Aubourg S, Bellaoui M, Bitton F, Bruyere C,Caboche M, Debast C, Gualberto J, Hoffmann B, Lecharny A,Ret M L, Martin-Magniette M L, Mireau H, Peeters N, Renou J P,Szurek Boris, Taconnat L, Small I. Genome-wide analysis of arabidopsis pentatricopeptide repeat proteins reveals their essential role in organelle biogenesis. Plant Cell, 2004, 16: 2089–2103[36] Su N, Hu M L, Wu D X, Wu F Q, Fei G L, Lan Y, Chen X L, Shu X L,Zhang X, Guo X P, Cheng Z J, Lei C L, Qi C K, Jiang L,Wang H Y, Wan J M. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production. Plant Physiol, 2012, 159: 227–238
[37] 舒庆尧, 夏英武, 左晓旭, 刘贵付. 二系杂交水稻制繁种中利用标记辅助去杂技术. 浙江农业大学学报, 1996, 22(1): 56–60 Shu Q Y, Xia Y W, Zuo X X, Liu G F. Maker-assisted elimination of contamination on two-line hybrid rice seed production and multiplication. J Zhejiang Agric Univ, 1996, 22(1): 56–60 (in Chinese)
Morphological Characterization and Fine Mapping of Zebra Leaf Mutant zebra1349 in Rice (Oryza sativa L.)
GUO Guo-Qiang1,2,3, SUN Xue-Wu2, SUN Ping-Yong2, YIN Jian-Ying3, HE Qiang2, YUAN Ding-Yang2,*,DENG Hua-Feng1,2,*, and YUAN Long-Ping1,2,*
1College of Agronomy, Hunan Agricultural University, Changsha 410128, China;2State Key Laboratory of Hybrid Rice, Hunan Hybrid Rice Research Center, Changsha 410125, China;3Hengyang Agricultural Science Research Institute, Hengyang 421001, China
A new zebra leaf mutant zebra1349 was attained in a restorer line crossing population of [R128//(R318/R1025) F1] F6in Hengyang Agricultural Science Research Institute of Hunan province. This mutant showed normal green leaves at seedlings stage, but a zebra leaf phenotype with green-yellow bands in penpendicular to leaf vein appeared at five days after transplanting,which was most obvious at sixth-leaf stage, and recovered normal green leaves around 30 days (ninth-leaf stage) after transplanting. Until the mature stage, the zebra1349 mutant showed insignificant difference with the wild type in major agronomic traits. The contents of total chlorophyll, chlorophyll a, chlorophyll b and carotenoid in yellow parts of the mutant leaf at sixth-leaf stage decreased by 55.86%, 61.02%, 39.34%, and 47.03%, respectively. Transmission Electron Microscopic (TEM) results indicated that the chloroplast of the mutant yellow leaf showed a serious thylakoid membrane degradation and decomposition, and the number of thylakoid grana lamella decreased significantly with larger gap and looser arrangement. Genetic analysis using F1and F2of the reciprocal crosses between zebra1349 and normal green rice varieties revealed that the zebra-leaf trait was controlled byone pair of recessive nuclear genes. With 1192 recessive plants in a F2population from the cross between zebra1349 mutant and normal green variety 02428, the ZEBRA1349 gene was finely mapped between two InDel markers indel39 and indel44 on chromosome 12 with a genetic distance of 0.04 cM and 0.17 cM respectively, and the physical distance was 89 kb based on comparing with the reference genome of Japonica rice Nipponbare. These results provide a foundation for further map-based cloning of ZEBRA1349 and molecular marker-assisted breeding.
Rice (Oryza sativa L.); Zebra leaf mutant; Chloroplast; Gene fine mapping
10.3724/SP.J.1006.2016.00957
本研究由国家高技术研究发展计划(863计划)项目“强优势水稻杂交种的创制与应用”(2011AA10A101)和衡阳市科技局重点项目“黄色带状标记基因在两用核不育系中的利用” (2011KZ15)资助。
The study was supported by the grants from National High-tech R&D Program of China (863 Program)(2011AA10A101) and the Key Project Funded by the Hengyang Science and Technology Bureau (2011KZ15).
(Corresponding authors): 袁隆平, E-mail: lpyuan@hhrrc.ac.cn, Tel: 0731-89733455; 邓华凤, E-mail: dhf@hhrrc.ac.cn; 袁定阳,E-mail: yuandingyang@hhrrc.ac.cn
联系方式: E-mail: hnggq2008@163.com, Tel: 0734-2405130
Received(): 2015-12-28; Accepted(接受日期): 2016-03-14; Published online(网络出版日期): 2016-03-28.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160328.1116.014.html
