相变浆液中甲烷水合物的生成过程强化
2016-09-18陈彬辛峰宋小飞李鑫钢严红超
陈彬,辛峰,宋小飞,李鑫钢,严红超
(天津大学化工学院,天津 300072;天津化学化工协同创新中心,天津 300072)
相变浆液中甲烷水合物的生成过程强化
陈彬,辛峰,宋小飞,李鑫钢,严红超
(天津大学化工学院,天津 300072;天津化学化工协同创新中心,天津 300072)
利用相变材料(PCM)正十四烷的固液相变过程,吸收甲烷水合释放的热量,实现了直接换热强化水合过程的目的。正十四烷与水混合制成相变乳液(PCE),经冷却后形成浆液。在半间歇水合器中,测定并计算了甲烷水合物在此浆液中的收率和生成速率。为了提高计算的准确性,设计了一套PVT装置,通过减压法实验测定了低温条件下甲烷在正十四烷中的溶解度。实验结果表明:低温条件下,甲烷在正十四烷中的溶解度与压力基本呈线性关系;相比于间接传热方式下的水合过程,相变浆液中甲烷水合物收率及生成速率得到了有效提升。
甲烷水合物;相变浆液;溶解度;传热;水合物收率;水合速率
引 言
水合物,是由小分子气体与水分子之间以非化学计量比形式形成的笼型晶体,常见的气体有甲烷、乙烷和二氧化碳[1]。由于形成水合物的气体分子尺寸大小不同,形成的水合物在晶体结构上也存在一定的差异,如SⅠ型结构(如CH4、CO2、H2等),SⅡ型结构(如N2、乙烷等)和SH型结构(如甲基环己烷)[2]。甲烷水合物,也称作“可燃冰”,主要存在于深海和高纬度沉积岩层内,根据目前已经探明的储量,以甲烷水合物形式存在的有机碳能源是当前化石能源中储存的有机碳能源的两倍以上[3-4]。由于水合物在能源储存及运输[5-6]、混合气体分离[7-8]、海水脱盐淡化[9]及二氧化碳捕获[10]等方面的应用前景,水合物的研究正越来越受到国内外学者的广泛关注。
甲烷水合物在生成过程中的水合热效应较为显著,每摩尔甲烷水合物生成时释放的热量为(-54.44±1.45)kJ[11],且容易发生团聚,受限于甲烷水合物生成过程中极大的传热和传质阻力,甲烷水合物生成速率和水合物收率一般较低[12]。为了强化甲烷水合物的生成过程,实践中已经采用过多种方法,如添加表面活性剂[13]、添加活性炭和纳米硅[14]、使用添加了硅砂和活性白土的多孔介质作为水合发生场所[15]、采用高速搅拌[16]的水合体系等手段来强化水合过程中的传质。为了移除水合过程中产生的大量水合热,Pang等[17]通过在水合发生器中内置一组缠绕的导热铜管以强化水合过程中的传热;Yang等[18]研究了在管式换热器中水合过程的生成动力学,然而在这样的间接传热体系中,其传热效率依然较低。当前已有一些利用体系内组分相变,如冰颗粒[19-20]的融化来实现直接传热式水合过程的研究,其传热效率更高,但制冰过程能耗大,并且冰颗粒容易凝结,水合器易发生阻塞等问题,不利于连续操作。近来,采用油水乳液[21]来研究气体水合物生成过程的报道越来越多,在油水乳液中,气体分子与水分子之间的接触面积可以有效增大,同时甲烷等气体在油相中溶解度远大于其在水中的溶解度,有利于气体分子向水合物相的传质。在较为普遍的油包水[22]体系中,油相作为分散剂可以有效减缓水合物在形成过程中的团聚,因而水合过程得以持续进行,水合物收率也较纯水体系有所提高。
目前采用以石蜡类材料作为相变材料[23]的水包油乳液来研究甲烷水合物生成的报道很少,本文采用了以正十四烷为相变材料的相变浆液[24],利用正十四烷融化时的相变潜热,可大为缓解水合过程中由水合热造成的体系温升,水合体系温度可维持在正十四烷的熔点(277.6 K)附近;同时甲烷在正十四烷中的溶解度远大于其在水中的溶解度,利于水合过程中的甲烷传质;水合过程开始前,浆液中大量的固态正十四烷颗粒有利于诱导甲烷水合物的非均相成核,促进水合物的生长。同时,现有的甲烷在正十四烷中的溶解度数据中[25],其在279~293 K条件下的溶解度数据尚不完备。为使水合过程计算更加准确,本实验利用水合器设计了一套 PVT装置,采用减压法测定了低温条件下,甲烷在正十四烷中的溶解度数据。本文还研究了相变浆液中的甲烷水合物生成过程,重点关注了不同压力条件对甲烷水合物收率和生成速率的影响。
1 实验材料和方法
1.1材料
甲烷,纯度99.99%,天津市六方工业气体有限公司。正十四烷,纯度98%,上海阿拉丁生化科技股份有限公司。脱水山梨醇单油酸酯(Span80)及脱水山梨醇单油酸酯聚氧乙烯醚(Tween60),化学纯,天津市光复化学试剂有限公司。
1.2实验装置
实验所用的装置如图1所示,水合器(内径35 mm,容积50 m l)是由316L不锈钢加工制成。在水合器上方安置了一个转速可达1200 r·min-1的电磁驱动搅拌器。为使水合过程中水合器内外温差尽可能减小,在水合器外壁处缠绕了数圈导热铜管,将低温水浴槽中的冷却液(乙二醇水溶液)与铜管闭合连通,通过控制冷却液的温度和流速可实现对水合器外壁温度的控制。水合器及甲烷进气管路采用聚氨酯泡沫进行封装隔热。采用两个Pt100阻抗型温度传感器监测水合器内外的温度,精度±0.1 K。通过CYB-20S型压力传感器(北京威斯特中航机电技术有限公司)和K9138F-1P-B型背压阀(北京熊川阀门制造有限公司)对水合器内的压力进行监测及控制,压力传感器及背压阀的精度为±10 kPa。温度、压力及质量流量计(MFM)信息由数据采集系统每 5 s记录一次;质量流量控制器(MFC)信息通过D07-19BM流量积算仪由相应软件显示并记录。质量流量计和质量流量控制器(北京七星华创电子股份有限公司)精度为满量程的2%。实验所用相变乳液是由高性能T25型分散机(德国IKA)制备得到。
1.3实验流程
1.3.1甲烷在正十四烷中溶解度测定使用恒流泵以5 m l·min-1的进液速率泵入30 m l正十四烷,启动低温恒温水浴槽使装置温度稳定在测量温度,记录此时 PVT单元中的压力(P1)和温度(T1)。通过质量流量控制器(MFC)通入甲烷气体至一定压力,关闭进气阀门,记录MFC累积进气流量Qcul。启动磁力搅拌,设置转速 250 r·min-1,使溶解达到平衡,当PVT单元内压力稳定时,关闭搅拌使装置恒温1 h,记录此时的压力(P2)和温度(T2)。为减小误差,在每个状态点时的溶解度至少测量5次。
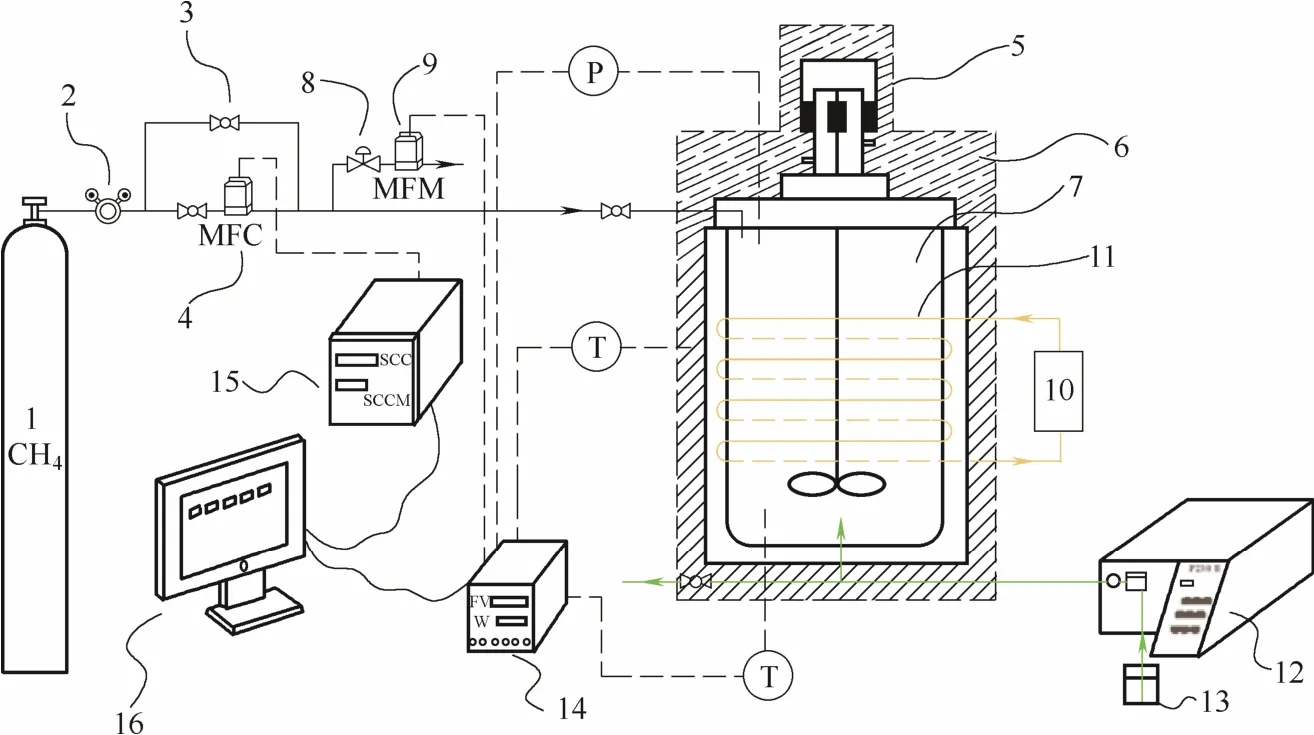
图1 实验装置示意图Fig.1 Experimental apparatus
1.3.2甲烷水合物生成以质量含量2.92%:1.08%:45%:51%的比例,精确称取Tween60、Span 80、正十四烷和去离子水进行混合,使用分散机在10000 r·min-1的转速下将混合液分散5 m in使其形成均匀乳液。水合开始前,校准图1中所示的质量流量控制器(MFC),质量流量计(MFM)以及温度、压力传感器等仪器。使用去离子水和制备的乳液相继清洗水合器后,使用甲烷气体多次换气,使水合器内处于甲烷气氛。使用恒流泵泵入 16 m l待用乳液,启动低温恒温水浴槽,使冷却液循环流通,待相变乳液中的所有的正十四烷液滴凝结成固态小颗粒后,将浆液缓慢升温至固态正十四烷颗粒的熔点(277.6 K)附近。将甲烷气体快速通入水合器中,使水合器内的压力达到预设值,待水合器内压力值稳定后,开启搅拌,水合过程中不断进气以使体系恒压。当MFC与MFM的瞬时流量差为零时,水合过程结束。
1.4实验原理
1.4.1甲烷在正十四烷中溶解度测定溶解前后,对PVT单元(水合器)中的甲烷气体作物质量衡算

其中nd为溶解在正十四烷中的甲烷气体的量,mol;nin为甲烷进气的量,mol;ncs、ncf分别为溶解前后PVT单元气相中的甲烷气体的量,mol。
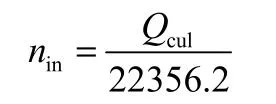

其中,20(m l)为体系内甲烷气体体积,22356.2 m l·mol-1是使用 P-T状态方程[26]计算得到的甲烷气体在标况下的摩尔体积;Vmol(T1,P1),Vmol(T2,P2)分别为甲烷气体在相应状态下的摩尔体积,可通过P-T状态方程[26]计算。
甲烷在正十四烷中的溶解度x

其中,nn-tetra为泵入的正十四烷的量,mol。
1.4.2甲烷水合物生成甲烷水合物的生成过程是按非化学计量比进行的相变过程[1]
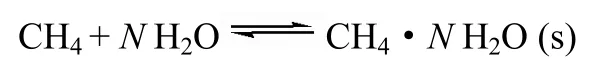
其中,N为甲烷水合物水合数,理论最大值为5.75[2]。
水形成水合物后,体积约为初始体积的 1.25倍[27]。在0~t时间段内,考虑到相变浆液的体积膨胀,进入到相变浆液体系中的甲烷气体的量为

其中,nMFC(t),nMFM(t)分别为0~t时间内质量流量控制器及质量流量计检测的甲烷气体累积的量,mol;ΔnCH4(h)(t)为0~t时间内用于形成水合物的甲烷气体的量,mol;P、T为实验压力和温度;MW、ρW分别为水的摩尔质量和密度,Z为实验条件下甲烷气体的压缩因子,可通过P-T状态方程[26]计算得到。
甲烷在水中的溶解度相较于在正十四烷中的溶解度可忽略不计[28],同时实验是在强搅拌条件下进行,作如下假设:
(1)甲烷在正十四烷中的溶解可快速达到饱和;
(2)只考虑固态正十四烷颗粒融化和水合物形成过程中的热效应。
进入到相变浆液中的甲烷气体一部分用于参与水合,一部分溶解在正十四烷中,如式(5)所示

其中,ΔnCH4(h)(t)、ΔnCH4(d)(t)分别为形成水合物时消耗的甲烷气体的量和溶解在液相正十四烷中的甲烷气体的量,mol。
对水合过程进行热量衡算,如式(6)所示

其中,ΔHh、ΔHe分别为每摩尔甲烷水合物生成焓变和每摩尔正十四烷融化焓变。
将式(5)和式(6)代入到式(4)中,可计算得到在0~t时间内,参与形成水合物消耗的甲烷气体的量如式(7)所示
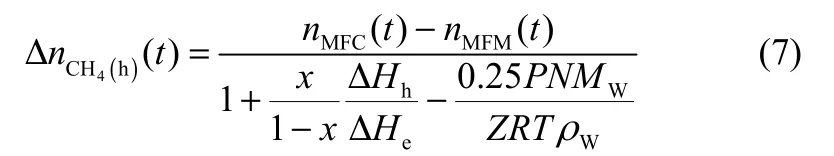
定义水合物收率ϕ:在0~t时间内形成甲烷水合物所消耗的甲烷气体量与理论最大甲烷储存量之间的比值。

其中,nW,i为相变浆液中水组分的初始量,mol。
定义水合速率rh(t):单位体积水中,在t~(t+Δt)时间内参与形成甲烷水合物的甲烷气体消耗速率。
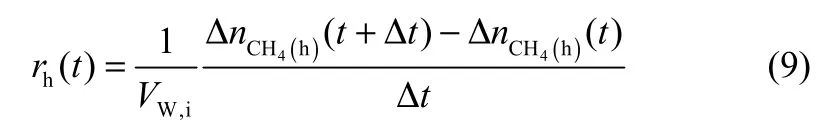
其中,VW,i为相变浆液中水组分的初始体积。
2 实验结果与讨论
2.1甲烷在正十四烷中溶解度测定
由于甲烷在正十四烷中溶解度较大,对相变浆液中甲烷水合物的生成过程影响较大。利用水合器,本实验设计了一套PVT装置,采用减压法测定了在临近固态正十四烷熔点时的甲烷溶解度数据。
如图2所示,在279.15 K和293.15 K条件下,温度对于甲烷在正十四烷中的溶解度影响较小,采用279.15 K条件下甲烷在正十四烷中的溶解热力学数据具有较强的可靠性。

图2 甲烷在正十四烷中的溶解度测量Fig.2 Methane solubility measurements at 279.15 K and 293.15 K respectively
实验分别测定了在2~6 MPa压力条件下的甲烷溶解度数据,压力对甲烷溶解度的影响趋于线性,尤其是在压力范围较小的情况下,甲烷溶解度(x)与压力基本呈线性相关,式(10)给出了温度为279.15 K时甲烷溶解度与压力的线性关系
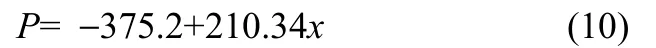
Nourozieh等[25]测定了在温度高于295 K条件下甲烷在正十四烷中的溶解度。与本实验在293.15 K温度下测得的溶解度数据相比,压力为2 MPa时,相对偏差为 8%,压力为 5 MPa时,相对偏差为3.8%。因而本实验所测的甲烷溶解度数据可靠性较强。

表1 甲烷在正十四烷中的溶解度数据Table 1 Practical measurements for methane solubility in n-tetradecane
当水合压力为6.28 MPa时,水合过程结束后,溶解在正十四烷中的甲烷气体量占进入到相变浆液中的甲烷气体总量的28.6%。结合所测溶解度数据和线性关系,实验采用了如表1所示的热力学数据进行后续水合过程的计算。
2.2甲烷水合物生成
在水合温度277.6 K,搅拌速率800 r·min-1条件下,实验研究了在 5、5.25、5.5、6、6.28 MPa下的甲烷水合物生成过程。在相变浆液中,水合过程的诱导时间很短,主要包括恒速水合阶段和快速水合阶段两个阶段。
2.2.1甲烷水合物收率水合物的生长是一种晶体生长过程,在本实验使用的相变浆液中,固态正十四烷颗粒为水合物的生长提供了大量成核点,因而水合过程可以快速开始。
如图3所示,在各组实验条件下,水合过程的诱导时间一般在 3~10 min。当经过一定时间的恒速水合过程后,水/水合物/正十四烷(液相)三相接触面积不断增大,为进一步水合提供了更多的生长点,因而水合过程进入快速水合阶段。由于水合过程中,生成的水合物晶体容易团聚,浆液黏度不断增大,甲烷从气相向水合物相的传质阻力增大,同时,固态正十四烷不断融化,水合过程的传热效率也不断降低。受限于传质和传热阻力的增大,水合过程继而停止。
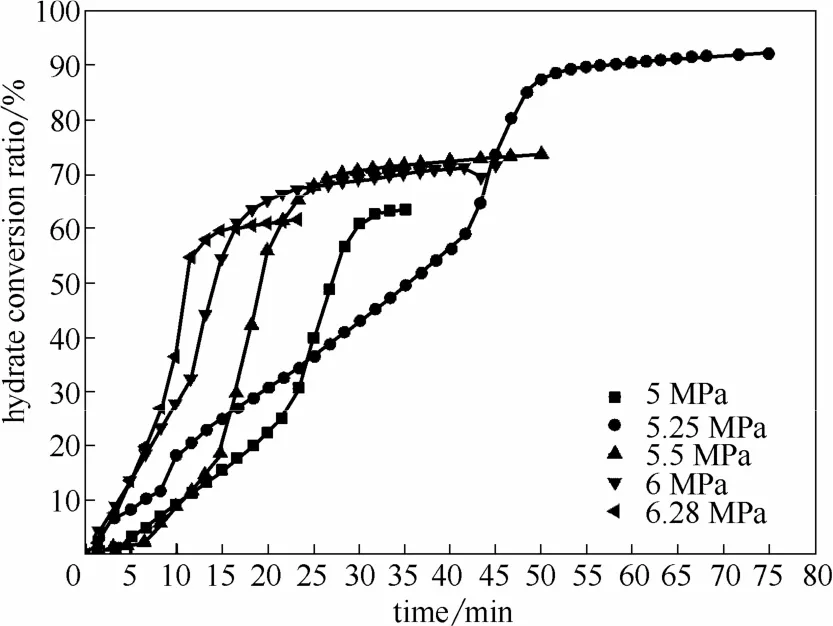
图3 搅拌速率800 r·m in-1和初始温度277.6 K条件下的甲烷水合物收率Fig.3 Methane hydrate yield ratio at agitation speed 800 r·m in-1and initial temperature 277.6 K
当水合压力在5~5.25 MPa下时,水合物收率随压力增大也相应提高,最大水合物收率为92.2%(单位体积水合物可存储标况下甲烷 157体积)。当水合压力高于5.25 MPa时,随着压力的增大,水合过程的转化率不断降低,主要由于水合物生成速率随着压力的增大不断加快,生成的水合物晶体颗粒容易团聚,使得进一步水合的传质阻力增大,因而当水合压力过大时,水合物收率却会降低。
2.2.2甲烷水合物生成速率采用以正十四烷为相变材料(PCM)的相变浆液,甲烷水合物的生成速率大幅提升,水合过程耗时也相应减少。
如图4所示,当甲烷水合物经过诱导开始形成后,将以较为稳定的生成速率进行水合。随着水合压力的增大,水合过程的推动力增大,恒速阶段的水合速率也逐步提高。水合压力为6.28 MPa时,恒速阶段的水合速率为0.0267 mol CH4·(m l H2O·s)-1,较水合压力 5 MPa时的恒速水合速率 0.014 mol CH4·(m l H2O·s)-1提升了90%。
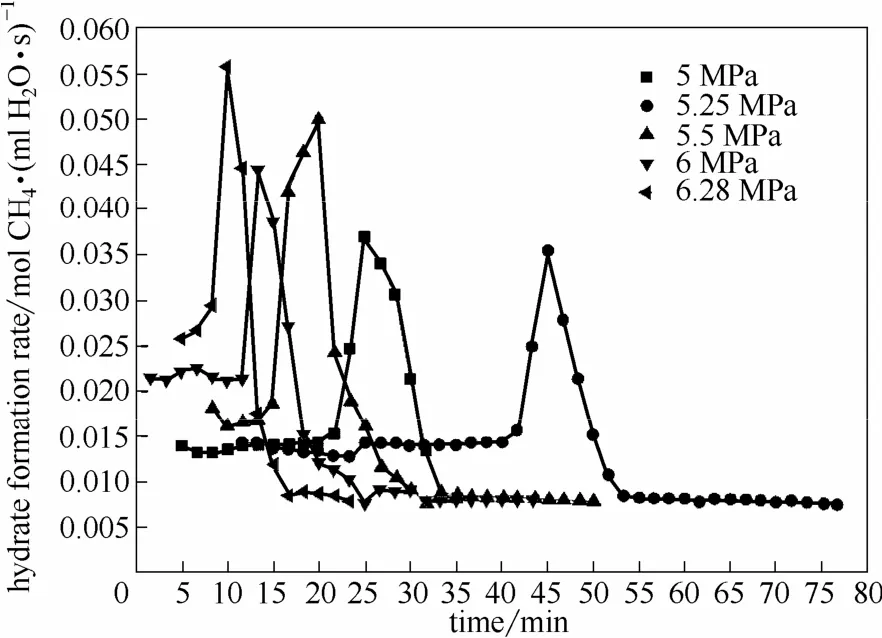
图4 搅拌速率800 r·m in-1和初始温度277.6 K条件下的甲烷水合物生成速率Fig.4 Methane hydrate formation rate vs. time at agitation speed 800 r·m in-1and initial temperature 277.6 K
当恒速水合进行一段时间后,水合速率会出现一个陡升过程,水合转入快速阶段,随着水合压力的增大,水合过程将更快地进入快速阶段。当相变浆液中的正十四烷固体颗粒完全融化后,水合过程趋于停止。
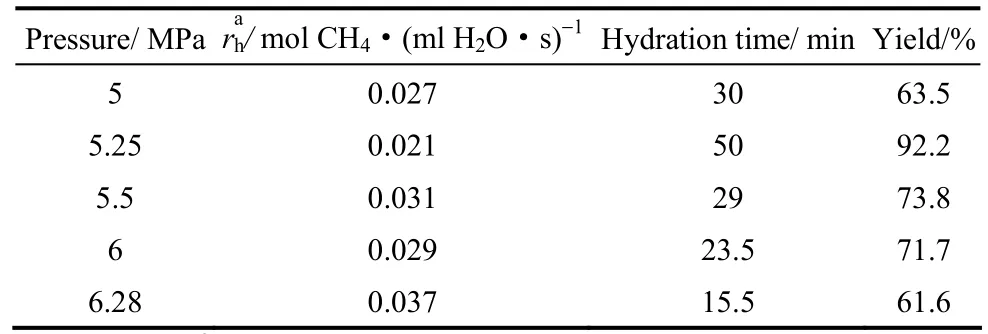
表2 快速水合阶段的平均水合速率、水合过程时间及水合物收率Table 2 Average rate of methane hydrate formation during rapid formation stage and hydrate formation time as well as hydrate yield
如表2所示,水合压力增大时,水合物生成推动力也会相应增大,但最终水合物收率不仅与水合推动力有关,也与水合物生成过程时间有关。当水合压力为5.25 MPa时,水合过程持续时间可达50 m in,最终的水合物收率也最高。

表3 本研究中甲烷水合物生成过程与已有文献数据之间的比较Table 3 Comparison of induction time, hydration time and hydrate yield between present work and previous works
在已有的关于甲烷水合物的研究中,多是采用水相溶液来研究其生成过程。如表3所示,在Ganji等[29]的实验中,纯水体系下,甲烷水合物的生成诱导时间约为12 h,并且水合过程时间超过24 h。同时其研究了不同添加剂(SDS,LABS,CATB,ENP)对水合速率的影响,在最优的实验条件下(8.3 MPa,500 mg·L-1SDS溶液中),生成的甲烷水合物最大收率为79.9%。Hao等[30]研究了在十二烷基硫酸钠溶液中甲烷水合物的生成,最优的水合时间约为370 min。从表3中的对比可以看出,采用正十四烷作为相变材料强化甲烷水合物生成过程中的传热,可大大减少水合时间,同时能得到较高的水合物收率。
3 结 论
在本实验工作中,通过测量低温条件下甲烷在液态正十四烷中的溶解度,结合更为精确的计算过程,研究了在相变浆液中甲烷水合物生成过程。实验结果发现:(1)在279.15~293.15 K条件下,温度对甲烷在正十四烷中的溶解度影响较小,在2~6 MPa压力范围内,甲烷溶解度随压力基本呈线性变化;(2)在实验压力5~6.28 MPa下,当经过3~10 min的诱导过程后,水合物开始生成,在各条件下,水合过程持续时间不超过50 m in;(3)水合压力5.25 MPa时,可得到92.2%的最大水合物收率,较6.28 MPa下的甲烷水合物收率提高了49.6%。后期将更多地关注水合过程中的传质过程。
符号说明
ΔHe——焓变,kJ·mol-1
M ——摩尔质量,kg·mol-1
N ——水合数
n ——物质的量,mol
P ——压力,Pa
Q——体积流量,m l
R——Boltzmann常数
r——水合速率,mol CH4·(m l H2O·s)-1
T——温度,K
t——时间,min
V——摩尔体积,m l·mol-1
x——摩尔分数,%
Z——气体压缩因子
ϕ ——水合物收率,%下角标
cf——溶解后
cs——溶解前
cul——累积
d——溶解
h——水合
i——初始时
in——进入
References
[1] SLOAN E D, KOH C A. Clathrate Hydrates of Natural Gas[M]. 3rd ed. Boca Raton: CRC Press Inc., 1998: 721.
[2] STROBEL T A, HESTER K C, KOH C A, et al. Properties of the clathrates of hydrogen and developments in their applicability for hydrogen storage[J]. Chemical Physics Letters, 2009, 478(4): 97-109.
[3] LU S M. A global survey of gas hydrate development and reserves: specifically in the marine field[J]. Renewable and Sustainable Energy Reviews, 2015, 41: 884-900.
[4] LEE S Y, HOLDER G D. Methane hydrates potential as a future energy source[J]. Fuel Processing Technology, 2001, 71(1): 181-186.
[5] SLOAN E D. Fundamental principles and applications of natural gas hydrates[J]. Nature, 2003, 426(6964): 353-63.
[6] CHA J H, SEOL Y. Increasing gas hydrate formation temperature for desalination of high salinity produced water w ith secondary guests[J]. ACS Sustainable Chemistry & Engineering, 2013, 1(10): 1218-1224.
[7] TOM ITA S, AKATSU S, OHMURA R. Experiments and thermodynamic simulations for continuous separation of CO2from CH4+ CO2gas mixture utilizing hydrate formation[J]. Applied Energy, 2015, 146: 104-110.
[8] LEE H J, LEE J D, LINGA P, et al. Gas hydrate formation process for pre-combustion capture of carbon dioxide[J]. Energy, 2010, 35(6): 2729-2733.
[9] PARK K N, SANG Y H, JIN W L, et al. A new apparatus for seawater desalination by gas hydrate process and removalcharacteristics of dissolved minerals (Na+, Mg2+, Ca2+, K+, B3+)[J]. Desalination, 2011, 274(1): 91-96.
[10] DASHTI H, YEW L Z, LOU X. Recent advances in gas hydrate-based CO2capture[J]. Journal of Natural Gas Science and Engineering, 2015, 23: 195-207.
[11] GUPTA A, LACHANCE J, SLOAN JR E, et al. Measurements of methane hydrate heat of dissociation using high pressure differential scanning calorimetry[J]. Chemical Engineering Science, 2008, 63(24): 5848-5853.
[12] RIBEIRO C P, LAGE P L C. Modelling of hydrate formation kinetics: state-of-the-art and future directions[J]. Chemical Engineering Science, 2008, 63(8): 2007-2034.
[13] ANDO N, KUWABARA Y, MORI Y H. Surfactant effects on hydrate formation in an unstirred gas/liquid system: an experimental study using methane and micelle-forming surfactants[J]. Chemical Engineering Science, 2012, 73(19): 79-85.
[14] GOVINDARAJ V, MECH D, PANDEY G, et al. Kinetics of methane hydrate formation in the presence of activated carbon and nano-silica suspensions in pure water[J]. Journal of Natural Gas Science & Engineering, 2015, 26: 810-818.
[15] SAW V K, UDAYABHANU G, MANDAL A, et al. Methane hydrate formation and dissociation in the presence of silica sand and bentonite clay[J]. Oil & Gas Science & Technology, 2014, 70(6): 1087-1099.
[16] LINGA P, KUMAR R, LEE J D, et al. A new apparatus to enhance the rate of gas hydrate formation: Application to capture of carbon dioxide[J]. International Journal of Greenhouse Gas Control, 2010,4(4): 630-637.
[17] PANG W X, CHEN G J, DANDEKAR A, et al. Experimental study on the scale-up effect of gas storage in the form of hydrate in a quiescent reactor[J]. Chemical Engineering Science, 2007, 62(8): 2198-2208.
[18] YANG D, LE L A, MARTINEZ R J, et al. Kinetics of CO2hydrate formation in a continuous flow reactor[J]. Chemical Engineering Journal, 2011, 172(1): 144-157.
[19] STAYKOVA D K, KUHS W F, SALAMATIN A N, et al. Formation of porous gas hydrates from ice powders: diffraction experiments and multistage model[J]. The Journal of Physical Chemistry B, 2003,107(37): 10299-10311.
[20] HENNING R W, SCHULTZ A J, THIEU V, et al. Neutron diffraction studies of CO2clathrate hydrate: formation from deuterated ice[J]. The Journal of Physical Chemistry A, 2000, 104(21): 5066-5071.
[21] HUANG L, LIANG M, BO W, et al. Separation of ethylene from refinery dry gas via forming hydrate in w/o dispersion system[J]. Separation & Purification Technology, 2013, 116(37): 342-350.
[22] LI X G, CHEN C, CHEN Y, et al. Kinetics of methane clathrate hydrate formation in water-in-oil emulsion[J]. Energy & Fuels, 2015,29(4): 2277-2288.
[23] HUANG L, PETERMANN M, DOETSCH C. Evaluation of paraffin/water emulsion as a phase change slurry for cooling applications[J]. Energy, 2009, 34(9): 1145-1155.
[24] SONG X F, XIN F, YAN H C, et al. Intensification and kinetics of methane hydrate formation under heat removal by phase change of n-tetradecane[J]. AIChE Journal, 2015, 61(10): 3441-3450.
[25] NOUROZIEH H, KARIZNOVI M, ABEDI J. Vapor-liquid equilibrium measurement and thermodynamic modeling of binary systems (methane + n-tetradecane)[J]. Fluid Phase Equilibria, 2012,318: 96-101.
[26] PATEL N C, TEJA A S. A new cubic equation of state for fluids and fluid mixtures[J]. Chemical Engineering Science, 1982, 37(3): 463-473.
[27] PARRISH W R, PRAUSNITZ J M. Dissociation pressures of gas hydrates formed by gas mixtures[J]. Industrial & Engineering Chemistry Process Design & Development, 1972, 11(1): 26-35.
[28] SERVIO P, ENGLEZOS P. Measurement of dissolved methane in water in equilibrium with its hydrate[J]. Journal of Chemical & Engineering Data, 2002, 47(1): 87-90.
[29] GANJI H, MANTEGHIAN M, OM IDKHAH M R, et al. Effect of different surfactants on methane hydrate formation rate, stability and storage capacity[J]. Fuel, 2007, 86(3): 434-441.
[30] HAO W, WANG J, FAN S, et al. Evaluation and analysis method for natural gas hydrate storage and transportation processes[J]. Energy Conversion and Management, 2008, 49(10): 2546-2553.
Enhancement of methane hydrate formation process in phase change slurry
CHEN Bin, XIN Feng, SONG Xiaofei, LI Xingang, YAN Hongchao
(School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China; Collaborative Innovation Center of Chemical Science and Engineering(Tianjin), Tianjin 300072, China)
The phase change emulsion(PCE) containing phase change material(PCM) of n-tetradecane was used to directly absorb heat of the hydration by the solid-to-liquid phase change of n-tetradecane. Once n-tetradecane in PCE was solidified in the hydrator, the PCE would convert to slurry. The impacts of different pressures from 5.0 to 6.28 MPa on the yield of methane hydrate and hydration rate in the slurry at the temperature 277.6 K were researched at a sem i-batch hydrator. Considering the influence of methane dissolution in n-tetradecane on the hydration process, a PVT apparatus to measure the solubility of methane in liquid n-tetradecane was designed, and a more precise calculation process was established to describe the methane hydration. The results showed that:at low temperature conditions, the solubility of methane in liquid n-tetradecane distributed linearly versus pressure,and the methane hydrate formation process was intensified significantly compared to indirect heat removal hydration.
methane hydrate; phase change slurry; solubility; heat removal; hydrate yield; hydration rate
date: 2016-03-25.
Prof. XIN Feng, xinf@tju.edu.cn
supported by the National Basic Research Program of China (2012CB215005).
TE 8
A
0438—1157(2016)08—3202—07
10.11949/j.issn.0438-1157.20160346
2016-03-25收到初稿,2016-06-07收到修改稿。
联系人:辛峰。第一作者:陈彬(1991—),男,硕士研究生。
国家重点基础研究发展计划项目(2012CB215005)。