构建原核表达质粒pGEX-4T-2-GFP并鉴定其在大肠杆菌中的表达*
2016-09-18周晨辰张鹏飞
陆 琤 周晨辰 张鹏飞 张 硌*
构建原核表达质粒pGEX-4T-2-GFP并鉴定其在大肠杆菌中的表达*
陆 琤①周晨辰①张鹏飞①张 硌①*
目的:构建绿色荧光蛋白(GFP)的原核表达质粒,用以研究小鼠巨噬细胞吞噬细菌的能力。方法:编码GFP的聚合酶链反应(PCR)产物经EcoRⅠ和BamHⅠ双酶切后,与双酶切后的载体pGEX-4T-2相连,将pGEX-4T-2-GFP转化E.coli DH5α提取质粒,经测序后转化E.coli BL21中诱导GST-GFP融合蛋白表达,将表达融合蛋白的大肠杆菌滴入培养巨噬细胞的皿中,于荧光显微镜下观察GFP的表达及大肠杆菌被吞噬情况。结果:获得的重组质粒测序正确。荧光显微镜下能清晰观察到培养基中及被巨噬细胞吞噬后发绿色荧光的大肠杆菌。结论:成功构建了pGEX-4T-2-GFP重组质粒,为研究小鼠巨噬细胞吞噬细菌的能力创造条件。
绿色荧光蛋白;pGEX-4T-2载体;重组质粒;表达;荧光显微镜
[First-author's address] Department of Medical Engineering, The Affiliated Hospital of Military Medical Sciences,Beijing 100071, China.
绿色荧光蛋白(green fluorescent protein,GFP)是一种在蓝色波长范围光线激发下,发出绿色荧光的蛋白[1]。GFP与传统的荧光抗体相比,其灵敏度高、无生物毒性,在酸、碱及加热等条件下稳定,荧光反应不需要任何外源反应底物,且其表达无物种或细胞组织的专一性,还可以消除因抗体与非靶位点相结合带来的背景荧光的干扰[2-3]。因此,GFP作为一种报告蛋白,在监测目的基因的表达、研究细胞内物质代谢及追踪细胞系的分化等方面有着极其广泛的应用[4-5]。
GFP的N-端或C-端可以和异质蛋白连接组成融合蛋白,既能保留异质蛋白的固有特性,又能保留GFP的发光能力,是良好的报告蛋白和荧光标记分子。因此,GFP融合蛋白实际上可作为一种“荧光标签”用来研究蛋白质在细胞中的定位、转移及相互作用等。基于这些特点,本研究构建能在细菌中表达荧光蛋白的pGEX-4T-2-GFP质粒来研究小鼠巨噬细胞吞噬细菌的能力[6-12]。
1 材料与方法
1.1材料及设备
(1)原核质粒pGEX-4T-2为本实验室保存;感受态细菌DH5α、BL21、质粒提取试剂盒和DNA电泳凝胶回收试剂盒均购自天根科技生化(北京)有限公司;限制性核酸内切酶BamHⅠ、EcoRⅠ、Q5 high-fidelity DNA polymerase、dNTPs以及DNA marker均购自美国NEB公司;DNA Ligation Kit购自大连TaKaRa公司;聚合酶链反应(polymerase chain reaction,PCR)引物由北京天一辉远生物科技有限公司合成;异丙基硫代β-D半乳糖苷(isopropylthio-β-D-galactoside,IPTG)为美国Amresco公司产品;1640培养基、胎牛血清购自美国Thermo Fisher Scientific公司;其他试剂均为国产分析纯。
(2)所用实验仪器为:梯度基因扩增(PCR)仪(美国伯乐,BIO-RAD,C1000 Touch),GL-1800干式恒温器(海门其林贝尔仪器制造有限公司),DYY-6D电泳仪(北京市六一仪器厂),WD-9413B凝胶成像分析仪(北京市六一仪器厂),ZWY-240恒温培养振荡器(上海智城分析仪器制造有限公司),HPX-9082MBE电热恒温培养箱(上海博迅实业有限公司医疗设备厂),sartorius 1-14离心机(德国希格玛),EX 450-490 DM 505 BA520荧光倒置显微镜(日本尼康,Nikon Eclipse Ts 100),BSC系列CLASSⅡTYPE A2生物安全柜(北京东联哈尔仪器制造有限公司)。
1.2实验方法
1.2.1GFP基因片段的获取
本实验室以GFP-X质粒为模板进行PCR扩增。引物序列如下:正向引物-CGCGGATCC ATGAGTAAAGGAGAAGAACTTTTCA,含BamHI酶切位点;反向引物-GGAATTCCCG TTATTTGTATAGTTCATCCATGCC,含EcoRI酶切位点。PCR反应条件为98 ℃、10 s,70 ℃、30 s,72 ℃、60 s,共34个循环,最后72 ℃延伸5 min。
1.2.2GFP原核质粒的构建
分别使用BamHI和EcoRI双酶切pGEX-4T-2 和PCR产物,1%琼脂糖凝胶电泳显示酶切结果正确后,凝胶回收载体片段和目的片段。将pGEX-4T-2 与GFP用DNA Ligation Kit 16 ℃连接30 min,得到连接产物。将连接产物全部转化至100 µl感受态细菌DH5α,涂布在含氨苄青霉素的LB琼脂平板中,将平板倒置于37 ℃恒温箱培养过夜。选取3个阳性菌落,扩增后用质粒提取试剂盒提取质粒DNA(提取条件:室温,离心力13400 g,具体步骤参照天根-高纯度质粒小提试剂盒说明书),将重组质粒送公司进行测序分析,经测序后将构建成功的质粒命名为pGEX-4T-2-GFP。
1.2.3融合蛋白GST-GFP的表达
将测序正确的重组质粒pGEX-4T-2-GFP转化BL21,涂布于含氨苄霉素的LB琼脂平板,将平板倒置于37 ℃恒温箱培养过夜。挑取转化后的单克隆接种于3 ml含氨苄霉素LB培养基中,37 ℃震荡培养过夜后,将菌液按1∶100接种到5 ml氨苄LB培养基,37 ℃培养至OD600为0.5~1.0,往菌液加入终浓度为0.5 mmol/L的IPTG,30 ℃、250 r/min诱导表达约5 h,收集细菌。
1.2.4小鼠腹腔巨噬细胞吞噬成像
脱臼处死1只小鼠,取其腹腔巨噬细胞于含胎牛血清的1640培养基中,在室温37 ℃、5%的CO2及饱和湿度条件下培养,1 d后换液,贴壁为腹腔巨噬细胞。取10 µl表达融合蛋白GST-GFP的BL21大肠杆菌滴入培养巨噬细胞的皿中,37 ℃培养1 h后荧光显微镜下观察吞噬情况。
2 结果
2.1扩增目的基因GFP
以pEGFP-N3质粒作为模板,用PCR方法扩增目的片段。共设为3组,即阴性对照组1、阴性对照组2和实验组。其中,阴性对照阻1,加入dNTP、引物及酶,不加模板;阴性对照阻2,加入dNTP、引物及模板,不加酶;实验组,加入dNTP、引物、模板及酶,反应结束后置于1%琼脂糖凝胶中电泳。因GFP的基因大小为717 bp,因此,在3组中位于500~1000 bp之间的条带即为GFP,如图1所示。
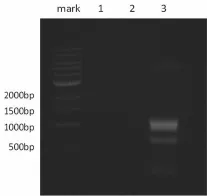
图1 目的基因PCR产物DNA电泳分析图
2.2巨噬细胞吞噬成像
转化了pGEX-4T-2-GFP的大肠杆菌体在自然光下即为黄绿色,将其置于显微镜下观察,整个菌体呈亮绿色,将小鼠腹腔巨噬细胞和该大肠杆菌于37 ℃孵育1 h后观察显示,发绿色荧光的大肠杆菌部分被巨噬细胞吞噬,如图2所示。

图2 显微镜下巨噬细胞吞噬大肠杆菌图(×40)
3 结论
本研究中采用pGEX-4T-2原核表达质粒,此类载体含有高效的原核表达启动子,能够在感受态细菌体内高效表达重组蛋白。而选择与之连接的GFP是良好的报告蛋白和荧光标记分子[13-15]。本研究结果显示,与目前广泛采用的报告基因如β-半乳糖苷酶基因、萤火虫荧光素酶基因等相比,GFP有其优越之处:①GFP基因表达的检测非常方便,不像其他报告基因的检测需要加入底物;②表达GFP的细菌在诱导剂IPTG的长时间作用下生长良好,表明GFP对细菌无毒性,且不干扰细菌的生长和功能;③检测表达时不用将细菌事先处理,细菌经诱导表达GFP后,荧光显微镜下即可看到明亮的绿色荧光,因而可在活细菌的情况下检测基因的表达[16-18]。
本研究通过测序,并于荧光显微镜下观察GFP的表达,成功构建了pGEX-4T-2-GFP表达质粒,为直观研究巨噬细胞吞噬细菌的能力提供了工具。
[1]Prasher DC,Eckenrode VK,Ward WW,et al.Primary structure of the Aequorea victoria green-fluorescent protein[J].Gene,1992,111(2):229-233.
[2]Chalfie M,Tu Y,Euskirchen G,et al.Green fluorescent protein as a marker for gene expression[J].Science,1994,263(5148):802-805.
[3]Fratamico PM,Deng MY,Strobaugh TP,et al. Construction and characterization of Escherichia coli O157:H7 strains expressing firefly luciferase and green fluorescent protein and their use in survival studies[J].J Food Protect,1997,60(10):1167-1173.
[4]Soboleski MR,Oaks J,Halford WP,et al.Green fluorescent protein is a quantitative reporter of gene expression in individual eukaryotic cells[J].FASEB J,2005,19(3):440-442.
[5]Hanson GT,McAnaney TB,Park ES,et al.Green fluorescent protein variants as ratiometric dual emission pH sensors.1.Structural characterization and preliminary application[J].Biochemistry,2002,41(52):15477-15488.
[6]Yuk IH,Wildt S,Jolicoeur M,et al.A GFP-based screen for growth-arrested,recombinant protein-producing cells[J].Biotechnol Bioeng, 2002,79(1):74-82.
[7]Che J M,Liu B,Lan JL.Transformation and expression of GFP gene into escherich coli K88[J].Biotechnol Bull,2010(9):198-204.
[8]Heim R,Prasher DC,Tsien RY.Wavelength mutations and posttranslational autoxidation of green fluorescent protein[J].Proc Natl Acad Sci USA,1994,91(26):12501-12504.
[9]Cubitt AB,Heim R,Adams SR,et al.Understanding,improving and using green fluorescent protein[J].Trends Biochem Sci,1995,20(11):448-455.
[10]Lnouye S,Tsuji FI.Expression of the gene and fluorescence characteristics of the recombinant protein[J].FEBS lett,1994,341(2-3):277-280.
[11]Sheen J,Hwang S,Niwa Y,et al.Greenfluorescent protein as a new vital marker in plant cells[J].Plant J,1995,8(5):777-784.
[12]Kain SR,Adams M,Kond epudi A,et al.Green fluorescent protein as a reporter of gene expression and protein localization[J].Bio techniques,1995,19(4):650-655.
[13]Rosario R,Brini M,Pizzo P,et al.Chimeric green fluorescent protein as a tool for visualizing subcellular organelles in living cells[J].Curr Biol,1995,5(6):635-642.
[14]Green CB,Zhao XM,Hoyer LL.Use of green fluorescent protein and reverse transcription-PCR to monitor Candida albicans agglutinin-like sequence gene expression in a murine model of disseminated Candidiasis[J].Infect Immun,2005,73(3):1852-1855.
[15]Van Roessel P,Brand AH.Brand imaging into the future:Visualizing gene expression and protein interactions with fluorescent proteins[J]. Nat Cell Biol,2002,4(1):E15-E20.
[16]Niedenthal RK,Riles L.Johnston M,et al.Green fluorescent protein as a marker for gene expression and subcellular localization in budding yeast[J].Yeast,1996,12(8):773-786.
[17]Schneider N,Schwartz JM,Köhler J,et al. Golvesin-GFP fusions as distinct markers for Golgi and post-Golgi vesicles in Dictyostelium cells[J].Biol Cell,2000,92(7):495-511.
[18]Zhang XM,Yin YB,Chen BD,et al.Transformation of Streptococcus pneumoniae in vivo by green fluorescence protein[J].J Fourth Mil Med Univ,2005,26(20):1847-1850.
Construction of pGEX-4T-2-GFP prokaryotic expressing plasmid and its protein expression/
LU Cheng, ZHOU Chen-chen, ZHANG Peng-fei, et al//
China Medical Equipment,2016,13(8):120-122.
Objective: To construct prokaryotic expressing plasmid of GFP gene. Methods: The PCR product of GFP coding sequence, which was digested with EcoR I and BamH I restriction enzymes, was taped into the plasmid pGEX-4T-2. Then pGEX-4T-2-GFP was transformed into E.coli DH5α and plasmid DNA was extracted. The recombinant plasmid was sequenced and then the expression of GST-GFP fusion protein was induced in BL21. After that, the E.coli which expressed GST-GFP fusion protein was transferred into the dish of cultivating macrophages. Fluorescence microscope was utilized to observe the GFP expression and e.coli swallowed. Results: The recombinant plasmid was sequenced correctly. E. coli expressing GFP both in medium and swallowed by macrophages can be observed clearly with the fluorescence microscope. Conclusion: The recombinant prokaryotic expressing plasmid pGEX-4T-2-GFP was successfully constructed, which facilitated the research for phagocytic capacity of macrophage.
Green fluorescent protein; pGEX-4T-2 vector; Recombinant plasmid; Expression; Fluorescence microscope
1672-8270(2016)08-0120-03 [中图分类号]R197.324
A
陆琤,女,(1987- ),硕士,助理工程师。军事医学科学院附属医院医学工程科,从事细胞信号转导研究工作。
10.3969/J.ISSN.1672-8270.2016.08.038
国家自然科学基金(31400739)“PH结构域蛋白PLEKHQ1协调巨噬细胞迁移与激活的机制研究”;军事医学创新基金(2015CXJJ29)“PLEKHQ1调控细菌性脓毒败血症的功能和机制研究”
①军事医学科学院附属医院医学工程科 北京 100071
marbleluo@126.com
2016-03-03
