活化氧化石墨烯的制备及对甲基橙的吸附
2016-09-16周彩云邓娟朱君妍周超郭永福周晓吉白仁碧
周彩云,邓娟,朱君妍,周超,郭永福,周晓吉,白仁碧
(苏州科技大学,分离净化材料与技术研发中心,江苏苏州215009)
活化氧化石墨烯的制备及对甲基橙的吸附
周彩云,邓娟,朱君妍,周超,郭永福,周晓吉,白仁碧
(苏州科技大学,分离净化材料与技术研发中心,江苏苏州215009)
为了提高氧化石墨烯(GO)的比表面积和吸附性能,采用氢氧化钾对GO进行高温固相活化,制备出活化氧化石墨烯(GOKOH),并将其用于对水中阴离子染料甲基橙(MO)的吸附研究。结果表明,GOKOH的比表面积可达672.48 m2/g。GOKOH能在较宽的pH范围内实现对MO的高效去除,去除率高达94.87%,吸附平衡时间约为150 min。准一级和准二级动力学拟合的理论平衡吸附容量分别为549.87 mg/g和549.45 mg/g,Langmuir模型的饱和吸附容量为632.91 mg/g。该吸附过程受边界层扩散与颗粒内扩散两个步骤控制,符合二级动力学模型和Langmuir模型,并主要以化学吸附为主。
氧化石墨烯;甲基橙;吸附
有机染料广泛应用于纺织、美容、皮革、印刷及造纸等行业。在染色工艺过程中大约有10%~15%的染料会进入到工业废水中〔1〕,这些进入到废水中的染料大多为含苯环的有毒及致癌化合物〔2〕,其化学结构稳定、成分复杂,使染料废水难以处理。当染料废水排放到自然水体后,还会增加水的色度,阻碍入射光的渗透,进而影响到水体生物的正常生长。
目前对染料废水处理的方法主要有膜分离法、生物处理法、化学絮凝法、电解法、氧化法、吸附法及离子交换法等。其中吸附法具有操作简单、造价低且吸附剂可以再生利用的优势。而氧化石墨烯(GO)作为一种新型的石墨烯衍生物,具有较大的机械强度和较高的比表面积,具有良好水溶性和易改变的化学活性,是一种性能优良的吸附材料〔3〕。
但常规方法(如改进的Hummers法)合成的GO比表面积较低,吸附性能不佳,一定程度上限制了其应用。如A.Esmaeili等〔4〕采用声化学法制备出GO比表面积不到60 m2/g。
采用氢氧化钾(KOH)对碳质材料如木质素、碳纳米管、碳纳米纤维及石墨烯纳米片等进行高温活化后,可以显著提高这些材料的孔隙率及比表面积〔5〕。这些活化后的碳基材料多用在电化学方面,而用于污染物吸附方面的研究则未见报道。
为此,笔者采用KOH对氧化石墨进行高温固相活化后,制备出活化氧化石墨烯(GOKOH),并对GOKOH进行表征,同时利用其对废水中阴离子染料甲基橙(MO)进行吸附研究,以期为进一步拓展GO在染料废水治理方面的应用提供思路与借鉴。
1 材料与方法
1.1试剂与仪器
试剂:氧化石墨(南京先丰纳米材料有限公司),MO(分析纯,上海国药集团化学试剂有限公司),氢氧化钾(分析纯,江苏强盛功能化学股份有限公司),无水乙醇(分析纯,无锡市晶科化工有限公司)。
仪器:真空管式高温烧结炉(OTF-1200X型,合肥科晶材料技术有限公司);傅里叶转换红外光谱(FT-IR,Nicolet-6700型,美国赛默飞世尔科技有限公司);紫外可见分光光度计(UV3600型,日本岛津);颗粒界面电位分析仪(ZETAPALS型,美国Brookhaven公司);台式扫描电子显微镜(PhenomG3型,荷兰Phenom-word公司);X射线衍射仪(DMax-2550型,日本力学电机株式会社);比表面积分析仪(美国Quantachrome公司)。
1.2材料的制备
GO的制备方法采用改进后的Hummers方法进行。活化GOKOH的制备方法:将氧化石墨与氢氧化钾按照1∶4的质量比研磨均匀后置于管式炉中,于800℃和氮气保护的情况下活化1 h,活化后的产物用去离子水反复冲洗干净,使其pH接近中性,置于70℃烘箱中烘干,即得GOKOH。
1.3GOKOH材料对MO的吸附
称取一定量的GOKOH,投加到20 mL含不同质量浓度MO的试样瓶中,置于水浴中于200 r/min和温度为298 K的条件下均匀振荡8 h后,用紫外分光光度计于464 nm处测其经0.22 μm滤膜过滤后溶液的剩余吸光度,根据吸光度测算剩余的MO质量浓度。溶液pH采用0.1 mol/L的HCl或NaOH溶液进行调节。GOKOH对MO的吸附容量qe按下式进行计算:
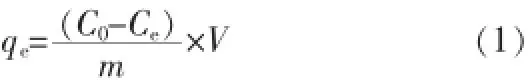
式中:C0——MO溶液的初始质量浓度,mg/L;
Ce——吸附后MO的剩余质量浓度,mg/L;
m——GOKOH的投加量,g;
V——MO溶液的体积,L。
2 结果与讨论
2.1GOKOH材料的表征
2.1.1FTIR
实验采用傅里叶红外对GO及GOKOH进行了表征分析,结果如图1所示。

图1 GOKOH和GO的FTIR
由图1可见,在3 200~3 600 cm-1的宽峰是由官能团中—OH伸缩振动引起的,GO中的1 720.05 cm-1特征峰是羧基官能团中的C=O拉伸振动引起的〔6〕,GO中的1 623.75 cm-1及GOKOH中的1 630.92 cm-1吸收峰是由于C=C的骨架伸缩振动所引起的〔7〕,GO中的1 384 cm-1处的特征峰对应于C—H的弯曲振动,GO中1052cm-1及GOKOH中1095.50cm-1处的特征峰则是由于含氧官能团中的C—O振动所导致的〔8〕。采用KOH对氧化石墨进行固相活化的方法能大幅减少GO表面含氧官能团的数量,其中变化最明显的是活化后GO表面所含的—OH数量显著下降。—OH数量的减少,使得GOKOH表面的电负性降低,而这则有利于对阴离子染料MO的吸附〔9〕。
2.1.2SEM
GOKOH和GO的SEM如图2所示。

图2 GOKOH和GO的SEM
由图2可见,无论是GO还是活化后的GOKOH,两者都显示出丝绸波浪片状结构且表面都有很多褶皱,这是石墨烯特有的特征。褶皱可以增加比表面积。相对于GO而言,GOKOH似乎显示出更多大小不一的孔洞,且这些孔洞的形成对吸附质在GOKOH表面的附着是有利的。
2.1.3Zeta电位
GOKOH与GO的Zeta电位如图3所示。

图3 GOKOH与GO的Zeta电位
由图3可见,GO及GOKOH在酸性及碱性条件下,其表面都呈现一定的电负性,且其表面所带负电荷的量随着溶液pH的增加而增加。与GO相比,在同一pH下,GOKOH表面的电负性较小,这对提高GOKOH对阴离子染料吸附是有利的。吸附剂表面正负性的大小,对其吸附行为有着重要的影响。根据吸附剂表面电荷性质及大小选择相应的吸附质,能大大提高吸附剂的吸附效率与其吸附容量。
2.1.4XRD
通过研究GOKOH的XRD发现,在12.16°、26.60°、42.84°分别出现了3个明显的衍射峰,对应的层间距分别为0.73、0.33、0.21 nm。从3个特征峰分别计算出的GOKOH层间距来看,其值均小于GO的层间距(d002通常在0.8nm左右)〔4〕。这是由于高温固相活化后的GO表面失去了大量的含氧官能团,从而导致其层间距变小,这一点与GOKOH的FTIR图谱相一致。GO层间距的变小使得GO层与层之间的大量含氧官能团通过活化脱除掉,层间空隙率相应增加,这对阴离子的吸附过程是有利的。
2.1.5BET
经计算,GOKOH的比表面积为672.48 m2/g,远高于经超声分散后冷冻干燥的GO比表面积(35.50 m2/g)。BJH脱附等温线测得的GOKOH总孔容为0.668 cm3/g,与GO的孔容差不多。GOKOH的孔径则主要分布在3~50 nm。
2.2GOKOH对MO的去除
2.2.1投加量的影响
GOKOH的投加量为0.001 0~0.005 0 g,MO溶液质量浓度为100 mg/L,考察GOKOH的投加量对MO去除效果的影响,结果如图4所示。

图4 GOKOH投加量对MO吸附的影响
由图4可见,MO去除率随着GOKOH投加量的增加而增加,当GOKOH投加量由0.001 0 g增加至0.005 0 g时,MO的去除率由29.49%增加到94.87%,然而GOKOH吸附容量却从589.81 mg/g降至379.47 mg/g,这表明单位吸附剂的吸附容量随吸附剂投加量的增加而减小。这主要是由于在一定浓度的MO溶液中,过量的吸附剂提供了大量的吸附位,使吸附位发生聚集与重叠,降低了吸附位的利用率〔10〕,导致在一定时间内,GOKOH吸附容量随着GOKOH投加量的增大反而减小了。考虑到应用成本,后续实验GOKOH投加量均为0.003 0 g,即0.1500 g/L。
2.2.2pH的影响
GOKOH的投加量为0.003 0 g,MO溶液质量浓度为100 mg/L,考察不同pH对MO吸附的影响。结果表明,随着pH的增加,GOKOH的吸附容量基本呈降低趋势。当pH为3时,MO去除率为82.50%,GOKOH的吸附容量达550.00 mg/g,MO去除率及吸附量表现最好。当pH为7时,GOKOH的吸附容量达525.74 mg/g,随着pH的继续增大,GOKOH的吸附容量迅速下降。原因是由于MO的化学属性会随着pH的变化而变化。当pH<3.1时,MO表面带正电荷,而吸附剂GOKOH的表面带负电荷,两者之间的静电相互作用可能是吸附发生的主要机理;当pH在3.1~4.4之间时,MO的酸性结构与碱性结构的量基本相当;碱性条件下,随着pH的增加,负电荷位点增加,而正电荷位点减少,溶液中阴离子染料与氢氧根之间对正电荷位点的竞争吸附导致GOKOH吸附容量与MO去除率的降低〔11〕。考虑到实际工业废水中染料废水的pH一般都接近中性,因此后续实验中MO溶液的pH选择为7左右。
2.2.3吸附时间的影响
投加0.003 0 g的GOKOH于20 mL初始质量浓度为100 mg/L的MO溶液中,考察不同吸附时间对MO的影响。结果表明,MO的吸附容量随着吸附时间的增加而逐渐增加,在90 min之前,吸附容量增加很快,此时,GOKOH表面含有较多未被占用的吸附位点;当吸附时间超过150 min后,GOKOH表面剩余的吸附位点数量越来越少,加上固相及液相阶段存在的MO分子之间的相互排斥力使得MO分子很难占据剩余的吸附活性位点,致使GOKOH吸附容量随着时间的增加变得愈加缓慢。
2.3吸附动力学
为研究GOKOH对MO的吸附机理,采用准一级、准二级及内扩散动力学模型对MO的吸附行为进行拟合。实验条件:MO初始质量浓度为100 mg/L,温度为298 K,GOKOH投加量为0.0150 g/L。
准一级动力学模型方程〔12〕如式(2)所示:
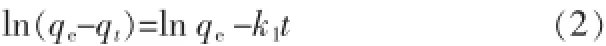
式中:qe——平衡吸附容量,mg/g;
t——吸附时间,min;
qt——t时刻对应的吸附容量,mg/g;
k1——准一级吸附速率常数,min-1。
准二级动力学模型是基于假定吸附速率受化学吸附机理的控制,这种化学吸附涉及到吸附剂与吸附质之间的电子共用或电子转移〔13〕。准二级动力学方程如式(3)所示:

式中:k2——准二级吸附速率常数,g/(mg·min)。
内颗粒扩散模型常用来分析反应中的控制步骤,求出吸附剂的颗粒内扩散速率常数,内扩散模型如式(4)所示:

式中:C——涉及到厚度、边界层的常数,mg/g;
ki——内扩散模型常数,mg/(g·min0.5)。
准一级动力学、准二级动力学及内颗粒扩散3种模型的模拟结果如图5所示。相应的吸附动力学参数如表1所示。
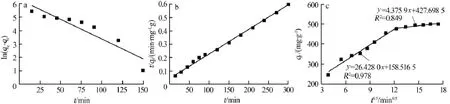
图5 MO的准一级动力学(a)、准二级动力学(b)和内扩散吸附(c)模型

表1 吸附动力学拟合参数
由图5、表1可见,根据实验及模拟结果,准一级动力学拟合的理论平衡吸附容量为549.87 mg/g,与准二级动力学拟合的理论平衡吸附容量相当,且二者均比实验所得的实际平衡吸附容量500.13 mg/g略高。从准一级与准二级动力学拟合的R2来看,准二级动力学模型更适合用来描述GOKOH对MO的吸附,吸附过程中的机理以化学吸附为主。
颗粒内扩散模型的拟合线段分为两段,且均不通过原点,这说明整个吸附过程是由两个不同因素控制的,其中第一阶段的吸附速率是受边界层扩散控制,后一阶段的吸附速率则主要由颗粒内扩散过程控制。
2.4吸附热力学
为进一步研究GOKOH对MO的吸附机理,采用了Langmuir及Freundlich两种热力学模型进行吸附过程的分析。Langmuir模型的假设条件为单层表面吸附、所有的吸附位均相同、被吸附的粒子完全独立。通过Langmuir模型可以计算出覆盖在吸附剂表面的单层分子的最大吸附容量,其公式如下:

式中:qm——吸附剂的理论最大吸附容量,mg/g。
KL——吸附平衡常数;
Ce——吸附平衡时吸附质质量浓度,mg/L;
qm与吸附剂的吸附位有关,理论上与温度无关;KL与吸附化学能有关。
Freundlich吸附等温线是一个经验方程,没有假设条件,方程形式如下:

式中:KF——吸附能力常数,(mg/g)·(L/mg)1/n;
n——吸附常数。
通常认为1/n在0~1之间,其值的大小表示吸附剂吸附能力的强弱,1/n越小,表示吸附性能越好。一般地,1/n在0.1~0.5之间表示易于吸附。GOKOH对MO的Langmuir及Freundlich两种热力学模型拟合结果如表2所示。

表2 GOKOH吸附等温线参数
由表2可见,Langmuir模型对GOKOH吸附MO的理论饱和吸附容量的拟合值为632.91mg/g,与实验结果609.42 mg/g比较接近。而从Freundlich模型拟合的结果来看,GOKOH对MO的吸附过程属于易吸附,且吸附过程应该属于化学吸附。结合两种模型的R2可知,GOKOH对MO的吸附过程更符合Langmuir模型。
2.5GOKOH的再生
将吸附饱和的GOKOH加入到装有无水乙醇的锥形瓶中,置于水浴摇床中振荡24 h后对溶液进行过滤、烘干(烘干温度为70℃)后进行二次再生吸附。结果显示:再生4次后GOKOH对MO的吸附容量为275.66 mg/g,再生率为55.1%。这表明GOKOH作为一种新型吸附剂具有较好的再生利用效率,能有效降低吸附剂的使用成本。
3 结论
(1)采用KOH对氧化石墨进行活化后,得到的GO比表面积高达672.48 m2/g,远高于采用Hummers方法合成出来的GO比表面积。
(2)活化后的GOKOH能在较宽的pH范围内有效去除染料废水中的MO,吸附平衡时间约为150min,MO去除率可达94.87%。
(3)GOKOH对MO的一级和二级动力学理论平衡吸附容量分别为549.87 mg/g和549.45 mg/g,Langmuir模型的饱和吸附容量为632.91 mg/g。GOKOH对MO的吸附过程以化学吸附为主,吸附速率受边界层扩散与颗粒内扩散两个步骤控制,且该吸附过程符合二级动力学模型与Langmuir模型。
[1]Bangash F K,Manaf A.Dyes removal from aqueous solution using wood activated charcoal of bombax cieba tree[J].Journal of the Chinese Chemical Society,2005,52(3):489-494.
[2]Dutta M,Basu J K,Faraz M H,et al.Fixed-bed column study of textile dye direct blue 86 by using a composite adsorbent[J].Archives of Applied Science Research,2012,4(2):882-891.
[3]冯冬燕,孙怡然,于飞,等.石墨烯及其复合材料对水中重金属离子的吸附性能研究[J].功能材料,2015,46(3):3009-3015.
[4]Esmaeili A,Entezari M H.Facile and fast synthesis of graphene oxide nanosheets via bath ultrasonic irradiation[J].Journal of Colloid& Interface Science,2014,432(20):19-25.
[5]Zheng B,Chen T W,Xiao F N,et al.KOH-activated nitrogen-doped graphene by means of thermal annealing for supercapacitor[J].Journal of Solid State Electrochemistry,2013,17(7):1809-1814.
[6]Tiwari J N,Mahesh K,Le N H,et al.Reduced graphene oxide-based hydrogels for the efficient capture of dye pollutants from aqueous solutions[J].Carbon,2013,56(5):173-182.
[7]GerÇel Ö,Özcan A,Özcan A S,et al.Preparation of activated carbon from a renewable bio-plant of Euphorbia rigida by H2SO4activation and its adsorption behavior in aqueous solutions[J].Applied Surface Science,2007,253(11):4843-4852.
[8]El-Hendawy A A.Influence of HNO3oxidation on the structure and adsorptive properties of corncob-based activated carbon[J].Carbon,2003,41(4):713-722.
[9]Gao Y,Yue Q,Gao B,et al.Preparation of high surface area-activated carbon from lignin of papermaking black liquor by KOH activation for Ni(Ⅱ)adsorption[J].Chemical Engineering Journal,2013,217(2):345-353.
[10]Matheswaran M,Karunanithi T.Adsorption of Chrysoidine R by using fly ash in batch process[J].Journal of Hazardous Materials,2007,145(1/2):154-161.
[11]Yao Y,He B,Xu F,et al.Equilibrium and kinetic studies of methyl orange adsorption on multiwalled carbon nanotubes[J].Chemical Engineering Journal,2011,170(1):82-89.
[12]Wang Sui,Wei Jing,Lü Shasha,et al.Removal of organic dyes in environmental water onto magnetic-sulfonic graphene nanocomposite[J].Clean-Soil,Air,Water,2013,41(10):992-1001.
[13]吴鹏,刘志明.海藻酸钠/纤维素水凝胶球的制备与应用[J].功能材料,2015,46(10):10144-10152.
Preparation of activated graphene oxide and its adsorption for methly orange
Zhou Caiyun,Deng Juan,Zhu Junyan,Zhou Chao,Guo Yongfu,Zhou Xiaoji,Bai Renbi
(Center for Separation and Purification Materials&Technologies,Suzhou University of Science and Technology,Suzhou 215009,China)
In order to improve the specific surface area and adsorption capacity of graphene oxide(GO),GOKOHhas been synthesized with KOH by high temperature solid state activation,and it is used for the research on its adsorption for anionic dye methyl orange(MO)in water.The results show that the specific surface area of activated GOKOHcan reach 672.48 m2/g.GOKOHcan effectively remove MO in a wide range of pH and the MO removing rate is as high as 94.87%,and the time of adsorption equilibrium is 150 min.The pseudo first order kinetics and pseudo second order kinetics fitted theoretical equilibrium adsorption capacities are 549.87 mg/g and 549.45 mg/g,respectively,and the saturated adsorption capacity of Langmuir model is 632.91 mg/g.The adsorption process is controlled by two different steps:boundary layer diffusion and inside particle diffusion.It is in line with the 2nd level dynamics model and Langmuir model,and it is mainly chemical adsorption.
activated graphene oxide;methyl orange;adsorption
X703.1
A
1005-829X(2016)05-0066-05
江苏省自然科学基金资助项目(BK20141179);苏州市分离净化材料与技术重点实验室(SZS201512);江苏省“青蓝工程”资助项目;苏州科技学院研究生培养创新工程(SKCX14_026);江苏省大学生实践创新训练计划项目(201410332005Z);江苏省普通高校研究生科研创新计划项目(SJZZ15_0170)
周彩云(1989—),硕士。E-mail:1257340586@qq.com。通讯联系人:郭永福,博士,副教授,硕士研究生导师。E-mail:yongfuguo@163.com。
2016-02-20(修改稿)
