黄芪注射液对人子宫内膜癌细胞β-catenin和E-cadherin表达的影响
2016-09-16欧阳小明廖德贵赖妙玲广州医科大学附属第二医院病理科检验科广东广州5060
欧阳小明,郅 程,周 芸,廖德贵,赖妙玲广州医科大学附属第二医院病理科,检验科,广东 广州 5060
基础研究
黄芪注射液对人子宫内膜癌细胞β-catenin和E-cadherin表达的影响
欧阳小明1,郅 程1,周 芸2,廖德贵1,赖妙玲1
广州医科大学附属第二医院1病理科,2检验科,广东 广州 510260
目的 研究黄芪注射液对子人宫内膜癌HEC-1-B细胞β-catenin和E-cadherin基因和蛋白表达的影响。方法 分别采用RT-PCR和免疫组化的方法检测β-catenin和E-cadherin基因和蛋白的表达。用含不同浓度的黄芪注射液的条件培养基分别培养人子宫内膜癌细胞株HEC-1-B 24、48、72 h后,应用RT-PCR检测各组细胞中β-catenin、E-cadherin基因表达,应用免疫细胞化学法检测HEC-1-B中β-catenin、E-cadherin蛋白表达。结果 RT-PCR结果显示,随着子宫内膜癌细胞在含有黄芪注射液的条件培养基中培养时间的延长,细胞中E-cadherin基因表达逐步增强(P<0.05),而β-catenin基因表达逐步减弱(P<0.05)。免疫组化染色结果显示,与对照组比较,黄芪注射液可明显降低子宫内膜癌HEC-1-B细胞中β-catenin蛋白的表达、增加E-cadherin蛋白的表达(P<0.05),而且黄芪注射液浓度越高处理时间越长β-catenin表达更低(P<0.05),黄芪注射液浓度越高E-cadherin表达更高(P<0.05)。结论 黄芪注射液可呈剂量和时间依赖性促进E-cadherin基因和蛋白的表达、抑制β-catenin基因和蛋白的表达,从而使WNT信号通路受到抑制。这可能是其发挥抗肿瘤作用的机制之一。
黄芪注射液;人子宫内膜癌细胞;β-catenin;E-cadherin
子宫内膜癌是女性生殖道三大恶性肿瘤之一,近年来,随着生活水平的提高、人口的老龄化、激素替代治疗的广泛应用,子宫内膜癌的发病率在世界范围内呈逐年上升趋势[1-2]。目前的治疗措施以手术及放疗为主,对于要求生育或晚期、复发患者需辅助激素治疗或化学治疗,然而化学治疗及激素治疗存在明显的禁忌症及毒副作用。因此,寻找安全、高效,适用范围广的抗子宫内膜癌新药是研究的热点。近几年利用天然药物防治子宫内膜癌是研究趋势,中医药抗子宫内膜癌的研究备受关注。
黄芪是一味常用的中药,在临床上应用广泛,其所含的有效成分主要有皂苷、黄酮和多糖等[3]。近年来研究显示,传统的补气药黄芪具有抗肿瘤能力。本研究使用含有黄芪注射液的条件培养基培养人子宫内膜癌细胞,并通过RT-PCR技术及免疫组化法研究黄芪注射液对人子宫内膜癌细胞WNT信号通路相关蛋白β-Catenin和E-cadherin表达的影响,以初步探讨黄芪注射液对人子宫内膜癌WNT信号通路的影响。
1 材料和方法
1.1材料
1.1.1药物与试剂黄芪注射液(AI),黄色的澄明液体,批号1001066,10 mL/支,每支相当于含生药20 g,成都地奥九泓制药厂生产;胎牛血清和DMEM培养基为GIBCO公司产品;TRIzol试剂为Invitrogen公司产品;RevertAidTM FirstStrandcDNA SynthesisKit为 Fermentas公司产品;RealMasterMix(SYBRGreen)、50 bp DNALadder为天根生化科技(北京)有限公司产品;β-Catenin引物和E-cadherin引物为上海生工生物工程技术服务有限公司产品;细胞爬片由江苏世泰公司生产;β-Catenin和E-cadherin抗体购自美国罗氏公司;En-Vision两步法免疫组化检测试剂盒由基因科技(上海)有限公司生产。
1.1.2细胞株 人子宫内膜癌腺癌HEC-1-B细胞株购买自上海细胞库,目录号为TCHu115。
1.1.3主要仪器医用超净工作台为上海跃进医疗器械厂产品;水套式CO2培养箱为美国Forma产品;Nanodrop1000紫外分光光度计为Thermo产品;PTC-220多通道PCR仪为美国Bio-rad产品;GelDoc2000凝胶电泳成像分析系统为美国Bio-Rad产品;免疫组化盒子为福建迈新生物技术开发有限公司生产;普通光学显微镜为重庆奥特光学仪器有限公司产品。
1.2方法
1.2.1细胞培养 将人子宫内膜癌腺癌HEC-1-B细胞接种于含10%(体积分数)灭活胎牛血清、1×105U/L青霉素和1×105U/L链霉素的DMEM培养基中,置37℃、饱和湿度、5%(体积分数)CO2恒温培养箱中。
1.2.2半定量RT-PCR 将HEC-1-B细胞接种于250 mL的培养瓶,待细胞融合生长后,实验分为黄芪组和对照组,实验组分别设100、200、300 mg/mL三个剂量小组。各组分别加入含药培养液2 mL,对照组加入2 mL正常培养液,分别继续常规培养24、48、72 h。收集细胞,按照Trizol试剂说明的方法提取细胞总RNA。经反转录(1 μg RNA,10 μL反应体积)得到10 μL cDNA,直接PCR。引物设计见表1,引物由华大基因科技有限公司合成,经PAGE纯化。该两对引物跨越内含子,可以排除基因组DNA的影响。经PCR(25 μL反应体系),上样电泳,平行作一孔DNA Marker(3 μL)。紫外灯下观察DNA条带拍照片记录。电泳胶立即进行光密度扫描,以GAPDH扩增产物校正作相对量分析。
1.2.3细胞爬片免疫组化 将消毒高压灭菌后的爬片置于孔板内,每孔1片。取对数生长期的HEC-1-B细胞,用胰酵消化,调成一定的浓度,接种于不同的有爬片的孔板内,于培养箱常规培养12 h,待细胞贴壁后,吸弃培养基,按1.2.2中分组进行处理。采用二步法行免疫细胞化学染色。结果判定:β-Catenin以细胞质或细胞膜棕黄色为阳性,E-cadherin以细胞膜或细胞质棕黄色为阳性,高倍视野下随机选取6个视野,参照许良中[4]选取染色部位较为集中的区域进行细胞计数和结果判定,染色强度分级和记分标准:棕褐色计3分,棕黄色计2分,淡黄色计1分,无着色计0分;阳性细胞数量分级和记分标准:一个视野内阳性着色细胞>75%计4分,51%~75%计3分,11%~50%计2分,1%~10%计1分;无阳性细胞为阴性,计分。将染色强度和阳性细胞数量两项积分相加,结果判定:0~3分为阴性,4~7分为阳性。
1.2.4数据统计 所有计数资料均以均数±标准差表示,数据符合正态分布,多组间用单因素方差分析,两组间用独立样本t检验比较分析,应用统计学软件SPSS 10.0进行处理。P<0.05有统计学意义。
2 结果
2.1RT-PCR结果
PCR产物经2%琼脂糖凝胶电泳与DNA Marker比较,证实扩增的目的片段大小完全吻合。用图像采集分析系统进行灰度扫描,作扫描面积积分半定量分析,比较各组E-cadherin/GAPDH和β-Catenin/GAPDH灰度比值。结果显示,随着子宫内膜癌细胞在含有黄芪注射液的条件培养基中培养时间的延长,细胞中E-cadherin基因表达逐步增强,而β-catenin基因表达逐步减弱(P<0.05,图1)。重复实验,结果反映一致,说明黄芪可促进体外培养人子宫内膜癌细胞的E-cadherin mRNA表达,同时也可抑制其β-catenin mRNA表达。
2.2免疫组化结果
细胞爬片免疫组化染色结果显示(表2、图2,3),与对照组比较,黄芪注射液可明显降低子宫内膜癌HEC-1-B细胞中β-catenin蛋白的表达、增加E-cadherin蛋白的表达(P<0.05),而且黄芪注射液浓度越高处理时间越长β-catenin表达更低,黄芪注射液浓度越高E-cadherin表达更高(P<0.05)。
3 讨论
中草药作为我国传统药物,其在抗肿瘤中具有多靶点、多效应、不良反应小、不易产生耐药性、安全有效等优点,但其化学成分复杂,药理作用广泛,很难从单一的方面来简单阐述。现有研究[5]显示黄芪有较明确的有效抗肿瘤化学成分,主要有多糖、黄酮类及皂苷类等,黄芪注射液是利用从黄芪中提取的这些有效成分精制而成的中药注射液,作为提高人体免疫力的药物,目前在临床上广泛运用于恶性肿瘤的辅助治疗。黄芪主要的抗肿瘤作用机制可能为直接抑制肿瘤细胞的生长和增殖、抑制肿瘤血管生成、促进肿瘤细胞凋亡、增强机体细胞免疫水平、阻止细胞周期蛋白复合物的磷酸化和通过抗氧化作用来实现对肿瘤生长的抑制等方式[6]。但黄芪的化学成分复杂,其所包含的其他成分是否也具有抗肿瘤作用及各种化学成分抗肿瘤作用的具体机制尚不明确,仍需大量的研究工作。本研究利用RT-PCR技术和免疫组化染色的方法首次探究了含黄芪注射液的条件培养基培养的子宫内膜癌细胞中β-catenin和E-cadherin基因、蛋白表达的变化,结果发现:黄芪注射液可显著降低子宫内膜癌细胞中β-catenin基因、蛋白的表达,同时促进E-cadherin基因、蛋白的表达,并呈现一定的时间效应和剂量效应。
表2 黄芪注射液对子宫内膜癌细胞β-catenin和E-cadherin蛋白表达的影响(n=6,)
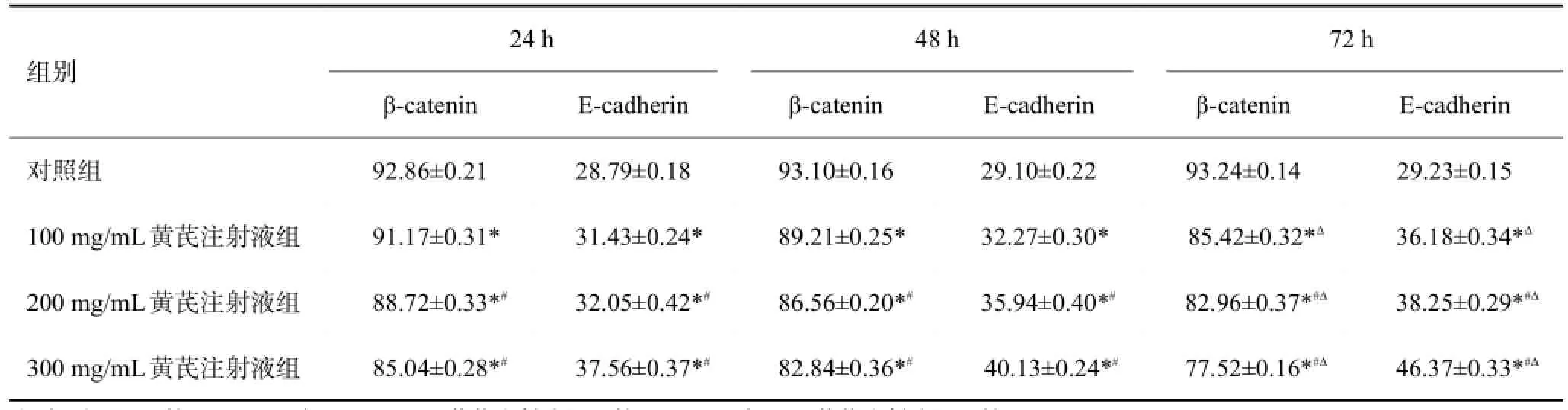
表2 黄芪注射液对子宫内膜癌细胞β-catenin和E-cadherin蛋白表达的影响(n=6,)
注:与对照组比较,*P<0.05;与100 mg/mL黄芪注射液组比较,#P<0.05;与24 h黄芪注射液组比较,ΔP<0.05.
组别48 h β-catenin 93.10±0.16 89.21±0.25* 86.56±0.20*#82.84±0.36*#E-cadherin 29.23±0.15 36.18±0.34*Δ38.25±0.29*#Δ46.37±0.33*#Δ对照组100 mg/mL黄芪注射液组200 mg/mL黄芪注射液组300 mg/mL黄芪注射液组24 h β-catenin 92.86±0.21 91.17±0.31* 88.72±0.33*#85.04±0.28*#E-cadherin 28.79±0.18 31.43±0.24* 32.05±0.42*#37.56±0.37*#E-cadherin 29.10±0.22 32.27±0.30* 35.94±0.40*#40.13±0.24*#72 h β-catenin 93.24±0.14 85.42±0.32*Δ82.96±0.37*#Δ77.52±0.16*#Δ
β-catenin是一种重要的粘附分子,一方面它与钙粘附蛋白相互作用形成E-cadherin/catenin复合体维持细胞结构的稳定性[7],另外它是WNT信号通路中的关键调控节点[8]。子宫内膜癌发生的一个重要因素就是WNT通路的异常激活,而这种异常激活的关键环节就是β-catenin由于降解障碍而在胞浆中异常聚集[9-10]。研究发现子宫内膜癌中β-catenin在核、浆中聚集明显高于正常子宫内膜,并且其在子宫内膜癌中的异常表达与肿瘤的浸润与转移密切相关[11]。肿瘤细胞向子宫肌层的快速浸染、转移是导致子宫内膜癌患者预后不良的主要原因。研究表明,正常子宫内膜中E-cadherin全部阳性表达,而在子宫内膜癌中E-cadherin表达下降,这在子宫内膜癌的发生、侵袭中起重要作用[12]。
本研究显示黄芪注射液可在促进子宫内膜癌细胞中E-cadherin表达增强的同时抑制其β-catenin在胞核、胞浆的聚集。而这可能进一步影响子宫内膜癌细胞的增殖、侵袭和转移。这提示我们黄芪注射液可能是一种潜在的Wnt信号通路抑制药物,它可能通过多靶点的作用于β-catenin和E-cadherin等分子从而抑制肿瘤WNT通路的异常激活以起到抗肿瘤的作用。在这一过程中,黄芪注射液中具体起作用的组分及其潜在的作用机制尚不明确,需要进一步的进行体内、体外实验来探究。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]张乃怿,吴成,廖秦平.子宫内膜癌的现状和筛查[J].中华临床医师杂志:电子版,2011,5(3):804-9.
[3]陈国辉,黄文风.黄芪的化学成分及药理作用研究进展[J].中国新药杂志,2008,17(1):1482-5.
[4]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-31.
[5]陈书磊,高萍,王涛.黄芪抗肿瘤有效成分及其作用机制研究进展[J].中国中医药现代远程教育,2015,13(5):151-2.
[6]丁 繁,王小虎.中药黄芪抗肿瘤研究进展[J].肿瘤学杂志,2013,19(1):64-8.
[7]Bansal N,Yendluri V,Wenham RM.The molecular biology of endometrialcancers and the implications forpathogenesis,classification,and targeted therapies[J].Cancer Control,2009,16(1):8-13.
[8]Zhou K,Wang GT,Wang YR,et al.The potential involvement of e-cadherin and beta-catenins in meningioma[J].PLoS One,2010,5(6):1-6.
[9]卞奕丁,万小平.WNT信号通路与子宫内膜癌研究进展[J].现代妇产科进展,2015,24(11):868-9.
[10]Barher N.The canonical Wnt/catenin signaling pathway[J]. Methods Mol Biol,2008,468(4):5-15.
[11]任世文,李洪安,李霞,等.β-catenin和E-cadherin在子宫内膜癌中的表达和意义[J].石河子大学学报:自然科学版,2011,29(4):471-4.
[12]Scholten AN,Aliredjo R,Creutzberg CL,et al.Combined E-cadherin,alpha-catenin,and beta-catenin expression is a favorable prognostic factor in endometrial carcinoma[J].Inter J GynecCancer,2006,16(3):1379-85.
Effects of astragalus injection on the expression of β-Catenin and E-cadherin in human endometrial carcinoma cells
OUYANG Xiaoming1,ZHI Cheng1,ZHOU Yun2,LIAO Degui1,LAI Miaoling1
1Department of Pathology,2Clinical Laboratory Second Affiliated Hospital,Guangzhou Medical University,Guangzhou 510260,China
Objective To investigate the effects of astragalus injection on the mRNA and protein expression of β-catenin and E-cadherin in HEC-1-Bendometrial carcinoma cells.Methods Cell climbing slices of HEC-1-B cells were prepared for the intervening experiment of astragalus injection on endometrial carcinoma cells,then their mRNA and protein expression of β-catenin and E-cadherin detected by RT-PCR and immunohistochemistry.Results RT-PCR results showed that with the incubation time of endometrial cancer cells in conditioned medium containing astragalus injection increased,E-cadherin gene expression of the cells gradually increased(P<0.05),while the β-catenin gene expression gradually decreased(P<0.05).The immunocytochemistry result indicated thatastragalus could significantly decrease β-catenin expression and increase E-cadherin expression in HEC-1-B cells(P<0.05).Moreover,accompanied by elevated concentration and treatment time of astragalus injection,β-catenin expression dropped progressively(P<0.05),meanwhile with the concentration of astragalus injection raised,E-cadherin expression gradually increased(P<0.05).Conclusion Astragalus injection could significantly inhibit WNT signaling pathway by promoting mRNA andprotein expression of E-cadherin,decreasing mRNA and protein expression ofβ-cateninin a dose-and time-dependent manner,which might be one of the mechanisms for its anti-tumor effect.
astragalus;endometrial carcinoma cells;β-catenin;E-cadherin
2016-04-15
广东省中医药管理局项目(20131265)
欧阳小明,E-mail:gzoyxm@163.com
