中国汉族人群双相障碍不同疾病状态下的氧化应激损害
2016-09-15李含秋张晓菲杨婵娟成雄超郑朝盾曹莉萍
李 烜,李含秋,张晓菲,杨婵娟,成雄超,郑朝盾,曹莉萍,林 鄞
(广州医科大学附属脑科医院,广州市惠爱医院,广东 广州 510370
中国汉族人群双相障碍不同疾病状态下的氧化应激损害
李烜,李含秋,张晓菲,杨婵娟,成雄超,郑朝盾,曹莉萍,林鄞
(广州医科大学附属脑科医院,广州市惠爱医院,广东广州510370
目的探索双相障碍患者的氧化应激指标水平,特别是不同的疾病状态是否存在差异。方法纳入53例双相障碍I型患者和59例正常对照组,患者组躁狂发作34例,抑郁发作19例。收集患者临床资料,采用汉密尔顿抑郁量表17项版(HAMD-17)和贝克-拉范森躁狂量表(BRMS)评定症状严重程度。所有受试者抽取清晨空腹外周静脉血,检测生化指标超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)和丙二醛(Malonaldehyde,MDA)水平。结果控制体质指数(BMI)后,①患者组的MDA(F=8.362,P<0.01)和GPx(F=4.550,P=0.013)水平均较正常对照组高。②将患者组分为躁狂发作组和抑郁发作组,MDA水平三组间总体差异有统计学意义(F=6.079,P<0.01),躁狂发作组和抑郁发作组均较正常对照高(P<0.01)。GPx活性三组间总体差异有统计学意义(F=3.355,P=0.022),抑郁发作组比正常对照组高(P=0.012)。③将患者组分为有精神病性症状组和无精神病性症状组,MDA水平三组间总体差异有统计学意义(F=5.646,P=0.001)。有精神病性症状组和无精神病性症状组均比正常对照组高(P<0.05或0.01)。GPx活性三组间总体差异有统计学意义(F=4.356,P<0.01),有精神病性症状组较正常对照组高(P<0.01);④未见发病年龄、住院次数、病程、HAMD和BRMS评分分别与SOD、GPx活性及MDA水平显著相关(P均>0.05)。结论双相障碍患者发作期有氧化应激系统失衡,可能和某些临床特征相关。
双相障碍;氧化应激;抗氧化酶
双相障碍(Bipolar disorder)是精神科临床常见的重性精神障碍,目前病因未明。初步的研究显示,氧化应激(Oxidative stress)可能参与双相障碍的发生发展[1]。超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)同属酶抗氧化系统,是体内重要的抗氧化酶;丙二醛(Malonaldehyde,MDA)是脂质过氧化的重要代谢产物,其水平可以反映体内脂质过氧化程度。多个研究显示,双相障碍患者的SOD、GPx活性和MDA水平均可能存在异常[2],但研究结果不尽一致。有研究指出可能与疾病状态或症状严重程度有关,但到底与哪些临床特征相关仍不清楚[3-4]。因此,本研究纳入双相障碍I型患者,探索患者的氧化应激指标水平,特别是不同的疾病状态是否存在差异。
1 对象与方法
1.1对象
于2014年5月-2015年1月在广州市惠爱医院门诊及住院部收集双相障碍患者。入组标准:①符合《精神障碍诊断与统计手册(第4版)》(Diagnostic and Statistical Manual of Mental Disorders Fourth edition,DSM-IV)双相障碍I型诊断标准;②年龄≤55岁;③汉族。排除标准:①器质性精神障碍患者;②入组前2周内存在外伤、感染或发热,有免疫和内分泌疾病、心肝肾等严重躯体疾病以及神经系统疾病;③精神活性物质或非成瘾物质所致精神障碍;④IQ≤70,沟通困难或不合作者。共收集53例,其中男性27例,女性26例;年龄18~46岁,平均年龄(26.9±8.6)岁;平均体质量指数(Body Mass Index,BMI)为(22.48±4.05);受教育年限3~8年;平均发病年龄(21.1±6.4)岁;住院次数1~5次,中位数2次;病期1~150月,中位数20月;汉密尔顿抑郁评定量表17项版(Hamilton Depression Scale-17 item,HAMD-17)评分(7.8±8.0)分;贝克-拉范森躁狂量表(Bech-Rafaelsen Mania Rating Scale,BRMS)评分(11.9±8.4)分。其中躁狂发作34例,抑郁发作19例,无混合发作。
按照疾病的状态,将患者分为躁狂组和抑郁组。躁狂组34例,其中男性20例,女性14例;平均年龄(26.0±8.2)岁;BMI(22.6±4.2);平均受教育年限(10.9±3.5)年;平均发病年龄(20.9±6.4)岁;住院次数1~5次,中位数2次;病期1~150月,中位数20月;HAMD-17评分(3.2±2.2)分;BRMS评分(16.9±8.1)分。抑郁组19例,其中男性7例,女性12例;年龄18~45岁,平均年龄(28.4±9.3)岁;BMI为(22.3±3.8);受教育年限3~8年,平均(11.7±3.3)年;平均发病年龄(21.5±6.6)岁;住院次数1~5次,中位数2次;病期1~140月,中位数20月;HAMD-17评分(16.0±8.1)分;BRMS评分(2.8±2.2)分。两组HAMD-17评分(t=-8.649,P<0.01)、BRMS(t=10.081,P<0.01)评分差异有统计学意义。两组性别、年龄、BMI、受教育年限、发病年龄、住院次数、病期差异均无统计学意义(P均>0.05)。
按照有无精神病性症状,将患者组分为有精神病性症状组和无精神病性症状组。有精神病性症状组32例,其中男性17例,女性15例;平均年龄(27.0±7.9)岁;BMI(22.9±3.8);平均发病年龄(21.0±6.7)岁;住院次数1~5次,中位数2次;病期1~150月,中位数20月;HAMD-17评分(7.1±8.3)分;BRMS评分(13.2±8.8)分。无精神病性症状组21例,其中男性10例,女性11例;平均年龄(26.7±9.7)岁;BMI(21.9±4.4);平均发病年龄(21.2±6.0)岁;住院次数1~5次,中位数2次;病期1~140月,中位数20月;HAMD-17评分(8.9±7.6)分;BRMS评分(9.8±7.4)分。两组间性别、年龄、BMI、发病年龄、住院次数、病期差异均无统计学意义(P均>0.05)。
正常对照组通过广告招募,均为附近社区的居民、单位职工及学校学生,年龄、性别分别与患者组匹配。入组标准:①既往和目前均无精神障碍;②二系三代无精神疾病家族史;③汉族;④年龄≤55岁。排除标准同患者组。共纳入正常对照组59例,其中男性31例,女性28例,年龄19~51岁,平均年龄(25.9±4.9)岁,平均BMI(20.56±2.24);受教育年限3~8年,平均(14.7±2.0)年。患者组与正常对照组年龄(t=0.460,P=0.968)、性别(χ2=0.866,P=1.000)差异无统计学意义。受教育年限差异有统计学意义(t=-6.843,P<0.01)。所有受试对象均签署知情同意书,本研究经过广州市惠爱医院伦理委员会批准。
1.2临床评估
所有患者组均接受《DSM-IV轴Ⅰ障碍临床定式检查》(Structured clinical Interview for DSM-IV Axis I Disorders,SCID-I)评估。采集受试者一般人口学资料、发病年龄、住院次数、病期、有无精神病性症状等临床资料。采用HAMD-17和BRMS评估入组时患者的症状严重程度。所有量表评定由两名经过一致性培训的精神科研究生完成,组内相关系数0.79。
1.3血液样本采集及生化指标检测
所有受试对象均禁食8小时,于次日7:00-9:00抽取空腹外周静脉血5ml,置于非抗凝管中,静置30min,10min/3000g离心后取上清于-70℃保存。生化指标SOD、MDA和GPx,均采用试剂盒,在南京建成生物工程研究所由专门技术人员在同一台全自动酶标仪上同期完成检测,每例样本测定2次,取平均值为最终值。两次测量误差小于千分之三。
1.4统计方法
文献提示BMI对生化指标有影响,所有比较均对BMI进行控制。首先比较患者组和正常对照组间生化指标水平的差异。接着,按照患者不同的疾病状态,分为躁狂发作组和抑郁发作组,比较组间生化指标水平的差异。另外,按照有无精神病性症状,将患者分组后进行比较。最后,在患者组中,探索生化指标和发病年龄、住院次数、病期、HAMD-17和BRMS评分的相关性。所有数据分析采用SPSS15.0。计量资料比较采用单因素方差分析,计数资料采用χ2检验。检验水准α=0.05,双侧检验。
2 结 果
2.1患者组和正常对照组生化因子水平比较
患者组和正常对照组比较,控制BMI后,患者组MDA(F=8.362,P<0.01)和GPx(F=4.550,P=0.013)水平均较正常对照组高;两组间SOD水平比较差异无统计学意义(F=0.569,P=0.568)。见表1。
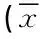
表1 患者组和对照组生化因子水平比较±s)
注:BMI作为协变量
2.2躁狂组、抑郁组和对照组生化因子水平比较
控制BMI后,MDA水平三组间总体差异有统计学意义(F=6.079,P=0.001)。两两比较,经LSD检验,躁狂发作组和抑郁发作组与和正常对照差异有统计学意义(P<0.01),两组均比正常对照组高;躁狂发作组和抑郁发作组差异无统计学意义(P>0.05)。GPx活性三组间总体差异有统计学意义(F=3.355,P=0.022)。两两比较,经LSD检验,抑郁发作组和正常对照组差异有统计学意义(P=0.012),躁狂组和对照组差异无统计学意义(P=0.057);躁狂发作组和抑郁发作组差异无统计学意义(P>0.05)。SOD活性三组间总体差异无统计学意义(F=0.140,P=0.870)。见表2。
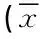
表2 躁狂组、抑郁组和对照组生化因子水平比较±s)
注:BMI作为协变量
2.3有无精神病性症状组和对照组生化因子水平比较
控制BMI后,MDA水平三组间总体差异有统计学意义(F=5.646,P=0.001)。两两比较,经LSD检验,有精神病性症状组和无精神病性症状组与和正常对照组差异有统计学意义(P<0.01),两组均比正常对照组高;有精神病性症状组和无精神病性症状组间差异无统计学意义(P>0.05)。GPx活性三组间总体差异有统计学意义(F=4.356,P=0.006)。两两比较,经LSD检验,有精神病性症状组和正常对照组差异有统计学意义(P=0.001),有精神病性症状组和无精神病性症状组差异无统计学意义(P=0.056);无精神病性症状组和正常对照组差异无统计学意义(P>0.05)。SOD活性三组间总体差异无统计学意义(F=0.773,P=0.512)。见表3。
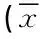
表3 有无精神病性症状组和对照组生化因子水平比较±s)
注:BMI作为协变量
2.4相关分析
控制BMI,将发病年龄、住院次数、病程、HAMD-17和BRMS评分分别与三个生化指标水平进行偏相关分析,均未见发病年龄、住院次数、病程、HAMD-17和BRMS评分分别与SOD、MDA和GPx水平显著相关(P均>0.05)。
3 讨 论
本研究纳入了双相障碍I型患者,检测了患者和正常对照组的外周血MDA水平、GPx和SOD活性。目前尚未见有在中国汉族人群中同时探讨双相障碍躁狂发作、抑郁发作患者的氧化应激相关因子情况。本研究结果显示,相较于正常对照组,患者组MDA水平和GPx活性均较高。按照所处疾病的不同状态分组后,抑郁组的MDA水平和GPx活性均较正常对照组高;躁狂组的MDA水平较正常对照组高。本研究还发现,有精神病性症状组的患者MDA水平和GPx活性均较正常对照组高;无精神病性症状组的MDA水平较正常对照组高。提示不同临床特征的患者可能存在不同的氧化应激水平。
活性自由基(Free Radical)通常是一些带不成对电子的原子或原子团,这些原子或原子团均是高活性的物质,可发生级联反应。活性自由基可破坏细胞膜、蛋白质、脂质以及核酸等细胞和亚细胞结构,从而影响细胞和器官的功能。正常情况下,人体内氧化物与抗氧化物处于动态平衡状态,一旦这种平衡被破坏,氧化应激被激发[5],相应的因子水平失衡,扰乱腺嘌呤和嘧啶的正常状态、影响DNA的复制能力、介导突变以及基因表达的修饰;还会引起蛋白质的巯基损失以及氨基酸异常修饰,导致使蛋白质失活,损伤细胞膜,最终改变细胞功能甚至导致细胞凋亡或坏死[6-7]。SOD和GPx同属酶抗氧化系统,SOD是体内抗氧化防御系统的第一道屏障,可催化O2-转化为过氧化氢(Hydrogen Peroxide,H2O2)[8]。GPx可以将H2O2还原成水,还可以减少脂质和非脂质氢过氧化物,减少过度消耗还原型谷胱甘肽(Glutathione,GSH)。GSH是人体内重要的抗氧化剂之一,过度消耗会导致抗氧化能力下降。
既往有研究显示,血清GPx活性在躁狂和抑郁发作时均升高[1,9],本研究与既往研究结果类似。GPx均可以将H2O2还原成水,保护细胞质免受损伤,被认为是维持细胞低水平的H2O2及减少脂质过氧化物的关键[10]。动物研究发现,GPx可有效抵抗多巴胺诱发的氧化应激。本研究相关分析并未发现抗氧化酶与抑郁或躁狂症状评分有相关性,提示抗氧化酶的异常可能仅与机体自由基状态有关,而与疾病严重程度无关。认知功能损害实际上也是双相障碍的核心症状之一,主要包括反应抑制、注意转换及持续注意困难。“稳定期双相障碍患者仍然存在认知功能损害”这一观点已得到业界比较一致的认可[11-12]。Corbetta等[13]发现大脑内抗氧化物与氧自由基失衡可能导致认知功能下降。大脑内氧化了的蛋白质逐渐累积,加剧了神经退行性变记忆认知功能的缺损[14]。本研究结果还显示,有无精神病性症状患者的GPx活性可能存在不同,有精神病性症状患者的GPx活性更高。既往的研究提示,有精神病性症状的双相障碍患者,认知功能损害比无精神病性症状的患者更为严重[12]。由此可见,抗氧化酶水平可能与认知功能这一症状维度更具有相关性,本课题组正在这一方面进行探索。
本研究结果未发现血清SOD异常,而既往关于SOD在同一疾病状态的研究报道有升高也有降低[1,15-17]。引起结果不一致的原因可能与药物治疗、饮食、生活方式以及病程等有关[18]。SOD是清除自由基的第一道防线,广泛分布于哺乳动物组织,将超氧阴离子转为H2O2[19]。SOD有三种类型被人类所熟知,其中SOD1含量最丰富。血清SOD活性,与红细胞SOD一样,主要为SOD1占优势,它的上调在双相障碍躁狂和抑郁发作中均有观察到,表明机体处于氧化应激状态。但最终的氧化应激损伤还要依赖其他的抗氧化系统。
MDA是目前广泛用于反映组织伤害和脂质过氧化程度的指标,可以间接反映体内脂质过氧化的水平。既往研究发现,MDA水平升高可见于未分疾病状态及躁狂或抑郁发作的双相障碍患者中[1,3,20],Machado-Vieira等[9]在未用药的躁狂患者中发现MDA水平升高。本研究结果和上述研究结果相同,提示氧化应激引起的脂质过氧化损伤可能广泛存在于双相障碍患者中,患者发病时的氧化损害明显。Andreazza等比较了不同疾病状态下双相障碍患者(稳定期31例,躁狂发作32例,抑郁发作21例)的氧化应激异常的差异,不仅发现患者在发病期血清硫代巴比妥酸反应物(Thiobarbituric Acid Reactive Substances,TBARS)水平高于正常对照组,且在稳定期TBARS水平仍高于正常对照组。TBARS是通过硫代巴比妥酸(TBA)方法与MDA以2:1的比例形成的络合物,是脂质过氧化过程中产生的大量的醛酮类物质;这些物质醛酮类物质在535nm处的吸光度反应即为MDA含量,二者均代表脂质过氧化损伤水平。本研究结果提示患者在急性期的脂质损害,在恢复期,可能会持续存在。但该研究纳入稳定期患者的总病程较长,平均为17.3年,且未提及患者的稳定时间。患者可能反复或一直处于氧化应激状态,细胞膜脂质的氧化损伤反复累积,再加上线粒体电子传递链的蛋白质损伤加重,产生更多的ROS,加剧脂质过氧化,造成不可逆损伤,甚至到病情缓解后仍不能完全恢复。因此,在恢复良好或稳定期较长的患者中,这种损害是否依然存在,目前还不得而知。本课题组正在进行这方面的探索。另外,Tsai等[21]发现双相障碍躁狂发作患者(n=23)血清TBARS水平较正常对照组高,经6周锂盐治疗后血清TBARS水平下降,de Sousa等[22]研究也发现,治疗后患者TBARS水平下降,在对锂盐应答良好的患者中最为明显。提示脂质氧化因子水平的变化,可能可以作为评估或预测疗效的指标。
本研究还存在以下不足之处:第一,本研究纳入的患者大部分均已经使用药物治疗,某些药物可能对氧化应激指标产生影响。研究发现情感稳定剂锂盐具有神经保护作用,甚至可以部分修复氧化应激介导的神经元损伤,甚至可以升高抗氧化酶的活性[23]。第二,本研究为横断面病例对照研究,不同疾病状态的氧化应激损害特点,尤其是抑郁和躁狂发作的比较,如能在相同的患者中进行比较,将更具说服力。
[1]Andreazza AC, Cassini C, Rosa AR, et al. Serum S100B and antioxidant enzymes in bipolar patients[J]. J Psychiatr Res, 2007,41(6):523-529.
[2]Andreazza AC. Combining redox-proteomics and epigenomics to explain the involvement of oxidative stress in psychiatric disorders[J].Mol Biosyst, 2012,8(10):2503-2512.
[3]Kapczinski F, Dal-Pizzol F, Teixeira AL, et al. Peripheral biomarkers and illness activity in bipolar disorder[J]. J Psychiatr Res, 2011,45(2):156-161.
[4]Raffa M, Barhoumi S, Atig F, et al. Reduced antioxidant defense systems in schizophrenia and bipolar I disorder[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2012,39(2):371-375.
[5]Kohen R, Nyska A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification[J]. Toxicol Pathol, 2002,30(6):620-650.
[6]Filomeni G, Ciriolo MR. Redox control of apoptosis: an update[J]. Antioxid Redox Signal, 2006,8(11-12):2187-2192.
[7]Aksenova MV, Aksenov MY, Mactutus CF, et al. Cell culture models of oxidative stress and injury in the central nervous system[J].Curr Neurovasc Res, 2005,2(1):73-89.
[8]Nordberg J, Arner ES. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system[J]. Free Radic Biol Med, 2001,31(11):1287-1312.
[9]Machado-Vieira R, Andreazza AC, Viale CI, et al. Oxidative stress parameters in unmedicated and treated bipolar subjects during initial manic episode: a possible role for lithium antioxidant effects[J]. Neurosci Lett, 2007,421(1):33-36.
[10] Yao JK, Keshavan MS. Antioxidants, redox signaling, and pathophysiology in schizophrenia: an integrative view[J]. Antioxid Redox Signal, 2011,15(7):2011-2035.
[11] Mann-Wrobel MC, Carreno JT, Dickinson D. Meta-analysis of neuropsychological functioning in euthymic bipolar disorder: an update and investigation of moderator variables[J]. Bipolar Disord, 2011,13(4):334-342.
[12] 林鄞, 曹莉萍, 温光池, 等. 稳定期双相障碍Ⅰ型患者执行功能及其影响因素研究[J]. 中国神经精神疾病杂志, 2008,34(11):641-644.
[13] Corbetta M, Patel G, Shulman GL. The reorienting system of the human brain: from environment to theory of mind[J]. Neuron, 2008,58(3):306-324.
[14] Radak Z, Kumagai S, Taylor AW, et al. Effects of exercise on brain function: role of free radicals[J]. Appl Physiol Nutr Metab, 2007,32(5):942-946.
[15] Selek S, Savas HA, Gergerlioglu HS, et al. The course of nitric oxide and superoxide dismutase during treatment of bipolar depressive episode[J]. J Affect Disord, 2008,107(1-3):89-94.
[16] Savas HA, Gergerlioglu HS, Armutcu F, et al. Elevated serum nitric oxide and superoxide dismutase in euthymic bipolar patients: impact of past episodes[J]. World J Biol Psychiatry, 2006,7(1):51-55.
[17] Gergerlioglu HS, Savas HA, Bulbul F, et al. Changes in nitric oxide level and superoxide dismutase activity during antimanic treatment[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2007,31(3):697-702.
[18] Yao JK, Reddy R, van Kammen DP. Abnormal age-related changes of plasma antioxidant proteins in schizophrenia[J]. Psychiatry Res, 2000,97(2-3):137-151.
[19] Johnson F, Giulivi C. Superoxide dismutases and their impact upon human health[J]. Mol Aspects Med, 2005,26(4-5):340-352.
[20] Kuloglu M, Ustundag B, Atmaca M, et al. Lipid peroxidation and antioxidant enzyme levels in patients with schizophrenia and bipolar disorder[J].Cell Biochem Funct, 2002,20(2):171-175.
[21] Tsai MC, Huang TL. Thiobarbituric acid reactive substances (TBARS) is a state biomarker of oxidative stress in bipolar patients in a manic phase[J]. J Affect Disord, 2015,173:22-26.
[22] de Sousa RT, Zarate CA, Jr., Zanetti MV, et al. Oxidative stress in early stage Bipolar Disorder and the association with response to lithium[J]. J Psychiatr Res, 2014,50:36-41.
[23] Marmol F. Lithium: bipolar disorder and neurodegenerative diseases Possible cellular mechanisms of the therapeutic effects of lithium[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2008,32(8):1761-1771.
(本文编辑:吴俊林)
Oxidative stress damage in different phases of bipolar disorder in Chinese Han population
LIXuan,LIHan-qiu,ZHANGXiao-fei,YANGChan-juan,CHENGXiong-chao,ZHENGChao-dun,CAOLi-ping,LINYin*
(TheAffiliatedBrainHospitalofGuangzhouMedicalUniversity,GuangzhouHuiaiHospital,Guangzhou510370,China
*Correspondingauthor:LINYin,E-mail:linymn@163.com)
ObjectiveTo explore differences of oxidative stress damage among different phases in patients with bipolar disorder. MethodsFifty-three patients with bipolar I disorder and 59 healthy controls(HC) were recruited in Guangzhou Huiai Hospital. Hamilton Depression Scale-17 item (HAMD-17) and Bech-Rafaelsen Mania Rating Scale(BRMS) were used to assess the clinical symptoms. Peripheral blood were collected in the early morning and used to test the contents of superoxide dismutase(SOD), glutathione peroxidase(GPx) and Malonaldehyde(MDA) in all participants. Results①The contents of MDA(F=8.362,P<0.01) and GPx(F=4.550,P=0.013) in patients were higher than HC. ②Patients were divided into manic group (MA) and depressive group (DP) according to the clinical symptoms. There were significant differences in MDA among the MA, DP and HC (F=6.079,P<0.01). MDA in MA and DP were higher than HC, respectively(P<0.01). The differences of GPx were significant among the three groups (F=3.355,P=0.022). GPx in DP was higher than HC (P=0.012). ③Patients were divided into psychotic group (Ps) and non-psychotic group (NPs) according to the psychotic symptoms. There were significant differences in MDA among the Ps, NPs and HC (F=5.646,P=0.001). MDA in Ps and NPs were higher than HC, respectively(P<0.05或0.01). The differences of GPx were significant among the three groups (F=4.356,P<0.01). GPx in Ps was higher than HC (P<0.01). ④There were no significant association between age of episode, counts of inpatient, duration of illness, HAMD and BRMS with SOD, GPx and MDA, respectively(P>0.05). ConclusionThere is oxidative stress system disturbance in the episode phrase of patients with bipolar disorder, which may be associates with the clinical characters.
Bipolar disorder; Oxidative stress; Antioxidant enzyme
广州市医药卫生科技项目(20141A011042);广州市医学重点学科项目(GBH2014-2D08)
林鄞,E-mail:linymn@163.com)
R749.4
A
10.11886/j.issn.1007-3256.2016.01.004
2016-01-06)
