以短时心率变异性反映充血性心力衰竭患者自主神经活动的改变
2016-09-15刘红夺儿王志刚
刘红夺儿 湛 萍 王志刚 彭 屹
(中国医学科学院基础医学研究所 北京协和医学院基础学院, 北京 100005)
以短时心率变异性反映充血性心力衰竭患者自主神经活动的改变
刘红夺儿 湛 萍 王志刚 彭 屹#*
(中国医学科学院基础医学研究所 北京协和医学院基础学院, 北京 100005)
基于短时心率变异性(HRV)分析,探讨充血性心力衰竭(CHF)患者自主神经活动的变化和影响。选用THEW数据库中正常人子数据库作为正常对照组(n=189),对于PhysioNet中两个CHF子数据库的样本(n=44),按照NYHA等级,将NYHA I-II级划分轻度CHF 组(n=12),NYHA III-IV级为重度CHF组(n=32)。对每一个Holter记录选取日间和夜间安静态各5 min的RR间期(RRI)序列,分别进行时域、基于AR模型的频域和去趋势波动(DFA)分析。在正常组、轻度CHF组和重度CHF组等三组中,CHF患者日间的短时分形尺度指数((α1)d)两两比较均有显著性差异,并存在下降趋势(依次分别为1.35±0.21、1.03±0.29和0.81±0.29),反映心率动力学从分形特性转向更随机化的结构。同时,日间HFn((HFn)d)在三组间的两两比较中均存在显著性差异,并存在上升趋势(依次分别为23.89%±12.78%、37.22%±11.24%和56.30%±15.28%), 表明CHF导致交感神经和迷走神经交互作用趋于消失。利用夜间RRI(RRIn),(HFn)d和(α1)d等3个指标进行Fisher线性判别,区分正常人和CHF患者的灵敏性和特异性分别为90.91%和92.06%,而区分轻度和重度CHF患者的灵敏性和特异性分别为84.38%和100%。所进行的研究将HRV非线性方法与传统方法相结合评估自主神经状态, 为监测CHF病情或观察治疗效果等潜在的临床应用提供了依据。
心率变异性;充血性心力衰竭;去趋势波动分析(DFA);自主神经系统
引言
美国心脏协会(American Heart Association, AHA)最新的心脏病与卒中统计数据显示,在2003—2013年间,尽管美国心血管病相关死亡率和心血管病死亡人数均下降,但2013年死亡人数中的30.8%仍与心血管病相关,其中心力衰竭占死因的1/9,且与1995年相比并没有变化[1]。这表明,降低心衰的发病率及病死率仍然具有很强的挑战性。
自主神经功能障碍是充血性心力衰竭(congestive heart failure,CHF)的典型特征[2]。心率变异性(heart rate variability, HRV)分析,可定量评估自主神经系统(autonomic nervous system, ANS)中交感神经和迷走神经活动的张力及其平衡性[3]。HRV作为无创间接测量手段,已广泛用于CHF的相关研究[4-5]。传统的分析方法已经显示,CHF患者具有较低的心率变异性和复杂度[4,6]。然而ANS的受损在早期并无明显症状,因此,寻求对CHF患者自主神经功能的评估并积极的干预具有重要的临床意义,也可防止更为严重的心脏恶性事件发生,进而有效地降低医疗成本。
HRV用于CHF的ANS评估主要包括两个方面:风险预测和诊断判别,其中前者占绝大多数。Nolan等招募了433名NYHA(New York Heart Association)等级在I-III级的CHF患者进行为期(482±161)d的随访,并做全因死亡率分析[7]。结果表明,HRV传统时域指标的降低可作为非住院治疗的CHF患者致死的独立预测因子。随后的研究也指出频域指标[8-9]和去趋势波动分析(detrended fluctuation analysis, DFA)中的短时分形尺度指数[10]亦可作为预测全因素致死率的HRV指标。
目前,CHF程度的诊断判别可通过NYHA心功能分级[11],以及包括心脏超声和多普勒血流等客观检查的第二类分级[12]。但这些诊断判别方法中,没有包含ANS活动的信息。HRV用于CHF的判别分析中,大多集中在年龄,性别匹配的正常人和CHF患者对应指标的统计学对比[13-15],只有少数进行了判别分析。Liu等提出一种CHF的检测方法[16]。将时域的3个指标(SDNN、pNN50%和CVrr),频域的4个指标(VLF、LF、HF和TP)以及信息熵的两个指标(ApEn和SampEn)分别进行线性组合,利用支持向量机,对30名正常人和17名 CHF 患者进行判别分析,无论是准确度,灵敏度还是特异度均达到100%。Pecchia等利用CART算法,对CHF的严重程度进行判别[17]。在54个正常人及NYHA I-III级的29名患者中,除采用传统的4个时域和频域指标之外,又加入了两个非标准指标ΔAVNN和Δ(LF/HF),灵敏度和特异度分别为89.7%和100%。判别方法相对复杂,判别参数的数量较多是目前类似研究的特点,而且HRV指标仅用于判别分析,鲜有就这些指标与CHF患者自主神经状态的关系作关联分析。
非线性分析为揭示HRV的生理和病理变化提供了新的视角,不仅可反映更多关于自主神经对于心率动力学调节的信息,而且与传统的时域和频域分析形成互补。特别是短时非线性分析契合了心率动力学的非线性和非平稳特征[18]。本研究以短时HRV分析为基础,联合时域、频域和非线性分析,以HRV指标变化表征CHF所引起的ANS状态改变,以及这些改变与CHF严重程度的关系,以期对疾病进展和疗效等方面提供有临床监测意义的依据。
1 材料与方法
1.1 数据来源
正常人数据与CHF患者数据分别来自THEW数据库(Telemetric and Holter ECG Warehouse, http://www.thew-project.org/)[19]和PhysioNet数据库(http://www.physionet.org/)[20]。THEW中的正常人子数据库(E-HOL-03-0202-003),包含202个Holter记录,剔除其中昼夜数据不完整的记录后,将余下的189个记录作为正常对照组(9~82岁)。另一个正常人数据来自PhysioNet中的Fantasia数据库,包含40个正常人2 h 心电图记录,其中20人属年长组(68~85岁),另外20人属年轻组(21~34岁),均在标准状态下观看电影Fantasia[21]。44位CHF患者的Holter记录来自PhysioNet数据库,其中有29个记录来自Congestive Heart Failure RR Interval Database(34~79岁,NYHA心功能分级I-III级);另外15个记录来自BIDMC Congestive Heart Failure Database(22~71岁,NYHA心功能分级III-IV级)。将所有CHF患者的44个记录按照NYHA级别分为两组,其中一组为轻度CHF(n=12, 4个NYHA I级和8个NYHA II 级),另一组为重度CHF(n=32, NYHA均为III-IV级)。各数据库均提供RR间期(RRI)序列标注文件。对数据段进行时间分割,定义日间为07:00~20:00,夜间为00:00~06:00。根据RRI序列趋势图,分别选取日间和夜间各1 h的安静态间期序列,再从其中随机选取时长为5 min的间期序列,去除异位心拍后供分析用。
1.2 频域分析
利用自回归(autoregressive, AR)模型对每一个RRI序列进行功率谱分析。选用Burg算法估计AR模型的系数,该算法是在递归约束下,从观测的数据利用线性预测器的前向和后向预测的总均方误差(功率)之和为最小的准则来估计反射系数,所选AR模型的阶数p为16[22]。功率谱分析中,低频段(low frequency, LF) 为0.04~0.15 Hz,高频段(high frequency, HF)为0.15~0.40 Hz,并采用归一化指标[23],即
(1)
(2)
1.3 去趋势波动分析
与几何分形相似,时间序列也具有自相似性。DFA是一种用于研究心率自相似性的尺度分析方法[13]。


(3)
将序列y(k)分成互不重合长度为n的若干个子序列,并在每个子序列中通过线性最小方差法获得其趋势yn(k),然后计算波动函数F(n),有
(4)
分形尺度指数α作为DFA的量化参数,可以通过F(n)关于子序列长度n的双对数图的斜率得到,关系式为F(n)∝n-α。DFA在n接近16时会产生Crossover现象。当选取4≤n≤16计算波动函数时,所得到的短时分形尺度指数α记为α1。
1.4 符号动力学分析
符号动力学分析(symbolic dynamic analysis, SDA),应用有限的符号描述系统动力学特性[24]。典型的是将RRI序列以3拍为一个字长单元,并以每拍所在的水平演化成符号序列。对符号序列中的每个字长单元,根据3拍的变化趋势可分为4种模式,分别是:
1)0V(连续3拍均在同一水平,无变化);
2)1V(连续2拍在同一水平上,另一拍水平有变化);
3)2LV(连续3拍的水平均有变化,但变化趋势相同);
4)2UV(连续3拍的水平均有变化,但变化趋势不同)。
分别计算这4种模式在所有符号序列中所占的百分比,将其记为0V%、1V%、2LV%和2UV%。以往研究表明,0V%和2UV%可分别表示心脏交感神经和迷走神经的变化[25]。交感神经活动的增强会引起0V%的增加和2UV%的减少,心迷走神经活动的增强则引起相反的变化方向,故本研究中仅对0V%和2UV%这两个指标进行分析。
1.5 统计分析
结果中的数据采用均值±标准差的方式表示。采用配对t检验或Wilcoxion符号秩和检验比较正常组,轻度CHF组以及重度CHF各组内日间和夜间特征指标的差异。独立样本t检验则用于正常组,轻度CHF组以及重度CHF组这三组中的两两组之间各参数差异的检验,同时也用于Fantasia数据中年轻组与年长组之间各指标的差异比较。
运用Fisher线性判别分析(Fisher linear discriminate analysis)对正常组与CHF组,以及轻度CHF组与重度CHF组进行分类判别。用全模型法得到判别方程后,选用留一法(leave-one-out)对判别结果进行检验,并对最终的结果进行评价,包括灵敏度(sensitivity)、特异度(specificity)和正确率(accuracy),有
(5)
(6)
(7)
式中,TP代表真阳性,TN代表真阴性,FP代表假阳性,FN代表假阴性。
所有统计分析采用SPSS 19.0(SPSS Inc, Chicago, USA),分析结果中如P<0.05,认为被检验指标间存在显著性差异。
2 结果
表1为正常组,轻度CHF组与重度CHF组在日间和夜间的各指标分析结果。正常组和重度CHF组两组中,RRI和α1两指标的昼夜间均存在显著差异,而在轻度CHF组中并无显著差异。对于频域和SDA指标,LFn、HFn、LF/HF、 0V%和2UV%,昼夜间的显著差异只存在于正常组中。此外,在正常组,轻度CHF组和重度CHF组这3个组中所进行的两两比较,频域指标(LFn、HFn和LF/HF)和α1只有在日间相对应的指标间存在显著差异, 并且LFn、LF/HF和α1依正常组、轻度CHF组和重度CHF组的顺序降低, HFn则依次升高。而相同的比较对于RRI,三组之间两两比较均存在显著差异的是夜间RRI。总之,正常组,轻度CHF组与重度CHF组这三组之间的两两比较均存在显著差异的指标是夜间RRI,日间的LFn、 HFn和LF/HF,以及日间的α1。从中选取3个相对独立的指标用作判别分析,即夜间RRI,日间的HFn和α1,分别记为RRIn、 (HFn)d和(α1)d。
图1为典型的正常组,轻度CHF组及重度CHF组日间5 min的RRI序列趋势图以及DFA波动函数双对数图的对比。可见,正常组RRI表现出相对于另外两组更强的波动趋势,轻度CHF组的波动则明显弱于正常组,而重度CHF组则仅仅表现出微弱的波动,表现出CHF组HRV的降低。再者,这三组的波动函数双对数图也呈现斜率递减,即α1逐渐降低,心率动力学从分形特性转向更为随机的结构。
表1 正常组与CHF患者日间和夜间各指标的分析结果
Tab.1 The results of analysis in the day and at night in normal controls and CHF patients
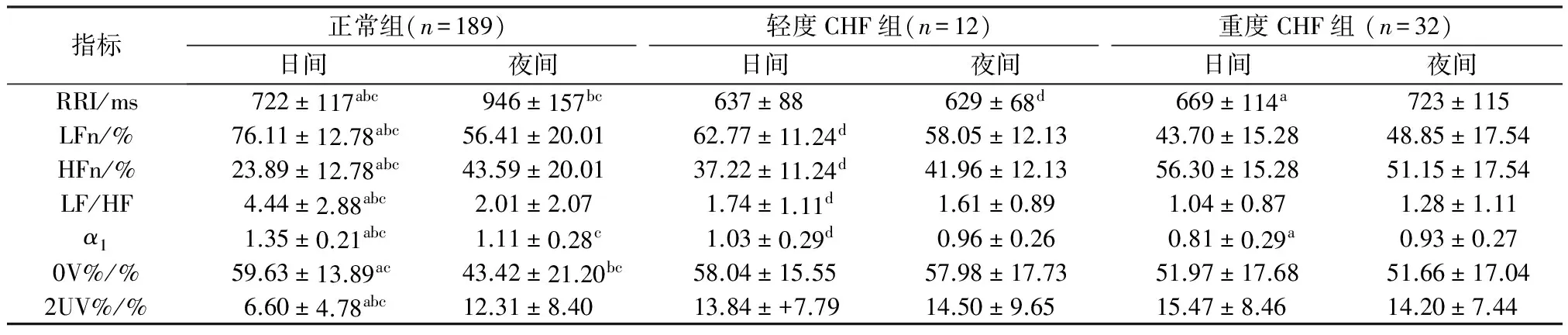
指标正常组(n=189)轻度CHF组(n=12)重度CHF组(n=32)日间夜间日间夜间日间夜间RRI/ms722±117abc946±157bc637±88629±68d669±114a723±115LFn/%76.11±12.78abc56.41±20.0162.77±11.24d58.05±12.1343.70±15.2848.85±17.54HFn/%23.89±12.78abc43.59±20.0137.22±11.24d41.96±12.1356.30±15.2851.15±17.54LF/HF4.44±2.88abc2.01±2.071.74±1.11d1.61±0.891.04±0.871.28±1.11α11.35±0.21abc1.11±0.28c1.03±0.29d0.96±0.260.81±0.29a0.93±0.270V%/%59.63±13.89ac43.42±21.20bc58.04±15.5557.98±17.7351.97±17.6851.66±17.042UV%/%6.60±4.78abc12.31±8.4013.84±+7.7914.50±9.6515.47±8.4614.20±7.44
注:aP<0.05 日间vs夜间;bP<0.05 正常组vs轻度CHF组;cP<0.05 正常组vs重度CHF组;dP<0.05 轻度CHF组vs重度CHF组。
Note:aP<0.05 day vs night;bP<0.05 normal controls vs mild CHF group;cP<0.05 normal controls vs severe CHF group;dP<0.05 mild CHF group vs severe CHF group.

图1 不同组别日间RRI序列图 (上)以及DFA波动函数的双对数图(下)。(a)正常组;(b)轻度CHF组;(c)重度CHF组Fig.1 The plots of RRI series (top) and log F(n) vs log n (bottom). (a) Normal controls; (b) Mild CHF group;(c) Severe CHF group
表2为正常组与CHF组Fisher线性判别分析的结果。将RRIn, (HFn)d, (α1)d作为输入参数,判别的灵敏度、特异度和正确率分别为90.91%、92.06%和91.85%。
表2 正常组与CHF患者Fisher线性判别结果
Tab. 2 Results of Fisher linear discriminant analysis between normal controls and CHF patients

判别指标RRIn(HFn)d(α1)d截距CHF组系数0 0330 60439 797-44 873正常组系数0 0470 50946 727-60 537灵敏度/%90 91(40/44)特异度/%92 06(174/189)正确率/%91 85(214/233)
表3为轻度CHF组与重度CHF组Fisher线性判别分析的结果。依旧将RRIn, (HFn)d, (α1)d作为输入参数,以重度CHF组为阳性,轻度CHF组作为阴性,判别的灵敏度、特异度和正确率分别为84.38%、100%和88.64%。
表3 轻度CHF组与重度CHF组Fisher线性判别结果
Tab. 3 Results of Fisher linear discriminant analysis between mild CHF group and severe CHF group

判别指标RRIn(HFn)d(α1)d截距重度CHF组系数0 0521 62774 747-95 923轻度CHF组系数0 0441 45170 403-77 674灵敏性/%84 38(27/32)特异性/%100 00(12/12)正确率/%88 64(39/44)
表4 Fantasia正常人数据库年轻组与年长组指标对比
Tab.4 Indexes of young group and old group in Fantasia database

指标年轻组年长组RRI/ms958±1581028±181 LFn/%59 58±18 0456 98±17 63HFn/%42 42±18 0443 02±17 63LF/HF1 95±1 302 17±3 04α11 02±0 291 19±0 300V%/%38 59±17 5449 33±18 122UV%/%14 40±7 95 12 20±7 24
表4为Fantasia数据库中40名正常人在年轻组与年长组的各指标之间的对比分析结果。可见,标准条件下,采用年轻组与年长组2 h记录中随机挑选的5 min RRI序列,所计算的各指标之间均无显著差异。因此,这些指标的选择有利于突出病理变化带来的影响。
3 讨论
本研究基于HRV短时分析,探讨CHF患者自主神经行为的改变。利用美国公共数据库中的Holter数据,刻画CHF患者自主神经调节随CHF病情加重时的演变。将时域、频域和非线性分析相结合,选择更具有统计学差异的特征,对正常人和CHF组进行判别分析,以较少的判别指标和最为简单的判别方法,取得了良好的判别结果。
短时分形尺度指数α1是由交感神经和副交感神经复杂的相互作用所决定的。Tulppo等的研究为α1与心脏自主神经平衡状态的关联性提供了以直接测量为依据的分析基础[26]。通过对正常人施加非药物性刺激,诱发交感神经和迷走神经共同兴奋,并在实验过程中同时记录ECG和腓骨神经的肌肉交感神经活动(muscle sympathetic nerve activity, MSNA)。结果显示,与基态相比,虽然MSNA显著增高,心率却无显著变化,同时LF/HF和α1显著降低,反映出交感神经和迷走神经的共同兴奋导致分形特性的消失。而分形特征的减弱或者消失是与心脏恶性事件的发生密切相关联的[27-29]。本研究的结果显示,相比于正常对照组,轻度CHF组和重度CHF组的α1均显著降低,提示这些患者心率动力学分形特性的减弱或者消失。与之相对应的,表现交感神经和迷走神经平衡的指标LF/HF在CHF患者中亦显著降低,而且在日间的降低幅度远大于夜间。从表1可见,产生这样变化的主要原因是CHF患者日间HFn均显著升高,而夜间的HFn只有升高的趋势,并无统计学上的显著性。反映迷走神经活性的2UV%也呈类似的变化方式。在日间本应交感神经活动更为占优的时段,CHF患者迷走神经活性占比却在升高, 从而反映出CHF患者呈交感神经和迷走神经共同兴奋的病理变化,很好地解释了CHF患者日间α1显著下降的原因。此外,对于(HFn)d和(α1)d这两个参数,不仅正常人和CHF患者之间存在显著差异,轻度CHF组和重度CHF组之间也存在显著差异,这不仅是取得良好判别效果的基础,也提示CHF的严重程度与ANS的损伤存在明显的关联性。
在对比分析中,RRI的结果值得注意。文献[26]的实验结果表明,交感神经和迷走神经的共同兴奋对心率影响有限,我们的分析结果也印证了这一点。日间的RRI(RRId)在正常人、轻度CHF组和重度CHF组之间虽有统计学差异,但相差的幅度有限,而且轻度CHF组和重度CHF组两者之间的RRId不存在统计学差异,确实体现了CHF患者日间交感神经和迷走神经同时兴奋的倾向。相反,如表1所示,与正常组对比,CHF组夜间表现交感神经活性的0V%明显升高,而表现迷走神经活性的2UV%却无明显差异,说明其夜间交感神经活动较正常组活跃,导致正常人和CHF患者的RRIn相差幅度很大,为判别分析提供了很好的基础。
影响HRV普及应用的因素之一,是其指标受个体差异的影响较大,存在较大的离散度。但一些非线性HRV指标,如我们所采用的短时分形尺度指数α1,在减小个体差异的影响方面更具优势,包括:更少地依赖于心率,更少的个体间差异和个体内差异,在长时和短时ECG记录中存在良好的相似性[30-31]。这其中的一些特性在我们利用Fantasia数据库数据进行的分析中也得到了验证。在频域、DFA和SDA分析指标中,α1的离散度最小。正是利用了这一优势,结合传统的分析指标,加之昼夜对比后选择更具统计学差异的指标进入分析和判别,利用简单的判别方法即取得了良好的判别效果。
目前,利用ECG提供的间期序列进行自主神经状态评测依然是心脏恶性事件风险预测的一个重要方向[32]。非线性分析所提供的新视角,与传统的分析指标相得益彰。本研究正是利用了这样的特点,结合时域、频域以及非线性分析,利用时长为5 min的短时RRI序列,不仅刻画了CHF病理条件下ANS行为的演变,而且具有判别区分效应。当然,研究中因为数据源的原因存在一些不足。比如轻度CHF组的样本量过少,共12人,而且其中NYHA只4人;另外,来自BIDMC Congestive Heart Failure Database 的15个样本中只标有NYHA Ⅲ-Ⅳ,无法进行更为细化的分类和验证。但是在此基础上所进行的轻度和重度CHF组划分,在一定程度上弥补了样本量不足的问题。而且我们的分析结果,体现出随CHF加重自主神经行为的演变,特别是日间出现的交感神经和迷走神经共同兴奋的病理变化。运用我们所提出的方法和指标,今后可在更加扩大的样本量和更加细分的数据集上验证,以期得到更广泛的运用。
4 结论
本研究采用短时HRV分析,反映CHF引起的自主神经调节的变化,并探讨了可能存在的病理机制。使用安静态的时域、频域和非线性分析,揭示了CHF导致患者交感神经和迷走神经交互作用趋于消失,使其心率动力学从分形特性转向更为随机化的结构,并且这些变化随CHF加重有加深的趋势。所提出的方法,不仅可以有效地区分正常人和CHF患者,而且可以区分CHF的严重程度。目前,HRV依然是无创监测自主神经状态的唯一方法,本研究的结果为利用HRV评估ANS状态,监测CHF病情或者观察治疗效果等潜在的临床应用,提供了依据。
[1] Mozaffarian D, Benjamin EJ, Go AS, et al. Heart disease and stroke statistics-2016 update a report from the American Heart Association [EB/OL].http://circ.ahajournals.org/content/early/2015/12/16/CIR.0000000000000350.full.pdf, 2015-12-16/2015-12-24.
[2] Millar PJ, Murai H, Floras JS. Paradoxical muscle sympathetic reflex activation in human heart failure [J]. Circulation, 2015, 131:459-468.
[3] Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurement, physiological interpretation and clinical use[J]. Circulation, 1996, 93: 1043-1065.
[4] Guzzetti S, Magatelli E, Mezzetti S. Heart rate variability in chronic heart failure [J]. Autonomic Neuroscience: Basic and Clinical, 2001, 90:102-105.
[5] Xhyheri B, Manfrini O, Mazzolini M, et al. Heart rate variability today [J]. Progress in Cardiovascular Diseases, 2012, 55: 321-331.
[6] Richard G, Sandercock H, Brodie DA. The role of heart rate variability in prognosis for different modes of death in chronic heart failure [J]. Pace, 2006, 29: 892-904.
[7] Nolan J, Batin PD, Andrews R, et al. Prospective study of heart rate variability and mortality in chronic heart failure: results of the United Kingdom heart failure evaluation and assessment of risk trial (UK-heart)[J].Circulation, 1998, 98: 1510-1516.
[8] Moore PKG, Groves D, Kearney MT, et al. HRV spectral power and mortality in chronic heart failure (CHF): 5 years results of the UK heart study[J]. Heart, 2004, 90: A6.
[9] La Rovere MT, Pinna GD, Maestri R, et al. Short term heart rate variability strongly predicts sudden cardiac death in chronic heart failure patients[J]. Circulation, 2003, 107(4): 565-570.
[10] Makikallio TH, Huikuri H, Hintze U, et al. Fractal analysis and time- and frequency-domain measures of heart rate variability as predictors of mortality in patients with heart failure [J]. Am J Cardiol, 2001, 87: 178-182.
[11] Dorgin M. Nomenclature and criteria for diagnosis for diseases of the heart and great vessels [M]. Boston: Little Brown and Company, 1994.
[12] Jessup M, Abraham WT, Casey DE, et al. 2009 focused update: ACCF/AHA guidelines for the diagnosis and management of heart failure in adults a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines[J]. Circulation, 2009, 119: 1977-2016.
[13] Peng CK, Havlin S, Stanley HE, et al. Quantification of scaling exponents and crossover phenomena in nonstationary heartbeat time series [J]. Chaos, 1995, 5(1): 82-87.
[14] Liu Chengyu, Li Ke, Zhao Lina, et al. Analysis of heart rate variability using fuzzy measure entropy [J]. Computers in Biology and Medicine, 2013, 43: 100-108.
[15] Thuraisingham RA. Preprocessing RR interval time series for heart rate variability analysis and estimates of standard deviation of RR intervals [J].Computer Methods and Program in Biomedicine, 2006, 83: 78-82.
[16] Liu Guanzheng, Wang Lei, Wang Qian, et al. A new approach to detect congestive heart failure using short-term heart rate variability measures [J]. PLoS ONE, 2014, 9: e93399.
[17] Pecchia L, Melillo P, Sansone M, et al. Discrimination power of short-term heart rate variability measures for CHF assessment [J]. IEEE Trans Inf Technol Biomed, 2011, 15: 40-46.
[18] 刘红夺儿, 朱逸, 湛萍, 等. 短时非线性方法用于心率变异性分析 [J].中国生物医学工程学报,2015, 34(2):229-236.
[19] Couderc JP. A unique digital electrocardiographic repository for the development of quantitative electrocardiography and cardiac safety: The Telemetric and Holter ECG Warehouse (THEW) [J]. J Electrocardiol, 2010, 43: 595-600.
[20] Goldberger AL, Amaral LAN, Glass L, et al. PhysioBank, PhysioToolkit, and PhysioNet: Components of a new research resource for complex physiologic signals [J]. Circulation, 2000, 101: 215-220.
[21] Iyengar N, Peng CK, Morin R, et al. Age-related alterations in the fractal scaling of cardiac interbeat interval dynamics [J]. Am J Physiol, 1996: 271: 1078-1084.
[22] Boardman A, Schlindwein FS, Rocha AP, et al. A study on the optimum order of autoregressive models for heart rate variability [J]. Physiol Meas,2002, 23: 325-336.
[23] Pagani M, Lombardi F, Guzzetti S, et al. Power spectral analysis of heart rate and arterial pressure variabilities as a marker of sympatho-vagal interaction in man and conscious dog [J]. Circ Res, 1986, 59: 178-193.
[24] Guzzetti S, Borroni E, Garbelli PE, et al. Symbolic dynamics of heart rate variability: a probe to investigate cardiac autonomic modulation [J]. Circulation, 2005, 112: 465-470.
[25] Porta A, Tobaldini E, Guzzetti S, et al. Assessment of cardiac autonomic modulation during graded head-up tilt by symbolic analysis of heart rate variability [J]. American Journal of Physiology- Heart and Circulatory Physiology, 2007, 293: 702-708.
[26] Tulppo MP, Kiviniemi AM, Hautala AJ, et al. Physiological background of the loss of fractal heart rate [J]. Circulation, 2005, 112: 314-319.
[27] Ho KK, Moody GB, Peng CK, et al. Predicting survival in heart failure case and control subjects by use of fully automated methods for deriving nonlinear and conventional indices of heart rate dynamics[J]. Circulation, 1997, 96:842-848.
[28] Vikman S, Mäkikallio TH, Yli-Mäyry S, et al. Altered complexity and correlation properties of R-R interval dynamics before the spontaneous onset of paroxysmal atrial fibrillation[J]. Circulation, 1999, 100:2079-2084.
[29] Huikuri HV, Poutiainen AM, Makikallio TH, et al. Dynamic behaviour and autonomic regulation of ectopic atrial pacemakers [J]. Circulation, 1999, 100:1416-1422.
[30] Perkiömäki JS, Zareba W, Ruta J, et al. Comparability of nonlinear measures of heart rate variability between long- and short- term electrocardiographic recordings[J]. Am J Cardiol, 2001, 87:905-908.
[31] Perkiömäki JS, Mäkikallio TH, Airaksinen KE, et al. Determinants and interindividual variation of R-R interval dynamics in healthy middle-aged subjects [J]. Am J Physiol Heart Circ Physiol, 2001, 280: H1400-H1406.
[32] Wellens HJJ, Schwartz PJ, Lindemans FW, et al. Risk stratification for sudden cardiac death: current status and challenges for the future [J]. European Heart Journal, 2014, 35: 1642-1651.
Short-Term Heart Rate Variability for Assessment of Autonomic Nervous Activity in Patients with Congestive Heart Failure
Liu Hongduoer Zhan Ping Wang Zhigang Peng Yi#*
(InstituteofBasicMedicalSciences,ChineseAcademyofMedicalSciences,SchoolofBasicMedicine,PekingUnionMedicalCollege,Beijing100005,China)
This study is aimed to investigate the autonomic modulation and influence in patients with congestive heart failure (CHF) based on short-term heart rate variability (HRV) analysis. One dataset from THEW as normal controls (n=189) and two datasets of CHF patients from PhysioNet were selected in this study. According to NYHA class, 44 CHF patients were divided into mild CHF group (NYHA I-II,n=12) and severe CHF group (NYHA III-IV,n=32). Two 5 minute episodes of RR interval (RRI), representing day and night in resting state, were selected in each Holter record. Then, time domain analysis, AR model based frequency domain analysis and detrended fluctuation analysis (DFA) were calculated in each series. The results demonstrated that there were significant differences for short-term fractal scaling exponent in the day ((α1)d) in any two groups among normal controls, mild CHF group and severe CHF group. Moreover, the declining trend of (α1)d(1.35±0.21, 1.03±0.29 and 0.81±0.29, respectively) showed the change of heart rate dynamics from fractal properties towards random structure. In the meanwhile, significant differences existed for HFn in the day ((HFn)d) in any two groups among the abovementioned three groups. And the sustained increase of (HFn)d(23.89%±12.78%, 37.22%±11.24% and 56.30%±15.28%, respectively) suggested the loss of reciporcal function between sympathetic and vagal branches. Using RRIn(night RRI), (HFn)dand (α1)d, the sensitivity and specificity for discriminating normal people and CHF patients reached 90.91% and 92.06%; Moreover, the sensitivity and specificity for discriminating mild CHF patients and severe CHF patients were 84.38% and 100%. Combining nonlinear analysis and traditional methods, our results provided the basis for clinical use of HRV in monitoring the progress of CHF and testing therapeutic effects.
heart rate variability (HRV); congestive heart failure (CHF); detrended fluctuation analysis (DFA); autonomic nervous system (ANS)
10.3969/j.issn.0258-8021. 2016. 02.005
2015-12-24, 录用日期:2016-02-16
国家自然科学基金(81071225,81471746)
R318
A
0258-8021(2016) 02-0155-07
# 中国生物医学工程学会会员(Member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: pengyi@pumc.edu.cn
