石斛内生甲基营养芽胞杆菌的拮抗和促生作用研究
2016-09-14武利勤顾海科王青尚宏忠刘桂君包放
武利勤 顾海科 王青 尚宏忠 刘桂君 包放
(北京市辐射中心,北京 100875)
石斛内生甲基营养芽胞杆菌的拮抗和促生作用研究
武利勤 顾海科 王青 尚宏忠 刘桂君 包放
(北京市辐射中心,北京 100875)
从霍山石斛中分离内生菌,旨在获得具有广谱抗菌活性和促生作用的内生细菌。以石斛黑斑病菌为指示菌,用对峙培养法筛选具有抗菌活性的内生菌;对筛选到的具有拮抗活性的菌株进行抗菌谱和促生长潜力的测定。结果显示,从霍山石斛中分离获得22株内生细菌,其中菌株RA具有较强抑菌活性,根据16S rDNA 序列分析结果鉴定 RA为甲基营养芽孢杆菌 Bacillus methylotrophicus。菌株RA可以产生IAA、嗜铁素、蛋白酶、表面活性剂和生物膜,RA对 8 种植物病原菌也具有较好的抑制作用,具有广谱抗菌活性;并且可以显著促进玉米幼苗的生长。RA菌株具有作为生防菌剂和生物肥料应用的良好潜力。
霍山石斛;内生细菌;甲基营养芽胞杆菌;抑菌活性;促生长
研究表明,80% 的植物病害是由植物病原真菌引起,目前用于防治植物病害的方法主要有化学防治和生物防治,化学农药防治严重污染环境和造成农产品农药残留,且在杀灭病原菌的同时,还对植株体内和土壤中有益微生物群落造成严重破坏。因此,微生物肥料、微生物农药是未来农业可持续发展的重要方向之一。
传统生物防治是将拮抗菌导入土壤中,但由于土壤习居菌排斥作用,拮抗菌很难定殖并发挥作用[1]。植物内生菌是指在其生活史的至少一个阶段存活于植物组织内部,而又不引发宿主植物表现出明显感染症状的微生物类群[2]。植物内生菌作为拮抗菌使用时,能够定殖在植物体内,优先占领有利的物理学位点和生物学位点,造成对病原菌侵染的物理阻隔或生态排斥效应,使病菌无法接近侵染位点而不能侵染寄主,因此利用内生菌来源的拮抗微生物防治植物病害成为研究热点之一。植物内生菌作为一种新的微生物资源引起了广泛关注,内生细菌既可以产生促生物质,直接促进植物生长[3],也可以通过与病原菌竞争空间或产生拮抗物质而间接起到促生作用[4]。利用植物内生细菌提高农作物产量和品质的研究已有较多报道[5-8]。
石斛是传统的名贵中药,具有益胃生津、滋阴清热、明目利嗓等作用,其中霍山石斛(Dendrobium huoshanense C. Z. Tang et S. J Che)为石斛中的名贵品种。由于近年来过度挖掘,目前野生资源已濒临枯竭,具有一定栽培规模的石斛生产基地相继建立。然而,随着大面积的人工栽培,由细极链格孢(Alternaria tenuissima)引起的石斛黑斑病在移植苗上普遍发生,病原菌危害幼嫩的叶片,引起黑褐色病斑,病斑周围叶片变黄,受害严重植株叶片全部脱落,是石斛栽培中的一个重要病害,给种植户带来严重的经济损失[9]。另外,该病菌可产生寄主转化性真菌毒素(ATC-toxin),而这些毒素涉及到动物癌症的发展[10],对石斛药材的安全性构成了潜在的威胁。
本研究拟从霍山石斛植株中分离内生菌,筛选对石斛黑斑病有较好拮抗活性的菌株,应用该菌对其他重要病原菌的抑菌活性进行测定,测定拮抗菌的抑菌谱,并对菌株分泌的抑菌和促生物质进行初步研究,以期获得具有广谱抗菌活性的内生菌,为石斛及其他植物病害的防治提供生物资源。
1 材料与方法
1.1材料
1.1.1供试菌株 石斛黑斑病菌(Alternaria tenuissima)、梨轮纹病菌(Botryosphaeria berengeriana f. sp. piricola)、棉花黄萎病菌(Verticillium dahliae Kleb)、白菜黑斑病菌(Alternaria brassicae(Berk.)Sace)、灰霉病菌(Botrytis cinerea)、辣椒立枯病菌(Rhizoctonia solani Kuhn)由本实验室分离保存;香蕉枯萎病菌(Fusarium oxysporum f. sp. Cubense)、稻瘟病菌(Pyricularia oryzae)和禾谷镰孢菌(Fusarium graminearum)购自中国农业科学院菌种保藏中心。
1.1.2植物材料 霍山石斛2014年4月采集于安徽六安霍山石斛种植基地。所采集的样品置于已灭菌的自封袋中,4℃保存,并于2 d内处理完。
1.1.3培养基 牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,水1 000 mL、pH 值7.4-7.6。用于细菌的分离和培养。马铃薯葡萄糖培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂15 g、水1 000 mL,pH值自然。用于真菌的培养。121℃灭菌20 min。
1.2方法
1.2.1霍山石斛内生细菌的分离和纯化 霍山石斛植株用自来水冲洗干净,然后流水冲洗 30 min。75%的乙醇表面消毒1 min,无菌水清洗3次,再放入0.1%氯化汞溶液中消毒1-3 min,无菌水冲洗4次,用无菌滤纸吸干。用无菌解剖刀将霍山石斛的根和叶片切成0.5 cm见方的小块,置于牛肉膏蛋白胨培养基上30℃培养。待长出菌落后重新于牛肉膏蛋白胨培养基平板上划线纯化。纯化的细菌接种于牛肉膏蛋白胨培养基斜面上,4℃保存备用。
1.2.2霍山石斛黑斑病拮抗内生菌的筛选 拮抗内生菌的筛选采用对峙培养法,直径6 mm的霍山石斛黑斑病菌接种在直径9 cm的PDA平板一侧,相对的一侧划线接种不同的内生菌株,两接种点相距3-4 cm,病原菌单独接种在PDA平板上做对照,均设3个重复,在25℃条件下培养,当对照快要长满全皿时,测量菌落直径和抑菌带宽度,抑菌活性采用抑制率(%)=[(对照菌落半径-处理菌半径)/对照菌落半径]×100%。
1.2.3拮抗内生菌形态观察与染色 将菌种接种到牛肉膏蛋白胨液体培养基,30℃、150 r/min培养16 h后,革兰氏染色,染色后用光学显微镜观察菌体形态。将液体培养基稀释涂平板,28℃恒温培养5 d,观察菌落形态。
1.2.4拮抗内生菌16S rDNA序列分析 拮抗内生菌RA 16S rDNA序列采用通用引物27F和 1492R[15]进行扩增,PCR产物经纯化后由北京三博远志公司测序。获得的16S rDNA基因序列在 GenBank中进行BLAST比对,用Clustal X软件进行序列相似性分析,采用MEGA 5软件以 Neighbor-joining方法构建系统发育树,用Bootstrap(1 000 次重复)进行检验[16]。
1.2.5拮抗内生菌抗菌谱分析 以梨轮纹病菌、棉花黄萎病菌、白菜黑斑病菌、灰霉病菌、辣椒立枯病菌、香蕉枯萎病菌、稻瘟病菌和禾谷镰孢菌作为供试植物病原菌,研究筛选到的拮抗内生菌的抗菌谱,方法同1.2.2。
1.2.6拮抗内生菌对病原菌菌丝生长影响 在 PDA平板上对峙接种拮抗内生菌和病原菌共同培养,待出现抑菌带后,在抑菌带边缘挑取菌丝,镜检菌丝生长状况。
1.2.7拮抗内生菌抗逆促生潜力的测定
1.2.7.1产 IAA(吲哚乙酸)的检测 拮抗内生菌IAA的产生采用Patten等[11]描述的比色法检测。
1.2.7.2溶磷能力检测 拮抗内生菌接种于解磷检测培养基 Pikovskaya's(PVK)[12],置于 28℃培养2 d。观察菌落周围透明圈大小可判断菌株的磷溶解能力。
1.2.7.3产嗜铁素能力的检测 拮抗内生菌嗜铁素的产生采用CAS检测平板法[13],活性内生菌在28℃培养 3 d 后,观察菌落外围黄色晕圈的大小。由于嗜铁素竞争培养基中的 EDTA 螯合的铁离子,使培养基由蓝色变为黄色,因此菌落周围黄色晕圈的可代表嗜铁素的产生。
1.2.7.4产蛋白酶检测 将拮抗内生菌株接种于脱脂奶粉蛋白酶检测培养基[14],置于28℃培养 2 d。观察菌落周围透明圈大小可判断菌株的蛋白质水解能力。
1.2.7.5拮抗内生菌生物膜成膜情况检测 牛肉膏蛋白胨培养基接种过夜活化后的供试菌株,30℃、150 r/min培养至对数中前期(OD600=1.0)。用新鲜的培养基洗涤离心后的菌体一次,将其重悬于等体积的培养基中。以1%的接种量加入到盛有培养基的小烧杯中,30℃静置培养48 h,观察菌株的成膜情况。
1.2.7.6产表面活性剂的检测 将过夜培养的菌液取20 μL滴到parafilm上,利用液面坍塌法观察表面活性剂的产生,如果液面坍塌,则该菌产生表面活性剂,对照为无菌牛肉膏蛋白胨培养液。
1.2.8拮抗内生菌促生效应研究 挑选颗粒饱满的玉米种子进行表面消毒,75%的乙醇表面消毒1 min,无菌水清洗3次,再放入2%次氯酸钠溶液中消毒10 min,无菌水冲洗4次,用无菌滤纸吸干后置灭菌培养皿中28℃催芽。待种子发芽后,加入浓度为1×108CFU/mL的 RA 菌悬液浸泡 2 h,对照组用同体积的无菌液体培养基代替。然后将其播种至盛有栽培基质(泥炭土∶蛭石=3∶1)的盆中,每盆1株,每组10盆,3次重复。处理后置于25℃的温室中培养。分别于种植后40 d 测量玉米幼苗的生长指标。
1.2.9数据分析 实验数据采用Excel及SPASS13.0软件进行差异显著性分析。
2 结果
2.1霍山石斛黑斑病拮抗菌的筛选
从霍山石斛叶片和根组织块中,根据菌落形态和菌体形态差异,共获得22株代表菌株。对峙培养法对分离到的22株内生菌进行抑菌活性筛选,结果(表1)发现菌株RA对石斛黑斑病菌表现出强烈的抑菌作用,抑菌率均达到70%。
2.2拮抗内生菌RA菌体形态特征
拮抗菌RA在牛肉膏蛋白胨培养基上培养5 d后形成圆形边缘不规则的扁平状菌落,表面有褶皱,乳白色不透明(图1-A),而其在水溶液中培养,有生物膜、沉淀产生,溶液变浑浊(图5-C)。革兰氏染色后经显微镜观察,发现菌株 RA成直杆状,两端钝圆,革兰氏染色后菌体呈紫色,为革兰氏阳性菌(图1-B)。
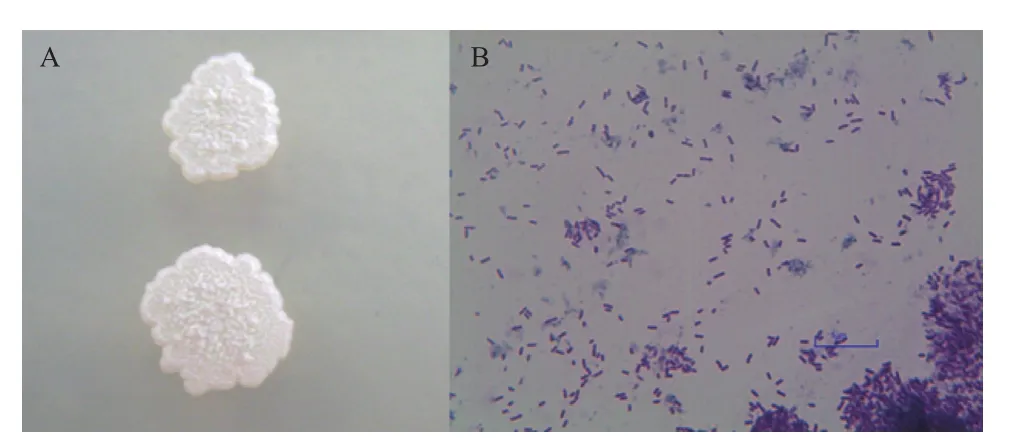
图1 拮抗菌RA菌落形态(A)和革兰氏染色形态(B)(1 000×)
2.3拮抗内生菌RA 16S rDNA的系统发育
将获得的 RA 菌株 16S rDNA 序列用 BLAST 与GenBank 中典型菌株进行比对分析,选择一些与测定序列同源性较高的序列作为参考序列,构建系统发育树。结果(图2)显示,菌株RA属于芽孢杆菌属Bacillus,与甲基营养芽孢杆菌B. methylotrophicus典型菌株EU194897聚为一簇,具有最近的亲缘关系。
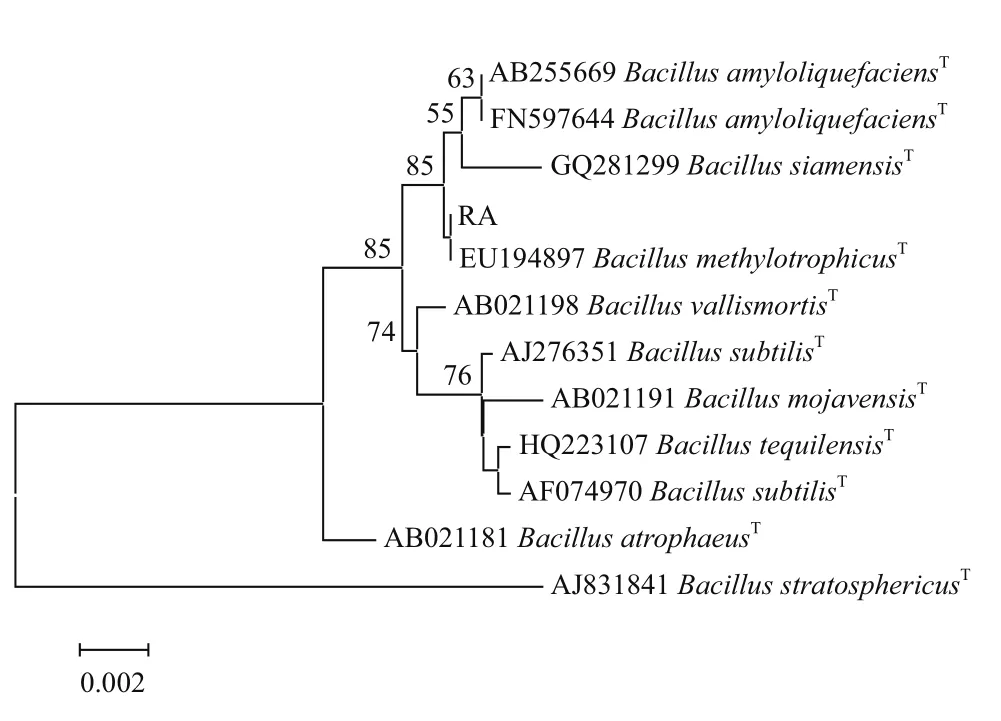
图2 拮抗菌RA的16S rDNA系统发育树
2.4拮抗内生菌RA的抑菌谱
菌株RA对其他8种供试植物病原真菌也表现出不同程度的抑制效果(表1、图3)。表1结果显示,菌株RA对梨轮纹病菌、棉花黄萎病菌、白菜黑斑病菌、灰霉病菌、禾谷镰孢菌、稻瘟病菌具有强烈的抑制作用,其中RA对棉花黄萎病菌和禾谷镰孢菌抑制效果最显著,抑菌率为 80.1%和86.9%。
菌株 RA对辣椒立枯病菌和香蕉枯萎病菌的抑菌能力稍弱,抑菌率为54.8%和63.6%(表1、图3)。菌株RA具有较广谱的抑菌能力,有较大的开发潜力。
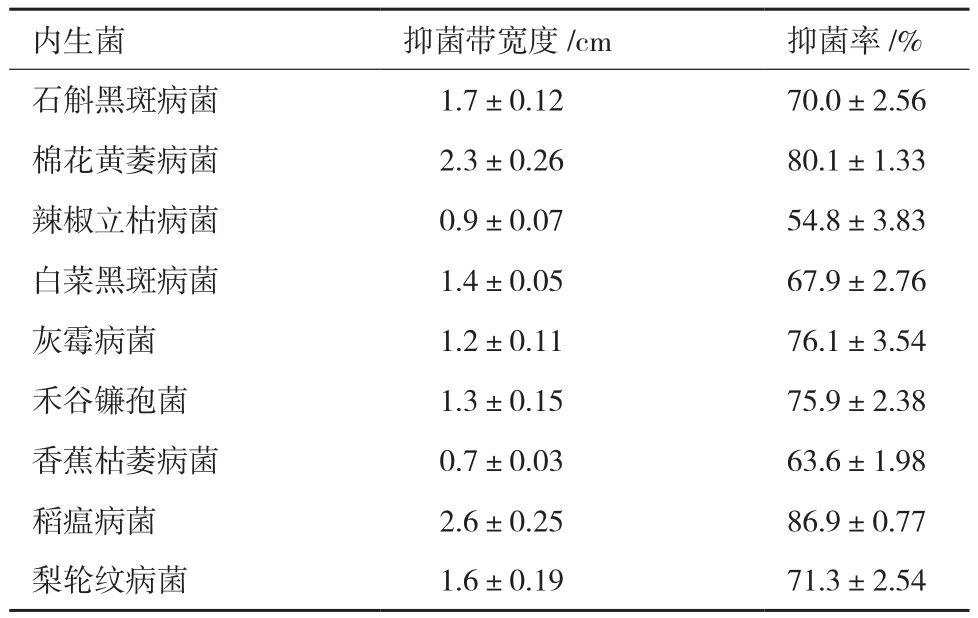
表1 拮抗内生菌RA对不同植物病原菌的抑制结果
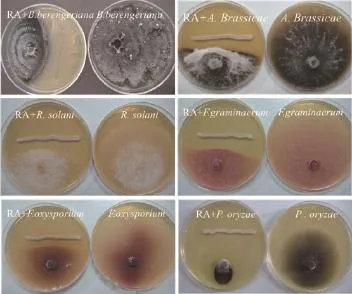
图3 拮抗菌RA对不同植物病原真菌的抑制效果
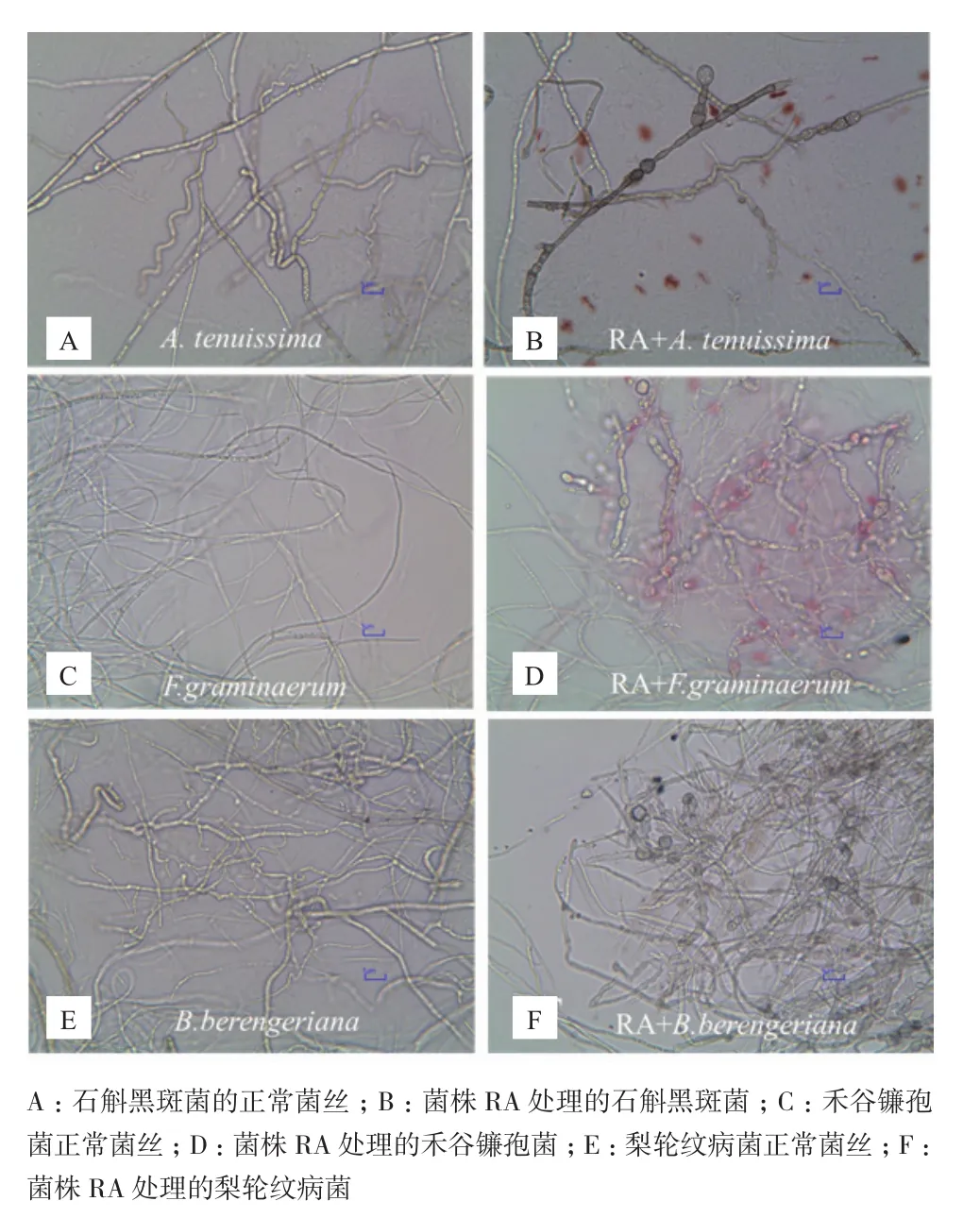
图4 拮抗菌RA处理后的植物病原真菌菌丝形态的变化(400×)
2.5拮抗内生菌RA对病菌菌丝形态的影响
对峙生长实验镜检结果表明,RA作用下病菌菌丝体绝大部分畸变,病原菌丝膨大成串珠状,菌丝开始畸形、扭曲,有的生长菌丝的顶端畸形,形成膨胀泡后破裂,细胞内物质向外泄漏(图4-B、4-D 和4-F),而对照组的病原菌菌丝形态生长正常,菌丝体粗细均匀且表面光滑、生长旺盛(图4-A、4-C、4-E),表明拮抗菌 RA 对病原菌菌丝有明显的破坏作用。
2.6拮抗内生菌RA促生潜力的评价
对拮抗内生菌RA进行抗逆促生潜力的评价,菌株RA无溶磷能力,而具有较强的产嗜铁素、蛋白酶和IAA能力,特别是在培养基中添加了L-色氨酸后,RA菌株IAA产量显著增加(表2,图5-A、5-B)。

表2 拮抗内生菌RA促生长特性
菌株RA在液体培养基中静止培养,形成生物膜;过夜培养的菌悬液表面发生坍塌,说明其具有产生表面活性剂的能力(表2,图5-C、5-D)。
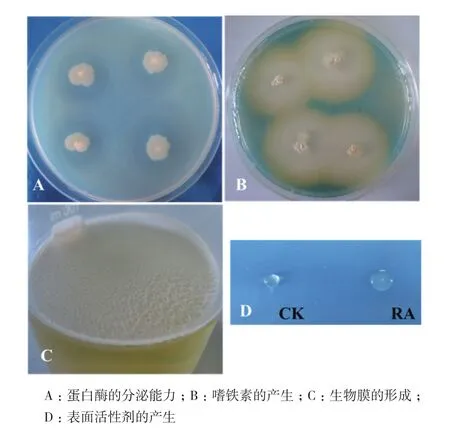
图5 拮抗内生菌RA抗逆促生潜力分析
2.7拮抗内生菌RA对玉米幼苗的促生效应
表3表明,菌株RA 处理可以极其显著增加玉米幼苗的株高和叶片数目,对根长和地上部分干重的促进作用也有显著的作用,但是对根的干重效果不明显。图6显示,用RA处理过的玉米幼苗明显比对照的植株健壮,叶片大,叶色浓绿,对玉米幼苗的促生效果明显;且经RA 处理过的玉米幼苗的平均根长显著高于对照,更有利于植株后期的健康生长。

表3 拮抗内生菌RA对玉米幼苗生长的促进作用

图6 拮抗内生菌RA对玉米幼苗生长的促进作用
3 讨论
内生细菌作为可以产生在药学和农业上具有广泛应用前景的活性物质的新资源,受到全世界研究者的关注[17-19]。具有促进植物生长和拮抗活性的内生菌应用于农业生产,可以减少化学农药和化肥的使用,从而降低环境污染和农产品的农药残留,对于农业生产具有重要的意义。以内生细菌短小芽孢杆菌INR7为主要成分的生防产品已成功的应用于农业生产,可以促进植物的生长和激发植物的系统抗性从而产生抗病性[20]。
本研究获得的石斛内生菌RA属于甲基营养芽胞杆菌,对石斛黑斑病和多种常见植物病原菌具有强烈的拮抗能力,具有广谱抗性,并且可以促进玉米幼苗的生长。赵智灵等[21]在人参中发现一株甲基营养芽孢杆菌B16,对7种人参病原菌均有较强抗性,与本研究结果一致。研究表明,生防菌株由于土壤习居菌的排斥作用而很难定殖并发挥作用[1]。本研究获得的菌株RA具有形成生物膜的能力,因此作为生防菌株应用时,可以利用植物体为微生物提供适宜的黏附表面形成生物膜,从而使之更加适应周围的环境而发挥其作用;同时,植物体也获益于内生菌的这种定殖方式带来的多种生物学效应[22]。
生防细菌通常以直接或间接的机制促进植物的生长[23]。直接机制包括合成生长激素或增强植物的营养状态,如增加矿质营养P、N和Fe的生物可利用度,大多数植物促生菌可产生嗜铁素,嗜铁素对Fe3+有高度的络合能力,大量结合根际或根围土壤中的Fe3+,嗜铁素-Fe3+复合物优先被促生菌利用,植物也可以利用,使包括病原菌在内的其他微生物因缺铁元素而难以繁殖,从而使宿主免遭病菌侵染,并且提供铁元素促进宿主的生长发育[24];促进植物生长的间接机制包括通过竞争铁抑制病原菌的生长,合成抗生素及产生杀菌剂如过氧化氢和细胞壁降解酶等。
本研究中内生菌RA具有合成嗜铁素和蛋白酶的能力,能够通过与病原菌竞争铁营养和降解病菌细胞壁抑制病原菌的生长,对多种植物病原菌具有良好的拮抗能力;且能够合成表面活性剂,表面活性剂具有与去污剂相似的作用机理,通过与病原菌磷脂双层相互作用形成离子通道,破坏膜的结构,导致病原菌细胞内容物的释放而最终引起病原菌的死亡[25]。因此菌株RA能够广谱抑制植物病原菌,可以保护宿主免受病菌侵害从而间接促进宿主的生长发育。
同时,RA可以合成生长激素IAA,且在色氨酸存在的情况下生长激素的产量可以成倍的增加,因此接种植物时,RA菌株可以利用植物体内的色氨酸,合成高浓度的IAA促进植物生长;RA 还可以通过产生嗜铁素螯合土壤中Fe3+,提供给宿主改善其铁营养状态。因此RA可以通过促进生长素的合成和改善植物的矿质营养状态直接促进其生长。
4 结论
从霍山石斛内生菌中筛选获得一株具有抗石斛黑斑病菌的菌株RA,RA具有广谱抗性且对玉米幼苗有显著的促生长作用。经鉴定RA为甲基营养芽孢杆菌。抗逆促生潜能分析表明,RA 可以产生IAA、嗜铁素、蛋白酶、表面活性剂和生物膜,具有良好的拮抗功能和促生功能,具备开发作为环保型生物源农药和生物肥料的条件。
[1]姚革, 张帆, 李舟. 土壤添加剂防治细菌性青枯病初报[J].生物防治通报, 1994, 10(3):106-109.
[2]Hallmann J, Quadt-Hallmann A, Mahaffee WF, et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology, 1997, 43(10):895-914.
[3]Surette MA, Sturz AV, Lada RR, et al. Bacterial endophytes in processing carrots(Daucus carota L. var. sativus):their localization, population density, biodiversity and their effects on plant growth[J]. Plant and Soil, 2003, 253(2):381-390.
[4]Nejad P, Johnson PA. Endophytic bacteria induce growth promotion and wilt disease suppression in oilseed rape and tomato[J]. Biological Control, 2000, 18(3):208-215.
[5]暴增海, 马桂珍, 张拥华, 等. 粘帚霉菌株对大豆促生及菌核病防效的研究[J]. 中国种业, 2007, 4:42-43.
[6]康慧颖, 王伟, 刘佳莉, 等. 两株具促生作用的苜蓿内生菌的分离纯化与鉴定[J]. 微生物学通报, 2015, 42(2):280-288.
[7]陈卓君, 吴毅歆, 毛自朝, 等. 萝卜根内生产酸克雷伯克氏菌的分离鉴定及其促生长作用研究[J]. 西南农业学报, 2014, 27 (4):1645-1648.
[8]周怡, 毛亮, 张婷婷, 等. 大豆内生芽孢杆菌的分离和促生菌株的筛选及鉴定[J]. 大豆科学, 2009, 28(3):502-506.
[9]张敬泽, 郑小军. 铁皮石斛黑斑病病原菌的鉴定和侵染过程的细胞学研究[J]. 植物病理学报, 2004, 34(1):92-94.
[10]张敬泽, 方钰蓉, 张海松, 等. 铁皮石斛黑斑病菌室内药效试验[J]. 植物保护, 2005, 31(1):44-47.
[11]Patten CL, Glick BR. Role of Pseudomonas putida indole-acetic acid in development of the host plant root system[J]. Applied and Environmental Microbiology, 2002, 68(8):3795-3801.
[12]Pikovskaya RE. Solubilization of phosphorus in soil in connection with vital activity of some microbial species[J]. Mikrobiologiya,1948, 17:362-370.
[13]Alexander DB, Zuberer DA. Use of chrome azurol S reagents to evaluate siderophore production by rhizosphere bacteria[J]. Biology and Fertility of Soils, 1991, 12(1):39-45.
[14]Smibert RM, Krieg NR. Phenotypic characterization[M]//Gerhardt P, Murray RGE, Wood WA, Krieg NR. Methods for general and molecular bacteriology. Washington, DC:American Society of Microbiology, 1994:607-654.
[15]Eden PA, Schmidt TM, Blakemore RP, et al. Phylogenetic analysis of Aquaspirillum magnetotacticum using polymerase chain reactionamplified 16S rRNA-specific DNA[J]. International Journal of Systematic Bacteriology, 1991, 41:324-325.
[16]Tamura K, Peterson D, Peterson N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28:2731-2739.
[17]Bhore SJ, Preveena J, Kandasamy KI. Isolation and identification of bacterial endophytes from pharmaceutical agarwood-producing Aquilaria species[J]. Phcog Res, 2013, 5:134-137.
[18]Brader G, Stephane C, Birgit M, et al. Metabolic potential of endophytic bacteria[J]. Curr Opin Biotechnol, 2014, 27:30-37.
[19]Christina A, Christapher V, Bhore SJ. Endophytic bacteria as a source of novel antibiotics:Anoverview[J]. Pharmacog Rev,2013, 7:11-16.
[20]Jeong H, Choi SK, Kloepper JW, Ryu CM. Genome sequence of the plant endophyte Bacillus pumilus INR7, triggering induced systemic resistance in field crops[J]. Genome Announc, 2014, 2 (5):e01093-14.
[21]赵智灵, 刘学周, 魏晓雨, 等. 人参可利用内生菌株的筛选和鉴定[J]. 中草药, 2015, 46(14):2143-2148.
[22]Danhorn T, Fuqua C. Biofilm formation by plant-associated bacteria[J]. Annual Review of Microbiology, 2007, 61:401-422.
[23]Blom D, Fabbri C, Connor EC, et al. Production of plant growth modulating volatiles is widespread among rhizosphere bacteria and strongly depends on culture conditions[J]. Environmental Microbiology, 2011, 13:3047-3058.
[24] Gamalero E, Glick BR. Mechanisms used by plant growth-promoting bacteria[M]//Maheshwari DK. Bacteria in Agrobiology:Plant Nutriente Management. Berlin, Germany:Springer, 2011:17-46.
[25]Heerklotz H. Interactions of surfactants with lipid membranes[J]. Quarterly Reviews of Biophysics, 2008, 41(3-4):205-264.
(责任编辑 马鑫)
Antagonistic Efficacy and Growth-Promoting Effect of Bacillus methylotrophicus Isolated from Dendrobium huoshanense
WU Li-qin GU Hai-ke WANG Qing SHANG Hong-zhong LIU Gui-jun BAO Fang
(Beijing Radiation Center,Beijing 100875)
Isolating endophytic bacteria form Dendrobium huoshanense aimed to obtain endophytic bacteria that have broad-spectrum antimicrobial activity and plant growth-promoting trait. Plate confrontation method was applied to screen the endophytic bacteria with antimicrobial activities against the black spot disease of D. huoshanense,of which the antimicrobial spectrum and plant growth-promoting(PGP)traits were determined. Total 22 endophytes were isolated from D. huoshanense,and strain RA presented strong inhibitory activities against Alternaria tenuissima and it was identified as Bacillus methylotrophicus on the basis of 16S rDNA sequence analysis and was selected for further studies. Strain RA was capable of co-producing IAA,siderophore,protease,biosurfactant,and biofilm,and significantly inhibited 8 plant pathogens and had broad-spectrum antimicrobial effects. A significant improvement in corn seedlings growth was observed when seeds of corn were bacterized prior to sowing. In conclusion,results clearly suggest that strain RA is a potential candidate for use as biocontrol agent and in biofertilizer.
Dendrobium huoshanense;endophyte;Bacillus methylotrophicus;antagonistic efficacy;growth promotion
10.13560/j.cnki.biotech.bull.1985.2016.08.029
2015-11-09
北京市科学技术研究院改革与发展专项基金项目(92201306)
武利勤,女,博士,研究方向:微生物资源;E-mail:wulq@163.com
