花生NBS-LRR类基因的克隆及表达特性分析
2016-09-14冯艳芳耿丽丽韩榕张杰
冯艳芳耿丽丽韩榕张杰
(1. 山西师范大学生命科学学院,临汾 041004;2. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
花生NBS-LRR类基因的克隆及表达特性分析
冯艳芳1,2耿丽丽2韩榕1张杰2
(1. 山西师范大学生命科学学院,临汾 041004;2. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
基于花生转录组及基因组数据,克隆获得一个花生的NBS-LRR类抗逆基因的全长序列,该基因与大豆抗病性蛋白基因(KHN40407.1)的相似性为79%,命名为AhNDrp基因。该基因不含内含子,cDNA 全长2 832 bp,有5个典型的抗逆性蛋白保守结构域,其中DomainⅤ是富含亮氨酸的重复序列。荧光定量PCR分析表明,AhNDrp基因在花生根中特异性表达,且黄曲霉处理后该基因表达量显著上升,说明该基因可能参与抗病反应。
花生;NBS-LRR基因;基因克隆;表达分析
栽培花生(Arachis hypogaea L.)作为一种重要的油料作物和经济作物,具有重要的经济价值和营养价值。2015年我国花生的总产量达1 670万t,居世界首位。但是一些生物及非生物胁迫会影响花生的产量和品质,如干旱、盐碱、低温、寒冷、高温及各种病原菌等外界不良环境会延缓植物的生长发育,降低植物的生产效率,甚至在极端条件下,会导致植物死亡。植物的应激反应是动态的,涉及到不同调节水平之间错综复杂的关系,包括新陈代谢的调节、生理上基因表达的调节和形态上的适应等[1]。使用寄主抗性是控制植物病害最有效、经济的方式[2]。
有研究表明,抗病基因(R基因)在识别和抵御病原菌入侵方面具有重要作用。编码具有核苷酸结合位点(NBS)和C-末端富含亮氨酸重复(LRR)的基因,是R基因中最大一类抗性基因[3]。植物NBS-LRR蛋白(nucleotide-binding site-leucine rich re-peat protein)根据氨基酸末端序列可分为两类,卷曲螺旋(CC)- NBS-LRR类蛋白质和TIR-NBSLRR类蛋白,后一类蛋白在单子叶植物中尚未被鉴别[4,5],而且TIR-NBS-LRR类蛋白可能比CC-NBSLRR型蛋白起源更早[6]。抗逆性反应的识别过程是基于NBS-LRR蛋白介导的直接或间接的识别病理分子——无毒蛋白AVR进行的,而AVR蛋白突变会使抗逆性反应过程中识别异常,从而导致抗性异常。也有研究表明,抗性反应的识别过程是通过NBSLRR蛋白与转录因子的相互作用进行的,Shen 等[7]的研究表明,在大麦中识别白粉病抗性蛋白(Mla10)是通过CC结构域与一个WRKY转录因子结构域的相互作用,进行防御反应。NBS结构域位于NBSLRR型蛋白的中间区域,存在于真核生物具有结合ATP和GTP的许多蛋白质之中,如ATP合成酶β亚基、核糖体延伸子、腺苷酸激酶以及抗病基因编码蛋白等。NBS结构域可以与核苷酸进行结合,LRR结构域在将感知到的病原体激活方面起着至关重要的作用[8-10]。
花生作为豆科植物家族中的一个重要成员,其NBS-LRR类基因在不同胁迫下的功能分析报道尚不多见。本研究以花生抗逆性基因AhNDrp为研究对象,以本课题组此前获得的花生根转录组测序数据为依据[11],从基因注释结果中筛选到contig281453为花生抗逆性蛋白,获得基因的半长序列,利用电子克隆技术获得AhNDrp全长基因,从而分析该基因在花生不同组织部位(根、茎、叶、幼胚)的表达情况以及干旱和黄曲霉胁迫下的表达特性,旨在为花生抗黄曲霉的机理研究提供依据。
1 材料与方法
1.1材料
1.1.1试验材料与处理 供试花生栽培品种白沙1016,由山东省花生研究所提供。花生根、茎、叶取自2周龄的组培苗,幼胚子叶为收集果针入土后25-55 d不同大小的花生荚果,剥皮后混合。所有植物材料取样后于液氮中迅速冷冻,在-80℃冰箱保存。干旱处理:当花生生长至15 d左右时,选择健壮且长势一致的幼苗,用15% PEG6000溶液模拟干旱处理,分别取未处理及处理后2、4、6和8 h的幼苗根,液氮速冻后于-80℃保存,用于总RNA提取和荧光定量PCR分析。试验设3次重复。
黄曲霉处理:花生剥去种皮后种植于温室中,3周后接种黄曲霉孢子。用无菌水收集在PDA培养基上培养2-3 d 的黄曲霉菌孢子,调整孢子浓度为6×108/ mL[12],喷于花生的根部,分别取未处理及处理后 1、3、5和7 d的幼苗根,液氮速冻后,于-80℃保存,用于荧光定量PCR分析。试验设3次重复。
1.1.2酶及主要试剂 Primer Star高保真聚合酶购自TaKaRa公司;2×Taq Mix PCR扩增试剂购自北京博迈得生物技术有限公司;pMD19-T Vector购自TaKaRa公司;DNA Marker DL2000分子量标准购自Promega公司;其他试剂均为国产分析纯产品。PCR产物测序由北京华大生物技术有限公司完成。反转录和荧光定量PCR试剂盒为北京天根公司FastQuant cDNA第一链合成试剂盒和SYBR Green荧光定量试剂盒。
1.1.3PCR 引物 引物的合成由上海生工生物技术有限公司完成,引物序列见表 1。

表 1 本研究所用的基因克隆和real-time的引物序列
1.1.4生物信息学数据库和软件 花生基因组网址(http://peanutbase.org);序列检索采用NCBI blast (http://www.ncbi.nlm.Nih.gcv/blast);蛋白保守结构域分析在(http://www.ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi)进行;三级结构预测在(http://swissmodel. expasy.org/workspace/index.php?func=modelling_ simple1)进行;氨基酸同源性比对分析采用DNAMAN软件;系统发育树构建采用MEGA4.0软件。
1.2方法
1.2.1花生基因组的提取 花生基因组DNA的提取采用改良的CTAB法[13]。将提取基因组放于-20℃储存备用。
1.2.2NBS-LRR类基因全长获得 根据peanutDB上序列,设计引物见序列表 1。以花生栽培品种白沙1016基因组为模板,AhNDrp-f和AhNDrp-r为引物进行PCR扩增。PCR 扩增程序为:94℃ 10 min;94℃ 30 s,50℃ 30 s,72℃ 2 min,30个循环;72℃10 min。取PCR产物电泳,选取目的条带,回收、克隆到 pMD19-T Vector,经 PCR 鉴定正确后进行测序拼接。
1.2.3RNA的提取、cDNA第一链的合成 RNA的提取 采用上海生工生物工程有限公司TRIzol试剂,提取方法参见说明书。TaKaRa公司的DNaseⅠ用于消化残留 DNA,cDNA 第一条链的合成用天根的FastQuant cDNA第一链合成试剂盒。
1.2.4花生AhNDrp的mRNA转录分析 分别提取花生2周龄的根、茎、叶和不同生长时期混合幼胚的总RNA及干旱和黄曲霉接种处理下不同时期的花生根总RNA,反转录成cDNA,进行AhNDrp基因表达特性分析。用天根公司的SYBR Green荧光定量试剂盒检测花生AhNDrp基因的表达量。设actin基因为内部参照,AhNDrp-real-time-f和AhNDrp-realtime-r分别为扩增目的基因的上下游引物。PCR 扩增程序为:95℃ 15 min;95℃ 10 s,60℃ 30 s,40个循环。序列中不包含内含子,编码943个氨基酸,终止密码子为TAG(图2)。

图1 AhNDrp基因的扩增结果

图2 AhNDrp基因的结构示意图
2 结果
2.1AhNDrp全长基因的获得与序列分析
本实验室经转录组测序,获得一条1 970 bp的EST序列(contig281453),在NCBI上进行比对,注释为NBS-LRR型抗逆性蛋白(NBS-LRR type disease resistance protein)。将该序列与http://peanutbase.org网站上公布的花生基因组序列进行比对,根据比对结果设计引物(AhNDrp-f/r),以花生基因组为模板,扩增得到3 200 bp的片段(图1),送测序。在NCBI数据库中进行相似性比较,该蛋白与大豆抗逆性蛋白(Glycine soja disease resistance protein RPM1,GenBank No:KHN40407.1)的相似性最高为79%。将该基因命名为AhNDrp基因,编码区为2 832 bp,GenBank登录号为KU128398。AhNDrp基因DNA序列与cDNA序列比对分析发现,AhNDrp基因DNA
2.2AhNDrp蛋白的生物信息学分析
2.2.1AhNDrp蛋白的保守结构域分析及三维结构预测 使用CDD(conserved domain database)在线数据库进行蛋白功能结构域的预测,发现AhNDrp蛋白有5个典型的抗逆性蛋白保守结构域(图3)。其中DomainⅠ为RX-CC-like结构域,位于2-127区,与抗病反应的必要因素RanGAP2相互作用;DomainⅡ为AAA-ATP酶结构域,由117个氨基酸组成,包含一个P-Loop(NBS结构域中的保守基序)元件;DomainⅤ位于595-804区,由209个氨基酸组成,是富含亮氨酸重复序列,LRR基序可参加蛋白-蛋白互作,在分子识别过程中发挥重要的作用。这3个保守区域说明AhNDrp属于NBS-LRR型抗逆性蛋白。
利用同源建模的分析工具SWISS-MODEL对花生NDrp蛋白结构域进行三维结预测。软件自动选择PDB数据库中的2qkwB作为模板,对目标蛋白的605-879氨基酸进行3-D结构预测,如图4所示,蛋白的胞内结构域是由132个α-螺旋、65个无规则卷曲、52个延伸链和26个β-折叠连接共同构成的复杂结构。

图3 花生AhNDrp蛋白保守结构域预测分析

图4 花生NDrp蛋白的三级结构
2.2.2AhNDrp蛋白同源性分析 将AhNDrp蛋白序列与豆科植物花生、大豆、野生大豆、鹰嘴豆、菜豆(Phaseolus vulgaris,XP_007158209.1)、苜蓿(Medicago truncatula,AF491998.1)和非豆科植物白梨(P.×bretschneideri,XP_009373508.1)、苹果(Malus domestica,XP_008342592.1)、蔷薇科落叶乔木植物梅(Prunus mume,XP_008238133.1)、可可(Theobroma cacao,XP_007040756.1)、川桑(Morus notabilis,XP_010110397.1)的抗逆性蛋白序列进行多重比对,并构建系统发育树(图5)。白沙1016号花生AhNDrp蛋白与白梨和苹果的进化关系最近;苜蓿和菜豆等次之;与鹰嘴豆、梅的进化关系最远。
2.3AhNDrp基因在干旱和黄曲霉处理下的表达特性分析
通过荧光定量PCR方法分析花生品种BS1016 中AhNDrp基因的表达情况,结果(图6-A)显示AhNDrp基因在茎、叶、幼胚中均无表达,仅在根中特异表达。用15% PEG6000溶液模拟干旱胁迫处理,分析0-8 h AhNDrp基因在花生根中的表达量(图6-B),发现随着干旱处理时间的增加AhNDrp基因表达量也逐渐上升,在处理6 h时表达量最高,处理8 h时表达量降低,但该基因在干旱处理下的表达量始终低于未处理时的植株,说明AhNDrp基因无抗干旱能力。用孢子浓度为6×108/mL的黄曲霉处理花生后,0-3 d,AhNDrp基因的表达量处于上升阶段,在3 d达到最高表达量,为对照表达量的1.62倍;之后开始下降,在第7天时表达量降到最低,明显低于对照组及其他处理组(图6-C)。

图5 12种植物抗逆性蛋白的系统发育树
3 讨论
目前花生基因组测序已经取得重要进展,部分基因组已公布(http://peanutbase.org),为花生新基因克隆及基因功能研究等提供了数据平台。本实验室通过对花生根、叶及未成熟种子的转录组深度测序,构建了含3万多条花生EST序列的数据库。本研究结合转录组数据和基因组测序,成功克隆到了花生AhNDrp全长基因,并利用生物信息学方法对该抗逆性蛋白结构和功能进行了预测,为后续探究花生抗逆性基因的表达调控和作用机制提供参考。
有报道指出,NBS-LRR类基因是在进化过程中通过串联或部分复制祖先基因而得到的。NBS结构域包含几个保守基序:P-loop、kinase 2a、kinase 3a 和GLPL motifs等[14];P-loop被证明在ATP结合能力中起到关键作用[10],在烟草[15]和拟南芥[16]PR5中也得到类似结论;kinase-3a激酶可以结合嘌呤或核糖[14],但是NBS结构域在植物抗病性机制中的作用尚不清楚。LRR结构域在蛋白与蛋白之间的相互作用中发挥重要作用,最新研究结果表明LRR蛋白片段足以启动防御信号[17],是识别病原体衍生的效应分子,随后激活宿主防御反应。LRR蛋白的多种结构域使其可以同时作为病原体探测器、传感器、开关和响应因子[18]。这些NBS-LRR类蛋白质在细胞生长、风化、细胞骨架的形成、囊泡运输和防御反应中起重要作用。目前,已从不同植物中克隆得到一些NBS-LRR类基因,例如,何利等[19]从桑树中克隆到5个NBS类基因分别为CL93、Unigene14278、Unigene26173、Unigene32704、Unigene31320的片段;史静东等[20]利用同源序列法分离小麦NBS-LRR类抗病基因类似片段,获得4 个RGAs片段。本研究利用电子克隆的方法,克隆得到的基因全长2 832 bp,命名为AhNDrp基因,含有NBS-LRR类抗病基因典型的保守结构域。
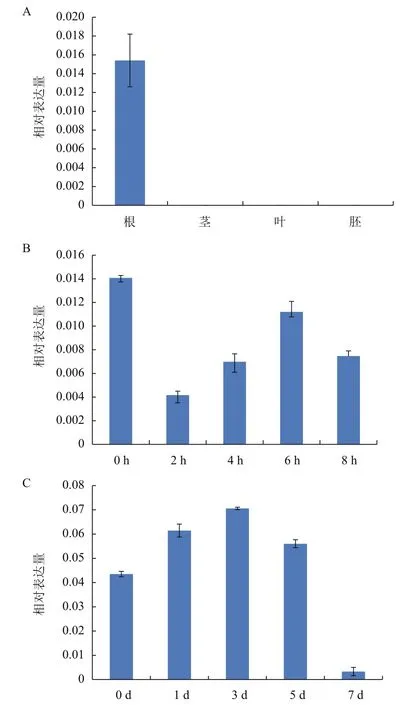
图6 AhNDrp基因口花生根、茎、叶、幼胚(A)及干旱(B)和黄曲霉接种处理下(C)花生根口表达分析
刘建成等[21]从草莓中克隆得到一个NBS-LRR类基因,经半定量 RT-PCR 分析显示,该基因在草莓的所有组织中都表达,但在茎尖分生组织中表达水平最高,且在叶中的表达水平明显受到外源水杨酸和脱落酸处理的影响。本研究中克隆的AhNDrp基因只在花生根部特异性表达,与前期转录组测序结果及半定量RT-PCR的结果一致。赵小波等[22]在花生抗旱品种中克隆到NBS-LRR类PDRl基因,该基因在干旱胁迫处理12 h 后表达量达到峰值。但本研究中,干旱处理后AhNDrp基因的表达量始终低于未处理时的植株,说明该基因的表达产物不参与干旱胁迫的响应,被迫应答干旱胁迫。
刘宇等[23]克隆到花生抗病基因,并测得在黄曲霉侵染后,种皮、籽仁及果皮中基因PnAG3的表达量都上升。而经黄曲霉胁迫后,AhNDrp基因在0-3 d中表达量持续上升,说明该基因可能参与了黄曲霉抗病反应过程。
NBS-LRR类基因是一类抗逆性基因,黄曲霉是一种致病性真菌,而在干旱胁迫下,黄曲霉菌株可能成为土壤中的优势菌株,导致花生黄曲霉毒素污染、品质下降等。所以测定AhNDrp基因在干旱和黄曲霉胁迫下的表达量,为在理想遗传背景下引进高效抗病基因的育种工作提供一定的参考。
4 结论
本研究克隆了花生AhNDrp基因的全长序列,含有NBS-LRR保守结构域,该基因在花生根部特异表达,并根据实时荧光定量PCR结果,推测其可能参与黄曲霉胁迫响应。
[1] Krasensky J, Jonak C. Drought, salt, and temperature stress-induced metabolic rearrangements and regulatory networks[J]. Journal of Experimental Botany, 2012, 63(4):1593-1608.
[2] Hulbert SH, Webb CA, Smith SM, et al. Resistance gene complexes:evolution and utilization[J]. Annual Review of Phytopathology, 2001, 39(4):285-312.
[3] Martin GB, Bogdanove AJ, Sessa G. Understanding the functions of plant disease resistance proteins[J]. Annual Review of Plant Biology, 2003, 54(4):23-61.
[4] Bai J, Pennill LA, Ning J, et al. Diversity in nucleotide binding siteleucine-rich repeat genes in cereals[J]. Genome Research, 2003,12(12):1871-1884.
[5] Meyers BC, Kozik A, Griego A, et al. Genome-wide analysis of NBSLRR-encoding genes in Arabidopsis[J]. Plant Cell Online, 2003,15(4):809-834.
[6] Yue JX, Meyers BC, Chen JQ, et al. Tracing the origin and evolutionary history of plantnucleotide-binding site-leucine-rich repeat(NBS-LRR)genes[J]. New Phytologist, 2011, 193(4):1049-1063.
[7] Shen QH, Saijo Y, Mauch S, et al. Nuclear activity of MLA immune receptors links isolate-specific and basal disease-resistance responses[J]. Science, 2007, 315(5815):1098-1103.
[8] Ooijen GV, Mayr G, Kasiem MMA, et al. Structure function analysis of the NB-ARC domain of plant disease resistance proteins[J]. Journal of Experimental Botany, 2008, 59(6):1383-1397.
[9] Takken FL, Albrecht M, Tameling WI. Resistance proteins:molecular switches of plant defence[J]. Current Opinion in Plant Biology, 2006, 9(4):383-390.
[10] Tameling WIL, Elzinga SDJ, Darmin PS, et al. The tomato R gene products I-2 and MI-1 are functional ATP binding proteins with ATPase activity[J]. Plant Cell, 2002, 14(11):2929-2939.
[11] Geng LL, Duan XH, Liang C, et al. Mining tissue-specific contigs from peanut(Arachis hypogaea L.)for promoter cloning by deep transcriptome sequencing[J]. Plant & cell physiology, 2014, 55 (10):1793-1801.
[12] 梁炫强, 潘瑞炽, 周桂元. 活性氧及膜质过氧化与花生抗黄曲霉侵染的关系[J]. 中国油料作物学报, 2002, 24(4):19-23.
[13] 宋国立, 崔荣霞. 改良CTAB法快速提取棉花DNA[J]. 棉花学报, 1998(5):273-275.
[14] TRAUT, Thomas W. The functions and consensus motifs of nine types of peptide segments that form different types of nucleotidebinding sites[J]. European Journal of Biochemistry, 1994, 222 (1):9-19.
[15] Mestre P, Baulcombe D. Elicitor-mediated oligomerization of the tobacco N disease resistance protein[J]. Plant Cell, 2006, 18(2):491-501.
[16] Ade J, Deyoung BJ, Golstein C, et al. Indirect activation of a plant nucleotide binding site-leucine-rich repeat protein by a bacterial protease[J]. Proceedings of the National Academy of Sciences,2007, 104(7):2531-2536.
[17] Eitas TK, Dangl JL. NB-LRR proteins:pairs, pieces, perception,partners, and pathways[J]. Current Opinion in Plant Biology,2010, 13(4):472-477.
[18] Takken FL, Goverse A. How to build a pathogen detector:structural basis of NB-LRR function[J]. Current Opinion in Plant Biology, 2012, 15(4):375-384.
[19] 何利. 桑树NBS类抗病基因的克隆与表达分析[D]. 镇江:江苏科技大学, 2014.
[20] 王海燕, 杨文香, 刘大群. 小麦NBS-LRR类抗病基因同源序列的分离与鉴定[J]. 中国农业科学, 2006, 39(8):1558-1564.
[21] 刘建成, 段可, 李静, 等. 草莓NBS-LRR家族基因FaNBS1的克隆与表达分析[J]. 果树学报, 2011(6):1025-1031.
[22] 赵小波, 张廷婷, 闫彩霞, 等. 花生中一个NBS-LRR类基因的克隆和表达分析[J]. 山东农业科学, 2015(5):1-5.
[23] 刘宇, 闫彩霞, 张延婷, 等. 花生NBS-LRR类抗病基因的克隆及原核表达[J]. 中国农业科技导报, 2010, 12(3):73-78.
(责任编辑 李楠)
Cloning and Expression Pattern Analysis of NBS-LRR Like-gene in Peanut
FENG Yan-fang1,2GENG Li-li2HAN Rong1ZHANG Jie2
(1. School of Life Sciences,Shanxi Normal University,Linfen 041004;2. State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing 100193)
Based on peanut's transcriptome and genome data,a full length sequence of NBS-LRR like-gene was cloned. This gene,which showed 79% similarity with disease resistance protein(KHN40407.1)of Glycine soja,was designated as AhNDrp gene. The length of cDNA of AhNDrp gene was 2 832 bp,and contained no intron. AhNDrp gene harbored 5 typical conserved domains with resistance-related protein,and Domain V was repeat sequence with rich leucine. Real-time quantitative PCR analysis showed that AhNDrp gene was expressed exclusively in root,and the expression was significantly increased after aflatoxin treatment,indicating that this gene was involved in the resistance response.
peanut;NBS-LRR gene;gene clone;expression analysis
10.13560/j.cnki.biotech.bull.1985.2016.08.014
2015-12-24
国家自然科学基金青年基金项目(31501711)
冯艳芳,女,硕士,研究方向:抗虫植物基因工程;E-mail:yanfang1369@163.com
韩榕,男,博士,教授,研究方向:环境植物学;E-mail:hhwrsl@163.com张杰,男,博士,研究员,研究方向:生防微生物功能基因;E-mail:jzhang@ippcaas.cn
