固载ClO2保鲜剂对米良猕猴桃腐败菌的抑菌活性
2016-09-14龙明秀谭书明贵州省现代农业发展研究所贵州贵阳550006贵州省生物技术研究所贵州贵阳550006遵义医药高等专科学校贵州遵义56006贵州大学生命科学学院贵州贵阳55005
龙明秀,王 辉,蒋 纬,谭书明(.贵州省现代农业发展研究所,贵州贵阳550006;.贵州省生物技术研究所,贵州贵阳550006;.遵义医药高等专科学校,贵州遵义56006;4.贵州大学生命科学学院,贵州贵阳55005)
固载ClO2保鲜剂对米良猕猴桃腐败菌的抑菌活性
龙明秀1,王辉2,蒋纬3,谭书明4,*
(1.贵州省现代农业发展研究所,贵州贵阳550006;2.贵州省生物技术研究所,贵州贵阳550006;3.遵义医药高等专科学校,贵州遵义563006;4.贵州大学生命科学学院,贵州贵阳550025)
为考察固载ClO2保鲜剂对米良猕猴桃腐败菌的抑菌效果,通过PDA平板培养法从米良猕猴桃病害组织中分离腐败菌,运用有伤和无伤接种法筛选最强致病力菌株,经形态学及分子生物学鉴定菌株,采用菌丝生长速率测定法考察固载ClO2保鲜剂对最强致病力菌株的抑菌效果。结果显示,从米良猕猴桃病害组织中分离出的7种腐败菌中,有3种致病力最强的菌株,经鉴定分别为漆斑菌属(Myrothecium sp.)、茎点菌属(Phoma sp.)和交链孢霉属(Alternaria sp.);常温下固载ClO2保鲜剂对3株菌株均有抑制作用,但都不能完全抑制菌种的生长,抑制活性交链孢霉属>漆斑菌属>茎点菌属;2℃下固载ClO2保鲜剂几乎能使3株菌株完全受到抑制。结果表明,固载ClO2对米良猕猴桃腐败菌有较好的抑菌效果,可以作为米良猕猴桃的保鲜剂用于降低腐败率。
固载二氧化氯,保鲜剂,猕猴桃,腐败菌,抑菌活性
猕猴桃营养丰富,极易软化腐烂,霉菌侵染是造成猕猴桃贮运期间果实大量腐烂变质的重要原由之一,发病率在20%~50%左右[1-3]。国内外学者对猕猴桃腐败菌做了大量研究。目前从猕猴桃中分离的腐败菌主要有Bortytis cinerea,Penicillium sp.[1],Botryosphaeria sp.[4],Phomopsis sp.[1,4-6]和Diaportheactinidiae等[7]属真菌,并认为病原菌主要是通过机械损伤侵染才导致腐烂。其中,大多数研究均表明Phomopsis sp.是猕猴桃贮藏期最主要的病原菌,且只有机械损伤的猕猴桃才会被Phomopsis sp.浸染[6]。因此,减少猕猴桃贮藏期霉菌的侵染是减少猕猴桃采后损失的有效途径之一。
ClO2具有高效杀菌和防霉保鲜的作用[8-10],杀菌消毒能力强,对人及动物无毒,不产生致癌、致突、致畸物质[11]。近年来,有关ClO2对猕猴桃的防腐保鲜应用进行了大量的研究。结果显示,固载ClO2不但对几种常见菌具有较好的杀菌效果,能有效降低猕猴桃的腐败率[12],而且能明显降低机械损伤猕猴桃的呼吸速率、乙烯释放速率及腐烂率[13]。采前ClO2处理能有效杀灭猕猴桃表面的有害微生物[14],CaCl2与ClO2对猕猴桃的保鲜有协同作用,其复合浸泡液能有效降低猕猴桃的腐烂率[15]。
贵州是我国猕猴桃的主产区之一,而米良是贵州主栽品种之一。本实验从腐烂的米良猕猴桃中分离、纯化得到猕猴桃致病菌,然后通过形态观察并结合分子鉴定,确定猕猴桃致病菌的种类,并研究固载ClO2保鲜剂对猕猴桃致病菌的抑菌作用,旨在为米良猕猴桃的防腐保鲜提供理论依据。
1 材料与方法
1.1材料与仪器
供分离的腐烂猕猴桃收集于修文县猕猴桃基地;固载ClO2保鲜剂自制[16]。
SPX-150B-Z型生化培养箱上海博讯实业有限公司医疗设备厂;数码生物显微镜上海精科天美科学仪器有限公司
1.2实验方法
1.2.1腐败菌的分离与纯化用0.1%升汞对猕猴桃的腐烂表面消毒,切取腐烂部位接种到PDA平板培养基上,在28℃下培养3~5 d,观察菌落形态,挑取不同形态菌丝植入另一PDA培养基内培养;重复上述操作直至得到纯化菌种,4℃保存备用[17-18]。
1.2.2致病力的测定将纯化后的腐败菌对猕猴桃进行有伤和无伤接种[19-22]。10 d左右观察病斑的侵染状况和发展程度,判断腐败菌致病能力的大小,选择致病力最强的3株进行菌属鉴定,并作为抑菌实验供试菌。1.2.3腐败菌属的鉴定
1.2.3.1形态学鉴定用苯酚-乳酸染液染色,然后进行镜检,观察记录菌落形态特征(包括菌体大小、形状、表面特征等),记录孢子大小、形状、类型等,并依据《真菌鉴定手册》确定菌属[23]。
1.2.3.2致病菌的ITS序列测定由南京金斯瑞生物科技有限公司进行DNA测序,并通过GenBank数据库进行同源性比对[24-25]。
1.2.4固载ClO2保鲜剂的制备按m亚氯酸钠∶m酒石酸∶m氯化钙∶m活性炭=6∶2∶1∶2比例分别称取3 g亚氯酸钠,1 g酒石酸,0.5 g氯化钙,1 g活性炭,然后将各试剂均匀混合于10 mL小烧杯中,固载ClO2保鲜剂需现配现用,每份配制5.5 g[16]。
1.2.5固载ClO2保鲜剂对猕猴桃致病菌抑菌活性测定采用菌丝生长速率法。将菌种在PDA上活化(25℃培养72 h)后,用无菌打孔器在菌种边缘打出7 cm菌饼,然后将菌饼接于另一PDA平板中央。在相同体积的无菌干燥器中加入5 mL无菌水,放入固载ClO2保鲜剂,并做对照。再将含猕猴桃腐败菌的PDA培养基放入干燥器中,分别在常温和2℃下观察记录菌落直径变化,用十字交叉法测量菌落直径[26-28],实验重复5次。
2 结果与分析
2.1猕猴桃腐败菌的分离与致腐性鉴定
在28℃下,对从猕猴桃病害组织中分离出的7种腐败菌分别进行有伤和无伤接种,通过腐败菌对猕猴桃致腐性的测定(结果见表1),筛选出致腐性最强的3株进行菌属鉴定,并作为供试菌种。

表1 7种腐败菌对猕猴桃的致病力(10 d)Table 1 Pathogenicity of seven pathogens on kiwifruit(10 d)
表1显示,7种腐败菌的有伤接种皆有不同程度的感染,编号为A、C、D的3株菌种致病性最强,而无伤接种均未出现感染,说明7种腐败菌都只能通过伤口浸染。研究表明,伤口侵染是大部分霉菌侵入猕猴桃果实的主要途径[6,29-31],而猕猴桃在采收、分级、储存、包装、运输和销售等环节均容易造成机械损伤,大大增加了霉菌浸染的机会,以至于霉菌发病率高达30%~50%[1-3]。
2.2猕猴桃优势致病菌鉴定结果
结合形态学和分子生物学[32]鉴定了3株致病力较强的腐败菌分别为:漆斑菌属(Myrothecium sp.)、茎点菌属(Phoma sp.)和交链孢霉属(Alternaria sp.)。
2.2.1漆斑菌属(Myrothecium sp.)的鉴定菌种A 在PDA培养基上的菌落形态和显微镜下的图片如图1所示。PDA培养基上菌落生长有一定的局限性,菌落正背面均为雪白色,菌丝短而密,边缘不褪色。显微镜下菌丝有隔膜,分生孢子外生,呈堆垫状,颜色有深有浅,无隔膜,不串生,分生孢子座有向外伸出的菌丝,分生孢子梗几乎无色。测定显示基因序列长度为572 bp,与GenBank同源性比对相似度为99%,所以确定该菌株为漆斑菌属(Myrothecium sp.),且GenBank登录号为AB472083.1。

2.2.2茎点菌属(Phoma sp.)的鉴定菌种C在PDA培养基上菌落形态和显微镜下的图片如图2所示。菌种C在PDA上生长较快,菌落呈絮状生长,随着菌落的扩大,从中心开始出现粉红色轮纹,并逐渐向外扩展,渐次转变为红褐色,背面为褐色至黑色,有轮纹,表面有水珠。显微镜下观察到菌丝有隔膜,分生孢子梗短或几乎没有,分支或不分支,分生孢子器密集,呈球形或锥形,分生孢子很小,透明,圆形或椭圆形。测定显示基因序列长度为527 bp,与GenBank同源性比对相似度为99%,所以确定该菌株为茎点菌(Phoma sp.),且GenBank登录号为HQ630963.1。
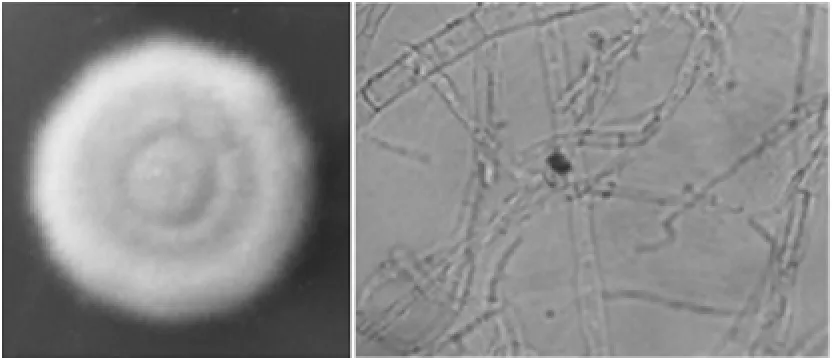
图2 茎点菌属在PDA平板上的菌落形态及其菌丝和孢子梗形态Fig.2 Colony morphology of Phoma sp.on PDA and it’s hyphal and conidiophore morphology
2.2.3交链孢霉属(Alternaria sp.)的鉴定菌种D在PDA培养基上菌落形态和显微镜下的图片如图3所示。菌种D在PDA培养基上菌落生长迅速,棉絮状,开始为浅灰色,后变为暗绿色,背面为褐色至黑色,表面生长疏松的浅灰色棉花状气生菌丝。在显微镜下观察到棕色分隔菌丝,分生孢子梗自菌丝发出,直立,不分枝,与营养菌丝区别不大。分生孢子顶生,呈暗色,椭圆形或卵形,纵横分隔呈壁砖状,较少单生,常有数个成链的同节孢子。测定显示基因序列长度为552 bp,与GenBank同源性比对相似度为100%,所以确定该菌株为交链孢霉属(Alternaria sp.),且GenBank登录号为JN867466.1。

图3 交链孢霉属在PDA平板上的菌落形态及其菌丝和孢子梗形态Fig.3 Colony morphology of Alternaria sp.on PDA and it’shyphal and conidiophore morphology
目前,鉴定的猕猴桃病原菌有Cryptosporiopsis、Cylindrocarpon、Phomopsis、Phoma、Botrytis和Altemaria等属真菌[1,6,30]。本研究结果与前人研究结果较为一致。Phoma和Altemaria是造成猕猴桃腐烂的常见病原菌。永田贤嗣[33]认为大茎点菌属(Macrophoma)真菌是日本猕猴桃软腐症主要病原菌。Bisiach等[34]也从猕猴桃上分离出了Phoma和Altemaria等病原菌。交链孢霉属(Alternaria sp.)是许多果蔬褐斑病的病原菌,具有很强的潜伏侵染能力,是造成江西奉新县猕猴桃[31]、四川“红阳”[35]、陕西省周至“华优”、“海沃德”、“秦美”[36]、“中华”[37-38]等猕猴桃果实溃疡病、褐斑病等的主要病原菌之一。Myrothecium sp.可引起番茄[39]、辣椒[40]、茄子[41]等果实的腐烂,而在猕猴桃上还未见报道。
2.3固载ClO2保鲜剂对米良猕猴桃致腐菌的抑菌活性
2.3.1固载ClO2保鲜剂对漆斑菌的抑菌活性如图4所示,常温下对照组漆斑菌生长迅速,处理组生长速率较对照组显著降低,说明常温下固载ClO2保鲜剂对漆斑菌有较好的抑制作用,但不能完全抑制其生长。处理组与对照组差异极显著(p<0.01)。2℃时对照组生长非常缓慢,处理组生长几乎完全受到抑制,说明2℃时固载ClO2保鲜剂能够完全抑制漆斑菌的生长。
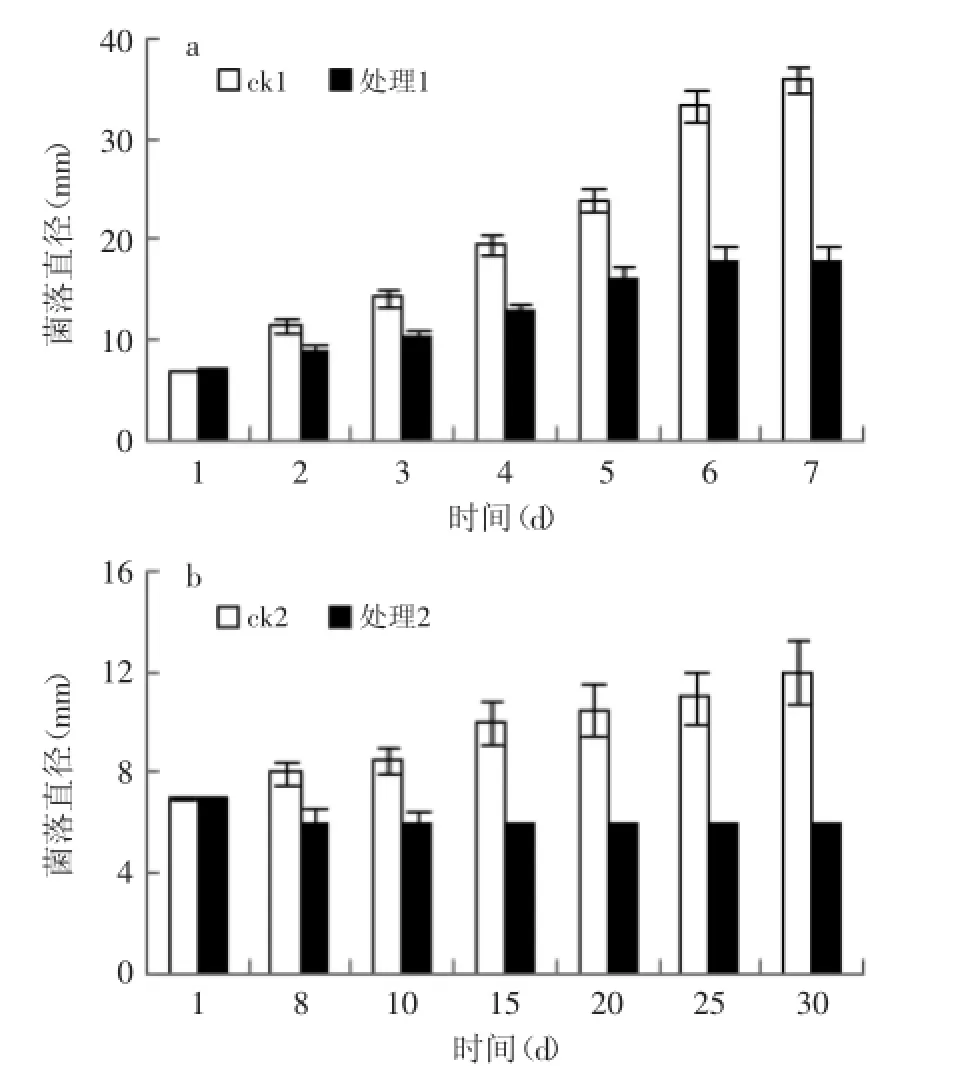
图4 常温(a)及2℃(b)下固载ClO2保鲜剂对漆斑菌的抑菌活性Fig.4 The bacteriostatic effect of solid ClO2preservative on Myrothecium sp.under the normal temperature(a)and 2℃(b)
2.3.2固载ClO2保鲜剂对茎点菌的抑菌效果如图5所示,常温下固载ClO2保鲜剂对茎点菌有一定的抑制作用,但也不能完全抑制其生长,处理组与对照组差异极显著(p<0.01)。2℃下对照组菌落前10 d生长很缓慢,10 d后菌落直径开始逐渐扩大,生长迅速,而处理组菌落直径不随时间扩大,并且出现菌丝层变薄的现象,菌落直径稍有萎缩,茎点菌的生长几乎完全受到抑制。
2.3.3固载ClO2保鲜剂对交链孢霉的抑菌效果如图6所示,常温下交链孢霉处理组第5 d时菌落直径基本不再扩大,说明ClO2对该菌有很强的抑制作用。处理组与对照组差异极显著(p<0.01)。2℃时对照组菌落生长随时间变化逐渐加快,而处理组菌落直径只扩大了0.5~1 mm左右,并且也出现菌丝层变薄的现象,生长几乎完全受到抑制。
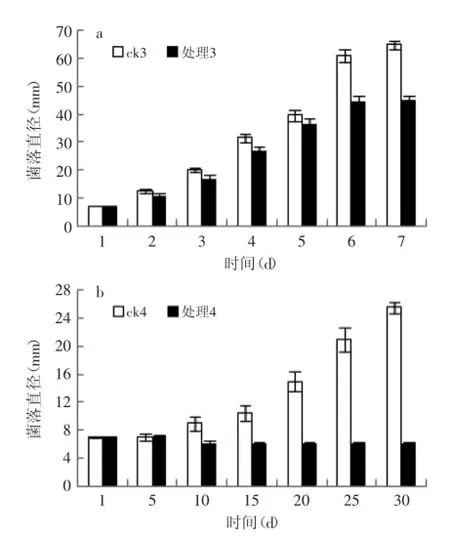
图5 常温(a)及2℃(b)下固载ClO2保鲜剂对茎点菌的抑菌活性Fig.5 Thebacteriostaticeffectofsolidchlorinedioxidepreservative on Phoma sp.under the normal temperature(a)and 2℃(b)
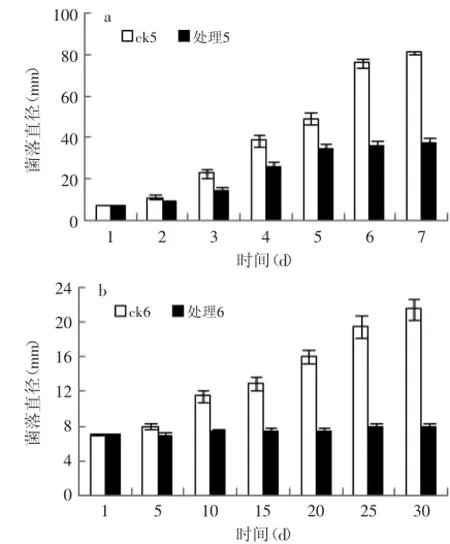
图6 常温(a)及2℃(b)下固载ClO2保鲜剂对交链孢霉的抑菌效果Fig.6 The bacteriostatic effect of solid chlorine dioxide preservative on Alternaria sp.under the normal temperature(a)and 2℃(b)
3 结论
从贵州省修文县米良猕猴桃病害组织中分离出3株腐败菌。通过形态学并结合分子生物学鉴定为漆孢霉属(Myrothecium sp.)、茎点菌属(Phoma sp.)和交链孢霉属(Alternaria sp.),且3株腐败菌均只能通过伤口浸染果实。说明减少猕猴桃采收、分级、包装、运输过程中的机械损伤能有效减少腐败菌的浸染,从而减少产后损失。本研究分离的病原菌Phoma sp.和Altemaria sp.与前人研究结果较为一致,而Myrothecium sp.可引起猕猴桃果实腐烂还未见报道,有待进一步研究。
固载ClO2保鲜剂通过持续释放低浓度ClO2起到杀菌抑菌的作用。常温下对3株菌株有明显的抑制作用,但不能完全抑制菌种的生长。抑制作用交链孢霉属>漆孢霉属>茎点菌属。2℃下固载ClO2保鲜剂几乎能使3株菌株完全受到抑制。说明固载ClO2保鲜剂在低温下的杀菌力更强,冷藏结合固载ClO2保鲜剂的使用将大大降低猕猴桃腐败率。
[1]丁爱冬,于梁,石蕴莲,等.猕猴桃采后病害鉴定和侵染规律研究[J].植物病理学报,1993,25(2):149-153.
[2]王瑞玲.红阳猕猴桃采后病害生理及臭氧保鲜技术研究[D].雅安:四川农业大学,2010.
[3]王晶.四川猕猴桃软腐病病菌的鉴定、遗传多样性及浸染果实后的生理变化研究[D].雅安:四川农业大学,2013.
[4]余桂萍,周洪旗.猕猴桃软腐病的发生规律与防治初探[J].资源开发与市场,2009,25(5):392-393.
[5]姜景魁,张绍升,廖廷武,等.猕猴桃黄腐病的研究[J].中国果蔬,2007(6):14-16.
[6]LUONGO L,SANTORI A,RICCIONI L,et al.Phomopsis sp. Associated with post-harvest fruit rot of kiwifruit in Italy[J]. Journal of Plant Pathology,2011,93(1):205-209.
[7]YOUNG Jin Koh,JAE Seoun Hu,JAE Sung Jung.Postharvest fruit rots of kiwifruit(Actinidia deliciosa)in Korea[J].New Zealand Journal of Crop and Horticultural Science,2005,33(3):303-310.
[8]DU J,HAN Y,LINTON R H.Efficacy of chlorine dioxide gas in reducing Escherichia coli O157∶H7 on apple surfaces[J].Food Microbiology,2003,20(5):583-591.
[9]FU M R,DU J H.The application of chlorine dioxide in food fresh-keeping[J].Food and Fermentation Industries,2004,20 (8):113-116.
[10]李忠铭,周大军.固载二氧化氯的杀菌特性及其应用研究[J].应用化工,2006,35(7):520-525.
[11]王双飞,黄丽婕.二氧化氯制备与应用[M].北京:中国轻工业出版社,2010.
[12]申艳敏,周大军.固载二氧化氯的释放特性及杀菌实验研究[J].河南化工,2003(11):23-25.
[13]田红炎,饶景萍.二氧化氯处理对机械损伤猕猴桃果实的防腐保鲜效果[J].食品科学,2012,33(18):298-302.
[14]田红炎,祝庆刚,饶景萍.采前二氧化氯处理对‘海沃德’猕猴桃的防腐保鲜效果[J].植物生理学报,2011,47(12):1167-1172.
[15]桂海龙.ClO2结合CaCl2处理对秦美猕猴桃冷藏品质的影响[D].杨凌:陕西西北农林科技大学,2014.
[16]龙明秀,谭书明.固载二氧化氯猕猴桃保鲜剂的研制及其应用[J].贵州农业科学,2013,41(4):130-133.
[17]王雅,樊明涛,赵萍,等.苹果中霉菌的分离与初步鉴定[J].食品工业科技,2009,30(10):164-166.
[18]张瑾,徐秉良,梁巧兰,等.杏采后病害病原菌鉴定及室内药剂筛选[J].植物学报,2011,37(5):118-123.
[19]李金花,王蒂,柴兆祥,等.甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J].植物病理学报,2011,41(5):456-463.
[20]赵淑艳,李喜宏,陈丽,等.桃采后病原菌种类及侵染规律研究[J].食品科学,2005,26(10):253-255.
[21]王卫芳,胡佳,赵立荣,等.进境美国苹果星裂壳孢果腐病菌的首次截获:病原真菌的鉴定及风险分析[J].植物病理学报,2011,41(3):232-239.
[22]严玉宁,何红,叶艺俊,等.香蕉叶鞘腐败病病原鉴定[J].植物病理学报,2007,41(2):124-130.
[23]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社出版,1979.
[24]段爱莉,高贵田,孙翔宇.贮藏“海沃德”猕猴桃中霉菌的分子鉴定及生物学特性的研究[J].食品工业科技,2012,33(10):321-325.
[25]HOYOSCL,ORDUZS,BISSETTJetal.Geneticandmetabolic biodiversity of Trichoderma from Colombia and adjacent neotropic regions[J].Fungal Genetics and Biology,2009,46(9):615-631.
[26]郭芹,吴斌,肖文龙,等.缓释型固体ClO2保鲜剂的制备与应用[J].食品科学,2010,31(18):441-444.
[27]李诚,蒋军喜,冷建华,等.6种杀菌剂对猕猴桃主要腐烂病菌的室内毒力测定[J].中国南方果树,2012,41(1):27-29.
[28]李诚,邱新兰,蒋军喜.吡唑醚菌酯等8种杀菌剂对猕猴桃果梗干枯病菌的室内毒力测定[J].中国南方果树,2014,42 (4):89-90.
[29]LEE J G,LEE D H,PARK S Y.First Report of Diaporthe actinidiae,the Causal Organism of Stemend Rot of Kiwifruit in Korea[J].Plant Pathology Journal,2001,17(2):110-113.
[30]MANNING M A,MEIER X,OLSEN T L.Fungi associated with fruit rots of Actinidia chinensis‘Hort16A’in New Zealand [J].New Zealand Journal of Crop and Horticultural Science,2003,31(4):315-324.
[31]李诚,蒋军喜,冷建华.奉新县猕猴桃果实腐烂病病原菌分离鉴定[J].江西农业大学学报,2012,34(2):259-263.
[32]汪昭贤.兽医真菌学[M].咸阳:西北农林科技大学出版社,2005:265.
[33]永田贤嗣.猕猴桃果实的软腐病[J].农业与园艺(日),1982,57(12):33-34.
[34]BISIACH M,MINERVINI G,VERCESI A.Biological and Epidemiology Aspects of the Kiwi Fruit(Actinidia Chinensis Planchon)Rot,Caused by Botrytis Cinerea Pers[J].Rivista di Patologia Vegetale,1984,20(2):38-55.
[35]YAN Jinyi,CUI Yongliang,DING Jian.Isolation and Identification of the Causal Pathogens for Kiwifruit Bacterial Canker and the Isolation of the Antagonistic Endophytic Fungi From Kiwifruit in Sichuan,China[J].Journal of Agricultural Science,2013,7(5):262-269.
[36]段爱莉,雷玉山,孙翔宇,等.猕猴桃果实贮藏期主要真菌病害的rDNA-ITS鉴定及序列分析[J].中国农业科学,2013,46 (4):810-818.
[37]赵金梅,高贵田,谷留杰,等.中华猕猴桃褐斑病病原鉴定及抑菌药剂筛选[J].中国农业科学,2013,46(23):4916-4925.
[38]林英任,郭英兰,方正舟,等.中华猕猴桃病害及其防治[J].中国林副特产,1995,32(1):13-15.
[39]TANDON R N,SRIVASTAVA M P.Myrothecium rot of tomato[J].Current Science,1963,32(9):426-427.
[40]梁力哲.辣椒种生漆斑菌的种子带菌和致病性及对光温的反应[J].华北农学报,1989,4(3):94-98.
[41]李宝聚,赵彦杰.李宝聚博士诊病手记(十五)茄子漆斑病病原鉴定[J].中国蔬菜,2009(15):20-21.
Antimicrobial activity of solid ClO2preservative on miliang kiwifruit pathogenic fungi
LONG Ming-xiu1,WANG Hui2,JIANG Wei3,TAN Shu-ming4,*
(1.Guizhou Institute of Integrated Agriculture Development,Guiyang 550006,China;2.Guizhou Institute of Biotechnology,Guiyang 550006,China;
3.Zunyi Medical and Phamaceutical College,Zunyi 563006,China;4.College of Life Sciences,Guizhou University,Guiyang 550025,China)
In order to investigated antimicrobial activity of solid chlorine dioxide preservative on miliang kiwifruit,pathogenic fungi were isolated from diseased tissue by PDA plate.Using injury and no injury inoculation to screening strongest virulence strains.Morphological and molecular way were used to identify strains.The antimicrobial activity of solid ClO2preservative on the most virulent strains was investigated by using the method of mycelium growth rate.Research had revealed that seven pathogen strains were parted from rotten miliang kiwifruit.Three of them were deemed as the most virulent strains and identified as Myrothecium sp.,Phoma sp. and Alternaria sp.All three strains were inhibited by solid ClO2preservative under room temperature but couldn’t completely inhibit their growth.The sequence of inhibition was Alternaria sp.,Myrothecium sp.and Phoma sp.The three strains were almost inhibited by solid ClO2preservative under 2℃.Solid ClO2spoilage of miliang kiwifruit had a good antibacterial effect.It can be used as a preservative for reducing the rate of corruption.
solid ClO2;preservative;kiwifruit;pathogenic fungi;antimicrobial activity
TS255.3
A
1002-0306(2016)04-0342-05
10.13386/j.issn1002-0306.2016.04.060
2015-06-10
龙明秀(1989-),女,研究实习员,主要从事食品贮藏与加工方面的研究,E-mail:692825923@qq.com。
谭书明(1964-),男,教授,主要从事农产品加工与贮藏方面的研究,E-mail:tshuming2003@yahoo.com。
黔科合NY[(2014)3011];黔科合人才团队(2012)4019;黔科合院所创能[2012(4002)];黔科合条X[2014]4001号。
