响应面法优化白果蛋白质提取工艺
2016-09-14张秀云李丹丹马艳芳莱芜职业技术学院信息工程系山东莱芜700菏泽市食品药品监督管理局山东菏泽74000山东农业大学生命科学学院山东泰安708
张秀云,李丹丹,马艳芳(.莱芜职业技术学院信息工程系,山东莱芜700;.菏泽市食品药品监督管理局,山东菏泽74000;.山东农业大学生命科学学院,山东泰安708)
响应面法优化白果蛋白质提取工艺
张秀云1,李丹丹2,马艳芳3
(1.莱芜职业技术学院信息工程系,山东莱芜271100;2.菏泽市食品药品监督管理局,山东菏泽274000;3.山东农业大学生命科学学院,山东泰安271018)
以白果为原料,在单因素实验的基础上采用响应面分析法研究白果蛋白质的提取工艺,考察提取液浓度、pH、料液比及提取时间对白果蛋白质提取率的影响。结果表明白果提取蛋白质的最适条件为:提取液浓度0.16 mol/L,pH8.7,料液比1∶26,提取时间5 h,此条件下,白果蛋白质的提取率为82.76%,与理论预测值83.01%相比,其相对误差为0.30%,说明优化得出的回归模型具有一定的实际指导意义。
白果蛋白质,提取,响应面法
白果,又名银杏,是银杏的种仁,具有可食性[1]。研究表明,白果内营养成分丰富,主要有淀粉、蛋白质、脂肪、维生素、尼克酸以及钾、钙、镁等多种微量元素等[2]。此外银杏酸、白果酚、胆固醇等功效成分亦成为白果的一大研究热点[3]。因此,白果广泛应用于食品、药品、保健品、化妆品等领域。
白果中含有8%~13%的蛋白质,因地域不同含量有所差异。研究显示,作为一种新型的植物蛋白,白果蛋白质氨基酸组成丰富合理,属于优质蛋白质,并具有良好的抗氧化和延缓衰老的作用[4-5]。此外,白果蛋白对食品的加工性能、营养和口感有一定的影响,其持油性、持水性和起泡性奠定了其在食品领域的应用基础[6]。但现今对白果蛋白的研究尚处于一个初步探索阶段,对其实际应用方面的研究还很匮乏。因此,提取白果蛋白质并进行深入研究对扩大其应用范围、充分发挥其生物功效有重要意义。目前对白果蛋白质的提取多采用传统提取法和正交优化实验,但是提取率不是很高[7-8]。因此为了获得高提取率的白果蛋白和充分利用原料,本文采用响应面分析法对白果蛋白质的提取工艺进行优化,得到白果蛋白质的最佳提取条件,为今后白果蛋白的大规模生产和其产品的深加工提供了可行性依据,对白果的综合利用及新产品开发提供基础研究资料。
1 材料与方法
1.1材料与仪器
白果郯城县汇丰食品有限责任公司;牛血清蛋白质南京三生生物技术有限公司;考马斯亮蓝G250上海绿鸟科技发展公司;氯化钠、三羟甲基氨基甲烷、盐酸、无水乙醇、氢氧化钠、磷酸、石油醚(均为分析纯) 天津市博迪化工有限公司。
K9860全自动凯氏定氮仪济南海能仪器有限公司;MP511 pH计上海精密仪器;TU180紫外可见分光光度计北京普析通用仪器有限公司;台式高速离心机上海卢湘仪器有限公司;高速组织粉碎机金坛市万华实验仪器厂。
1.2实验方法
1.2.1白果蛋白提取工艺流程白果→脱种皮和胚芽→干燥(60℃)→粉碎过筛(60目)→石油醚脱脂→干燥(60℃)→提取(Tris-HCl法)→离心15 min→定容→含量测定。
1.2.2白果蛋白质的提取及测定采用Tris-HCl提取法提取白果蛋白质。采用凯氏定氮法测定脱脂白果粉中的总蛋白质含量,参照GB 5009.5-2010;采用考马斯亮蓝法测定白果提取液中蛋白质的含量,参照文献[9-10];白果蛋白质提取率的计算公式为:
白果蛋白质提取率(%)=提取液中蛋白质含量/原料中蛋白质含量×100
1.2.3提取白果蛋白质的单因素实验选取提取液浓度、pH、料液比及提取时间四个因素进行单因素实验。固定pH8.0、料液比1∶25、提取时间6 h,提取液Tris-HCl浓度选取0.1、0.15、0.2、0.25、0.3、0.35 mol/L;固定提取液浓度0.2 mol/L、料液比1∶25、提取时间6 h,提取液pH采用4.0、5.0、6.0、7.0、8.0、9.0六个水平;固定提取液浓度0.2 mol/L、pH8.0、提取时间6 h,料液比采用1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)6个水平;固定提取液浓度0.2 mol/L、pH8.0、料液比1∶25;提取时间采用2、4、6、8、10、12 h六个水平,分别进行单因素实验。
1.2.4响应面法提取白果蛋白质工艺研究在上述单因素实验的基础上,对提取液浓度、pH、料液比及提取时间四个实验进行了Box-Behnken实验设计,进行响应面分析,优化工艺条件。实验因素与水平见表1。

表1 Box-Behnken实验设计因素与水平值Table 1 Factors and levels of Box-Behnken experiment design
1.2.5数据处理方法用Excel和Design-Expert 6.0软件进行实验数据的图表和数据分析。用Box-Behnken组合进行提取工艺优化。
2 结果与分析
2.1白果蛋白质含量测定结果
凯氏定氮法测定白果中的蛋白质含量为10.27%,含水量7.21%。
2.2提取白果蛋白质的单因素实验
2.2.1提取液浓度对白果蛋白质提取率的影响由图1可见,在Tris-HCl浓度为0.1~0.2 mol/L的范围内随着Tris-HCl浓度的提高,蛋白质提取率不断升高,当Tris-HCl浓度为0.2 mol/L时,白果蛋白质的提取率达到最高。继续增加提取液浓度,蛋白质提取率不断下降。可能是进一步提高浓度时,离子的水合作用,降低了蛋白质的溶解度[11],从蛋白质提取率及节约溶质用量两方面考虑,选择0.2 mol/L的Tris-HCl溶液为白果蛋白质的提取液。
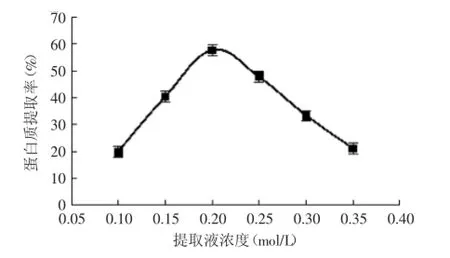
图1 提取液浓度对白果蛋白质提取率的影响Fig.1 Effect of Tris-HCl concentration on the extraction rate of Ginkgo protein
2.2.2pH对白果蛋白质提取率的影响由图2可知,当提取液pH由pH4.0逐步升高到pH9.0时,白果蛋白质提取率也逐渐增大,尤其在pH4.0~8.0之间规律更为明显,但当继续增大pH,提取率增大不明显。这是因为碱性条件可以会打破蛋白质分子间的部分氢键[12],从而促使淀粉和蛋白质分离,增加了蛋白提取率。但是,过碱性环境会使蛋白质发生变性或水解,可能会影响蛋白质的活性,因此提取白果蛋白质的提取液pH应控制在pH8.0左右。

图2 pH对白果蛋白质提取率的影响Fig.2 Effect of pH on the extraction rate of Ginkgo protein
2.2.3料液比对白果蛋白质提取率的影响图3反映了料液比对蛋白质提取率的影响,图中曲线显示了蛋白质提取率随料液比的变化而变化,随着溶剂量的增大,蛋白质提取率随之增大。当水料比为1∶35时,蛋白质提取率达到最大值,但是由图可知在水料比由1∶30变为1∶35时,蛋白质提取率的变化曲线走势平缓。由于过高的水料比会产生大量的废液,增大成本,所以最终将料液比定为1∶30。

图3 料液比对白果蛋白质提取率的影响Fig.3 Effect of the solid-liquid rate on the extraction rate of Ginkgo protein
2.2.4提取时间对白果蛋白质提取率的影响由图4看出,提取时间在6 h时,蛋白质提取率达到最高水平,其后随着提取时间的进一步增加,蛋白质提取率下降,但下降幅度不大,在6~12 h的区间内,提取率从46.63%下降到36.02%,下降了10.41%。分析原因:给予白果粉充足的溶胀时间,有利于蛋白质的分离溶解[13],但若提取时间过长,则可能有部分蛋白质出现凝聚沉淀,与不溶物质一起在离心时除去了,而且时间加长也会加大生产成本,所以综合各方面因素,认为浸提时间选4 h比较合适。

图4 提取时间对白果蛋白质提取率的影响Fig.4 Effect of extraction time on the extraction rate of Ginkgo protein
2.3响应面法实验结果
在单因素实验的基础上,进行了响应面优化实验,其实验设计及结果如表2所示。
利用Design Expert 6.0软件对表2响应面分析结果进行回归分析,对提取液浓度(A)、pH(B)、料液比(C)及提取时间(D)等四个因素进行回归拟合,得到回归方程为:Y=80.15+3.53A+4.48B+2.77C+1.78D-0.69A2-2.40B2-0.58C2-0.97D2-4.30AB-2.72AC-3.13AD-1.44BC+0.70BD-1.14CD
对该实验模型的显著性分析见方差分析表3。模型F=16.91,Pr>F值<0.0001表明此回归模型是极显著的。有0.01%的可能是因外界环境的干扰而发生变化。A、B、C、D、B2、AB、AC、AD的Pr>F值均小于0.05,说明这些是显著的模拟项。失拟项F=0.71,Pr>F= 0.9999>0.05表明失拟项相对于纯误差不显著,且无失拟因素存在,回归方程拟合充分,因此可用该回归方程代替实验真实点对实验结果进行分析。
各因素的F值大小可以反映因素对实验指标的重要性,F值越大表明对实验指标的影响越大[14]。由表3可知,F(A)=49.27,F(B)=79.39,F(C)=30.33,F(D)=12.58,且F(B)>F(A)>F(C)>F(D),即各因素对白果蛋白提取率的影响顺序为:pH>提取液浓度>料液比>提取时间。
回归方程中各因素系数的绝对值大小反应了其对响应值的影响程度,系数的正、负反应影响的方向[15]。因为本方程的二次项系数是负值,代表3D图形抛物面开口向下,有极大值,因此可以进行优化分析[16]。

表2 Box-Behnken实验设计与结果Table 2 Box-Behnken experiment design and the results of these experiments

表3 回归模型方差分析Table 3 Variance analysis of the regression model
利用Design Expert软件做不同因素间的响应面分析图和等高线图。该图组可直观地反映各因素及其交互作用对蛋白质提取率的影响。其中等高线的形状可以反映两因素间交互作用的强弱,椭圆形表示两因素间交互作用较强,圆形则相反[17-18]。具体结果及分析见图5~图7所示。
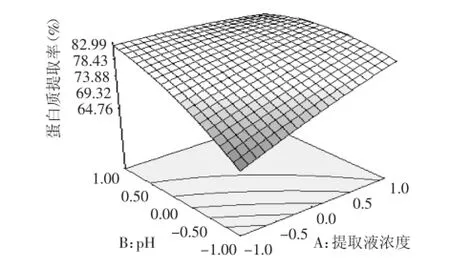
图5 提取液浓度和pH的交互作用Fig.5 The interaction of Tris-HCl concentration and pH
图5表明,提取液浓度和pH的交互作用对白果蛋白质的提取率有显著影响。图中曲线显示,当料液比和提取时间一定时,随着提取液浓度的增大,白果蛋白质提取率逐渐增大且趋于平缓,随着pH的增大,白果蛋白质提取率先增大随后保持平缓的变化趋势。提取液浓度和pH两因素对白果蛋白质提取率交互作用显著。

图6 提取液浓度和料液比的交互作用Fig.6 The interaction of Tris-HCl concentration and solid-liquid rate
图6表明,当pH和提取时间一定时,随着提取液浓度的增大,白果蛋白质提取率先增大随后趋于平缓,随着提取液浓度的增大,白果蛋白质提取率先增大随后有减小的趋势。随着料液比的增大,白果蛋白质提取率先增大随后趋于平缓。因此,提取液浓度和料液比两因素对白果蛋白质的提取率影响显著。
图7表明,当pH和料液比一定时,增大提取液浓度白果蛋白质提取率也随之增大,达到最大之后趋于平缓,随着提取时间的延长,白果蛋白质提取率先增大随后保持平缓的变化趋势。因此,pH和料液比的交互作用对白果蛋白质提取率具有显著影响。

图7 提取液浓度和提取时间的交互作用Fig.7 The interaction of Tris-HCl concentration and extraction time
2.4验证实验
经软件分析优化,由该模型得到的最佳优化条件为:提取液浓度为0.158 mol/L,pH8.67,料液比1∶25.78,提取时间5.15 h,且预测白果蛋白质提取的理论值为83.01%。考虑到实际操作性,将实验条件修正为:提取液浓度为0.16 mol/L,pH8.7,料液比1∶26,提取时间5 h,在此修正条件下进行三次提取实验,蛋白质提取率的平均值为82.76%,与理论值较为接近,表明数学模型对优化白果蛋白质的提取工艺是可行的。与李莹莹等[7]采用正交实验优化白果蛋白质提取率75.01%相比,响应面分析法提取具有较高的提取率。
3 结论
利用响应面分析法建立的数学模型方差分析说明模型显著拟合度好,可用该回归方程代替实验真实点对实验结果进行分析。利用实验模型进行响应面分析,对实验因素及其相互作用进行探讨,优化提取白果蛋白质的最佳提取工艺条件为:0.16 mol/L,pH8.7,料液比1∶26,提取时间5 h,且此条件下蛋白质提取率的平均值为82.76%,与理论值较为接近,表明数学模型对优化白果蛋白质的提取工艺是可行的。
[1]黄文,谢笔钧.白果的研究和开发利用[J].湖北林业科技,2002(3):41-42.
[2]李思斯,江波,张涛,等.银杏外种皮总黄酮的提取及其抗氧化活性研究[J].食品工业科技,2011,32(8):291-294.
[3]Liu H J,Wang X L,Zhang L,et al.Inhibitions of vascular endothelial growth factor expression and foamation by EGb 761,a special extract of Ginkgo biloba,in oxidatively modified lowdensity lipoprotein-induced human THP-1 monocytes cells[J]. Phytomedicine,2009,16(2):138-145.
[4]黄文,谢笔钧,姚平,等.白果活性蛋白的抗生物氧化作用[J].营养学报,2002,24(2):192-194.
[5]黄文,谢笔钧,王益,等.白果蛋白质的分离、纯化、理化特性及其抗氧化活性研究[J].中国农业科学,2004,37(10):1537-1543.
[6]Huang Wen,Deng Qianchun,Xie bijun,et al.Purification and characterization of an antioxidant protein from Ginkgo biloba seeds[J].Food Research International,2010,43(1):86-94.
[7]李莹莹,吴彩娥,杨剑婷,等.白果蛋白质提取及SDS-PAGE分析[J].食品科学,2010,31(22):36-40.
[8]孙小斐,乔玉辉.白果蛋白的提取分离及其等电点的测定[J].食品工业,2012(9):156-158.
[9]王艾平,周丽明,考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化[J].河南农业科学,2014,43(3):150-153.
[10]罗群.考马斯亮蓝法快速测定菜籽粕中可溶性蛋白质的含量[J].成都大学学报自然版,2014,33(2):125-127.
[11]许亚平,林俊兵.蛋白质提纯研究进展[J].天津化工,2006,20(4):9-11.
[12]张相年,赵树进,李超.蛋白分离技术的应用和进展[J].中国药业,2006,15(2):72-73.
[13]李顺灵,严有兵,李向珍.食用菜籽蛋白的提取分离及其应用研究[J].食品工业科技,2007,14(3):12-14.
[14]陈源,杨道富,范丽华,等.响应面法优化微波提取茂谷桔橙皮总黄酮工艺[J].中国食品学报,2013,13(4):80-85.
[15]戴喜末,熊子文,罗丽萍.响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J].食品科学,2011,32(8):93-97.
[16]王岸娜,孙玉丹,李龙安,等.响应面法优化猕猴桃糖蛋白提取工艺研究[J].河南农业科学,2012,41(8):121-127.
[17]王淑霞,李爱梅,张俊杰,等.响应面分析法优化龙眼核中多酚物质提取工艺[J].食品科学,2011,32(10):35-39.
[18]袁建,李大川,石嘉怿,等.响应面法优化麦麸蛋白质和膳食纤维的提取工艺[J].食品科学,2011,32(10):25-30.
Optimization of Ginkgo protein extraction by response surface methology
ZHANG Xiu-yun1,LI Dan-dan2,MA Yan-fang3
(1.Department of Information Engineering,Laiwu Vocational and Technical College,Laiwu 271100,China;2.Heze Food and Drug Administration,Heze 274000,China;3.College of Life Sciences,Shandong Agricultural University,Tai’an 271018,China)
The response surface analysis method was used to study the Ginkgo protein extraction process on the basis of single factor experiment with Ginkgo for materials,the effect of Tris-HCl concentration,pH,solidliquid rate,extraction time on the protein extraction yield was inspected.The research results showed that the optimal conditions for ginkgo protein extraction:0.16 mol/L,pH8.7,1∶26(g/mL),and 5 h.Under this condition,the yield of Ginkgo protein was 82.76%,compared to the theoretical value,the relative error of 0.30%.Optimized regression equation derived some practical significance.
Ginkgo protein;extraction;response surface method
TS251.1
B
1002-0306(2016)04-0299-05
10.13386/j.issn1002-0306.2016.04.051
2015-07-24
张秀云(1980-),女,硕士,讲师,主要从事食品生物技术方面的研究,E-mail:zhangxiuyun1980@126.com.。
