黄皮疣柄牛肝菌多酚提取及对Caco-2结肠癌细胞抑制作用研究
2016-09-14刘雨阳侯玉艳吴素蕊赵天瑞昆明理工大学云南省食品安全研究院云南昆明650500中华全国供销合作总社昆明食用菌研究所云南昆明650
刘雨阳,侯玉艳,吴素蕊,赵天瑞,樊 建,*(.昆明理工大学,云南省食品安全研究院,云南昆明650500;.中华全国供销合作总社昆明食用菌研究所,云南昆明650)
黄皮疣柄牛肝菌多酚提取及对Caco-2结肠癌细胞抑制作用研究
刘雨阳1,侯玉艳1,吴素蕊2,赵天瑞1,樊建1,*
(1.昆明理工大学,云南省食品安全研究院,云南昆明650500;2.中华全国供销合作总社昆明食用菌研究所,云南昆明650221)
以黄皮疣柄牛肝菌为原料,乙醇为提取溶剂,采用Folin-Ciocalteu法测定多酚含量,研究了乙醇浓度、提取温度、料液比和提取时间对多酚得率的影响。在单因素实验的基础之上,通过正交实验优化提取工艺参数,并测定了所得多酚组成及其对Caco-2结肠癌细胞的抑制作用。结果表明,最佳提取工艺条件为:温度为80℃,乙醇浓度为50%,料液比为1∶25 g/mL,提取1 h。在此提取工艺条件下,最佳提取次数为2次时,黄皮疣柄牛肝菌多酚的得率为5.46%± 0.04%;在18种酚类物质中,在黄皮疣柄牛肝菌中检出5-磺基水杨酸、儿茶素和肉桂酸等8种多酚类物质,其中5-磺基水杨酸含量最高为779.00 mg/100 g;黄皮疣柄牛肝菌多酚对Caco-2结肠癌细胞产生一定程度的抑制作用,当其浓度为175 μg/mL时,抑制率达55.07%。
黄皮疣柄牛肝菌,多酚,Caco-2结肠癌细胞,抗癌
黄皮疣柄牛肝菌又称黄癞头(Leccinellum crocipodium),属真 菌 界(Fungi),担子菌 门(Basidiomycota),伞菌纲(Agaricomycetes),牛肝菌目(Boletales),牛肝菌科(Boletaceae),疣柄牛肝菌属(Leccinellum),菌肉细嫩、味道鲜美[1]。外生菌根菌,夏秋季生于针阔叶混交林或阔叶林下,子实体粗壮坚实,商品性状极佳[2]。云南、江苏、浙江、安徽、福建、湖南、湖北、广东、西藏、贵州和台湾均有分布[3]。黄皮疣柄牛肝菌蛋白质含量为35.1%,可作为蛋白质来源之一,满足人们对蛋白质营养的需求。黄皮疣柄牛肝菌含有许多生物活性物质,如多酚、多糖等[4],还含有镁、铁、钙、锌等矿物质元素。
野生菌多酚是一类广泛存在于野生菌内的大分子化合物。其具有较强的抗氧化性[5]、抑制癌细胞[6]、降血压[7]和降血脂[8]等特点,并应用于食品、化妆品、药品及保健品等领域。早于1957年,Lucas E H[9]首次研究并报道了美味牛肝菌能够发挥抗肿瘤作用。但对于黄皮疣柄牛肝菌中提取的多酚类物质抑制癌细胞的研究鲜有报道。本文以云南地区的黄皮疣柄牛肝菌为原料,采用乙醇溶剂浸提法,提取黄皮疣柄牛肝菌中的粗多酚,优化提取工艺条件,测定其多酚组成,并探究其对Caco-2结肠癌细胞的抑制作用,旨在为黄皮疣柄牛肝菌的进一步研究提供理论依据。
1 材料与方法
1.1材料与仪器
新鲜黄皮疣柄牛肝菌购自云南曲靖马龙县;结肠癌细胞(Caco-2) 由中科院昆明动物所提供;乙腈,HPLC级德国Merck KGaA公司;5-磺基水杨酸、没食子酸、原儿茶酸、绿原酸、儿茶素、4-羟基苯甲酸、香草酸、咖啡酸、丁香酸、对香豆酸、芦丁、鞣花酸、阿魏酸、3,4-二甲氧基苯甲酸、苯甲酸、白藜芦醇、槲皮素、肉桂酸均≥99%,Sigma公司;二甲基亚砜(AMSO) Biomol公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、胎牛血清、不完全培养基DMEMGibco公司;胰蛋白酶和磷酸盐缓冲液(PBS)Amresco公司;Na2CO3、Folin-ciocalteu、没食子酸、乙酸和乙醇等其他试剂均为国产分析纯。
ZD-F12真空冷冻干燥机南京载智自动化设备有限公司;AL204型分析天平梅特勒-托利多仪器上海有限公司;HH-4恒温水浴锅金坛市科析仪器有限公司;YHZ82恒温振荡器常州国华电器有限公司;L500台式低速自动平衡离心机湖南湘仪实验室仪器开发有限公司;1260高效液相色谱仪Agilent,Germany;CCL-170B-8二氧化碳培养箱ESCO,Singapore;SpectraMax M5多功能酶标仪Molecular Devices,America;生物显微镜重庆澳浦光电技术有限公司。
1.2实验方法
1.2.1黄皮疣柄牛肝菌多酚的提取流程

1.2.2黄皮疣柄牛肝菌多酚含量测定
1.2.2.1多酚得率的测定多酚含量的测定使用Folin-ciocalteu方法并经过适当修改进行测定[11]。取黄皮疣柄牛肝菌多酚提取液0.5 mL加入2.5 mL 0.2 mol/L福林酚试剂,振荡均匀后静置5 min,加入2.0 mL 7.5% Na2CO3溶液,摇匀,避光静置1 h后765 nm下测定吸光值。
1.2.2.2标准曲线的绘制配制20、40、60、80 μg/mL没食子酸溶液,参照1.2.2.1方法测定吸光值,同时等体积蒸馏水代替没食子酸溶液调零,绘制标准曲线。
1.2.2.3多酚得率的计算取不同条件下提取的样液,测定吸光值,按下式计算得率。
多酚得率(%)=[提取液浓度(mgGAE/mL)×提取液体积(mL)×稀释倍数]/[菌粉质量(g)×1000]×100 1.2.3黄皮疣柄牛肝菌多酚提取实验设计及优化
1.2.3.1单因素实验以多酚得率为指标,考察提取温度、乙醇浓度、提取时间、液料比对多酚得率的影响。
在其他相同的提取条件下(提取温度80℃,乙醇浓度70%,提取时间1 h,液料比1∶25 g/mL,提取次数为2次),分别考察提取温度(40、50、60、70、80、90℃)、乙醇浓度(30%、40%、50%、60%、70%、80%)、料液比(牛肝菌粉∶提取液)(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 g/mL)、提取时间(0.5、1、1.5、2、2.5、3 h)4个单因素对黄皮疣柄牛肝菌多酚得率的影响。
1.2.3.2正交实验设计在单因素实验的基础上,选择乙醇浓度、料液比、提取温度、提取时间为正交实验因素,设计3个水平,以多酚提取率为考察指标,采用L9(34)正交表优化实验方案,研究黄皮疣柄牛肝菌中多酚类物质提取的最佳工艺条件,因素水平设计见表1。

表1 实验因素与水平Table 1 Factors and levels of the experiment
1.2.4提取次数的确定准确称取2 g黄皮疣柄牛肝菌粉,每份加入50%的乙醇溶液50 mL,80℃水浴提取1 h。提取次数超过1次的,合并提取液,测定吸光值,计算得率。
1.2.5HPLC法测定多酚的种类样品配制:提取黄皮疣柄牛肝菌中多酚类物质,55℃真空浓缩至膏状,加少量水将提取物溶出后定容,测定提取物中多酚类物质含量。进样前用0.45 μm有机膜过滤,备用。
参照Liang等[12]的方法并适当修改:色谱柱:Agilent C18(4.6 mm×250 mm,5 μm);紫外检测波长280 nm,柱温25℃,进样量10 μL,流速1 mL/min,流动相A为0.1%乙酸溶液,流动相B为0.1%乙酸乙腈溶液。梯度洗脱程序:0~2 min、10%B;2~27 min、10~30%B;27~40 min、30~90%B;40~41 min、100%B;梯度均为线性变化。
1.2.6黄皮疣柄牛肝菌多酚类物质对Caco-2结肠癌细胞抑制作用
1.2.6.1细胞培养在无菌环境下吸出溶有Caco-2细胞的冻存液,加入5 mL 37℃预热的含10%胎牛血清的完全DMEM培养基中,1000 r/min离心5 min。弃去上清液,加入适量的培养液后接种于培养皿中,置于37℃5%CO2浓度以及饱和湿度环境的培养箱中培养,24 h后更换培养液,继续培养24 h[13],观察生长情况。
1.2.6.2MTT法检测细胞存活率稀释合适的倍数使细胞浓度约为1×104个/孔。吸取200 μL稀释后的细胞液至96孔板中,边缘的孔中加入150 μL PBS。37℃细胞培养箱培养24 h。取出后将孔板中的培养基完全吸出,加入不同浓度的样液(将冷冻干燥的乙醇提取物,用少量二甲基亚砜(DMSO)溶解,然后加入完全培养基稀释)200 μL到96孔板中,置于37℃5% CO2浓度以及饱和湿度环境的培养箱中培养48 h。然后弃去其中的培养液,加入150 μL 0.5 mg/mL MTT溶液至孔板中,37℃培养箱中继续培养4 h后,将MTT溶液吸取干净,然后每孔加入150 μL DMSO溶液,紫色结晶产物完全溶解后[14]于570 nm波长下测定吸光值。按照如下方法计算细胞存活率:
细胞存活率(%)=(A0-A1)(/A2-A1)×100
式中:A0为单个样品处理组吸光度,A1为培养板本底吸光度,A2为未加样品的对照组Caco-2结肠癌细胞吸光度。
1.3数据处理
数据采用Origin 8.5统计分析,实验重复3次,结果用表示,并用SPSS 19.0软件进行统计处理。
2 结果与分析
2.1回归方程确立
以没食子酸浓度(线性范围:0.002~0.010 mg/mL)与吸光度建立标准曲线回归方程为:C=6.323A+0.01495 (R2=0.9986)。没食子酸溶液在0.002~0.010 mg/mL范围内线性关系良好。
2.2单因素实验结果及分析
2.2.1温度对多酚类物质提取效果的影响由图1可知,黄皮疣柄牛肝菌多酚得率随提取温度的升高先增加后降低,在温度达到80℃时,多酚提取率达最大值。温度升高,提取液的粘度下降,分子运动加速,氢键更易断裂,多酚的渗透、溶解、扩散速度也加快,因而多酚类物质更易于溶出。但温度过高也会使多酚发生氧化或者降解等一些不可逆的化学反应。另外,温度过高也会导致提取剂乙醇的挥发,导致多酚得率的下降[15]。
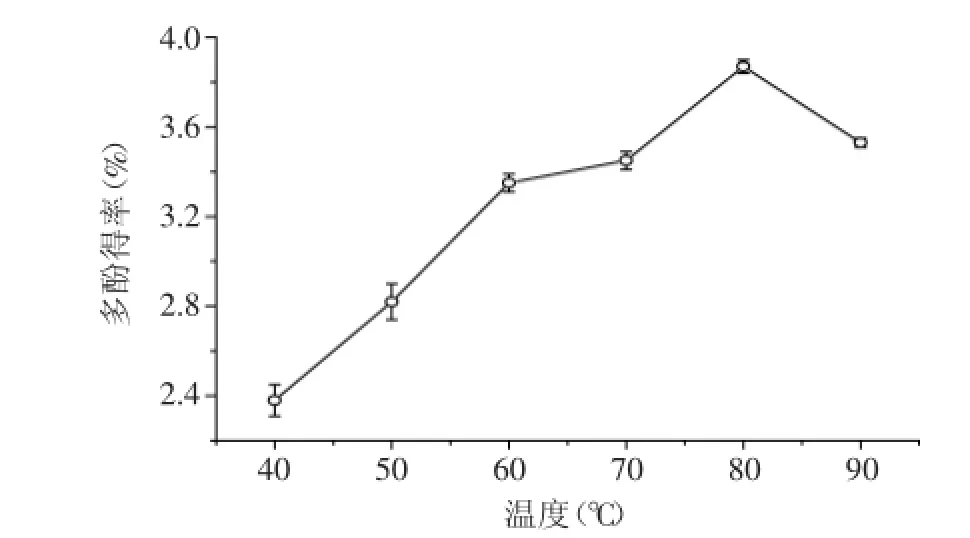
图1 温度对黄皮疣柄牛肝菌多酚得率的影响Fig.1 Effect of temperature on the extraction of Leccinellum crocipodium polyphenols
2.2.2乙醇浓度对多酚类物质提取效果的影响由图2可知,随着乙醇浓度增大,黄皮疣柄牛肝菌多酚的提取率不断增加。当乙醇浓度达到60%时,多酚得率最高,超过此浓度,提取得率下降。可能是因为乙醇浓度过高,一部分乙醇会挥发影响提取率。另外,乙醇浓度过高会使醇溶性杂质、色素成分溶出,导致提取率下降,而乙醇浓度较低时,糖类物质和水互溶会影响多酚的提取率[16]。
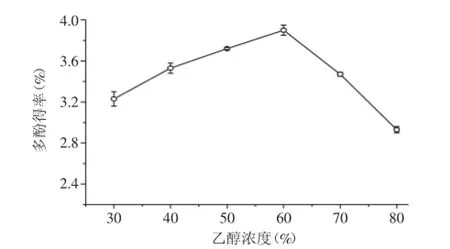
图2 乙醇浓度对黄皮疣柄牛肝菌多酚得率的影响Fig.2 Effect of ethanol concentration on the extraction ofLeccinellum crocipodium polyphenols
2.2.3料液比对提取效果的影响由图3可知,在相同提取条件下,随着料液比的增大,黄皮疣柄牛肝菌多酚得率不断增加。当料液比达到1∶25时,大多数多酚被提取出来。加大溶剂量后,多酚得率没有显著提高。另外,料液比过高,醇溶性杂质浸出率也会增高,对后续处理不利。因此,综合考虑到溶剂的用量以及节能减排等需要,选取最佳料液比为1∶25。
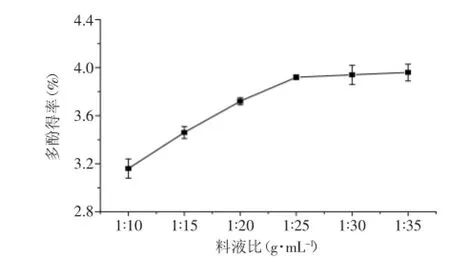
图3 料液比对黄皮疣柄牛肝菌多酚得率的影响Fig.3 Effect of solid-liquid on the extraction of Leccinellum crocipodium polyphenols

图4 时间对黄皮疣柄牛肝菌多酚得率的影响Fig.4 Effect of time on the extraction of Leccinellum crocipodium polyphenols
2.2.4时间对多酚类物质提取效果的影响理论上说,提取率随提取时间的增加而增大[17]。但是提取达到一定时间时,多酚的溶出达到平衡,即使再延长提取时间,提取率也不会显著增加。另外,浸提时间过长时,多酚物质会发生降解、氧化等化学反应致使多酚分子结构发生一定的破坏。由图4可知,提取1 h后,多酚提取率有所下降,故选取1 h为最佳提取时间。
2.3牛肝菌多酚提取工艺的正交实验
在单因素实验的基础上,以黄皮疣柄多酚得率为考察指标,采用L9(34)正交表研究最佳提取条件,结果见表2。
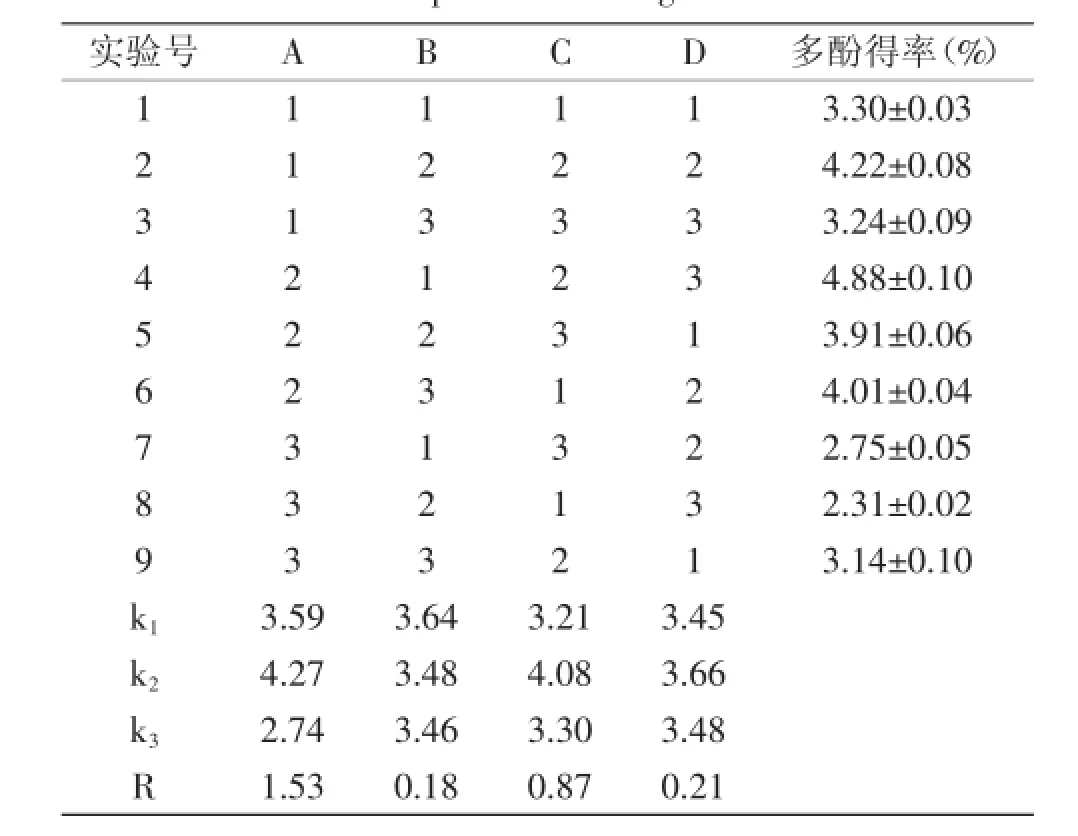
表2 实验设计与结果Table 2 Experimental design and result
由表2结果可知,4个因素对黄皮疣柄牛肝菌多酚浸提效果影响最大的是浸提温度,其次是料液比和时间,影响最小的是乙醇浓度。浸提黄皮疣柄牛肝菌多酚的最佳工艺条件组合为A2B1C2D2,即温度为80℃,乙醇浓度为50%,料液比为1∶25 g/mL,提取1 h。对照正交表,正交实验9组实验中没有A2C2D2B1,按A2C2D2B1条件补加实验,重复三次取平均值,得黄皮疣柄牛肝菌多酚的得率为5.46%±0.04%,且高于正交实验表中其他组合的多酚得率。
2.4浸提次数对多酚类物质提取效果的影响
在黄皮疣柄牛肝菌多酚提取的最佳工艺条件下,连续提取5次,分别测取单次浸提多酚类物质的含量并累计相加,浸提次数对黄皮疣柄牛肝菌多酚类物质提取效果的影响如图5所示。提取2次和提取3次的提取物中多酚无显著性差异(p>0.05),考虑到节约能源和人力,选取最佳浸提次数为2次。
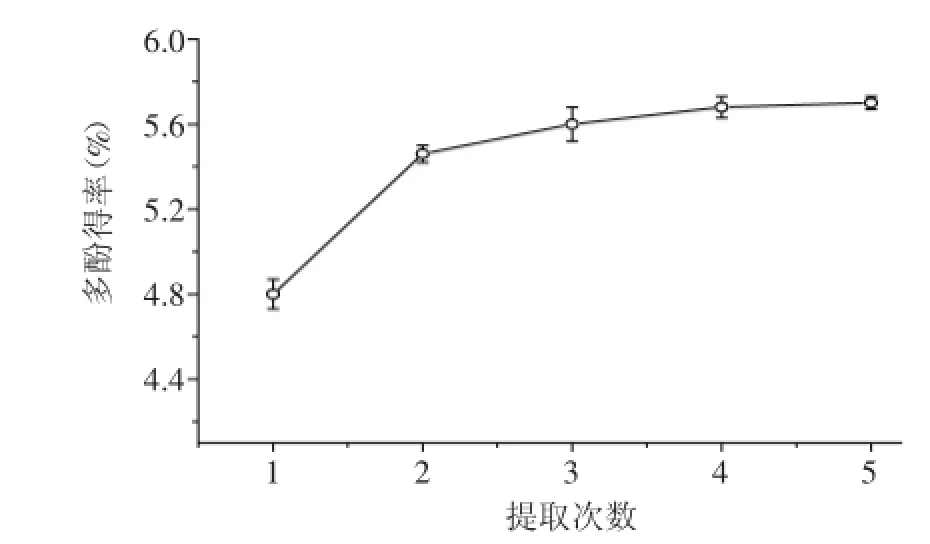
图5 提取次数对黄皮疣柄牛肝菌多酚得率的影响Fig.5 Effect of extraction times on Leccinellum crocipodium polyphenols
2.5HPLC法测定多酚的成分
在1.2.5所述色谱条件下,将黄皮疣柄牛肝菌样品进样,测定18种多酚类物质的含量,各成分的含量以毫克等量每100克牛肝菌干重(mg/100 g)来表示,测定结果见表3。

表3 黄皮疣柄牛肝菌样品多酚测定结果Table 3 Determination results of Leccinellum crocipodium samples
由表3可以看出,在该色谱条件下测定黄皮疣柄牛肝菌样品,检测出8种酚类物质,且5-磺基水杨酸在所检测的18种酚类物质中含量最高。在黄皮疣柄牛肝菌中还检测出绿原酸、儿茶素、对香豆酸、鞣花酸、苯甲酸、槲皮素和肉桂酸共8种多酚类物质。
在此色谱条件下,18种酚类物质得到了较好的分离,说明该色谱条件适合测定黄皮疣柄牛肝菌中5-磺基水杨酸、绿原酸、儿茶素、肉桂酸等多酚类物质。黄皮疣柄牛肝菌中所含多酚类物质的含量存在差异,其中5-磺基水杨酸含量最高为779.00 mg/100 g。
2.6MTT法检测细胞存活率分析
黄皮疣柄牛肝菌对Caco-2结肠癌细胞的抑制作用如图6所示(对照组细胞存活率设为100%)。
由图6可知,Caco-2结肠癌细胞经过不同浓度的黄皮疣柄牛肝菌多酚提取物诱导培养48 h后,细胞存活率均有一定程度的下降。与对照组相比,呈显著性差异(p<0.05)。且细胞存活率与多酚浓度呈良好的线性关系,随浓度的增加而递减。当其多酚浓度为175 μg/mL时,细胞存活率为44.93%,抑制率达55.07%。

图6 黄皮疣柄牛肝菌乙醇提取物对细胞存活率的影响Fig.6 Effect of polyphenolic extracts from Leccinellum crocipodium on cell viability
实验表明,黄皮疣柄牛肝菌对Caco-2结肠癌细胞产生一定程度的抑制作用。Caco-2结肠癌细胞数量的减少可能是黄皮疣柄牛肝菌多酚对细胞凋亡的诱导作用,也可能是对细胞增殖的抑制作用。细胞增殖、凋亡调控的异常与肿瘤发生、发展有关[18]。此前有报道指出,美味牛肝菌粗多糖对MCF-7细胞48 h抑制率仅为19.12%[19],低于黄皮疣柄牛肝菌多酚对结肠癌细胞的抑制作用。Fridrich等[20]研究表明,苹果多酚能够抑制结肠癌细胞增殖,而对正常细胞增殖作用不明显。可可粉多酚提取物对Caco-2结肠癌细胞生长抑制率高达70%,主要原理是使细胞周期阻滞于G2/M期[21]。此外,Caco-2结肠癌细胞数量的减少可能与牛肝菌多酚的抗氧化作用相关。Caco-2结肠癌细胞细胞数量的减少还可能受黄皮疣柄牛肝菌提取物中所含多酚类物质的种类和含量的影响。黄皮疣柄牛肝菌对Caco-2结肠癌细胞抑制作用的机理有待探究,对其他癌细胞的作用效果有待进一步的实验。
3 结论
在单因素实验的基础之上,通过正交实验优化提取工艺,确定了最佳提取工艺条件为:温度为80℃,乙醇浓度为50%,料液比为1∶25 g/mL,提取1 h,提取次数为2次时,黄皮疣柄牛肝菌多酚的得率为5.46%± 0.04%。黄皮疣柄牛肝菌中多酚含量存在较大的差异,在18种多酚类物质中,5-磺基水杨酸、儿茶素和肉桂酸等8种多酚类物质均被检出,其中5-磺基水杨酸含量最高,为779.00 mg/100 g;体外细胞实验结果表明,黄皮疣柄牛肝菌中提取的多酚类物质对Caco-2结肠癌细胞产生一定程度的抑制作用,可以开发为癌症有效的治疗剂。研究表明黄皮疣柄牛肝菌中多酚类化合物含量较高,具有一定的开发利用前景。
[1]袁明生.中国大型真菌彩色图谱[M].四川科学技术出版社,2013.
[2]梅文泉,董宝生,和丽忠,等.黄皮疣柄牛肝菌营养成分分析[J].中国食用菌,2005,24(1):25-26.
[3]李泰辉,宋斌.中国食用牛肝菌的种类及其分布[J].食用菌学报,2002,9(2):22-30.
[4]朱萍,张微思,罗晓莉.美味牛肝菌膨化即食产品生产工艺技术研究[J].中国野生植物资源,2009,28(5):41-44.
[5]Huang M,Zhang S,Zhang M,et al.Effects of polysaccharides fromMorchellaconicaonnitricoxideproductionin lipopolysaccharide-treated macrophages[J].Applied Microbiology &Biotechnology,2012,94(3):763-771.
[6]Choi D Y,Lee Y J,Hong J T,et al.Antioxidant properties of naturalpolyphenolsandtheirtherapeuticpotentialsfor Alzheimer’s disease[J].Brain Research Bulletin,2012,87(2):144-153.
[7]王茂胜,连宾.美味牛肝菌研究[J].贵州林业科技,2003,31 (3):34-38.
[8]唐薇,鲁新成.美味牛肝菌多糖的生物活性及其抗S-180肿瘤的效应[J].西南师范大学学报:自然科学版,1999,24(4):478-481.
[9]Byerrum R U,Clarke D A,Lucas E H,et al.Tumor inhibitors in Boletus edulis and other Holobasidiomycetes[J].Antibiotics& Chemotherapy,1957,7(1):25-29.
[10]Mei J P,Yoo E S,Koh Y S,et al.Antioxidant effects of the ethanol extract from flower of camellia japonica via scavenging of reactive oxygen species and induction of antioxidant enzymes [J].International Journal of Molecular Sciences,2011,12(4):2618-2630.
[11]Zuo L L,Wang Z Y,Fan Z L,et al.Evaluation of antioxidant andantiproliferativepropertiesofthreeactinidia(actinidia kolomikta,actinidia arguta,actinidia chinensis)extracts in Vitro [J].International Journal of Molecular Sciences,2012,13(5):5506-5518.
[12]Liang Q,Cui J,Li H,et al.Florets of sunflower(Helianthus annuus L.):potential new sources of dietary fiber and phenolic acids[J].Journal of Agricultural&Food Chemistry,2013,61 (14):3435-3442.
[13]司徒镇强.细胞培养[M].世界图书出版公司西安分公司,1996.
[14]Prasad K N,Hao J,Shi J,et al.Antioxidant and anticancer activities of high pressure-assisted extract of longan(Dimocarpus longan Lour.) fruit pericarp[J].Innovative Food Science& Emerging Technologies,2009,10(4):413-419.
[15]李珍.苹果皮渣多酚提取、纯化及抗氧化活性研究[D].北京:中国农业科学院,2014.
[16]吕成林,汪秋宽,宋悦凡,等.羊栖菜多酚的提取及纯化工艺研究[J].食品工业科技,2014,35(22):231-240.
[17]郝少莉,仇农学,王宏.苹果渣中多酚物质的提取技术研究[J].西北农业学报,2006,15(2):152-155.
[18]林雅军,黄云虹,甄永占,等.赖氨大黄酸通过抑制HER-2信号通路诱导乳腺癌SK-Br-3细胞凋亡[J].药学学报,2008,43(11):1099-1105.
[19]刘晏瑜.美味牛肝菌抗肿瘤作用及免疫功能初步探究[D].长春:吉林农业大学,2014.
[20]Fridrich D,Kern M,Pahlke G,et al.Apple polyphenols diminish the phosphorylation of the epidermal growth factor receptor in HT29 colon carcinoma cells[J].Molecular Nutrition& Food Research,2007,51(5):594-601.
[21]Carnésecchi S,Schneider Y,Lazarus S A,et al.Flavanols and procyanidins of cocoa and chocolate inhibit growth and polyamine biosynthesis of human colonic cancer cells[J].Cancer Letters,2002,175(2):147-155.
The polyphenol extraction of Leccinellum crocipodium and their inhibitory effect on proliferation of Caco-2 cells
LIU Yu-yang1,HOU Yu-yan1,WU Su-rui2,ZHAO Tian-rui1,FAN Jian1,*
(1.Yunnan Institute of Food Safety,Kunming University of Science and Technology,Kunming 650500,China;
2.Kunming Edible Fungi Institute of All China Federation of Supply and Marketing Cooperatives,Kunming 650221,China)
The polyphenols were extracted from the Leccinellum crocipodium by ethanol as extraction solvent extraction and Folin-Ciocalteu method.The effect of ethanol concentration,temperature,solid-liquid ratio and time on the extraction efficiency of polyphenols were identified.Based on single factor test,an orthogonal design was applied to optimize extraction process.The polyphenol composition and inhibitory effect on Caco-2 cells of Leccinellum crocipodium were investigated in the present work.The results showed that the optimum conditions for extraction of polyphenols were temperature of 80℃,ethanol concentration of 50%,solid-liquid ratio of 1∶25,extracted 1 h,two times.Under this condition,polyphenol extraction rate was 5.46%±0.04%. Among 18 kinds of polyphenols,the polyphenols of this wild edible fungi were mainly composed of 5-sulfosalicylic acid,catechin,cinnamon and other five kinds of polyphenols,and the content of 5-sulfosalicylic acid up to 779.00 mg/100 g.The inhibitory effects on colon carcinoma cells showed that the cell inhibition rate was up to 55.07%,when the polyphenols concentration was 175 μg/mL.
Leccinellum crocipodium;polyphenol;colon carcinoma cells;anticancer
TS201.3
B
1002-0306(2016)04-0278-06
10.13386/j.issn1002-0306.2016.04.047
2015-09-10
刘雨阳(1991-),女,硕士研究生,研究方向:发酵工程,E-mail:303245011@qq.com。
樊建(1964-),男,硕士,副教授,研究方向:食品科学与工程,E-mail:fanj333@163.com。
国家科技支撑计划课题(2013BAD16B01)。
