重组枯草芽孢杆菌素subtilosin A基因的合成及其在毕赤酵母中的表达
2016-09-14陈柏雄黄佳俊林俊芳郭丽琼陈俊飞刘英丽华南农业大学食品学院生物工程系华南农业大学食品生物技术研究所广东广州50640齐鲁工业大学化学与制药工程学院山东济南505北京工商大学食品质量与安全北京实验室北京00048
陈柏雄,黄佳俊,林俊芳,*,郭丽琼,*,陈俊飞,刘英丽(.华南农业大学食品学院生物工程系,华南农业大学食品生物技术研究所,广东广州50640;.齐鲁工业大学化学与制药工程学院,山东济南505;.北京工商大学食品质量与安全北京实验室,北京00048)
重组枯草芽孢杆菌素subtilosin A基因的合成及其在毕赤酵母中的表达
陈柏雄1,黄佳俊1,林俊芳1,*,郭丽琼1,*,陈俊飞2,刘英丽3
(1.华南农业大学食品学院生物工程系,华南农业大学食品生物技术研究所,广东广州510640;2.齐鲁工业大学化学与制药工程学院,山东济南250353;3.北京工商大学食品质量与安全北京实验室,北京100048)
人工改造并合成subtilosin A的结构基因(rsbo A),并在毕赤酵母中诱导表达重组蛋白。结果表明:经阳性大肠杆菌转化子菌落PCR和测序鉴定,表明重组质粒pPIC9K-sbo构建正确;经阳性酵母转化子的菌落PCR产物电泳检测,可见清晰目的基因条带,证明重组酵母GS115-pPIC9K-sbo构建正确;经枯草芽孢杆菌素蛋白电泳检测,可见明显蛋白条带,表明重组rsbo A基因在毕赤酵母GS115中获得了分泌表达。在抑菌效果检测中,重组酵母工程菌的发酵液对铜绿假单胞菌具有一定的抑菌活性。本研究开创了有望替代抗生素的小分子肽细菌素异源表达新思路,为枯草芽孢杆菌素subtilosin A的工业化生产奠定了基础。
subtilosinA,基因重组,毕赤酵母,抗菌活性
细菌素是由微生物合成的具有抑制特定微生物生长的一种多肽,由于其抑菌的特异性,有望成为替代抗生素成为新一代的治疗细菌感染的药物。枯草芽孢杆菌素subtilosin A是一种环状细菌素,蛋白分子内含有三个特殊的硫醚键[1],最早是从枯草芽孢杆菌168中分离得到[2],其蛋白合成与后期加工通过八个基因的基因簇sbo-alb进行调控[3],其中sbo基因作为结构基因,编码多肽前体[4],前体肽的成熟要经过几个独特的化学修饰过程。
subtilosin A作为Ⅰ类细菌素,具有分子量小,拥有特殊蛋白结构,具有很宽的抗菌谱,对革兰氏阳性菌、革兰氏阴性菌、好氧菌与厌氧菌都有抑制作用[5]。近几年,对疾病相关病原体的研究也表明了subtilosin A对单纯胞疹病毒Type 1[6]、与阴道疾病相关的病原体[7]具有抑制作用,有望成为代替抗生素作为新型治疗药物。
巴斯德毕赤酵母(Pichia pastoris)因具有对外源基因翻译后加工,如糖基化、蛋白磷酸化等特点,同时也具有培养容易、生长快、表达高等优点,现已作为一种外源蛋白表达系统广泛应用于基因工程研究中[8]。
目前,国内外对subtilosin A基因改造已进行广泛的研究。孙会刚等利用强启动子P45分别与subtilosin A合成基因簇中sbo-albA、albB-albC连接转化回枯草芽孢杆菌168中以提高subtilosin A的产量[9]。Quanli Liu等通过构建purL基因缺失的解淀粉芽孢杆菌以提高subtilosin A的产量[10]。目前国内外对其研究中,只是在其原始报道的来源菌株芽孢杆菌中进行改造,但是其产量低而无法进行工业化生产的问题始终未能得到解决。由于利用非芽孢杆菌菌株进行表达以提高其产量的研究目前未见报道,本研究试图将subtilosin A的前体编码基因sbo按照毕赤酵母的密码子偏好性进行改造,让其于毕赤酵母中表达,利用酵母菌的蛋白翻译后加工的能力,大量获得有活性的枯草芽孢杆菌素subtilosin A。
1 材料与方法
1.1材料与仪器
大肠杆菌(Escherichia coli DH5α)、铜绿假单胞菌(Pseudomonas aeruginosa)本实验室保存;毕赤酵母菌(Pichia pastoris GS115)及表达载体pPIC9K Invitrogen公司;质粒小提试剂盒、PCR产物纯化试剂盒北京天根生化科技有限公司;Taq聚合酶、T4连接酶、DNA marker 3、DNA Marker 1广州东盛生物科技有限公司;限制性内切酶NotⅠ、EcoRⅠ和SalⅠ、Premixed Protein Marker(Low)TaKaRa公司;其他试剂均为国产分析纯。
电子分析天平ALC-2104瑞士METTLER TOLEDO公司;核酸凝胶电泳仪DYY-6C北京六一仪器厂;小型垂直蛋白电泳仪美国Bio-Rad公司;干式恒温器MK-20杭州奥盛仪器有限公司;微量台式冷冻离心机FRESC21美国Thermo Fisher公司。
1.2实验方法
1.2.1培养基的配制LB培养基:Trypton 10 g/L,Yeast extraction 5 g/L,NaCl 10 g/L。
MD培养基:1.34%YNB,4×10-5%Biotin,2% Dextrose。
BMGY培养基:100 mmol/L磷酸钾缓冲液(pH6.0),1.34%YNB,4×10-5%Biotin,1%Glycerol,1%Yeast Extract,2%Peptone。
BMMY培养基:将BMGY培养基中的1%Glycerol换成0.5%(v/v)甲醇。
1.2.2基因的设计及合成根据GenBank中登录的枯草芽孢杆菌素subtilosin A的前体sbo成熟肽段的氨基酸序列(DQ452520.1),参照Codon Usage Database中的毕赤酵母偏爱密码子表,利用DNASTAR软件设计枯草芽孢杆菌素subtilosin A前体SBO核酸序列,并在两端分别引入EcoRⅠ和NotⅠ酶切位点,得基因全长146 bp,由上海捷瑞生物工程有限公司合成。基因名称为rsbo A。
1.3PCR引物
根据合成的重组sbo基因和pPIC9K的MCS上下游核酸序列设计引物,引物由上海捷瑞生物工程有限公司合成。重组sbo基因(拟扩增片段大小为146 bp)引物为:上游引物sbo-up:5’-GAA TTC ATG AAG AAG GCT GTT ATT G-3’(25 nt)和下游引物sbo-dn:5’-GCG GCC GCT TAA CCC CAC AAA CCA A-3’(25 nt)。pPIC9K的通用引物(拟扩增的片段大小为318 bp):上游引物α-factor:5’-TAC TAT TGC CAG CAT TGC TGC-3’(21 nt)和下游引物3’AOX1:5’-GCA AAT GGC ATT CTG ACA TCC-3’(21 nt)。反应条件为:94℃预变性5 min;94℃1 min,51℃1 min,72℃25 s,共29个循环;最后72℃延伸10 min。
1.4重组表达质粒的构建
将连有rsbo基因的pGH载体及毕赤酵母pPIC9K载体分别经EcoRⅠ和NotⅠ双酶切(50 μL体系中按酶活力单位比经37℃酶切20 h),切胶回收目的基因rsbo片段及载体片段,按摩尔比5∶1经DNA T4连接酶16℃连接过夜,连接产物转化感受态大肠杆菌DH5 α,经筛选获得重组菌。重组菌经过培养提取重组质粒并经过PCR鉴定以及测序鉴定,获得正确的重组质粒,命名为pPIC9K-sbo。
1.5酵母转化
将重组表达质粒pPIC9K-sbo和空载体pPIC9K分别电击转化感受态毕赤酵母GS115,涂布于MD平板,30℃孵育2~3 d,于MD平板上挑阳性菌株单克隆于10 μL无菌ddH2O中,取其2 μL为模板,用引物α-Factor 和3′AOX1进行PCR扩增。扩增产物经3%琼脂糖凝胶电泳进行鉴定。
1.6目的基因的诱导表达
将阳性转化子接种于25 mL BMGY培养基中,30℃振荡培养24 h,6000 r/min离心5 min,收集菌体,经100 mL BMMY培养基重悬,转入1 L的三角瓶中继续振荡培养,每隔24 h加入甲醇使其终浓度为1%进行诱导表达,每隔0、6、12、24、36、48、60、84 h取4 mL发酵液测量菌体OD600,1 mL发酵液离心收集上清进行Tricine-SDS PAGE分析和细菌素抗菌活性的测定。
1.7Tricine-SDS PAGE分析
参照Schägger H的方法[11]。
1.8细菌素抗菌活性的测定
以铜绿假单胞菌作为指示菌初步测试发酵上清抗菌活性。挑铜绿假单胞菌单菌落于15 mL LB液体培养基中37℃培养12 h获得菌液。上述发酵60 h的发酵液离心后取上清,用0.22 μm滤膜过滤菌体获得粗提的发酵液。取稀释100倍的铜绿假单胞菌菌液100 μL,与粗提发酵液100 μL混合均匀后涂LB板;以稀释100倍的铜绿假单胞菌菌液100 μL,与野生型酵母粗提发酵液混合涂板作为对照组。37℃培养18 h后观察平板上菌落生长状况,通过菌体生长速率比对情况作为初步的抑菌能力检测。
2 结果与分析
2.1含重组subtilosin A基因sbo的酵母重组质粒的构建与鉴定
2.1.1目的基因rsboA的合成重组目的基因由上海捷瑞生物工程有限公司协助合成并连接至pGH质粒上(图1)。
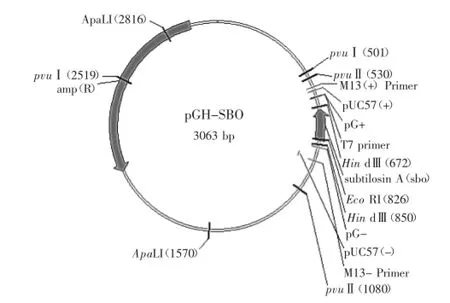
图1 pGH-sbo载体图Fig.1 Vector of pGH-sbo
2.1.2重组质粒pPIC9K-sbo的PCR鉴定分别进行双酶切的pGH-sbo质粒与pPIC9K质粒经纯化后过夜
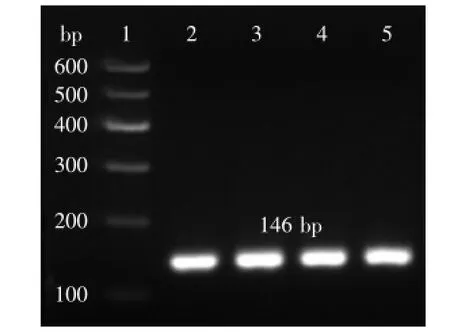
图2 pPIC9K-sbo菌落PCR检测阳性克隆Fig.2 Colony PCR identification of positive clones of pPIC9K-sbo

图3 合成基因与测序结果比对Fig.3 Sequence alignment of SBO and pPIC9K-sbo
连接,连接产物转化到Escherichia coli DH5α,通过含有100 μg/mL Amp的LB平板随机筛选阳性克隆,用引物sbo-up和sbo-dn进行菌落PCR,进行3%琼脂糖凝胶电泳,获得与目的基因146 bp大小一致的单一目的条带(图2)。结果表明重组质粒成功转化DH5α,将含有重组质粒菌体进行测序,测序结果与合成基因相似度达100%(图3)完全相同,因此判断重组质粒构建成功。
2.1.3重组质粒pPIC9K-sbo的PCR鉴定用试剂盒提取质粒,将重组表达质粒pPIC9K-sbo电击转化感受态毕赤酵母GS115,涂布于MD平板,随机挑阳性克隆,用引物α-factor和3’AOX1进行菌落PCR(图4),进行3%琼脂糖凝胶电泳,获得与pPIC9K载体α因子上下游基因加上目的基因大小总和为318 bp大小一致的单一目的条带,结果表明重组质粒成功转化为GS115。

图4 GS115-pPIC9K-sbo菌落PCR检测阳性克隆Fig.4 Colony PCR identification of positive clones of GS115-pPIC9K-sbo
2.2含重组subtilosin A基因sbo的酵母表达与活性初测
2.2.1重组subtilosin A基因sbo表达产物的Tricine-SDS PAGE分析经验证的重组菌体GS115-pPIC9K-sbo划平板分离,挑单菌落于25 mL BMGY中30℃振荡摇菌过夜,离心收集菌体转移至100 mL BMMY中进行发酵,每24 h添加100%甲醇至发酵液中终浓度为0.5%,发酵60 h后取发酵液高速离心取上清液进行Tricine-SDS PAGE分析,subtilosin A蛋白分子量大小为4.3251 ku,结果(图5)显示subtilosin A通过pPIC9K在毕赤酵母GS115中表达成功。
2.2.2重组subtilosin A基因sbo表达产物的活性测定
取上述发酵60 h发酵液离心后上清液,用0.22 μm滤膜过滤菌体获得粗提的发酵液。以铜绿假单胞菌为指示菌株进行初步的抑菌活力测试,结果见图6,图a为菌液与重组酵母发酵液混合涂板,图b以野生酵母发酵液混合涂板当对照。由于铜绿假单胞菌菌体在生长过程中会分泌绿脓菌素[12],而使培养基带浅绿色。如图显示,对比图b平板,其菌体生长达到一定浓度而使培养基带有浅绿色,而图a平板上明显颜色较浅,说明混有重组基因表达产物的菌体,在生长时受到了抑制,证明发酵产物具有一定的抑菌活力。
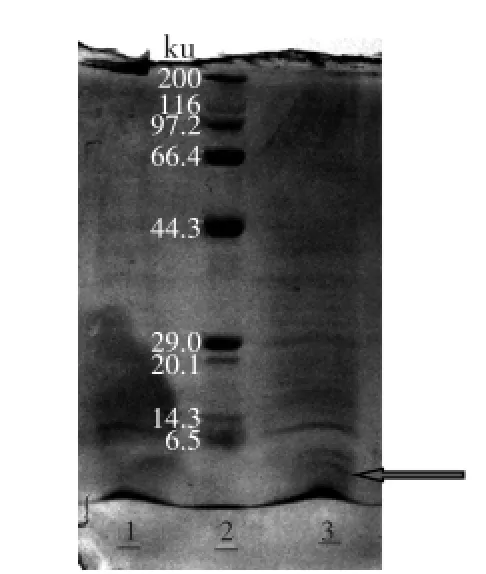
图5 GS115-pPIC9K-sbo发酵液Tricine-SDS PAGE分析Fig.5 Fermentation broth of GS115-pPIC9K-sbo analyzed by Tricine-SDS PAGE

图6 GS115-pPIC9K-sbo发酵液抑菌活力测试Fig.6 Anti-bacteria tested by fermentation broth of GS115-pPIC9K-sbo
3 结论
本实验利用毕赤酵母作为真核生物具有成熟的蛋白加工能力,且毕赤酵母表达系统具有培养易、生长快、表达高等优点,创新性地尝试将枯草芽孢杆菌素subtilosin A在毕赤酵母GS115中进行表达。首先合成并改造subtilosin A的结构基因sbo,连接入pPIC9K穿梭载体中,转化大肠杆菌DH5α中大量克隆,再通过电激转化入毕赤酵母,通过Tricine-SDS PAGE分析显示,subtilosin A已成功于毕赤酵母GS115中表达,进一步以铜绿假单胞菌作为指示菌,初步证明了表达产物具有一定的抑菌活力。然而,本研究的结果显示芽孢杆菌素的表达量依旧偏低,原因可能是芽孢杆菌素属于小分子多肽,在酵母宿主中难以分离且易被酵母胞内酶所降解,导致抑菌活力不稳定,这些问题都有待进一步研究。
[1]Marx R,Stein T,Entian K-D,et al.Structure of the Bacillus subtilis peptide antibiotic subtilosin a determined by H-NMR and matrix assisted laser desorption/ionization time-of-flight mass spectrometry[J].Journal of Protein Chemistry,2001,20(6):501-506.
[2]Babasaki K,Takao T,Shimonishi Y,et al.Subtilosin A,a new antibiotic peptide produced by Bacillus subtilis 168:isolation,structural analysis,and biogenesis[J].Journal of Biochemistry,1985,98(3):585-603.
[3]Zheng guolu,Robin Hehn,Peter Zuber.Mutational Analysis of the sbo alb Locus of Bacillus subtilis:Identification of Genes Required for Subtilosin Production and Immunity[J].Journal of Bacteriology,2000,182(11):3266-3273.
[4]Zheng guolu,YAN LZ,VEDERAS JC,et al.Genes of the sbo-alb Locus of Bacillus subtilis are required for production of the antilisterial bacteriocin subtilosin[J].Journal of Bacteriology,1999,181(23):7346-7355.
[5]Shelburne CE,An FY,Dholpe V,et al.The spectrum of antimicrobial activity of the bacteriocin subtilosin A[J].The Journal of Antimicrobial Chemotherapy,2007,59(2):297-300.
[6]Torres NI,Noll KS,Xu S,et al.Safety,formulation,and in vitro antiviral activity of the antimicrobial peptide subtilosin against herpes simplex virus type 1[J].Probiotics and Antimicrobial Proteins,2013,5(1):26-35.
[7]Noll KS,Prichard MN,Khaykin A,et al.The natural antimicrobial peptide subtilosin acts synergistically with glycerol monolaurate,lauric arginate,and ε-poly-L-lysine against bacterial vaginosis-associated pathogens but not human lactobacilli[J]. Antimicrobial Agents and Chemotherapy,2012,56(4):1756-1761.
[8]胡世界,罗素兰,张吉贞,等.巴斯德毕赤酵母表达系统及其高水平表达策略[J].生物技术,2007,17(6):78-83.
[9]孙会刚,张充,吕凤霞,等.启动子P43表达关键酶基因对subtilosinA合成的调控作用[J].食品工业科技,2013,34(23):164-71.
[10]Liu quanli,Gao guang,Xu haijin,et al.Identification of the bacteriocin subtilosin A and loss of purL results in its high-level productioninBacillusamyloliquefaciens[J].Researchin Microbiology,2012,163(6):470-478.
[11]Schägger H.Tricine-SDS-PAGE[J].Nature Protocols,2006,1:16-22.
[12]陈登宇,夏佩莹,孟庆荣.铜绿假单胞菌L型的诱导及其产绿脓菌素能力的研究[J].实用医药杂志,2008,25(1):77-79.
Synthesis of recombinant gene for Bacillus subtilis bacteriocin subtilosin A and its expression in Pichia pastoris
CHEN Bai-xiong1,HUANG Jia-jun1,LIN Jun-fang1,*,GUO Li-qiong1,*,CHEN Jun-fei2,LIU Ying-li3
(1.Department of Bioengineering,College of Food Science,South China Agricultural University,Institute of Food Biotechnology,South China Agricultural University,Guangzhou 510640,China;2.The School of Chemistry and Pharmaceutical Engineering,Qi-Lu University of Technology,Ji’nan 250353,China;3.Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
In this study,the recombinant gene for subtilosin A(rsbo A)was synthesis for the sake of the expression for this bacteriocin in host cell P.pastoris.Both the results of colony PCR of positive Escherichia coli recombinants and DNA sequencing indicated that recombinant plasmid pPIC9K-sbo was constructed successfully.In addition,the results of colony PCR of positive P.pastoris recombinants indicated that recombinant Pichia GS115-pPIC9K-sbo was constructed successfully.Protein electrophoresis analysis of positive P.pastoris recombinants displayed that the recombinant gene rsbo A was secretory expressed in P.pastoris GS115. Analysis of antimicrobial activity showed that the fermentation broth of this recombinant yeast possess antibacterial activities against P.aeruginosa.The result of this work built a new strategy of bacteriocins,a small molecule peptide,in heterologous expression.The study laid a foundation for industrialized production of Bacillus subtilis antibiotic peptide subtilosin A.
subtilosin A;genetic recombinant;Pichia pastoris;antibacterial activity
TS201.3
A
1002-0306(2016)04-0228-04
10.13386/j.issn1002-0306.2016.04.037
2015-06-01
陈柏雄(1992-),男,硕士研究生,研究方向:微生物基因组学与基因工程,E-mail:bxiong63976@163.com。
林俊芳(1962-),男,研究员,研究方向:天然产物生物工程研究与产品开发,E-mail:linjf@scau.edu.cn。郭丽琼(1963-),女,教授,研究方向:食品微生物和菌类食品研究与开发,E-mail:guolq@scau.edu.cn。
广东省科技计划项目(2015A020209121);广州市科技计划项目(2015Y1-00173);北京市教委一般项目(SQKM201610011004)。
