合成二肽ACE抑制活性及抗高血压初步研究
2016-09-14王建国闫冰雨雷楗勇中山大学生命科学学院有害生物控制与资源利用国家重点实验室广东广州5075广州世优生物科技有限公司广东广州500
王建国,闫冰雨,雷楗勇,吴 越,郭 蕾,邢 珂,*(.中山大学生命科学学院有害生物控制与资源利用国家重点实验室,广东广州5075;.广州世优生物科技有限公司,广东广州500)
合成二肽ACE抑制活性及抗高血压初步研究
王建国1,闫冰雨1,雷楗勇2,吴越1,郭蕾1,邢珂1,*
(1.中山大学生命科学学院有害生物控制与资源利用国家重点实验室,广东广州510275;2.广州世优生物科技有限公司,广东广州510220)
目的:对合成二肽的ACE抑制活性进行系统地筛选,寻找具有高ACE抑制活性的二肽并研究其在动物体内的降血压作用。方法:利用可见光分光光度法对35种合成二肽的ACE抑制活性进行测定,并对具有高ACE抑制活性的二肽进一步测定其IC50值。选取ACE抑制效果最佳的二肽进行原发性高血压大鼠(SHR)降血压实验。实验采用灌胃方法分别以1、10、25、50、100 mg/kg的剂量溶于1 mL生理盐水进行给药,分别于给药后2 h和4 h测量大鼠血压变化。结果:研究发现大部分二肽都具有一定程度的ACE抑制活性,其中以氨基酸序列为半胱氨酸-丙氨酸(Cys-Ala,CA)和半胱氨酸-组氨酸(Cys-His,CH)的二肽ACE抑制活性最高,其ACE抑制率分别达到84.38%和70.79%。经测定CA和CH的IC50值分别为23.22 μmol/L 和61.17 μmol/L。SHR大鼠降血压实验表明CA在体内的降压效果显著。给药后4 h CA降压效果优于给药后2 h,给药后2 h CA降压效果与给药剂量呈较好的正相关性(R2>0.8)。结论:体外ACE抑制率测定及SHR大鼠降血压实验发现合成二肽CA具有较高的ACE抑制活性和较好的体内降血压效果,提示CA可以作为降血压保健食品的添加成分,值得进一步研究。
血管紧张素转化酶,二肽,高血压
高血压是全球最常见的慢性病,是导致心血管病和肾脏病等发生以及死亡的最主要危害因素[1]。人体的血压调节主要是受到血管紧张素系统(reninangiotensin system,RAS)和激肽系统(kallikrein kinin system,KKS)的控制,而血管紧张素转化酶(Angiotensin converting enzyme,ACE)在这两个系统中起着关键的作用[2]。在RAS系统中,ACE能够使没有生理活性的血管紧张素Ⅰ(AngiotensinⅠ,AngⅠ)转化为具有升压活性的血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)。在KKS系统中,ACE可将血管舒缓激肽降解为失活片段,导致血管收缩,引起血压升高[3]。目前高血压的药物治疗主要是对ACE进行抑制,阿利吉仑、卡托普利、依那普利、阿拉普利和赖诺普利都是广泛应用的抗高血压药物。然而,这些药物会引发诸如咳嗽、过敏、味觉紊乱和皮疹等副作用[4],因此,寻找安全可靠、毒副作用小的ACE抑制剂成为抗高血压药物研究的热点。
近年来,相关研究表明一些从动物[5-7]、植物[8]以及乳制品[9]中分离得到的天然生物活性肽具有抑制ACE活性、降低血压的作用[10-11]。相比传统降压药物,这些天然活性肽具有特异性高、毒副作用小、疗效好、可用药剂量更大等优点[12-14]。其中二肽和三肽可以在小肽转运蛋白的帮助下被肠粘膜完整的吸收,因此,这些二肽和三肽对ACE的抑制作用以及降压效果也较为明显[15-16]。目前,尚未有报道对二肽的氨基酸构成以及其ACE抑制活性进行系统的分析研究,本研究旨在系统地对所有种类二肽的ACE抑制活性进行筛选,寻找ACE抑制活性较高的二肽并通过动物实验明确其在体内的降血压效果,为合成高血压治疗药物提供参考。由于实验经费和时间限制,本文仅包含了第一批35种合成二肽的实验结果。
1 材料与方法
1.1材料与仪器
35种合成二肽(名称详见表1)吉尔生化有限公司(人工合成),纯度>95%;卡托普利(Captoril) 西格玛奥德里奇公司,纯度≥98%;呋喃丙烯酰三肽(FAPhe-Gly-Gly,FAPGG) 西格玛奥德里奇公司,纯度≥98%;ACE西格玛奥德里奇公司;原发性高血压大鼠(Spontaneously Hypertensive Rats,SHR) 雄性,31周龄,北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2012-0001,饲养一周适应环境后按每5只一组进行分组;生理盐水山东华鲁制药有限公司。
VICTOR X多标记酶标仪酶标仪铂金埃尔默公司;移液器法国吉尔森公司;BP-98A智能无创血压仪北京软隆生物技术有限公司;注射器上海双鸽实业有限公司;灌胃针上海玻利鸽工贸有限公司;无特定病原体(Specific pathogen-free,SPF)级动物实验室中山大学北校区动物实验大楼。
1.2实验方法
1.2.1ACE抑制率的测定本实验将二肽样本用超纯水溶解后配制20 mg/mL原液,然后稀释成20 μg/mL浓度的样品作为实验组,以0.002 μg/mL的Captoril溶液为阳性对照,以生理盐水为阴性对照。实验于37℃下,以340 nm为主波长检测ACE底物FAPGG的吸光度,以405 nm为参比波长消除噪音影响,检测以3 min为间隔连续检测1 h。根据公式:抑制率(%)=×100,计算样品的抑制率。其中E为样品孔的ACE酶活(U/L),计算公式为E=×115;Ss为样品孔ACE动力学曲线直线段的斜率,Sp为未加抑制剂孔的ACE动力学曲线直线段的斜率,Sb为空白孔ACE动力学曲线直线段的斜率。
1.2.2IC50测定实验将二肽(CA、CH)原液稀释成200 μg/mL浓度的样品作为试样,以20 μg/L浓度的Captoril样品作为阳性对照,对各样品按3浓度倍梯度进行稀释,后按1.2.1所述方法测定样品的ACE抑制率,进而计算IC50值。
1.2.3大鼠降压实验按照如下剂量:Captoril (100 mg/kg)、生理盐水、CA(100、50、25、10、1 mg/kg)将相应药品溶于生理盐水中利用灌胃方式进行给药。利用无创血压仪分别测量大鼠灌胃前、灌胃后2 h、灌胃后4 h后的舒张压(Diastolic Blood Pressure,DBP)、收缩压(Systolic Blood Pressure,SBP)和平均动脉压(Mean Blood Pressure,MBP),取其平均值作为相应的血压值。
1.2.4统计分析数据统计采用R(3.2.1版本)进行平均值、标准差的计算以及两样本均值单尾t检验,数值均以均值±标准误表示。采用R(3.2.1版本)ggplot2包及plot函数作图。
2 结果与讨论
2.135种二肽的ACE抑制率
本研究用可见光分光光度法连续监测35种二肽在1 h内对ACE的抑制活性,结果见表1,发现除氨基酸序列为异亮氨酸-亮氨酸(Ile-Leu,IL)、异亮氨酸-缬氨酸(Ile-Val,IV)和赖氨酸-天冬氨酸(Lys-Asp,KD)的三种二肽外,其余32种二肽都对ACE有不同程度的抑制作用。32种二肽的平均ACE抑制率为12.05%,大部分二肽的ACE抑制率在0%~20%之间,其抑制效果相对较弱,而CA和CH的ACE的抑制效果则较为明显,其抑制率分别达到84.38%和70.79%(图1),极显著高于其他二肽(p<0.01)。相关研究曾发现从鸡蛋清中分离到的序列为亮氨酸-色氨酸(Leu-Trp,LW)的二肽具有ACE抑制活性和抗高血压作用,其ACE抑制IC50值为6.8 μmol/L[17]。本实验测得LW的ACE抑制活性为14.77%,再次证实二肽LW具有ACE抑制作用。然而还未有相关研究对CA和CH的ACE抑制活性及抗高血压作用进行探讨,本研究发现CA和CH具有强于LW的抑制作用。
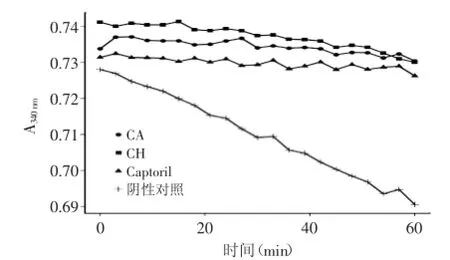
图1 二肽CA和CH的ACE抑制活性Fig.1 ACE inhibitory activities of CA and CH
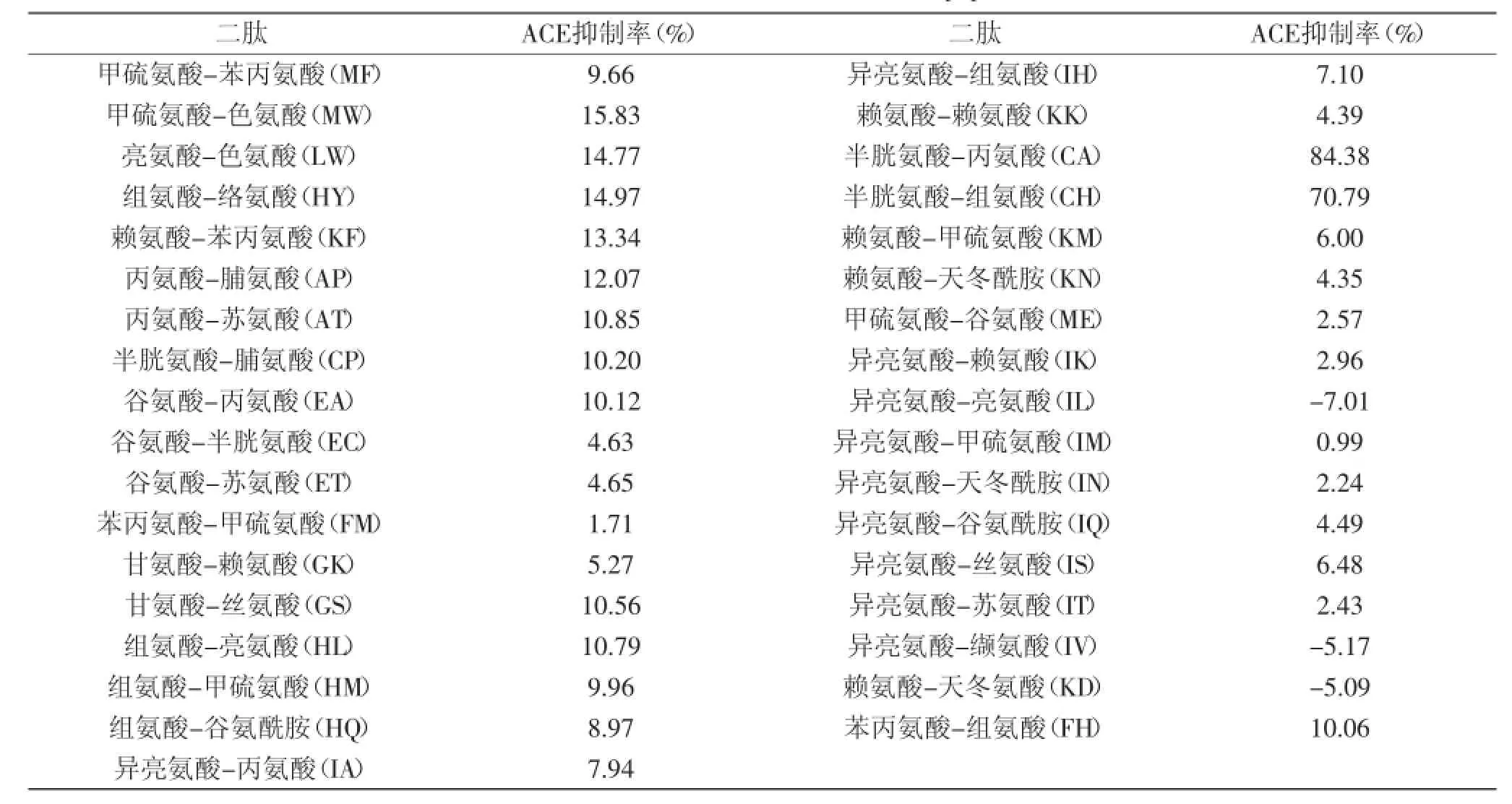
表1 35种二肽的ACE的抑制率Table 1 ACE inhibitor activities of 35 dipeptides
如图1所示1 h连续检测发现CA和CH对ACE的活性有持续稳定的抑制作用,其抑制效果与0.002 μg/mL 的Captoril的作用效果相近。
2.2CA和CH的IC50测定
研究对二肽CA和CH的ACE抑制活性进行更加精确的测定,浓度梯度实验结果显示CA的IC50值为23.22 μmol/L,CH的IC50值为61.17 μmol/L,阳性对照Catopril的IC50值为3.07×10-4μmol/L。
2.3CA体内降血压实验
相关研究表明部分ACE抑制剂的ACE抑制活性与实际降血压作用之间存在差别[18],因此,体外检测所得到的具有高ACE抑制率的二肽是否能在生物体内拥有好的降血压效果还需要进一步的动物实验来验证。在本研究中选用CA进行SHR大鼠降血压实验。用CA、生理盐水和Captoril对SHR大鼠进行灌胃,并分别于给药后2、4 h监测大鼠的血压变化,结果见图2、图3。
如图2所示当CA剂量为1 mg/kg时,给药2 h后SHR大鼠血压无明显改变;当CA剂量达到10 mg/kg时,SHR大鼠血压开始呈下降趋势,其中SBP下降(16.1±4.73)mmHg(p=0.09),下降较为明显。随着CA剂量不断提高,给药2 h后SHR大鼠血压下降幅度进一步增大,当CA剂量达到100 mg/kg时,SBP下降(49.26±10.42)mmHg,DBP下降(45.58±9.27)mmHg,MBP下降(47.01±9.64)mmHg,各指标均极显著低于给药前(p<0.01),降压效果与同等浓度的Catopril无显著差异(p>0.47)。

图2 CA灌胃后2 h SHR大鼠血压改变情况Fig.2 Antihypertensive effects of CA 2 h after oral administration to SHR
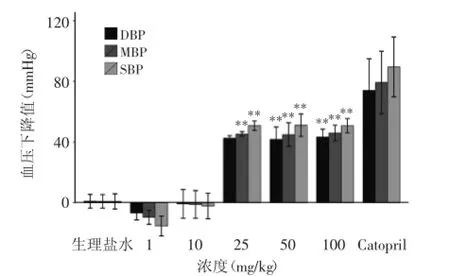
图3 CA灌胃后4 h SHR大鼠血压改变情况Fig.3 Antihypertensive effects of CA 4 h after oral administration to SHR
在给药后4 h继续检测SHR大鼠血压变化。发现当CA剂量为10 mg/kg时,给药后4 h降压作用基本消失(图3)。而当CA剂量达到25 mg/kg时,其降压效果则要优于给药后2 h。以SBP为例,用25 mg/kg的CA灌胃SHR大鼠后4 h的SBP比给药前下降(50.86± 3.16)mmHg(p<0.01),比给药后2 h下降(27.67± 11.02)mmHg(p=0.08);当CA浓度达到50 mg/kg和100 mg/kg时,给药后4 h各血压指标也较给药后2 h低。DBP和MBP的变化与SBP一致。阳性对照Catopril 的DBP、MBP、SBP给药后4 h比给药后2 h分别下降(32.4±14.79)mmHg(p=0.14)、(34.5±14.83)mmHg (p=0.13)、(38.7±15.47)mmHg(p=0.12)。
由图2和图3可以看出,SBP、DBP、MBP下降幅度随着CA剂量的增加整体呈上升趋势。但灌胃后2 h以上各指标下降值与CA剂量呈很好的正相关,而在灌胃后4 h以上各指标变化值与CA剂量呈非线性关系。利用Pearson相关系数分析CA剂量与血压指标灌胃前后的改变量之间的相关性,得到CA对应的各项指标的相关系数。如表2所示,CA灌胃后2 h的各项血压指标的平均改变量与剂量的相关系数R2>0.8(p<0.05),说明CA急性药效与剂量呈一定程度的正相关性,CA急性药效的研究适宜在灌胃后2 h进行采样。图4反映了SHR大鼠给药后2 h,SBP下降幅度随CA剂量增加呈线性增长。以上结果同时显示当CA剂量达到25 mg/kg后,给药后4 h SHR大鼠血压下降幅度不再随剂量增加发生明显改变,SBP下降水平维持在50 mmHg左右。
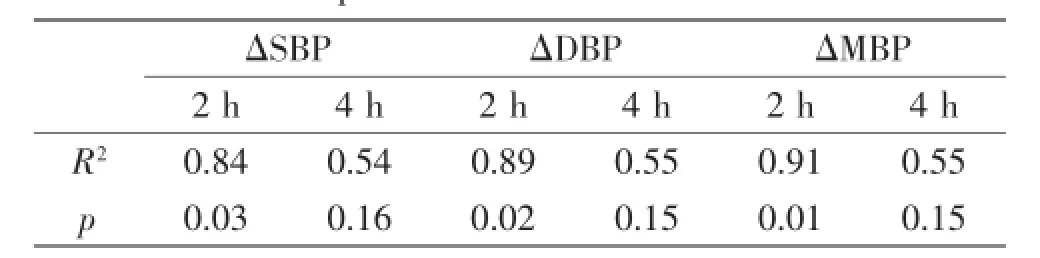
表2 CA剂量与灌胃前后血压变化的Pearson相关系数Table 2 Pearson correlation coefficient of changes of blood pressure and dose of CA

图4 灌胃后2 h SHR大鼠SBP与CA剂量的关系Fig.4 The relationship of SBP at 2 h after oral administration and dosage of CA
针对生物活性肽降血压效果的研究曾显示,不同长度的短肽在SHR大鼠体内的有效作用时间不同。二肽和三肽(如:IW、VW、LW、IY及LKP)因为较容易被肠粘膜完整的吸收,其达到最大药效的时间一般在给药后2 h左右,当时间超过2 h后其降压效果就逐步降低[16-17,19]。而相对长一些的LKPNM、LVGRPRHQG和Captoril的最大药效时间则是在给药后4~8 h不等[17,19]。在本研究中发现,CA在给药4 h后的降压效果优于给药后2 h。分析其原因可能与CA在体内吸收相较其他二肽更慢,或作用半衰期更长有关。
此外,从植物、动物或奶制品中分离得到的具有高ACE抑制活性的生物肽C端多为色氨酸(W)、苯丙氨酸(F)、酪氨酸(Y)和脯氨酸(P),而N端多为脂肪类支链氨基酸如缬氨酸(V)和异亮氨酸(I)[20-22]。氨基酸的构成与短肽和ACE的亲和能力紧密相关。而在本研究中,对35种二肽进行了系统的筛选,发现仅有的两个N端为半胱氨酸的二肽CA和CH的ACE抑制活性明显高于其他二肽。提示N端为半胱氨酸同样有利于二肽和ACE结合,从而提高短肽的ACE抑制活性。这一发现为进一步的生物活性肽的降压研究提供了新的线索。
3 结论
应用可见光分光光度法对35种合成二肽的ACE活性进行测定发现N端为半胱氨酸(Cys)的二肽CA 和CH具有较高的ACE抑制活性,SHR大鼠降血压实验进一步证明CA的体内降压效果明显。由于二肽为生物体内固有的分子,毒副作用相对较小且具有口服降压的可能,因此,二肽分子CA和CH作为降血压药物或抗高血压保健食品添加成分有一定的开发前景。此外,实验结果同时提示研究二肽的ACE抑制活性具有重要科学和应用价值,实验计划进一步完成其余300余种二肽的ACE抑制活性研究。
[1]Abougalambou S S,Abougalambou A S.A study evaluating prevalence of hypertension and risk factors affecting on blood pressure control among type 2 diabetes patients attending teaching hospital in Malaysia[J].Diabetes Metab Syndr,2013,7(2):83-86.
[2]Guang C,Phillips R D.Plant food-derived Angiotensin I converting enzyme inhibitory peptides[J].J Agric Food Chem,2009,57(12):5113-5120.
[3]Eriksson U,Danilczyk U,Penninger J M.Just the beginning:novel functions for angiotensin-converting enzymes[J].Curr Biol,2002,12(21):R745-R752.
[4]Saito M,Sakagami H,Fujisawa S.Cytotoxicity and apoptosis induction by butylated hydroxyanisole(BHA)and butylated hydroxytoluene(BHT)[J].Anticancer Res,2003,23(6C):4693-4701.
[5]Kleekayai T,Harnedy P A,O’keeffe M B,et al.Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J].Food Chem,2015,176:441-447.
[6]Borawska J,Darewicz M,Vegarud G E,et al.Ex vivo digestion of carp muscle tissue--ACE inhibitory and antioxidant activities of the obtained hydrolysates[J].Food Funct,2015,6(1):211-218.
[7]Wang Y K,He H L,Chen X L,et al.Production of novelangiotensinI-convertingenzymeinhibitorypeptidesby fermentation of marine shrimp Acetes chinensis with Lactobacillus fermentum SM 605[J].Appl Microbiol Biotechnol,2008,79(5):785-791.
[8]Hilmi Y,Abushama M F,Abdalgadir H,et al.A study of antioxidant activity,enzymatic inhibition and in vitro toxicity of selected traditional Sudanese plants with anti-diabetic potential [J].BMC Complement Altern Med,2014,14:149.
[9]Norris R,Poyarkov A,O’keeffe M B,et al.Characterisation of the hydrolytic specificity of Aspergillus niger derived prolyl endoproteinase on bovine beta-casein and determination of ACE inhibitory activity[J].Food Chem,2014,156:29-36.
[10]Aihara K,Kajimoto O,Hirata H,et al.Effect of powdered fermented milk with Lactobacillus helveticus on subjects with high-normal blood pressure or mild hypertension[J].J Am Coll Nutr,2005,24(4):257-265.
[11]Balti R,Bougatef A,Sila A,et al.Nine novel angiotensin I-converting enzyme(ACE)inhibitory peptides from cuttlefish(Sepia officinalis)muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J]. Food Chem,2015,170:519-525.
[12]Ishida Y,Shibata Y,Fukuhara I,et al.Effect of an excess intake of casein hydrolysate containing Val-Pro-Pro and Ile-Pro-Pro in subjects with normal blood pressure,high-normal blood pressure,or mild hypertension[J].Biosci Biotechnol Biochem,2011,75(3):427-433.
[13]Yamada A,Sakurai T,Ochi D,et al.Novel angiotensin I-converting enzyme inhibitory peptide derived from bovine casein [J].Food Chem,2013,141(4):3781-3789.
[14]Matsui T,Matsufuji H,Seki E,et al.Inhibition of angiotensin I-converting enzyme by Bacillus licheniformis alkaline protease hydrolyzates derived from sardine muscle[J].Biosci Biotechnol Biochem,1993,57(6):922-925.
[15]Vercruysse L,Van Camp J,Morel N,et al.Ala-Val-Phe and Val-Phe:ACE inhibitory peptides derived from insect protein with antihypertensive activity in spontaneously hypertensive rats [J].Peptides,2010,31(3):482-488.
[16]Marczak E D,Usui H,Fujita H,et al.New antihypertensive peptides isolated from rapeseed[J].Peptides,2003,24(6):791-798.
[17]Hiroyuki Fujita K Y,Masaaki Yoshikawa.Classification and Antihypertensive Activity of Angiotensin I-Converting Enzyme Inhibitory Peptides Derived from Food Proteins[J].Journal of Food Science,2000,65(4):6.
[18]王海燕,张佳程.食品降血压肽的比较与评价方法[J].食品与发酵工业,2001(10):67-70.
[19]Fujita H,Yoshikawa M.LKPNM:a prodrug-type ACE-inhibitorypeptidederivedfromfishprotein[J]. Immunopharmacology,1999,44(1-2):123-127.
[20]Guan-Hong Li G-W L,Yong-Hui Shi,Sundar Shrestha. Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J].Nutrition Research,2004,24:18.
[21]Cheung H S,Cushman D W.Inhibition of homogeneous angiotensin-converting enzyme of rabbit lung by synthetic venom peptides of Bothrops jararaca[J].Biochim Biophys Acta,1973,293(2):451-463.
[22]Byun H G,Kim S K.Structure and activity of angiotensin I converting enzyme inhibitory peptides derived from Alaskan pollack skin[J].J Biochem Mol Biol,2002,35(2):239-243.
A preliminary study of inhibitory activities on angiotensin I-converting enzyme and antihypertensive effects of synthetic dipeptide
WANG Jian-guo1,YAN Bing-yu1,LEI Jian-yong2,WU Yue1,GUO Lei1,XING Ke1,*
(1.State Key Laboratory of Biocontrol,Sun Yat-sen University,Guangzhou 510275,China;2.Withyou Biotech Co.,Ltd.,Guangzhou 510220,China)
Objective:The purpose of this work was to study the inhibitory activities on angiotensin I-converting enzyme(ACE)and the antihypertensive effects of synthetic dipeptides.Methods:The inhibitory activities on ACE of 35 synthetic dipeptides were screened by using ultraviolet and visible spectrophotometry.The IC50of dipeptides with high inhibitory activity was also measured.The antihypertensive effects of dipeptides were subsequently studied in spontaneously hypertensive rats(SHR)at 2 h and 4 h after oral administration diluted in 1 mL normal saline according to the dosages of 1,10,25,50,100 mg/kg,respectively.Results:With the exception of a few dipeptides,most of dipeptides showed ACE inhibitory activities.Among them,Cys-Ala(CA)and Cys-His(CH)were dipeptides with the highest ACE inhibitory activities,of which the ACE inhibition rates were 84.38%and 70.79% respectively.The dose response data showed the IC50values of CA and CH were 23.22 μmol/L and 61.17 μmol/L respectively.The antihypertensive effects of CA in spontaneously hypertensive rats(SHR)were further studied.The data showed obvious antihypertensive effect of CA in SHR.The results also revealed that the antihypertensive effects after 2 h of administration was positively correlated with doses of oral administration(R2>0.8),and the overall antihypertensive effects after 4 h of administration were higher than that after 2 h of administration.Conclusion:Based on the results of determination on in vitro ACE inhibitory activities and in vivo experiments,CA was the dipeptide with high ACE inhibition rate and strong antihypertensive effect,which suggested CA could be used as functional food ingredients with potential therapeutic benefit in the prevention and treatment of hypertension.
angiotensin I-converting enzyme(ACE);dipeptide;hypertension
TS201.1
A
1002-0306(2016)04-0160-05
10.13386/j.issn1002-0306.2016.04.023
2015-07-02
王建国(1992-),男,博士研究生,研究方向:生物信息学,E-mail:wangjg22@mail2.sysu.edu.cn。
邢珂(1977-),男,博士,研究员,研究方向:生物信息学和进化生物学,E-mail:xingk@mail.sysu.edu.cn。
广东省海洋渔业科技推广专项科技攻关与研发项目(A201301C09);广东省科技计划项目(2012A080202006)。
