云南铜色牛肝菌多糖分离纯化及抗氧化活性研究
2016-09-14曾丽萍王心诗吴素蕊赵天瑞昆明理工大学云南省食品安全研究院云南昆明650500中华全国供销合作总社昆明食用菌研究所云南昆明6503
曾丽萍,王心诗,吴素蕊,樊 建,赵天瑞,*(.昆明理工大学云南省食品安全研究院,云南昆明650500;.中华全国供销合作总社昆明食用菌研究所,云南昆明6503)
云南铜色牛肝菌多糖分离纯化及抗氧化活性研究
曾丽萍1,王心诗1,吴素蕊2,樊建1,赵天瑞1,*
(1.昆明理工大学云南省食品安全研究院,云南昆明650500;2.中华全国供销合作总社昆明食用菌研究所,云南昆明650223)
通过对铜色牛肝菌多糖进行分离纯化和活性分析,为野生铜色牛肝菌的进一步推广和应用提供理论依据。本研究采用热水浸提法提取的粗多糖为原料,并利用DEAE-52纤维素柱层析和SephadexG-100柱层析对所获得的粗多糖进行纯化,得到两种单一多糖PB-1A、PB-2A,比旋光度和紫外扫描方法鉴定多糖的纯度。通过体外抗氧化实验评价体系研究,比较铜色牛肝菌粗多糖及纯化后的多糖PB-1A、PB-2A对羟基自由基、DPPH自由基的清除活性以及总还原能力。结果表明:铜色牛肝菌多纯化糖前后的对羟基自由基、DPPH自由基的清除活性以及总还原能力呈现一定效量关系,且均为PB-2A>PB-1A>铜色牛肝菌粗多糖。
云南铜色牛肝菌,多糖,热水浸提法,分离纯化,抗氧化
铜色牛肝菌(Boletus aereus Fr.ex Bull)又名黑牛肝菌、煤色牛肝菌,是一种食药两用的野生真菌[1],具有“低脂肪、低热量、高蛋白”的特点,广泛分布在我国的云南、四川、贵州等地区[2]。
近来,许多研究者对牛肝菌多糖的活性进行了研究,为牛肝菌的开发利用提供了理论基础。赵云霞[3]通过抗氧化实验证明黑牛肝菌多糖对急性酒精损伤小鼠的心脏和脾脏有一定的保护作用;杨立红[4]利用热水浸提的野生食用牛肝菌多糖的研究表明纯化后的多糖总抗氧化性高于粗多糖;黄俊丽[5]对松茸、黑牛肝菌、双孢白蘑菇三种食用菌研究表明黑牛肝菌的还原力最强。在野生牛肝菌市场中,铜色牛肝菌数量相对较大,商品价值高,有降血压、血脂、血糖及抗氧化等功效,具有较强的开发潜力和更广的市场前景[6]。
本文采用热水浸提法对云南野生铜色牛肝菌中的多糖进行提取,利用DEAE-52纤维素层析和SephadexG-100凝胶层析进行分级纯化,并通过体外抗氧化实验研究,考查了粗多糖及纯化后多糖的抗氧化活性,以期为进一步研究其构效关系提供实验基础,同时也为云南地区铜色牛肝菌多糖的开发利用提供一定的理论基础及指导意义。
1 材料与方法
1.1材料与仪器
野生铜色牛肝菌样品购自于云南省易门县;DEAE-52纤维素柱层析填料北京索莱宝科技有限公司;SephadexG-100柱层析填料北京鼎国昌盛生物技术有限责任公司;其他试剂均为分析纯。
Alpha 1-2冷冻干燥机北京五洲东方科技发展有限公司;AL204分析电子天平梅特勒-托利多仪器有限公司;UV-1800PC紫外-可见分光光度计上海美普达仪器有限公司;HH-4数显恒温水浴锅金坛市科析仪器有限公司;LXJ-Ⅱ飞鸽大容量离心机
上海安亭科学仪器厂;OSB-2100旋转蒸发仪上海爱朗仪器有限公司;WZZ-2A自动数显旋光仪上海精贤光电科技有限公司;BSZ-100自动部分收集器重庆杰恒蠕动泵有限公司。
1.2实验方法
1.2.1实验流程新鲜铜色牛肝菌样品→冷冻干燥后粉碎(过60目筛)→热水浸提粗多糖溶液→Sevag法除蛋白→硫酸蒽酮法测多糖含量→精制多糖(透析袋截流分子量7000 u、蒸馏水48 h、冷冻干燥备用)→离子交换柱层析(苯酚-硫酸法跟踪检测)→凝胶过滤(苯酚-硫酸法跟踪检测)→纯度鉴定→抗氧化活性分析。
1.2.2铜色牛肝菌粗多糖的提取参照王心诗[7]对铜色牛肝菌热水浸提的最佳提取工艺。本实验将新鲜的野生铜色牛肝菌于冷冻干燥机中冻干后粉碎至60目备用。准确称取适量的样品,在料液比1∶40 g/mL、水浴温度49℃、浸提时间3.6 h的条件下浸提,反复浸提2次,过滤,合并滤液,浓缩,得到多糖水提物。
1.2.3分离纯化及纯度验证
1.2.3.1DEAE-52纤维素柱层析称取25 mg已脱出蛋白的牛肝菌粗多糖溶于5 mL蒸馏水,进行DEAE-52纤维素层析柱(2.6 cm×60 cm)纯化粗多糖,以5000 r/min离心10 min,取上清液上样,依次用蒸馏水、0.3、0.5 mol/L NaCl溶液进行洗脱,流速控制为1 mL/min,分管收集,每管5 mL,取1 mL利用苯酚-硫酸法跟踪检测[8],直至检测不到糖组分的流出。收集合并主峰的洗脱液绘制洗脱曲线。将超纯水洗脱部分浓缩后透析,冷冻干燥,备用。
1.2.3.2SephadexG-100柱层析称取20 mg DEAE-52分离后的多糖组分,溶于5 mL蒸馏水进行SephadexG-100凝胶层析柱(1.6 cm×80 cm)纯化粗多糖,上样,用蒸馏水进行洗脱,流速控制为0.5 mL/min,分管收集,每管4 mL,取1 mL利用苯酚-硫酸法跟踪检测,直至检测不到糖组分的流出,收集合并主峰的洗脱液,绘制洗脱曲线。收集相应组分冻干备用,进行进一步研究。
1.2.3.3比旋光度测定参照闫景坤[9]方法并略改。在20℃589 nm钠光下测定30%、60%、80%浓度乙醇沉淀物的旋光度值。
1.2.3.4紫外分光度法[10]将纯化后的多糖配制成1 mol/L溶液,在190~700 nm范围内进行紫外光谱扫描,以蒸馏水作空白。
1.2.4铜色牛肝菌多糖的抗氧化活性研究
绿原酸是咖啡生豆的主要成分,咖啡生豆经烘焙后,绿原酸含量明显降低。这是由于绿原酸是由奎宁酸和肉桂酸(或咖啡酸、阿魏酸、香豆酸)形成的内酯,其性质不稳定,在整个烘焙加热过程中,绿原酸酯键断裂,生成一系列非挥发性的内酯和挥发性的酚类(如儿茶酚,愈创木酚等)[12],使得绿原酸含量急剧下降。
1.2.4.1羟基自由基清除能力参照Smirnoff等[11]方法并略作改动,测定铜色牛肝菌多糖对羟基自由基清除活性。分别吸取1 mL不同浓度的铜色牛肝菌多糖溶液于10 mL离心管中,加入1 mL 9.0 mmol/L FeSO4溶液和1 mL 9.0 mmol/L H2O2溶液,摇匀、静置10 min,加入1 mL 9.0 mmol/L水杨酸-乙醇溶液,充分混匀,于37℃恒温水浴锅中保温30 min,以3000 r/min离心15 min,吸取上层清液于比色皿中,在510 nm处测定其吸光值。每个样品做三组平行,以蒸馏水调零。羟基自由基清除率的计算公式如下:
羟自由基清除率(%)=[A0-(Ax-AX0)]/A0×100
式中:Ax:样品组的吸光值;A0:空白对照组;AX0:样品对照组吸光值。
1.2.4.2DPPH自由基清除能力参照李波等[12]方法并略作改动,测定铜色牛肝菌多糖对DPPH自由基清除活性。分别吸取1 mL不同浓度的多糖溶液,加入2 mL 0.05 mmol/L的DPPH-甲醇溶液,充分混合,并在暗处反应30 min,在517 nm处测定其吸光值。每个样品进行三组平行实验,DPPH自由基清除率的计算公式如下:
DPPH清除率(%)=[A0-Ax)]/A0×100
式中:Ax:样品组的吸光值;A0:空白对照组的吸光值。
1.2.5数据处理实验数据的统计使用Oringe 8.5软件,实验数据的差异性分析使用SPSS 19.0软件,其结果表示为平均值±标准差(,n=3)。
2 结果与分析
2.1铜色牛肝菌多糖的分离纯化
2.1.1DEAE-52纤维素柱层析将已脱除蛋白多糖经过蒸馏水、0.3、0.5 mol/L NaCl溶液依次洗脱,洗脱曲线如图1所示。经DEAE-52纤维素柱层析后得到三个洗脱峰分别命名为PB-1(管号10~22)、PB-2(管号110~132)、PB-3(管号209~225)。其中,PB-1与PB-2的峰面积相对较大,含量较多,收集相应部分的洗脱液,透析后冷冻干燥,用于进一步纯化。
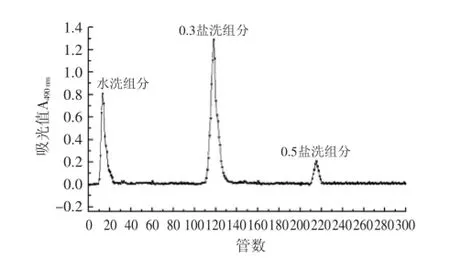
图1 铜色牛肝菌多糖的DEAE-52柱层析洗脱曲线Fig.1 Elution profile of crude polysaccharides extracted from B.aereus on DEAE-52 column
2.1.2SephadexG-100凝胶柱层析通过SephadexG-100凝胶柱层析对PB-1、PB-2进一步纯化,绘制洗脱曲线如图2所示。PB-1、PB-2经过SephadexG-100分离后仍为单一对称峰,说明二者在分子量组成上是均一的。将其分别命名为PB-1A(管号8~21)和PB-2A(管号109~122),收集相应的洗脱液、浓缩,冻干,并用于纯度鉴定,进行抗氧化性研究。
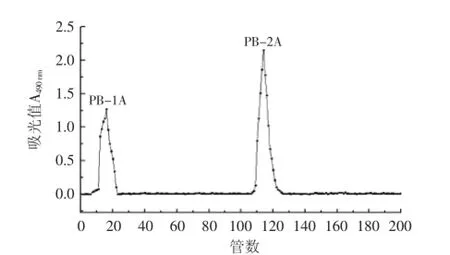
图2 PB-1、PB-2经SephadexG-100的水洗脱曲线Fig.2 The eluted curve with water of PB-1and PB-2 on SephadexG-100
2.2纯度验证
2.2.1比旋光度采用比旋光度法对PB-1A、PB-2A分别进行纯度鉴定,结果如表1所示。在三种乙醇浓度下,PB-1A、PB-2A的比旋光度基本相同,表明两者为相对均一多糖,其比旋光度分别为+42.33°、+31.67°。
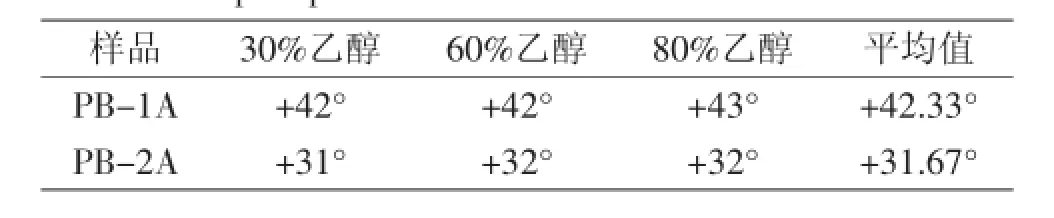
表1 不同浓度乙醇沉淀铜色牛肝菌多糖的比旋光度Table 1 Specificrotator power of polysaccharides of Boletus aereus precipitated with several concentration ethanol
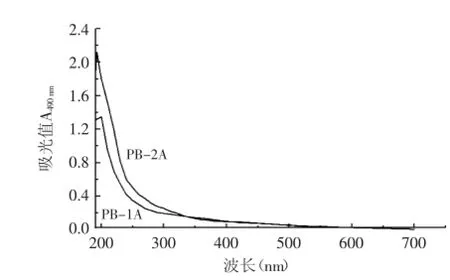
2.2.2紫外扫描图将经SephadexG-100分离纯化后的多糖进行紫外扫描,其扫描结果如图3所示。铜色牛肝菌多糖中的PB-1A、PB-2A在260、280 nm波长处都没有明显的特征吸收峰,表明样品中均不含有核酸和蛋白质,在620 nm处无吸收峰则表明均不含色素类物质。
2.3铜色牛肝菌粗多糖及纯化后的PB-1A、PB-2A多糖的抗氧化活性比较
2.3.1羟基自由基清除能力羟基自由基作为活性氧中最活泼的自由基,其毒性也最大,它几乎能与活细胞中任何分子快速发生反应[14]。由图4可知,PB-1A、PB-2A和铜色牛肝菌粗多糖的羟基自由基清除活性随着多糖的浓度增加而逐步增强。其中,PB-1A、PB-2A和铜色牛肝菌粗多糖的IC50值分别为0.96、0.67、3.29 mg/mL。经方差分析可知,三种多糖的羟基自由基清除率具有显著差异(p<0.05),在同等浓度下,羟基自由基清除能力顺序为:PB-2A>PB-1A>铜色牛肝菌粗多糖。
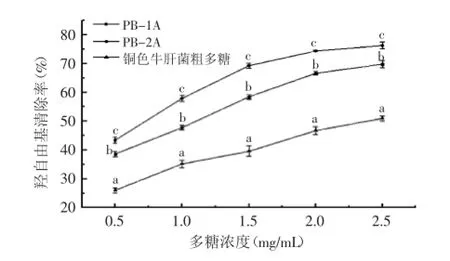
图4 铜色牛肝菌多糖羟基自由基清除活性Fig.4 Hydroxyl radical scavenging capacity of polysaccharide from Boletus aereus
2.3.2DPPH自由基清除能力通过DPPH·乙醇溶液在波长517 nm处有紫色团的强吸收峰,当存在自由基清除剂时,吸收峰减弱或消失,因而可以通过测定吸收减弱程度来评价样品清除自由基的能力[15]。由图5可知,PB-1A、PB-2A和铜色牛肝菌粗多糖的DPPH自由清除活性随着多糖的浓度增加而逐步增强。其中,PB-1A、PB-2A和铜色牛肝菌粗多糖的IC50值分别为0.34、0.14、0.60 mg/mL。经方差分析可知,三种多糖的DPPH自由基清除率具有显著差异(p<0.05),在同等浓度下,DPPH自由基清除能力顺序为:PB-2A>PB-1A>铜色牛肝菌粗多糖。
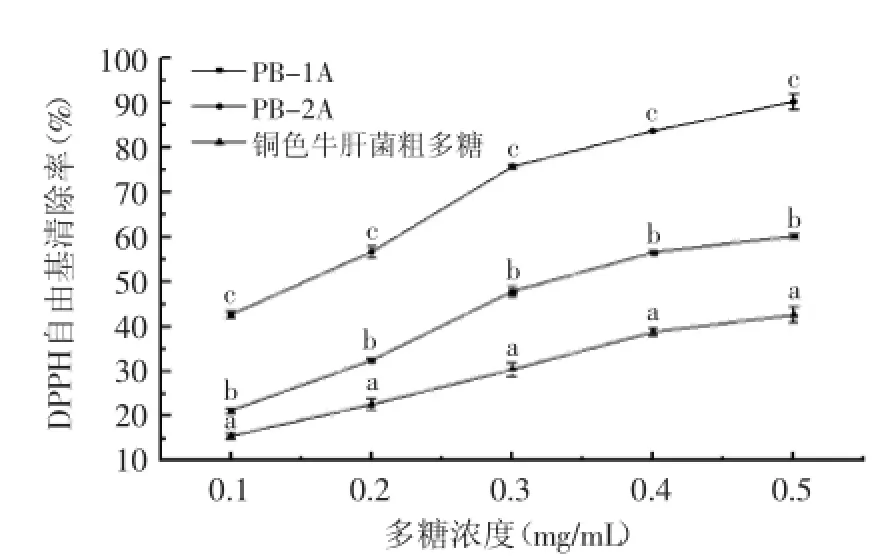
图5 铜色牛肝菌多糖DPPH自由基清除活性Fig.5 DPPH scavenging capacity of polysaccharide from Boletus aereus
2.3.3还原力抗氧化剂的还原力与其抗氧化性活性之间有着密切的关系,即可以通过测定其还原力的强度来说明其抗氧化活性[16]。由图6可知,PB-1A、PB-2A和铜色牛肝菌粗多糖的还原能力随着多糖的浓度增加而逐步增强,经方差分析可知,三种多糖的还原力具有显著差异(p<0.05),在同等浓度下,还原能力顺序为:PB-2A>PB-1A>铜色牛肝菌粗多糖。
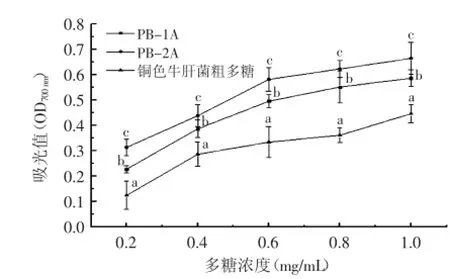
图6 铜色牛肝菌多糖还原能力Fig.6 Reducing power of polysaccharide from Boletus aereus
3 结论
通过DEAE-52离子交换和ScphadexG-l00凝胶过滤将水提的铜色牛肝菌多糖活性组分进行分级纯化,得到两种较纯的单一多糖PB-1A、PB-2A。比较铜色牛肝菌粗多糖、PB-1A及PB-2A的自由基清除能力和还原力,其抗氧化能力为PB-2A>PB-1A>铜色牛肝菌粗多糖。本实验通过探讨纯化方法及抗氧化作用,确定了酸性纯多糖PB-2A的抗氧化作用明显优于其他两种。
[1]张亚光.中国常见食用菌图鉴[M].昆明:云南科技出版社,1999:65.
[2]黄俊丽,张慜.高温蒸汽瞬时漂烫对黑牛肝菌酶活和品质影响的研究[J].食品与生物技术学报,2010,29(5):653-659.
[3]赵云霞,陶眀煊,郭永月,等.黑牛肝菌多糖对酒精性损伤小鼠心脏及脾脏抗氧化作用的研究[J].南京师大学报:自然科学版,2014,37(1):133-136.
[4]杨立红,刘林德,钟旭生,等.野生牛肝菌多糖的分离鉴定及其抗氧化性研究[J].食品科学,2008,29(8):335-338.
[5]黄俊丽,张慜.松茸、黑牛肝菌、双孢白蘑菇提取物体外抗氧化性实验研究[J].食品与生物技术学报,2011,30(3):342-347.
[6]岳万松,熊勇,陈毅坚.云南牛肝菌的内生真菌分离、鉴定和ITS序列特征研究[J].食品工业科技,2014,35(19):172-176.
[7]王心诗,邰丽梅,吴素蕊,等.响应面法优化水提铜色牛肝菌多糖工艺[J].中国食用菌,2015,34(1):60-64.
[8]巴媛媛,王莹,朴美子.苯酚-硫酸法测定瓦尼木层孔菌菌丝体多糖含量的条件优化[J].食品工业科技,2011,32(5):389-391.
[9]闫景坤,李琳,吴建勇.人工培养冬虫夏草胞外多糖的分离纯化研究[J].现代食品科技,2010,26(4):366-369.
[10]陈小娥,方旭波,钟秋琴.蛎菜酸性多糖的分离纯化和降血糖活性研究[J].中国食品学报,2008,8(5):75-79.
[11]Smirnoff N,Cumbes Q.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[12]李波,徐贵华,芦菲,等.七种云南产食用菌的抗氧化活性研究[J].食用菌,2010,32(2):66-67.
[13]Oyaizu M.Studies on products of browning reactions:Antioxidative activities of products ofbrowning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44:307-315.
[14]朱月,李彩霞,毕晓丹.猪苓多糖分级纯化及对羟自由基清除作用的研究[J].安徽农业科学,2011,39(30):18553-18555.
[15]王和才,胡秋辉.DPPH法测定紫红薯提取物清除自由基的能力[J].食品研究与开发,2010,31(1):132-135.
[16]侯秀娟,沈勇根,徐明生,等.化橘红多糖的提取纯化及抗氧化活性研究[J].中国酿造,2012,31(9):135-138.
Purification and antioxidant activity of polysaccharide from Boletus aereus in Yunnan
ZENG Li-ping1,WANG Xin-shi1,WU Su-rui2,FAN Jian1,ZHAO Tian-rui1,*
(1.Yunnan Institute of Food Safety,Kunming University of Science and Technology,Kunming 650500,China;2.Kunming Edible Fungi Institute of All China Federation of Supply of Marketing Cooperative,Kunming 650223,China)
The purification and activity analysis of Boletus aereus polysaccharides can provide a theoretical basis for the further application and popularization of B.aereus.In the present work,crude polysaccharides of Bronze Boletus was extracted by hot water and then successively purified with DEAE-52 ion exchange column and SephadexG-100 gel permeadun column.Two polysaccharides,named PB-1A and PB-2A,were obtained after purification.The purity of obtained polysaccharide was determined by specific rotation method and UV spectral scanning.The total reducing power,hydroxyl free radical and DPPH free radical scavenging activity of crude polysaccharides,PB-1A and PB-2A were determined by in vitro antioxidant evaluation system.The results demonstrated that the total reducing power,hydroxyl free radical and DPPH free radical scavenging activity of B.aereus polysaccharides before and after purification showed a dose-dependent manner,with activities being PB-2A>PB-1A>crude polysaccharides of B.aereus.
Boletus aereus of Yunnan;polysaccharide;extraction with hot water;separation and purification;antioxidant
TS201.1
A
1002-0306(2016)04-0151-04
10.13386/j.issn1002-0306.2016.04.021
2015-07-27
曾丽萍(1990-),女,在读硕士研究生,研究方向:农产品贮藏与加工,E-mail:825767453@qq.com。
赵天瑞(1964-),男,大学本科,副教授,研究方向:农产品加工,E-mail:food363@163.com。
国家科技支撑科技课题(2013BAD16B01)。
