沙门氏菌在鲜切蔬菜中生长行为及其预测模型构建
2016-09-14李建国中国热带农业科学院分析测试中心海南省热带果蔬产品质量安全重点实验室农业部热作产品质量安全风险评估实验室海南海口570黑龙江省农产品质量检验检测中心黑龙江哈尔滨50090
马 晨,李建国,程 景(.中国热带农业科学院分析测试中心,海南省热带果蔬产品质量安全重点实验室,农业部热作产品质量安全风险评估实验室,海南海口570;.黑龙江省农产品质量检验检测中心,黑龙江哈尔滨50090)
沙门氏菌在鲜切蔬菜中生长行为及其预测模型构建
马晨1,李建国1,程景2
(1.中国热带农业科学院分析测试中心,海南省热带果蔬产品质量安全重点实验室,农业部热作产品质量安全风险评估实验室,海南海口571101;2.黑龙江省农产品质量检验检测中心,黑龙江哈尔滨150090)
为揭示沙门氏菌在鲜食蔬菜或调味蔬菜中的生长情况,以蒜苗、香菜、西红柿、黄瓜和小葱为实验对象,点植接种两株沙门氏菌混合菌液(Salmonella enteritidis ATCC 13076和S.newport ATCC 6962),研究不同接种剂量下沙门氏菌在鲜切蔬菜中生长情况,考察不同温度下沙门氏菌在鲜切黄瓜中的动态生长情况,并构建生长模型。结果表明:4℃下,沙门氏菌在所试鲜切蔬菜中均不生长。28℃,高接种剂量下(2.0 log CFU/g和3.0 log CFU/g),沙门氏菌在各种蔬菜中的生长势(δ)在4.25~5.84 log CFU/g之间,表明其在各种蔬菜中生长良好(菌落数量>7.0 log CFU/g)。1.0 log CFU/g接种剂量下,除了黄瓜外,沙门氏菌在其他蔬菜中生长良好(菌落数量约5.0 log CFU/g)。微量接种剂量0.1 log CFU/g,小葱和番茄中沙门氏菌长势尚好(δ>0.5 log CFU/g),其他蔬菜中沙门氏菌不生长(δ<0.5 log CFU/g)。采用Baranyi模型对实测数据进行拟合,结果显示:7、15、20和25℃下沙门氏菌在鲜切黄瓜中的最大比生长速率(μmax)分别为0.026、0.11、0.14和0.29 h-1;7℃和15℃时,迟滞时间分别为24.33 h和9.44 h,20℃和25℃时不经历迟滞期,直接进入对数生长期。采用次级模型Ratkowsky方程描述最大生长速率和储藏温度的关系,模型可靠性较好。所以,蔬菜品种、接种剂量和储藏温度影响沙门氏菌在鲜切蔬菜中的生长。
沙门氏菌,鲜切蔬菜,调味蔬菜,黄瓜,模型构建
沙门氏菌属是最常见的食源性致病菌之一,其危害范围大,可引起各类农产品污染。据估计,美国每年源于沙门氏菌属细菌感染的病例约140万[1]。我国每年发生的细菌性食物中毒事件中,由沙门氏菌引起的食物中毒也屡居首位[2]。所以,关注农产品上沙门氏菌污染情况显得十分重要。除了畜禽等动物性产品,近年来,欧美国家不断爆发新鲜果蔬被沙门氏菌污染事件,并逐年增长[3-5]。生菜、黄瓜、番茄、瓜类、菠菜、豆芽和果蔬沙拉等都曾分离出沙门氏菌[4-5]。为了控制沙门氏菌污染事件的发生,大量学者研究了不同沙门氏菌血清型在各类蔬菜上的存活和生长情况,并开发了多种沙门氏菌防控措施[5-7]。因而,果蔬中致病菌的研究成为农产品质量安全领域的研究热点之一。
由于我国食品消费方式与欧美国家相差较大,大多蔬菜均经过热加工处理后才食用,所以致病菌污染问题一直未受到重视[7]。但是,随着人们饮食观念的转变,蔬菜沙拉、生食蔬菜等逐渐受到人们的喜爱。另外,调味蔬菜如香菜、小葱和蒜苗等是凉拌菜和各类熟菜的必要搭配,一般不经过处理,清洗切碎后直接食用。目前,我国关于新鲜蔬菜上致病菌爆发事件的报道较少,但是研究生食和调味蔬菜上致病菌的生长情况,将为农产品微生物定量风险评估提供基础数据,也是保障农产品质量安全的重要方面。
本实验选取鲜食蔬菜和调味蔬菜蒜苗、香菜、西红柿、黄瓜和小葱为实验对象,研究沙门氏菌在几类鲜切蔬菜中的生长情况,研究不同温度下沙门氏菌在鲜切黄瓜中的生长情况,并构建生长模型。本研究将为蔬菜中沙门氏菌的污染防控提供科学依据。
1 材料与方法
1.1材料与仪器
蒜苗、香菜、西红柿、黄瓜和小葱均购于海口市农贸市场,运回实验室后立即实验或者放置冰箱4℃不超过12 h;沙门氏菌Salmonella enteritidis ATCC 13076,S.newport(ATCC 6962;西红柿爆发分离菌株)均购自美国模式培养物保藏中心(American type culture collection,ATCC)。
HVE-50型自动灭菌锅日本Hirayama;SJ-CJ-1FD型超净工作台苏洁净化;BHC-1300IIB2型苏州金净生物安全柜苏州金净;PYX-250S型生化培养箱广东韶关科力实验仪器有限公司;BagMixer 400拍打式匀质器法国INTERSCIENCE公司。
1.2样品处理及接种方法
1.2.1蔬菜样品处理新鲜蔬菜去掉受损叶片,自来水洗净沥干。在无菌室用灭菌刀具将其切成2 cm× 2 cm×2 cm立方体或长条,置于200 mg/kg次氯酸钠溶液10 min,无菌水漂洗4次,取出后置于无菌超净工作台中自然晾干。称取10 g样品于无菌样品袋中,备用。
1.2.2接种液制备及样品接种菌种冻干培养物划线接种于大豆酪蛋白琼脂(TSA)固体培养基,37℃培养24 h。挑取单菌落接种于胰酪胨大豆肉汤(TSB)液体培养基,37℃培养18~24 h。4℃,4000×g离心10 min,弃上清,用0.1%蛋白胨水悬浮,按上述条件离心2次。等体积混合两种菌株悬浮液,稀释菌液浓度至8.0 log CFU/mL左右。梯度稀释制成稀释度为1.0、2.0、3.0和4.0 log CFU/mL菌液,待用。
取1 mL接种液,用50 μL移液枪分20次均匀点植接种在样品中,置于生物安全柜中2 h自然晾干,使接种液中的菌体充分附着在样品上[8]。不同鲜切蔬菜中样品最终接种量大约为0.1、1.0、2.0和3.0 log CFU/g,储藏温度为4℃和28℃。研究不同温度条件下鲜切黄瓜生长情况的实验中,沙门氏菌最终接种量为3.0 log CFU/g沙门氏菌,储藏温度为7、15、20和25℃。
1.3沙门氏菌计数方法和应用模型
1.3.1沙门氏菌计数不同鲜切蔬菜中沙门氏菌生长情况的实验中,4℃储存6 d后计数,28℃储存2 d后计数。不同温度下鲜切黄瓜中沙门氏菌生长情况实验中,储藏7 d,7℃每天取样,15和20℃每12 h取样,25℃第1 d每4 h取样,后期每12 h取样。定时取样,加入90 mL无菌BPW缓冲蛋白胨水,匀质拍打2 min后,无菌生理盐水梯度稀释,选择合适的梯度稀释液0.1 mL涂布亚硫酸铋琼脂(BS)和木糖赖氨酸脱氧胆盐琼脂(XLD),37℃培养48 h,统计平板上沙门氏菌数量,以log CFU/g为单位[8]。
1.3.2应用模型应用ComBase数据库的在线软件DMFit version 2015(ComBase online http://browser. combase.cc/DMFit.aspx)拟合沙门氏菌在不同温度下鲜切黄瓜中的生长情况。应用Baranyi模型(初级模型)[8],该模型表述如下:

式中:Y0,Ymax,Y(t)分别表示初始菌数、最大菌数和t时间菌数,单位为log CFU/g。μmax表示比生长速率(h-1),λ表示迟滞时间(h),q0表示初始时细胞的生理状态。
采用次级模型Ratkowsky square-root描述μ与储藏温度的关系[9],模型表述如下:
式中:μmax表示比生长速率(h-1),T表示实测温度,T0表示微生物生长的理论最低温度,℃。
1.4数据处理与分析
生长势(δ)计算方法为沙门氏菌终浓度(4℃第2 d和28℃第6 d)与初始浓度差值,均以log CFU/g为单位。当δ>0.5 log CFU/g时,认为食品基质可以支持致病菌生长;δ<0.5 log CFU/g时,认为食品基质不支持致病菌的生长[6]。以上数据应用DMFit软件数据拟合,Origin 8.0软件作图和分析。次级模型采用IPMP version 2013软件进行拟合。
每种蔬菜做两份样品三个重复。数据显著性分析采用基于Tukey检验的单因素方差分析(ANOVA)(p≤0.05判断为差异显著,p>0.05判断为差异不显著,由Origin 8.0分析所得)。
采用均方根误差(Root Mean Square Error,RMSE)、准确因子(Accuracy factor,Af)和偏差因子(Bias factor,Bf)对预测值和实测值进行分析检验,以评价建立的动力学模型的可靠性。RMSE越小,表示模型预测值的离散程度越小。偏差因子(Bf)表示模型的结构偏差(Structural deviations),即低估预测或高估预测的程度,一般0.90<Bf<1.05,模型为最好;0.70<Bf<0.90 或1.06<Bf<1.15,模型为可接受;Bf<0.70或Bf>1.15模型不可接受。偏差因子不能表示参数估计的平均准确性,因此常结合准确因子(Af)来对模型进行数学检验,Af值越大表示平均值准确性越低,而Af值等于1表示预测值与观测值之间完全吻合。RMSE、准确因子和偏差因子表达式如下:

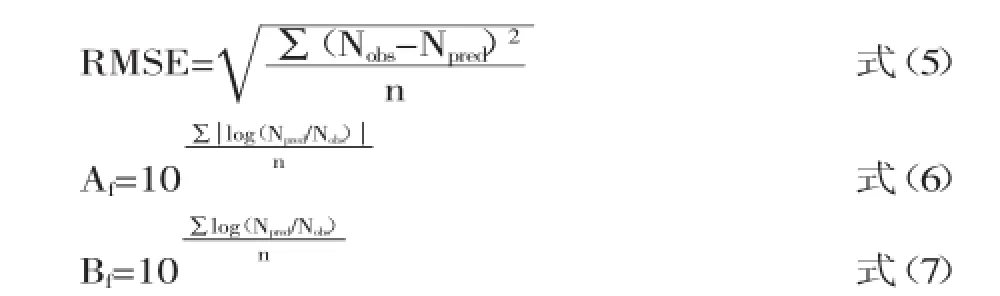
式中,Nobs表示沙门氏菌数量实测值,Npred表示应用模型预测得到的沙门氏菌相应数量,n是实验次数。
2 结果与讨论
2.1沙门氏菌在鲜切蔬菜中生长情况
4℃储藏6 d后,沙门氏菌在各类鲜切蔬菜中的数量与初始量相当(图1a),表明此温度下沙门氏菌不生长。与本文相似,其他报道证明,4~5℃条件下沙门氏菌在苹果、芒果、西瓜、卷心菜、生菜等鲜切果蔬中生长也受到抑制[10-12]。图1b表示28℃储存2 d后,不同接种剂量下,沙门氏菌在5种鲜切蔬菜中的生长情况。结果显示,随着沙门氏菌接种剂量增大,每种蔬菜中沙门氏菌的最终数量基本呈上升趋势(同初始量相比)。高接种剂量下(2.0 log CFU/g和3.0 log CFU/g),各种蔬菜中沙门氏菌最终数量均超过7.0 log CFU/g。1.0 log CFU/g接种剂量下,黄瓜中沙门氏菌几乎没有生长,其他蔬菜中最终沙门氏菌数量在5.0 log CFU/g左右。微量接种剂量0.1 log CFU/g下,小葱和番茄中沙门氏菌长势尚好,其他蔬菜中沙门氏菌生长较差。所以,蔬菜品种和接种剂量影响沙门氏菌在鲜切蔬菜中的生长行为。
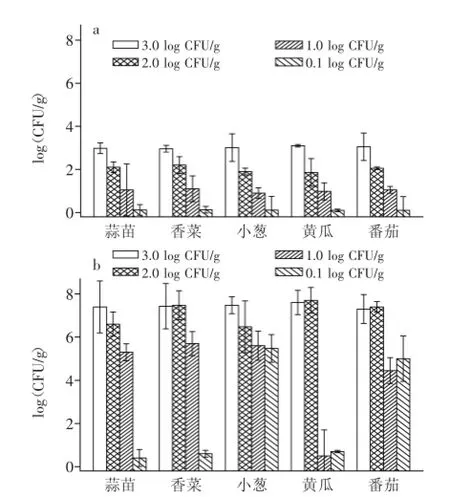
图1 沙门氏菌在不同鲜切蔬菜中生长情况(4℃和28℃)Fig.1 Behaviour of Salmonella sp.in different fresh-cut vegetables(4℃and 28℃)
除了番茄外(pH4.2~4.5),其他蔬菜pH均大于6.0,均在沙门氏菌生长的最适范围(pH6.2~7.2)[6]。28℃,沙门氏菌在各种鲜切蔬菜中的生长势(growth potential,δ)如表1所示。SantAna等报道[6],当δ>0.5 log CFU/g时,认为食品基质可以支持致病菌的生长;δ<0.5 log CFU/g时,认为食品基质不支持致病菌的生长。表1结果显示,1.0、2.0和3.0 log CFU/g接种剂量下(1.0 log CFU/g时黄瓜除外),沙门氏菌在各种蔬菜中的生长势在3.39~5.84 log CFU/g之间,表明各种蔬菜均是沙门氏菌生长的良好基质。微量接种剂量下(0.1 log CFU/g),沙门氏菌在小葱和番茄中生长势较高,可支持沙门氏菌生长,其他三种蔬菜不支持沙门氏菌生长(δ<0.5 log CFU/g)。沙门氏菌在5种蔬菜中的生长势随着接种剂量的增加而增加,在最高接种剂量3.0 log CFU/g时,稍有下降。差异显著性分析表明,同种蔬菜不同接种剂量下的沙门氏菌生长势存在显著差异(p<0.05),相同接种剂量下不同蔬菜间的沙门氏菌生长势也存在明显差异(p<0.05)。
沙门氏菌在黄瓜和番茄上的生长情况研究较多,特别是沙门氏菌与西红柿相互作用的分子机制已揭示。Pan等报道[13],25~35℃条件下,番茄中沙门氏菌数量约增长5~6 log CFU/g(初始接种剂量为2.0 log CFU/g)。10、20和30℃下,沙门氏菌可在黄瓜中生长,数量约增长1.6~1.8 log CFU/g(20和30℃)[14]。Campbell等[15]报道了由香菜引起的沙门氏菌爆发事件,常温下Thompson血清型菌株在切碎香菜中生长迅速,26℃下数量约增长3~4 log CFU/g。另外,生葱中也曾分离出鼠伤寒沙门氏菌和纽波特沙门氏菌[16]。目前还没有蒜苗中沙门氏菌的研究。本实验得到的结果与以上报道基本相似。
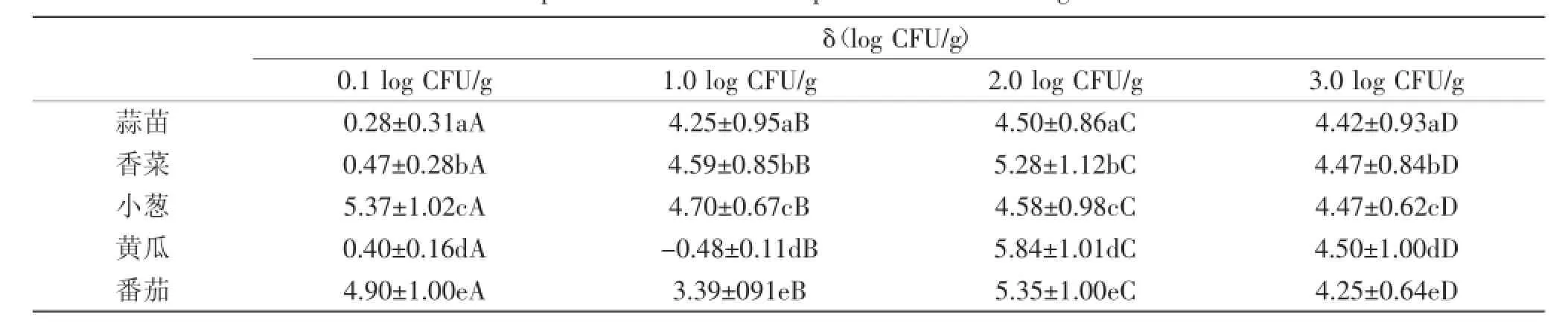
表1 沙门氏菌在鲜切蔬菜中的生长势(28℃)Table 1 Growth potential of Salmonella sp.in five fresh-cut vegetables(28℃)
2.2不同温度下沙门氏菌在鲜切黄瓜中的生长情况黄瓜是深受人们喜爱的蔬菜,常用来凉拌或生食。因而,黄瓜上的微生物质量安全值得关注。沙门氏菌在7、15、20和25℃条件下的生长曲线如图2所示(接种剂量3.0 log CFU/g)。7℃下,沙门氏菌在鲜切黄瓜中生长缓慢,经过较长的迟滞期。其他温度下,沙门氏菌数量经过对数生长期,并逐渐到达稳定期。采用Baranyi和Robert模型拟合不同温度下沙门氏菌在鲜切黄瓜中的生长参数,结果如表2所示。回归系数(R2)在0.93~0.98,说明此模型对实验数据的拟合度较好。比生长速率(μmax)随着温度的增加而增加。从25℃到7℃,μmax分别为0.29、0.14、0.11和0.026 h-1。随着储藏温度的升高,沙门氏菌的生长迟滞期逐渐降低,7℃和15℃时,迟滞时间(λ)分别为24.33 h和9.44 h,20℃和25℃时,沙门氏菌生长不经历迟滞期,数量直接升高。随着储藏温度的升高,沙门氏菌最大菌落数(Nmax)也随之增大(见表2)。所以,储藏温度影响沙门氏菌在鲜切蔬菜中的生长行为。降低储藏温度是降低细菌污染和蔬菜保鲜的有效方式。

表2 不同温度下沙门氏菌在鲜切黄瓜中生长参数的拟合结果Table 2 Growth parameters of Salmonella in cucumber stored at different temperatures
采用次级模型Ratkowsky square-root模型描述μmax与储藏温度的关系。Ratkowsky模型的均方根误差(RMSE)为0.068。不同温度下,沙门氏菌在鲜切黄瓜中生长观测值的偏差因子和准确因子如表3所示。本实验的研究结果表明,各组Bf值都在0.90~1.05之间,本实验的模型属于最好类型。Af在1.01~1.22之间,接近于1,说明预测值和实测值吻合性较好。所以,建立的生长预测模型能较好地预测7~25℃下沙门氏菌在鲜切黄瓜上的生长状况。
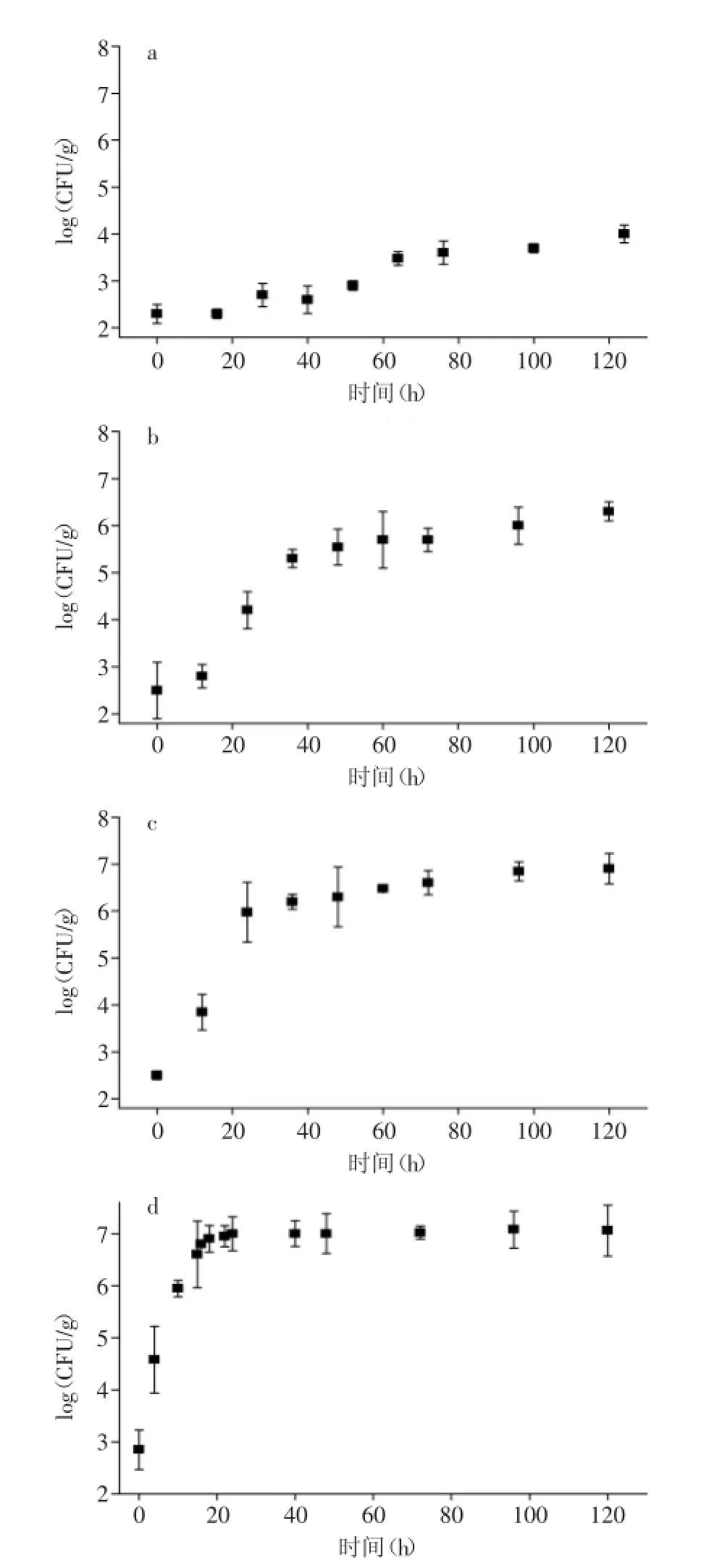
图2 不同温度下沙门氏菌在鲜切黄瓜中生长趋势Fig.2 Growth of Samonella on cucumber at different temputure
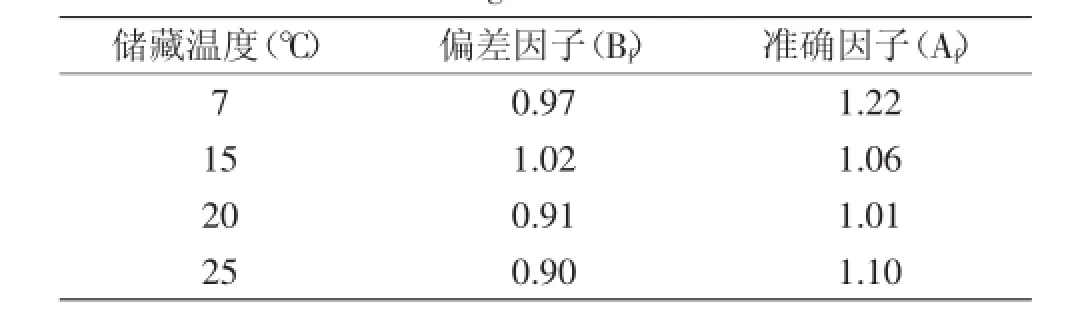
表3 不同温度下沙门氏菌在黄瓜中生长预测值的偏差因子和准确因子Table 3 Mathematical validations of secondary model of Salmonella grown on cucumber
本文得到的结果与文献[8]中沙门氏菌在即食生菜上生长参数的研究结果相似。文献[8]中,7、15、20 和25℃下,三株沙门氏菌在生菜中的平均比生长速率分别为0.06、0.12、0.16和0.31 h-1。迟滞时间分别为26.7、5.9、4.5和1.9 h。本文得到的沙门氏菌在黄瓜中的最大比生长速率和迟滞时间与此报道相似。与罗婵等的报道相比[10],相同温度下沙门氏菌在鲜切生菜和卷心菜中的生长参数均低于本文得到的相关参数。多种因素共同影响沙门氏菌在蔬菜中的生长情况,比如菌株血清型、接种剂量、蔬菜品种、蔬菜基质中背景微生物数量,蔬菜切割面大小等[11]。所以,本实验的结果与此文献的差异可能由多种因素引起,蔬菜品种和沙门氏菌菌株血清型可能是主要原因。
3 结论
本研究不同接种剂量下沙门氏菌在鲜切蔬菜中生长情况,4℃下,沙门氏菌均不生长。28℃,沙门氏菌在各种蔬菜中生长良好。微量接种剂量0.1 log CFU/g下,小葱和番茄中沙门氏菌长势尚好(δ>0.5 log CFU/g)。选用Baranyi模型为初级模型,拟合鲜切黄瓜中沙门氏菌在7、15、20和25℃的生长参数(相关系数R2≥0.93)。采用次级模型Ratkowsky方程描述最大生长速率和储藏温度的关系,通过均方根误差、准确因子和偏差因子对模型进行可靠性评价,该模型的可靠性较好。本结果将为鲜食蔬菜上微生物定量风险评估提供基础数据。
[1]Newell D G,Koopmans M,Verhoe L,et al.Food-borne diseases-the challenges of 20 years ago still persist while new onescontinuetoemerge[J].InternationalJournalofFood Microbiology,2010,139:S3-S15.
[2]Yang B W,Qu D,Zhang X L,et al.Prevalence and characterizationofSalmonellaserovarsinretailmeatsof marketplace in Shaanxi,China[J].International Journal of Food Microbiology,2010,141(1-2):63-72.
[3]Lynch M F,Tauxe R V,Hedberg C W.The growing burden of foodborn outbreaks due to contaminated fresh produce:Risks and opportunities[J].Epidemiology and Infection,2009,137:307-315.
[4]Brandl M T,Cox C E,Teplitski M.Salmonella interactions with plants and their associated microbiota[J].Phytopathology,2013,103(4):316-325.
[5]Deering A J,Mauer L J,Pruitt R E.Internalization of E.coli O157∶H7 and Salmonella spp.in plants:A review[J].Food Research International,2012,45(2):567-575.
[6]Sant’Ana A S,Barbosa M S,Destro M T,et al.Growth potential of Salmonella spp.and Listeria monocytogenes in nine types of ready-to-eat vegetables stored at variable temperature conditions during shelf-life[J].International Journal of Food Microbiology,2012,157(1):52-58.
[7]刘一倩,易欣欣.新鲜蔬果中食源性致病细菌研究进展[J].生物技术通报,2014,27(4):19-24.
[8]Sant’Ana A S,Franco B D,Schaffner D W.Modeling the growth rate and lag time of different strains of Salmonella enterica and Listeria monocytogenes in ready-to-eat lettuce[J]. Food Microbiology,2012,30(1):267-273.
[9]Ratkowsky D A,Olley J,McMeekin TA,et al.Relationship between temperature and growth rate of bacterial cultures[J]. Journal of Bacteriology,1982,149:1-5.
[10]罗婵,陈安均,崔慧玲,等.肠炎沙门氏菌在鲜切果蔬中的动态生长变化[J].食品与发酵工业,2013,39(7):24-29.
[11]Sim H L,Hong Y K,Yoon W B,et al.Behavior of Salmonella spp.and natural microbiota on fresh-cut dragon fruits at different storage temperatures[J].International Journal of Food Microbiology,2013,160:239-244.
[12]Ukuku DO,Sapers GM.Effect of time before storage and storage temperature on survival of Salmonella inoculated on fresh-cut melons[J].Food Microbiology,2007,24:288-295.
[13]Pan W,Dw S.Modeling the growth of Salmonella in cut red round tomatoes as a function of temperature[J].Journal of Food Protection,2010,73:1502-1505.
[14]Likotrafiti E,Anagnou M,Lampiri P,et al.Effect of storage temperature on the behaviour of Escherichia coli O157∶H7 and Salmonella enterica serotype Typhimurium on salad vegetables [J].Journal of Food Research,2014,3(2):1-8.
[15]Campbell J V,Mohle-Boetani J,Reporter R,et al.An outbreak of Salmonella serotype Thompson associated with fresh cilantro [J].Journal of Infectious Diseases,2001,183(6):984-987.
[16]郑华英,刁平,朱焰,等.从直接食用的生葱中检出沙门氏菌的报告[J].中国食品卫生杂志,2004,16(3):248-249.
Behaviour of Salmonella sp.on fresh-cut vegetables and predictive models for growth
MA Chen1,LI Jian-guo1,CHENG Jing2
(1.Hainan Provincial Key Laboratory of Quality and Safety for Tropical Fruits and Vegetables,Ministry of Agriculture Laboratory of Quality&Safety Risk Assessment for Tropical Products,Analysis and Testing Center Chinese Academy of Tropical Agriculture Science,Haikou 571101,China;2.Quality Inspection and Test Center for Agricultural Products of Heilongjiang Province,Harbin 150090,China)
In order to investigate the behaviour of Salmonella in raw-eaten vegetables or seasoned vegetables,a cocktail of two serovars(Salmonella enteritidis ATCC 13076 and S.newport ATCC 6962)were spot inoculated into fresh-cut vegetables(garlic sprout,cilantro,tomato,cucumber and shallot)with four inoculum levels(0.1,1.0,2.0 and 3.0 log CFU/g).Growth kinetics of Salmonella in fresh-cut cucumber at different temperatures were also studied and predictive models were used for fitting the growth data.Results indicated that no obvious growth of Salmonella was observed in all the tested vegetables at 4℃for 6 days.At 28℃,growth potential(δ)of Salmonella in all tested vegetables were between 3.39 and 5.28 at the high inoculum levels of 2.0 and 3.0 log CFU/g,indicating good growth of Salmonella in all vegetables(maximum populations>7.0 log CFU/g).At 1.0 log CFU/g inoculum levels,Salmonella grew well in all tested vegetables with maximum populations of about 5.0 log CFU/g,except in cucumber at the low inoculum levels of 0.1 log CFU/g,Salmonella grew only in tomato and shallot(δ>0.5 log CFU/g),and no obvious growth was observed in other three vegetables(δ<0.5 log CFU/g).Growth curves for each culture condition in cucumber were built separately by fitting data to the Baranyi model.The results indicated that specific growth rate(μmax)of Salmonella in fresh-cut cucumber were 0.026,0.11,0.14 and 0.29 h-1at 7,15,20 and 25℃respectively and lag time was 24.33 h and 9.44 h at7℃and 15℃.However,there was no lag time at 20℃ and 25℃.The Ratkowsky square-root model was used to describe maximum growth rate as a function of storage temperature and the mathematical models were validated.Thus,vegetable kinds,inoculum dose and storage temperature all had an impact on the behaviour of Salmonella in fresh-cut vegetables.
Salmonella;fresh-cut vegetables;seasoned vegetable;cucumber;predictive model
2015-07-17
马晨(1986-),女,博士,研究方向:食品和环境微生物,E-mail:mc19860112@163.com。
中国热带农业科学院院本级基本科研业务费专项资金(1630052014010);海南省自然科学基金(20153163);蔬菜产品未知危害因子识别与已知危害因子安全性评估(GJFP2015001)。
TS201.3
A
1002-0306(2016)04-0123-05
10.13386/j.issn1002-0306.2016.04.015
