TNFAIP3/A20协同地塞米松在重症急性胰腺炎发生早期的保护作用
2016-09-14陈丽舒杨元生陈垦陈杏田刘少波广东药科大学临床学院广东广州500广东药科大学第二附属医院消化内科广东广州5000广东药科大学中药学院广东广州50006
陈丽舒,杨元生,陈垦,陈杏田,刘少波(.广东药科大学 临床学院,广东 广州 500;.广东药科大学第二附属医院 消化内科,广东广州5000;.广东药科大学中药学院,广东广州50006)
TNFAIP3/A20协同地塞米松在重症急性胰腺炎发生早期的保护作用
陈丽舒1,杨元生2,陈垦1,陈杏田1,刘少波3
(1.广东药科大学 临床学院,广东 广州 510310;2.广东药科大学第二附属医院 消化内科,广东广州510300;3.广东药科大学中药学院,广东广州510006)
目的了解肿瘤坏死因子诱导蛋白3(TNFAIP3/A20)在重症急性胰腺炎(SAP)起病早期胰腺中的表达情况,并探讨TNFAIP3/A20协同地塞米松(DEX)在重症急性胰腺炎早期发挥的作用。方法96只SD大鼠随机分为空白组(SO组)、重症急性胰腺炎组(SAP组)、地塞米松组(DEX组),3组于2、6、12、24 h时间点每组分别处死8只。SAP组和DEX组用牛黄胆酸钠诱导大鼠建立SAP模型,DEX组大鼠下肢肌注0.5 mg/100 g地塞米松进行治疗,其余两组不干预。HE染色观察胰腺、肝脏病理损伤,碘比色法测血清淀粉酶(AMS)含量,ELISA法检测胰腺组织NF-κB、IκB表达量,RT-PCR法检测胰腺组织中TNFAIP3/A20 mRNA表达量。比较3组大鼠不同时段上述指标的差异。结果24 h DEX组胰腺炎症损伤较SAP组减轻;各时间点DEX组血清AMS较SAP组降低(P<0.01);各时间点SAP组、DEX组血清AMS均较 SO组升高(P<0.01)。各时间点 DEX组较 SAP组胰腺组织中 NF-κB、IκB含量降低(P<0.01)。各时间点DEX组较SAP组胰腺组织TNFAIP3/A20 mRNA含量表达升高(P<0.05),且随时间推移呈递增趋势。各时间点DEX组、SAP组胰腺炎症损伤评分、血清AMS、组织NF-κB、IκB、A20含量较SO组升高。结论TNFAIP3/A20可能协同DEX在SAP疾病发生早期发挥保护作用。
肿瘤坏死因子诱导蛋白3;核因子-κB抑制蛋白;重症急性胰腺炎;地塞米松
重症急性胰腺炎(sever acute pancreatitis,SAP)是临床常见的消化系统疾病,其中20%~25%的病人病情易加重,可出现局部或全身并发症、多器官功能衰竭甚至威胁生命。研究指出IKK/IκB/NF-κB信号通路在多种急、慢性疾病中都发挥重要作用,参与了炎症细胞增殖、分化、凋亡等生物过程。而地塞米松(dexamethasone,DEX)为临床治疗SAP常用药物,能明显缓解患者腹痛、腹胀症状,其作用可能与抑制促炎细胞因子产生及减少中性粒细胞聚集有关。本文探讨IKK/IκB/NF-κB抑制蛋白TNF-α诱导蛋白3协同DEX在SAP疾病早期对胰腺组织炎症反应的保护作用。
1 材料
1.1实验动物与分组
SPF级SD雌性大鼠96只,8周龄,体质量(200 ±40)g,广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2013-0002。96只大鼠按照随机数字表法随机分为空白组(SO组)、SAP组、DEX组,每组分为2 h、6 h、12 h、24 h 4个时间点组,每时间点各8只,适应性饲养1周。
1.2试剂与仪器
5%(ρ)牛黄胆酸钠、DEX(Sigma公司);戊巴比妥钠(鼎国生物技术公司);752紫外分光光度计(上海凌光公司);酶标仪 iMark(BIO-RAD公司);Scanspeed 1730R低温离心机(Labogene公司);DNP-9162电热恒温培养箱(上海精宏公司);C1000 Thermal cycler普通PCR仪(BIO-RAD公司);7300荧光定量仪(ABI公司);UV Transilluminator M-26凝聚成像系统(UVP公司);EPS-300电泳仪(Tanon公司);显微数码照相机(Leica公司);大鼠NF-κB ELISA试剂盒(邦奕生物技术公司);淀粉酶试剂盒(南京建成生物工程研究所);TNF-α诱导蛋白3兔抗大鼠抗体(Santa cruze公司);二抗山羊抗兔(中杉金桥公司);DAB显色剂(Novolink公司)。
2 方法
2.1SAP模型建立及标本采集
应用5%(ρ)牛黄胆酸钠(sodium taurocholate,STC)逆向胰胆管静推诱导大鼠SAP模型,用微泵缓慢泵入5%STC(0.1 mL/100 g,0.3 mL/min),注射完2~3 min后观察到胰腺充血、肿胀、胰胆管均扩张。SO组仅开腹有翻动肠管和胰腺之后关腹。两组大鼠均于术后在大腿皮下注射生理盐水(2 mL/100 g),于2、6、12、24 h时间点用3%(ρ)戊巴比妥钠麻醉大鼠后心脏取血(4 mL)处死大鼠,血液室温放置2 h,1 000 r/min离心 10 min,取上层血清分装入 EP管内-70℃冻存备用,留取胰腺组织标本后冻存于液氮。
2.2病理切片
所有大鼠均取相同部位的胰腺组织大小约1 cm×1 cm×0.5 cm,生理盐水洗净后,4%(φ)多聚甲醛溶液固定24 h、脱水、脱脂、石蜡包埋、切片及HE染色。显微镜下观察各时间点病理变化结果,并用Kusske大鼠胰腺病理组织学评分标准[1]进行评分。
2.3血清淀粉酶(serum amylase,AMS)检测
取备用血清采用碘-淀粉比色法检测血清AMS的含量,按照说明书配好待测溶液,利用752紫外分光光度计于波长606 nm下测量样本A值,用标准品绘制A值曲线,根据公式计算出样本AMS含量。
2.4ELISA法检测胰腺NF-κB、IκB含量
将胰腺组织剪成细小碎片,溶解裂解液RIPA使用前加入 1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF),以每20 mg组织200 mL裂解液比例加入裂解液,50 mg组织用玻璃匀浆器充分匀浆裂解,2 000~3 000 r/min,离心20 min左右收集上清。采用间接夹心ELISA法,按照说明书进行包被,加样,加酶标抗体,显色,终止反应等步骤后得出A值,利用标准品绘制的A值曲线得出样本的最终浓度。
2.5RT-PCR法检测胰腺中肿瘤坏死因子诱导蛋白3(TNF-alpha-inducedprotein3,TNFAIP3/A20)mRNA的表达情况
2.5.1引物设计 GenBank上查找目的基因mRNA序列,在 CDS区设计特异性引物,运用 Primer express 2.0软件进行引物设计:Sequence Name: R-A20(扩增片段长度102 bp)
Forward Primer:5′-TGAGCGTTGTCACAATGCG-3′Reverse Primer:5′-ATGCCGTTAAACGTCCGAGT-3′。内参基因:
Sequence Name:R-GAPDH(扩增片段长度110 bp)Forward Primer:5′-AGGGCTGCCTTCTCTTGTGA-3′Reverse Primer:5′-AACTTGCCGTGGGTAGAGTCA-3′。
2.5.2组织总RNA提取 在超净台内,取约0.5 g胰腺组织于EP管内,剪碎后加Trizol 1 mL再用玻璃棒研磨匀浆,混匀,室温放置5 min,加入氯仿0.2 mL,振荡15 s,室温孵育2~3 min,4℃ 12 000 r/min离心15 min,取上清液至新的1.5 mL EP管。加入上清液等体积的异丙醇,混匀,-20℃孵育样品20~30 min,4℃12 000 r/min离心10 min,弃上清。75% (φ)乙醇800 μL洗涤沉淀1次,4℃7 500 r/min离心5 min,弃乙醇。真空干燥5~10 min,加DEPC处理水20~50 μL溶解RNA,-80℃备用。
2.5.3PCR反应 待测样本PCR反应体系为H2O 18 μL,10×PCR buffer 2.5 μL,dNTPS 0.5 μL,TAQ 0.5 μL,Forward Primer(10 pmol/μL)0.5 μL,Reverse Primer(10 pmol/μL)0.5 μL,cDNA 2 μL,总体积25 μL。扩增条件为93℃ 2 min,然后93℃15 s,55℃25 s,72℃25 s,共40循环。结果应用相对定量法-Ct值的定量方法,ΔCt=Ct目的基因-Ct内参基因,△△Ct=ΔCt-△Ct最大值,样本的相对表达量=2-△△Ct。
2.6统计学处理
3 结果
3.13组大鼠各时间点胰腺的病理变化
SO组大鼠胰腺组织结构完好,无明显变化。SAP组:2 h组腺泡细胞结构完整,少量单核细胞渗出;6 h组有中量单核细胞渗出,少量出血;12 h组细胞组织结构混乱,出血,出现凝固性坏死;24 h组腺泡细胞结构混乱,大片坏死,出血,见表1、图1。DEX组:2 h组腺泡细胞结构完整,未见单核细胞渗出,6 h组有少量单核细胞渗出,无出血,12 h组细胞结构较为完整,出现单核细胞渗出,24 h组织出现少量凝固性坏死,无明显出血。DEX组病理评分较SAP组降低,差异有统计学意义(P<0.01)。见表1。
3.2各时间点3组AMS含量的变化
SAP组、DEX组血清AMS均较SO组升高(P<0.01),且随时间点推移呈递增趋势,DEX组血清AMS较SAP组降低(P<0.01),SO组随时间点无明显变化。见表2。
表1 3组各时间点胰腺病理评分比较Table 1 Scores of pancreatic pathology in three groups at different times(,n=8)
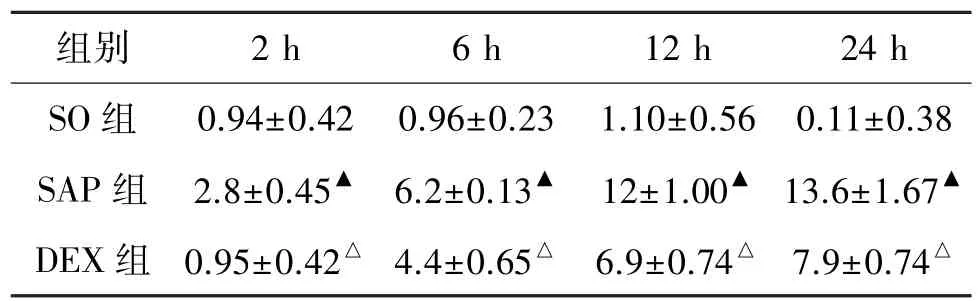
表1 3组各时间点胰腺病理评分比较Table 1 Scores of pancreatic pathology in three groups at different times(,n=8)
与SO组比较:▲P<0.01;与SAP组比较:△P<0.01。
组别 2 h 6 h 12 h 24 h SO组 0.94±0.42 0.96±0.23 1.10±0.56 0.11±0.38 SAP组 2.8±0.45▲ 6.2±0.13▲ 12±1.00▲ 13.6±1.67▲DEX组 0.95±0.42△ 4.4±0.65△ 6.9±0.74△ 7.9±0.74△
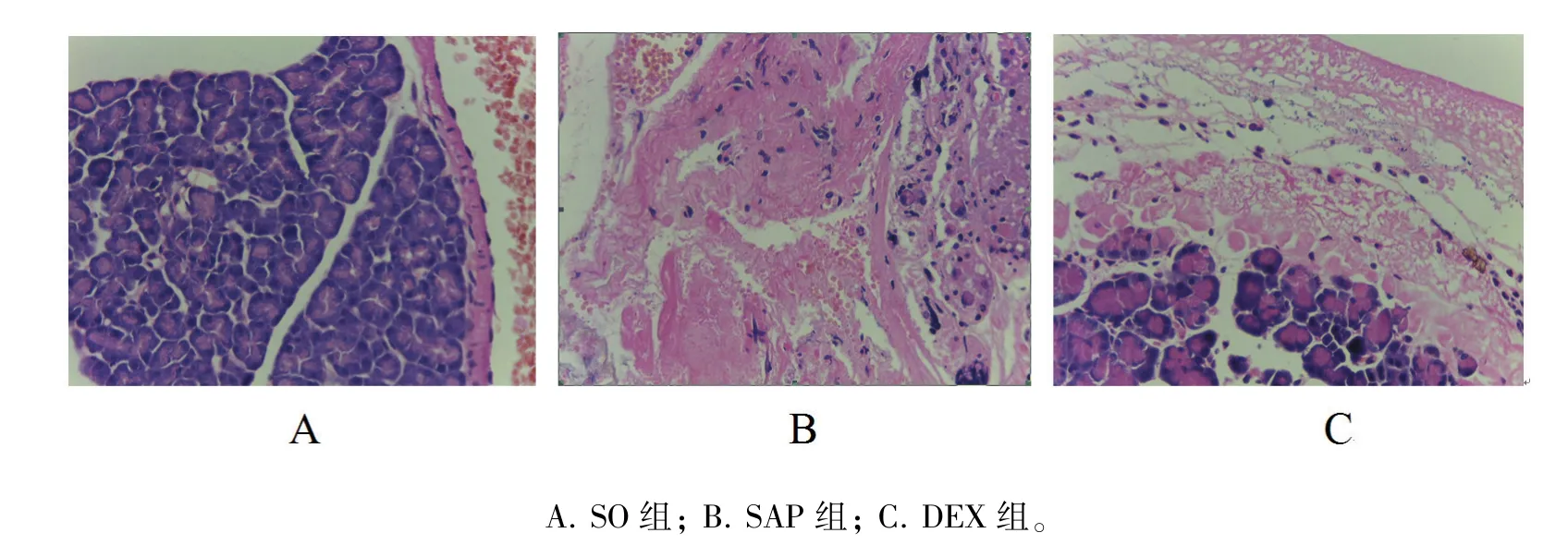
图1 HE染色各组胰腺组织镜下病理改变(HE,400×)Figure 1 Pathology of pancreatic tissue in 24 h by HE staining(HE,400×)
3.3 各时间点3组间胰腺中NF-κB、IκB含量的比较
各时间点DEX组NF-κB含量较SAP组降低(P <0.01),SAP组、DEX组胰腺NF-κB含量随时间推移逐渐升高且与SO组差异明显(P<0.01),SO组各时间点间无明显变化。各时间点DEX组胰腺IκB含量较SAP组降低(P<0.01),SAP组、DEX组胰腺IκB随时间推移逐渐升高且与SO组差异明显(P< 0.01),SO组各时间点间无明显变化。见表3。
3.4各组大鼠胰腺TNFAIP3/A20 mRNA的表达结果
DEX组各时间点TNFAIP3/A20 mRNA含量较SAP组增加(P<0.01),DEX组胰腺A20 mRNA表达随时间推移递增趋势明显(P<0.01),且较SO组明显增加(P<0.05)。见表4。
表2 各时间点3组之间血清AMS含量的比较Table 2 Level of serum amylase in three groups at different times(,n=8) ρ/(U·L-1)

表2 各时间点3组之间血清AMS含量的比较Table 2 Level of serum amylase in three groups at different times(,n=8) ρ/(U·L-1)
与SO组比较:▲P<0.01;与SAP组比较:△P<0.01。
组别 2 h 6 h 12 h 24 h SO组 573.3±124.9 582.6±103.6 580.0±124.9 579.3±103.5 SAP组 1 580.0±330.5▲ 1 863.3±259.3▲ 3 560.0±591.9▲ 4 076.7±637.7▲DEX组 791.7±100.6△ 1 291.0±241.4△ 2 480.7±329.6△ 3 119.0±203.3△
表3 不同时间点3组胰腺NF-κB、IκB含量的比较Table 3 Levels of NF-κB and IκB in three groups at different times(,n=8) ρ/(U·L-1)
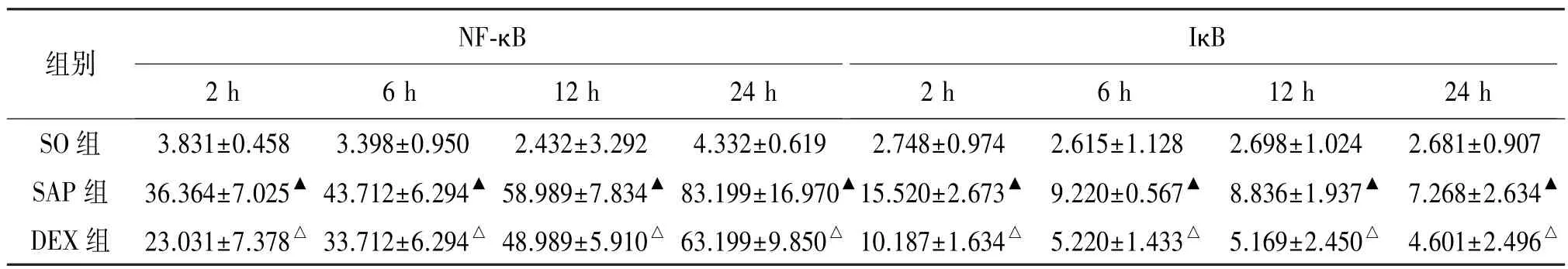
表3 不同时间点3组胰腺NF-κB、IκB含量的比较Table 3 Levels of NF-κB and IκB in three groups at different times(,n=8) ρ/(U·L-1)
与SO组比较:▲P<0.01;与SAP组比较:△P<0.01。
组别 NF-κB IκB 2 h 6 h 12 h 24 h 2 h 6 h 12 h 24 h SO组 3.831±0.458 3.398±0.950 2.432±3.292 4.332±0.619 2.748±0.974 2.615±1.128 2.698±1.024 2.681±0.907 SAP组 36.364±7.025▲43.712±6.294▲58.989±7.834▲83.199±16.970▲15.520±2.673▲ 9.220±0.567▲ 8.836±1.937▲ 7.268±2.634▲DEX组 23.031±7.378△33.712±6.294△48.989±5.910△63.199±9.850△10.187±1.634△ 5.220±1.433△ 5.169±2.450△ 4.601±2.496△
表4 不同时间点两组之间胰腺TNFAIP3/A20 mRNA含量的比较Table 4 Expression of pancreatic TNFAIP3/A20 mRNA in three groups at different times(,n=3)

表4 不同时间点两组之间胰腺TNFAIP3/A20 mRNA含量的比较Table 4 Expression of pancreatic TNFAIP3/A20 mRNA in three groups at different times(,n=3)
与SAP组比较:▲P<0.01;与SO组比较,△P<0.05。
组别 2 h 6 h 12 h 24 h SO组 6.246±3.208 6.122±2.688 6.405±3.160 6.595±3.109 SAP组 8.615±4.188▲ 20.509±1.539▲ 21.582±5.547▲ 28.917±10.679▲DEX组 9.859±7.906△ 39.678±17.557△ 94.323±13.555△ 344.232±68.410△
4 讨论
SAP迄今仍无特效药,其起病机制涉及NF-κB等炎症通路的激活引起的机体免疫应答反应。NF-κB参与免疫反应的早期和炎症反应各阶段,AIPTNF3/A20、血红素加氧酶-1、肿瘤坏死因子受体相关因子-1等受NF-κB双向调控[2],JAK2被EPO受体活化激活NF-κB,STAT1与TNF-α受体结合以下调 NF-κB,而 MAPK/ERK激酶-1及其家族中p38、ERK1/2可激活NF-κB[3],可见NF-κB激活或抑制过程中受多种因子调控。AIPTNF3/A20作为炎性负调节关键分子,通过泛素化影响NF-κB的胞内信号转导从而减轻炎症损伤[4]。本研究旨在探究TNFAIP3/A20协同DEX在SAP疾病早期对NF-κB/IκB信号通路的抑制作用,为临床诊疗提供理论基础。
IκB(inhibitor of NF-κB,IκB)通过C端锚蛋白重复序列与NF-κB结合以抑制NF-κB活化。本实验结果显示,DEX组、SAP组大鼠胰腺组织NF-κB、IκB含量较SO组升高,DEX组、SAP组炎症损伤程度与NF-κB、IκB含量增加趋势成正比。可能由于胰腺细胞内MyD88介导NF-κB/IκB信号通路激活IκB激酶复合体(IκB kinase,IKK)后使IκB磷酸化,NF-κB暴露核定位位点,游离NF-κB移位到细胞核,与特异性κB序列结合,NF-κB/IκB信号通路被激活,启动炎性细胞因子转录[5],诱发SAP早期炎症。
DEX早期药理作用为减轻组织渗出、水肿、毛细血管扩张、白细胞浸润及吞噬反应的作用。本研究结果显示,DEX组较SAP组胰腺组织炎症损伤减轻,血清AMS降低。推测可能由于DEX通过糖皮质激素受体(glucocorticoid reccptor,GR)结合后形成激素-受体复合体转移到细胞核中,以同型二聚体形式与糖皮质激素应答原件(GRE)结合,影响靶基因转录[6],激活膜结合蛋白等抗炎蛋白的翻译以减轻SAP大鼠早期炎症损伤。而TNFAIP3/A20为编码790氨基酸的90 000含有7个调控NF-κB所必需的Cys2-Cys2锌指(zincfinger,ZnF)基序的TNF-α诱导性表达蛋白,其基因定位于染色体6q23.3[7]。DEX组较SAP组胰腺组织中 NF-κB、IκB含量降低,TNFAIP3/A20含量升高。TNFAIP3/A20具有与调节分子TAX1BP1联合并与E2酶接触,引起泛素化合蛋白酶体降解,从而抑制炎症信号传导通路传导的作用[8]。吴丽娟等[9]研究结果表明 TNFAIP3/ A20对人单核细胞LPS/NF-κB/IκB具有明显调节作用,能下调NF-κB、TNF-α表达;TNFAIP3/A20为TNF-α抑制蛋白,刘纳新等[10]研究表明DEX治疗可下调TNF-α并使得SAP炎症缓解。本研究结果提示DEX可能协同TNFAIP3/A20对SAP大鼠胰腺组织NF-κB/IκB信号通路起到一定的抑制作用。
本实验中 DEX组较 SAP组胰腺组织TNFAIP3/A20 mRNA含量表达升高,DEX组与SAP组均较SO组升高,推测SAP模型大鼠起病早期胰腺内NF-κB/IκB信号通路被激活致炎症损伤逐步加重,刺激TNFAIP3/A20升高但不足以逆转炎症反应;DEX组胰腺内TNFAIP3/A20较SAP组大幅升高,炎症损伤较SAP组缓解;而SO组各时间点NF-κB、IκB、TNFAIP3/A20含量未发生明显变化。推测TNFAIP3/A20可能存在抑制IκB作用从而阻断NF-κB/IκB信号通路转导,并协同DEX抑制SAP大鼠胰腺炎症的发生发展,其分子调节机制有待进一步深究。
[1]杨超,范红,岳伟,等.短期间歇性闭合式腹腔灌洗治疗大鼠早期重症胰腺炎的免疫机制[J].世界华人消化杂志,2013,21(8)641-646.
[2]ICHIKAWA K,OHSHIMA D,SAGARA H.Regulation of signal transduction by spatial parameters:a case in NF-κB oscillation[J].IET Syst Biol,2015,9(2):41-51.
[3]王念林,陈垦,龙友明,等.核因子-κB在大鼠急性坏死性胰腺炎中作用的实验研究[J].中华胰腺病杂志,2005,5 (2):93-96.
[4]YUK J M,KIM T S,KIM S Y.Orphan nuclear receptor ERRα controls macrophage metabolic signaling and a20 expression to negatively regulate TLR-induced inflammation [J].Immunity,2015,43(1):80-91.
[5]WANG J,ZHU R,SUN D.Ntracellular uptake of curcuminloaded solid lipid nanoparticles exhibit anti-inflammatory activities superior to those of curcumin through the NF-κB signaling pathway[J].J Biom Nanotechnol,2015,1(3): 403-415.
[6]KHOSRAVANIAN H,RAZI M,FAROKHI F,et al. Simultaneous administration of dexamethasone and vitamin ereversedexperimentalvaricocele-inducedimpactin testicular tissue in rats;correlation with Hsp70-2 chaperone expression[J].Int Braz J Urol,2015,41(4):773-790.
[7]李扬秋,杨力建,陈少华,等.从炎症调节因子到肿瘤抑制因子-A20的特点及其在淋巴细胞肿瘤发生中的作用[J].循证医学,2011,11(1):54-59.
[8]MELE A,CERVANTES J R,CHIEN V.Single nucleotide polymorphisms at the TNFAIP3/A20 locus and susceptibility/ resistance to inflammatory and autoimmune diseases[J]. Adv Exp Med Biol,2014,8(9):163-183.
[9]吴丽娟,刘国栋,陈伟.锌指蛋白A20对人单核细胞LPS应答的影响[J].第三军医大学学报,2007,9(14):1388-1390.
[10]刘纳新,刘存丽,施红旗,等.乌司他丁、地塞米松对急性坏死性胰腺炎大鼠TNF-α、IL-10和GR的影响[J].肝胆胰外科杂志,2008,20(5):336-339.
(责任编辑:幸建华)
Protection of TNFAIP3/A20 coordinated with dexamethasone in early stage of severe acute pancreatitis
CHEN Lishu1,YANG Yuansheng2,CHEN Ken1,CHEN Xingtian1,LIU Shaobo3
(1.ClinicalMedicalCollege,GuangdongPharmaceuticalUniversity,Guangzhou510310,China;2.Departmentof Gastroenterology,the Second Affiliate Hospital of Guangdong Pharmaceutical University,Guangzhou 510310,China;3.Traditional Chinese Medicine College,Guangdong Pharmaceutical University,Guangzhou 510006,China)
Objective To study the expression of tumor necrosis factor-inducible protein 3(TNFAIP3/A20)in pancreas during the early onset of severe acute pancreatitis(SAP),and the effect of TNFAIP3/A20 coordinated with dexamethasone(DEX)in the early stage of SAP.Methods 96 SD rats were randomly divided into three groups,including the SO group,the SAP group and the DEX group.The model of SAP was established by sodium taurocholate treatment.Eight SD rats were killed in each group at 2,6,12 and 24 h.The pathological damage of pancreas and liver was observed by HE staining.Serum amylase(AMS)was detected by iodine-starch colorimetry.The expression of NF-κB and IκB was measured by ELISA.TNFAIP3/A20 mRNA in pancreas was detected by RT-PCR.Results Compared with the SAP group,DEX treatment attenuated the inflammatory injury in pancreas at 24 h,and decreased serum AMS level and NF-κB and IκB expression at different times(P<0.01).In contrast,DEX treatment increased the expression of TNFAIP3/A20 mRNA in pancreas(P<0.05).Conclusion TNFAIP3/A20 coordinated with dexamethasone might play a protective role in the early stage of severe acute pancreatitis.
tumor necrosis factor-inducible protein 3;nuclear factor-κB inhibitory protein;severe acute pancreatitis;dexamethasone
R657.5+1
A
1006-8783(2016)04-0507-05
10.16809/j.cnki.1006-8783.2015111601
2015-11-16
广东省科技厅社会发展项目(2012B060300029)
陈丽舒(1990—),女,2013级硕士研究生,Email:chenlishu90@163.com;通信作者:陈垦,男,教授,主任医师,硕士研究生导师,主要从事胰腺病学临床与基础研究,Email:chenkenck@126.com。
网络出版时间:2016-04-26 10:56 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160426.1056.002.html
