双氢青蒿素促胃癌细胞凋亡的作用
2016-09-14尤琪张卉宁黎昆东张巨峰广东药科大学中药学院生命科学与生物制药学院广东广州50006
尤琪,张卉宁,黎昆东,张巨峰(广东药科大学.中药学院;.生命科学与生物制药学院,广东广州50006)
双氢青蒿素促胃癌细胞凋亡的作用
尤琪1,张卉宁2,黎昆东2,张巨峰2
(广东药科大学1.中药学院;2.生命科学与生物制药学院,广东广州510006)
目的研究双氢青蒿素(dihydroartemisinin,DHA)对人胃癌细胞 (SGC-7901、HGC-27)生长抑制和促凋亡的作用。方法用WST-1方法检测DHA处理后的胃癌细胞增殖情况,流式细胞术检测细胞周期和凋亡情况,细胞划痕实验检测细胞的迁移能力。结果 不同浓度的DHA可以抑制胃癌细胞(SGC-7901、HGC-27)的增殖,且呈现浓度依赖性增长趋势。DHA作用48 h后,胃癌细胞的周期阻滞在S期,同时有诱导胃癌细胞凋亡的作用;DHA作用24 h和48 h后,对胃癌细胞的迁移能力有抑制作用。结论DHA可有效地抑制胃癌细胞的增殖,并促进其凋亡。
双氢青蒿素;胃癌细胞;细胞增殖;细胞凋亡
根据2013年“全球癌症负担系列研究”统计的癌症数据显示,在中国,胃癌的发病率26.84%,死亡率23.55%,均高于全球水平,分别位居肿瘤发病率的第2位、死亡率的第3位[1]。目前,治疗胃癌以手术并结合药物化疗为主,但较高的复发率以及化疗药物引起的并发症等缺点[2],使多靶点治疗、毒副作用较小的中药及其单体成为潜在的抗肿瘤药物[3-4]。青蒿素是中药植物青蒿中提取的环状倍半萜类化合物,具有良好的抗恶性疟疾作用,由于难溶于水,影响了其疗效的发挥,因此合成了抗疟效价高、速效、低毒的青蒿素衍生物——双氢青蒿素(dihydroartemisinin,DHA)。近年来发现,DHA对肝癌、宫颈癌、骨肉瘤等肿瘤细胞的生长有明显的抑制作用[5-8],但关于胃癌细胞的研究尚未报道。本实验以人胃癌细胞系作为研究对象,研究DHA抑制胃癌细胞增殖的作用,为中药抗肿瘤药物的开发提供依据。
1 材料与方法
1.1主要试剂
双氢青蒿素(奥伦生物公司);Opti-MEM培养基(美国Gibco公司);胎牛血清(Life TechnologiesTM公司);0.25%胰酶溶液(美国Technologies公司);PBS磷酸缓冲液(美国ThermoFisher公司);WST-1细胞增殖及细胞毒性检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(碧云天公司)。
1.2方法
1.2.1WST-1实验 取对数生长期的胃癌细胞,调整细胞的浓度为105/mL,取100 μL接种于96孔板。细胞贴壁后,加入不同浓度的DHA(0.78、1.56、3.13、6.25、12.50 μmol/L),每个浓度设4个平行孔,继续培养48 h,每孔加入10 μL WST-1溶液,37℃继续培养3 h,测定450 nm处的各孔吸光值 (A值)。按照公式,抑制率=1-×100%,计算细胞增殖抑制率。绘制以浓度为横坐标,抑制率为纵坐标的细胞增殖抑制图。
1.2.2流式细胞仪检测细胞周期 采用PI染色法检测细胞周期,取胃癌细胞3×105/孔接种于6孔板中,设未处理的胃癌细胞为对照组,经过DHA处理的作为处理组。分别以DHA浓度为6.25 μmol/L的作用于SGC-7901细胞,浓度为1.56 μmol/L的作用于HGC-27细胞,经过48 h处理后,收集细胞,用PBS洗涤细胞3次,加入预冷的70%(φ)乙醇,4℃固定过夜,加入PBS洗涤2次,弃上清后每管加入PI工作液,混匀细胞,然后在室温下避光孵育30 min后上流式细胞仪检测。
1.2.3流式细胞仪检测细胞凋亡 取胃癌细胞3× 105/孔接种于6孔板中,分别设置对照组和处理组,作用于细胞48 h后,收集细胞于流式管中,预冷的PBS洗涤2次,加入195 μL的Annexin V-FITC结合液,轻轻重悬细胞,加入5 μL Annexin V-FITC和10 μL碘化丙啶染色液,轻轻混匀,室温避光孵育10~20 min,上流式细胞仪进行检测。
1.2.4划痕实验 用记号笔在6孔板背后用直尺均匀地划横线,每条线相隔约0.5~1 cm,横穿过每孔。其中每孔至少穿过5条线。取对数生长期的胃癌细胞,调整细胞浓度3×105/mL,以每孔2 mL的接种量接种于6孔板中,培养24 h,加入DHA后分别培养24 h、48 h,在显微镜下观察细胞迁移情况。采用软件Image-Pro Plus测量细胞划痕的距离,划痕愈合率=(0 h划痕宽度-12 h或24 h划痕宽度)/ 0 h划痕宽度×100%。
1.2.5统计学处理 使用SPSS12.0统计学软件,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1DHA对胃癌SGC-7901、HGC-27细胞增殖的抑制作用
与对照组相比,DHA能显著抑制胃癌细胞SGC-7901、HGC-27细胞的生长,且随着药物浓度的增加,具有明显的剂量依赖性(P<0.05,P<0.01)。DHA对SGC-7901、HGC-27细胞的生长抑制曲线见图1、图2。

图1 DHA对SGC-7901细胞增殖的抑制作用Figure 1 Effect of DHA on SGC-7901 cell growth

图2 DHA对HGC-27细胞增殖的抑制作用Figure 2 Effect of DHA on HGC-27 cell growth
2.2DHA对胃癌SGC-7901、HGC-27细胞周期的影响
与对照组相比,DHA作用48 h后,SGC-7901和HGC-27细胞的S期比例增加,分别增加了22.66%、9.03%,差异有统计学意义(P<0.01,P<0.05)。结果表明,DHA可促使SGC-7901和 HGC-27细胞阻滞在S期。见图3、4。
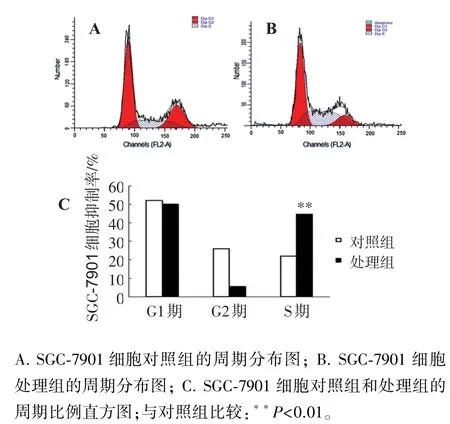
图3 流式细胞仪检测DHA对SGC-7901细胞周期的影响Figure 3 Effect of DHA on cell cycle of SGC-7901 cells by FCM
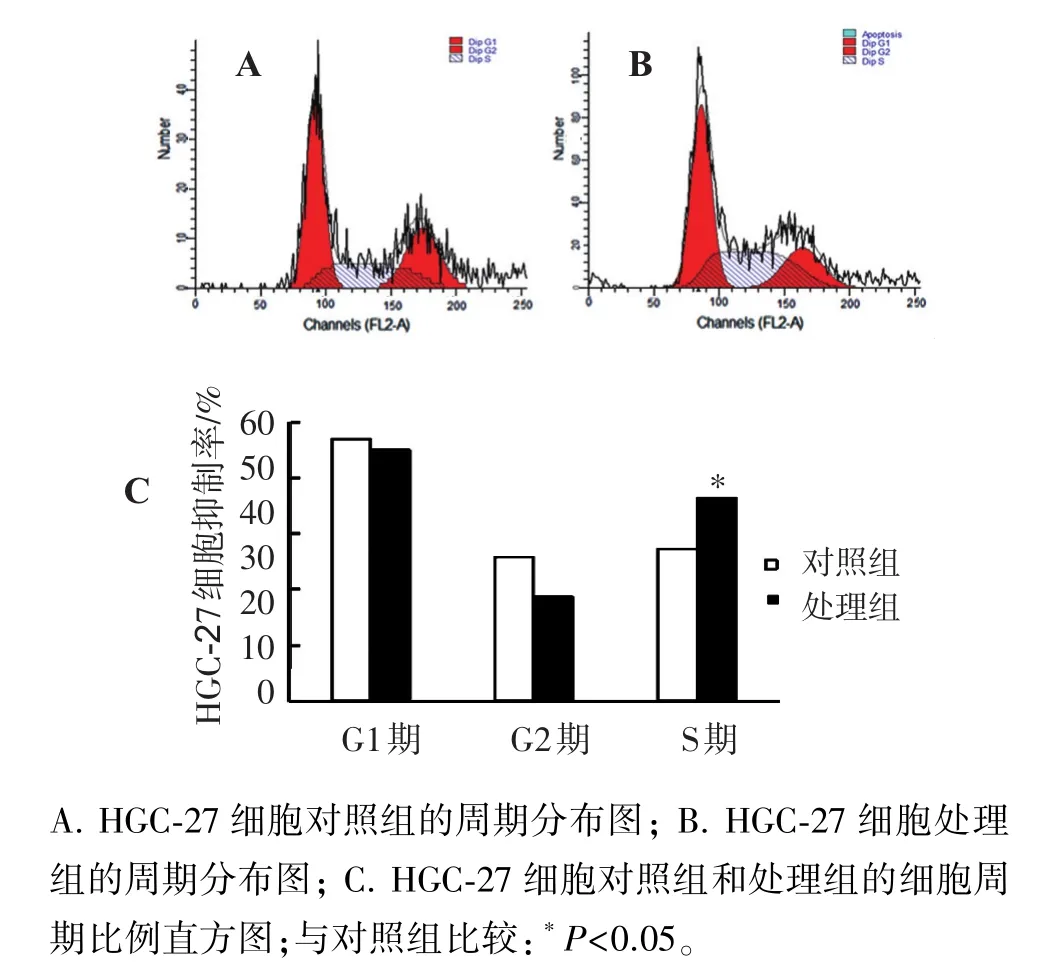
图4 流式细胞仪检测DHA对HGC-27细胞周期的影响Figure 4 Effect of DHA on cell cycle of HGC-27 cells by FCM
2.3DHA对胃癌SGC-7901、HGC-27细胞凋亡的影响
经过48 h的DHA处理后,与对照组相比,SGC-7901细胞凋亡细胞增加了7.59%,HGC-27细胞凋亡增加了12.65%,提示DHA对胃癌细胞具有明显的凋亡作用(P<0.01)。

图5 流式细胞仪检测DHA对SGC-7901细胞凋亡的影响Figure 5 Effect of DHA on cell apoptosis in SGC-7901 cells by FCM
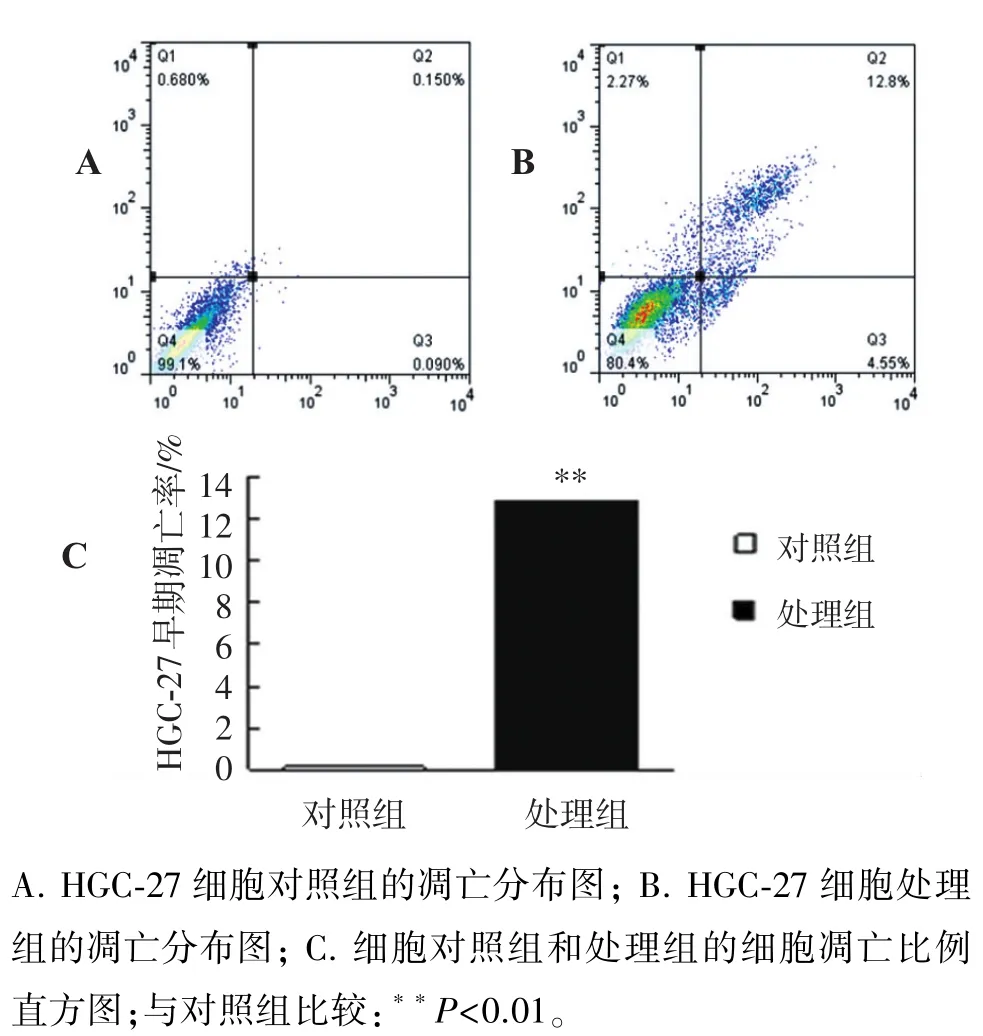
图6 流式细胞仪检测DHA对HGC-27细胞凋亡的影响Figure 6 Effect of DHA on cell apoptosis in HGC-27 cells by FCM
2.4DHA对胃癌SGC-7901、HGC-27细胞迁移的影响
与对照组相比,DHA分别作用24、48 h后,SGC-7901和HGC-27细胞的愈合速度明显变慢(P<0.05)。结果表明,DHA能明显降低SGC-7901和HGC-27细胞迁移能力,见表1。
表1 DHA对胃癌细胞迁移能力的影响Table 1 Effect of DHA on the migration of gastric cancer cells (s,%)

表1 DHA对胃癌细胞迁移能力的影响Table 1 Effect of DHA on the migration of gastric cancer cells (s,%)
与对照组比较:*P<0.05。
组别 24 h 48 h SGC-7901 HGC-27SGC-7901 HGC-27对照组 32.09±0.1 25.81±2.1 65.19±2.7 63.61±2.1处理组 17.22±2.2*16.25±1.9*36.78±1.9*32.68±1.5*
3 讨论
DHA是青蒿素类衍生物,被世界卫生组织推选为一线强效治疗恶性疟疾的药物,近年来研究发现,DHA具有抗肿瘤、抗炎、增强免疫力等作用,特别在抗肿瘤的作用中,具有多靶点、多通路、对正常细胞毒副作用小等优点[9-10],为其临床应用开发奠定了基础。
癌症发生的实质是细胞周期调控的紊乱,使机体细胞无间断的进入细胞周期,失去自主凋亡能力,恶性增殖失控的结果。因此抑制胃癌细胞增殖,并促使细胞凋亡是治疗胃癌的重要方面。本研究提示DHA可以明显抑制胃癌细胞的增殖,且呈浓度依赖性趋势,说明DHA对不同分化程度的胃癌细胞均具有抑制增殖的作用。当DHA浓度为6.25 μmol/L时,中分化SGC-7901细胞的抑制率是44.07%,而低分化HGC-27细胞的抑制率达到了63.64%,提示不同分化程度的胃癌细胞对相同浓度的DHA的敏感度也不同。
相关文献[14-17]表明,Bcl-2基因是一种原癌基因,其参与了胃癌细胞分化的过程,在不同分化程度的胃癌组织中均高表达,且在高分化胃癌组织中的表达明显高于低分化胃癌组织,从而提高了胃癌的发病率。本实验中,DHA可以使胃癌细胞的周期进程阻滞在S期,并且诱导胃癌细胞出现凋亡现象,说明DHA可以通过延长细胞周期并促使细胞发生凋亡的方式,达到减缓细胞增殖的目的。但DHA促使胃癌细胞凋亡的具体作用机制是否与调控Bcl-2蛋白表达有关还需进一步的深入研究。
[1]FITZMAURICE C,DICKER D,PAIN A,et al.The global burden of cancer 2013[J].JAMA Oncology,2015,1(4): 505-527.
[2]王亚旭,毕德利.影响胃癌术后复发及预后的相关因素分析[J].中国普通外科杂志,2011,20(4):334-337.
[3]王亚坤,谢长生,楼金杰,等.中医药治疗胃癌的实验研究进展[J].中华中医药学刊,2015,33(11):2743-2745.
[4]王超,沈克平,胡兵.中药复方治疗胃癌实验研究进展[J].中华中医药学刊,2014,32(9):2243-2245.
[5]毛媛.双氢青蒿素对人肝癌HepG2细胞生长及Mcl-1和Caspase-3基因表达的影响[D].江西:南昌大学,2014.
[6]HU C J,ZHOU L,CAI Y.Dihydroartemisinin induces apoptosis of cervical cancer cells via upregulation of RKIP and downregulation of bcl-2[J].Cancer Biol Ther,2014,15 (3):279-288.
[7]LIU W,WANG D W,YU S Y,et al.The effect of dihydroartemisinin ontheproliferation,metastasisand apoptosis of human osteosarcoma cells and its mechanism [J].J Biol Regul Homeost Agents,2015,29(2):335-342.
[8]AN F F,LIU Y C,ZHANG W W,et al.Dihydroartemisinine enhances dictamnine-inducedapoptosisviaacaspase dependent pathway in human lung adenocarcinoma A549 cells[J].Asian Pac J Cancer Prev,2013,14(10):5895-5900.
[9]汪溪,李建业,厦春咸.双氢青篙素抗肿瘤作用研究进展[J].海南医学,2010,21(13):119-121.
[10]邱淑敏,陈涛,刘美玲.中药诱导肿瘤细胞凋亡机制研究进展[J].动物医学进展,2015,36(1):183-186.
[12]DU X X,LI Y J,WU C L,et al.Initiation of apoptosis,cell cycle arrest and autophagy of esophageal cancer cells by dihydroartemisinin[J].Biomed Pharmacother,2013,67 (5):417-424.
[13]CHEN H,SUN B,WANG S,et al.Growth inhibitory effects ofdihydroartemisininonpancreaticcancercells: involvement of cell cycle arrest and inactivation of nuclear factor-kappaB[J].J Cancer Res Clin Oncol,2010,136 (6):897-903.
[14]聂明豪,李秀荣,杨彬,等.NF-kB和Bcl-2在胃癌组织中的表达及意义[J].中外医疗,2010,33(5):43-44.
[15]朱新勇,张同全,王福春,等.p53、bcl-2和nm23基因在胃癌组织中的表达及其临床意义[J].中国普外基础与临床杂志,2003,10(6):589-592.
[16]姚国栋.Bcl-2、bax基因与胃癌[J].中国肿瘤,2003,12 (11):36-38.
[17]朱瑞雪,时永全,张连峰.NDRG2和Bcl-2在胃癌组织中的表达及意义[J].细胞与分子免疫学杂志,2015,31 (4):516-519.
(责任编辑:幸建华)
Effect of dihydroartemisinin on the apoptosis of gastric cancer cells
YOU Qi1,ZHANG Huining2,LI Kundong2,ZHANG Jufeng2
(1.School of Traditionnal Chinese Medicine;2.School of Life Science&Biopharmacology,Guangdong Pharmaceutical University,Guangzhou 510006,China)
Objective To investigate the growth inhibitory and apoptosis effects of DHA on gastric cancer cells.Methods The proliferation of gastric cancer cells was detected using WST-1.The cell cycle progression and cell apoptosis were determined by flow cytometry.The cell migration ability was detected by wound-healing assay.Results The different concentrations of DHA inhibited the proliferation of gastric cancer cells(SGC-7901,HGC-27)in a concentration-dependent manner.DHA arrested the cell cycle of gastric cancer cells at S phase and promoted the apoptosis of gastric cancer cells at 48 h.After treatment with DHA for 24 h and 48 h,the metastasis ability of gastric cancer cells were declined.Conclusion DHA can effectively inhibit the proliferation of gastric cancer cells and promote cell apoptosis.
DHA;gastric cancer cells;proliferation;apoptosis
R735.2
A
1006-8783(2016)04-0466-04
10.16809/j.cnki.1006-8783.2016050301
2016-05-03
国家自然科学基金项目(81171447);广东省科技计划项目(2014A020212303);广东大学生科技创新培育专项资金项目(pdjh2016b0262)
尤琪(1993—),女,2014级中药学专硕研究生;通信作者:张巨峰(1973—),男,教授,硕士生导师,主要从事肿瘤基因治疗和分子标记物筛选的研究,Email:jfzhanglll@163.com。
网络出版时间:2016-07-08 14:52 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160708.1452.003.html
