北京地区草莓灰霉病菌的转座子及其分布频率
2016-09-14张晓歌张国珍
张 佳, 张晓歌, 张 璨, 张国珍
(中国农业大学植物病理学系,农业部植物病理学重点实验室, 北京 100193)
北京地区草莓灰霉病菌的转座子及其分布频率
张佳,张晓歌,张璨,张国珍*
(中国农业大学植物病理学系,农业部植物病理学重点实验室, 北京100193)
为了解北京地区草莓灰霉病菌的转座子类型及其分布,本研究用转座子Boty和Flipper的特异性引物对北京地区2012-2013年从12个草莓园采集和分离的60株草莓灰霉病菌进行PCR扩增。结果表明,北京地区草莓灰霉病菌群体中共存在3种转座子类型:transposa型、Boty型和Flipper型。其中,以transposa型菌株最多,占供试菌株的63.3%,Boty型菌株占供试菌株的28.3%,Flipper型菌株最少,仅占8.4%,未检测到vacuma型菌株。选取属于不同转座子类型的18株菌株测定其对草莓叶片的致病力,结果显示Boty型菌株所致病斑的平均直径显著大于Flipper型。草莓灰霉病菌转座子类型与致病力的关系有待进一步研究。转座子类型的检测为进一步研究灰葡萄孢的遗传多样性及遗传变异提供了基础。
草莓;灰葡萄孢;转座子;Boty;Flipper
(The Key Laboratory of Plant Pathology, Ministry of Agriculture; Department of Plant Pathology,China Agricultural University, Beijing100193, China)
灰霉病是草莓上的重要病害,主要发生在采果期。染病的果实在采摘后通常迅速腐烂,不能食用和出售,造成严重损失[1]。灰霉病的病原菌灰葡萄孢(BotrytiscinereaPers.)能侵染200种以上的植物,其中以双子叶植物居多,可导致寄主植物毁灭性损失[2]。
转座子是一类可移动的遗传因子,其DNA片段可以从原位上单独复制或断裂下来,环化后插入另一位点,并对其后的基因起调控作用。转座子可以用于研究丝状真菌群体多样性,主要是因为转座子是一种不依赖同源重组而能在基因组内移动的遗传学元件,其广泛存在于原核生物和真核生物基因组中,且在真菌基因组中的分布、插入位置、拷贝数不同,从而在菌株间或群体内导致多样性[3]。在灰葡萄孢中有2种转座子Boty和Flipper。转座子的有无与灰葡萄孢的多样性存在一定的联系[3-4],主要是这两种转座子的存在与否可影响灰葡萄孢菌株的分生孢子大小、生长速率、致病性以及对杀菌剂的抗性[5]。Boty是一个具有多重拷贝,分散在灰葡萄孢整个基因组中的单元,它包含596 bp的长末端重复序列[6]。Flipper是硝酸盐还原酶基因编码区的一段插入序列,长度为1 842 bp,可能编码一种转座酶。Flipper在灰葡萄孢基因组中的数量从0到20个拷贝数不等[7]。
早在1997年,Giraud等[5]根据灰葡萄孢菌株基因组中是否存在转座子Boty和Flipper,将来自法国香槟产区葡萄上的灰葡萄孢分为2类,即transposa型(同时含有Boty和Flipper转座子)和vacuma型(不含有Boty和Flipper中的任一种转座子),另外也有部分菌株只含有Boty转座子。在随后的十几年中,美国、匈牙利、希腊等国相继报道了本国灰葡萄孢的转座子类型。目前,根据转座子Boty和Flipper的有无,一般将灰葡萄孢分为4种类型,即transposa型、Boty型(只有转座子Boty)、Flipper型(只有转座子Flipper)和vacuma型,且各类型的菌株所占比例也不同,其中在美国[8]和匈牙利[9],transposa型的菌株分别占群体的83.3%和67.9%,而其余3种类型的菌株比率较少;在希腊,葡萄、草莓、番茄和黄瓜上的灰葡萄孢,以transposa型的菌株占优势,其中草莓的灰葡萄孢中transposa型占50%以上;而猕猴桃和苹果上的灰葡萄孢,以vacuma型占优势[10]。
我国对灰霉病菌转座子类型的研究很少。张静[11]检测了湖北省100株来自不同寄主灰葡萄孢的转座子,发现共存在4种类型的菌株:transposa型、Boty型、Flipper型和vacuma型,比率分别为62%、11%、23%和4%。黄燕等[12]从国内6省13个县市的蚕豆病株上分离了100株灰葡萄孢,发现可分为3类:transposa型、Boty型和Flipper型,其中Boty型菌株最多,占检测群体的61.0%。目前尚未见国内关于草莓灰霉病菌转座子类型的报道。
近年来,北京地区大力发展设施草莓种植模式,主要为日光温室栽培,且种植面积持续增长。设施栽培也为灰霉病的发生提供了有利条件。据我们观察,草莓灰霉病菌不同菌株在菌落形态、菌核特征和致病性等方面表现多样性,对杀菌剂异菌脲的抗性也存在差异[13]。本研究重点检测了2012-2013年从北京地区12个草莓园采集的草莓灰霉病菌的转座子类型,初步分析了不同菌株的转座子类型与致病力的关系,旨在为研究我国灰葡萄孢的遗传多样性及遗传变异机制提供科学依据。
1 材料与方法
1.1供试菌株
草莓灰霉病病菌(Botrytiscinerea):2012年和2013年从北京市5个区县的12个草莓种植园采集草莓灰霉病病果,带回实验室进行分离培养和纯化,每个病果只保留1个单孢菌株,共获得60株,其中2012年18株,2013年42株(表1)。

表1 2012-2013年北京地区采集的草莓 灰霉病菌菌株信息Table 1 Tested isolates of Botrytis cinerea collected from 12 strawberry gardens in Beijing from 2012 to 2013
续表1Table 1(Continued)

采集区县Collectingdistrict菌株编号Isolatenumber采集地点Collectingsite采集年份Year转座子类型Transposontype通州区TongzhouRZY1瑞正园2013transposaRZY2瑞正园2013FlipperRZY3瑞正园2013transposaRZY4瑞正园2013transposaRZY5瑞正园2013Flipper海淀区HaidianBJ17北京农林科学院林果所2013transposaBJ18北京农林科学院林果所2013FlipperBJ19北京农林科学院林果所2013transposaLGS1北京农林科学院林果所2013transposaLGS2北京农林科学院林果所2013transposaLGS3北京农林科学院林果所2013transposaLGS4北京农林科学院林果所2013FlipperLGS5北京农林科学院林果所2013transposaSJT1苏家坨2013FlipperSJT2苏家坨2013transposaSJT3苏家坨2013transposaBJ20一品香山草莓园2012transposaBJ21一品香山草莓园2012transposaBJ22一品香山草莓园2012transposa房山区FangshanBJ1夏场2012transposaBJ8夏场2012transposaBJ10夏场2012FlipperBJ11夏场2012transposaFS1夏场2013FlipperFS2夏场2013FlipperFS3夏场2013transposaFS4夏场2013transposaFS5夏场2013transposaFS6夏场2013BotyFS7夏场2013transposaFS8夏场2013transposaBJ2韩村河2012transposaBJ3韩村河2012transposaBJ4韩村河2012transposaBJ5韩村河2012transposaBJ6韩村河2012transposaBJ7韩村河2012transposa大兴区DaxingQYD青云店2013Boty总计Total60
1.2培养基
PDA培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 mL。
1.3基因组DNA的提取
将分离纯化的菌株在铺有灭菌玻璃纸的PDA平板上20℃黑暗培养3 d,收集菌丝体,采用 CTAB法[14]提取菌丝体DNA。
1.4草莓灰霉病菌转座子类型的检测
在灰葡萄孢中,检测转座子Boty的PCR引物为LTR98(5′-AGCCTGTAGAATCACCAACG-3′)和LTR728(5′-CGGTATTTCTGGTTGGCA-3′),扩增产物大小为648 bp[15]。检测转座子Flipper的PCR引物为F300(5′-GCACAAAACCTACAGAAGA-3′)和F1500(5′-ATTCGTTTCTTGGACTGTA-3′),扩增产物大小为1 250 bp[8]。
PCR反应体系为25 μL:2×TaqPCR Mix(Aidlab)12.5 μL,10 μmol/L上下游引物各1 μL,模板50 ng。
转座子Boty的PCR扩增程序为[15]:95℃预变性3 min;94℃变性40 s,60.3℃退火40 s,72℃延伸1 min(40个循环); 72℃延伸10 min。
转座子Flipper的PCR扩增程序为[8]:95℃预变性3 min;94℃变性40 s,58℃退火40 s,72℃延伸1.5 min(40个循环); 72℃延伸10 min。
取10 μL PCR扩增产物进行1%琼脂糖凝胶电泳,经溴化乙锭染色后在凝胶成像仪下观察扩增结果,并照相。
1.5致病力的测定
从不同类型转座子的菌株中随机选取18株(transposa型9株;Flipper型6株;Boty型3株)进行致病力测定。采用草莓离体叶片有伤接种,草莓品种为‘红颜’。菌株在PDA培养基上20℃黑暗条件下培养3 d,用灭菌的直径5 mm打孔器在菌落边缘打取菌饼。用无菌昆虫针将草莓叶表面轻轻刺伤,将菌饼的菌丝面朝下接种于伤口处。以PDA培养基为对照,每株菌株重复接种3个叶片,每个叶片接种2个菌饼。将接种后的叶片置于20℃黑暗条件下保湿培养,72 h后用十字交叉法测量病斑直径。
2 结果与分析
2.1草莓灰霉病菌的转座子类型
用转座子Boty和Flipper的特异性引物对供试菌株的基因组DNA进行PCR扩增后,得到的Boty片段长度为648 bp,Flipper片段长度为1 250 bp(图1)。
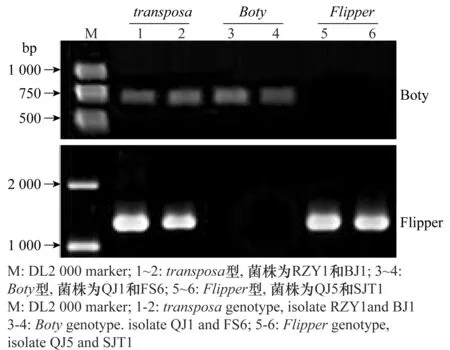
图1 灰葡萄孢转座子PCR扩增产物的凝胶电泳检测Fig.1 Electrophoresis of PCR amplicon of Botrytis cinerea transposon genotype
根据PCR扩增结果,北京地区草莓灰霉病菌共存在3种转座子类型:transposa型(同时含有Flipper和Boty)、Boty型(只有Boty)和Flipper型(只有Flipper)。
2.2不同转座子类型的草莓灰霉病菌所占的比率
对60个灰霉病菌菌株转座子的PCR扩增结果表明,transposa型菌株共38株,占供试菌株的63.3%,Flipper型菌株17株,占供试菌株的28.3%,Boty型菌株5株,占8.4%,未发现vacuma型的菌株(图2)。

图2 含有不同转座子的草莓灰霉病菌菌株所占百分率Fig.2 Percentage of Botrytis cinerea isolates carrying different transposons
2.3北京五区县不同转座子类型草莓灰霉病菌的分布比例
分析北京市5个区草莓灰霉病菌的转座子类型及其所占比例,发现与北京地区总体情况一致,即在昌平、通州、海淀和房山区均为transposa型的菌株最多,Flipper型次之,Boty型所占比率最少,但各区菌株的转座子类型也有一定差异,通州区和海淀区共19株,均有2种类型,即transposa型和Flipper型,未发现有Boty型,昌平区和房山区共40株,均有3种类型,即transposa、Flipper和Boty,大兴区因为只有1株,为一种类型,即Boty型(图3,表1)。

图3 北京市5个区县不同转座子类型的 草莓灰霉病菌菌株所占百分率Fig.3 Proportion of Botrytis cinerea isolates carrying different transposons from 5 districts in Beijing
2.4不同转座子类型的菌株对草莓叶片的致病力
选取的18株菌株对草莓叶片均有致病性。不同菌株的致病力有差异,病斑直径在13.0~26.8 mm之间。比较不同转座子类型菌株所致病斑大小,发现Boty型菌株引起的病斑直径显著大于transposa型菌株,也大于Flipper型菌株,但差异不显著(表2)。

表2 不同转座子类型的灰葡萄孢菌株的致病力比较1)Table 2 Comparison of pathogenicity of Botrytis cinereaisolates carrying different transposons
1) 根据Duncan分析,同列数据后相同小写字母表示数据间无显著性差异(α=0.05)。
According to Duncan analysis, data followed by the same letters in the same column mean no significant difference at 0.05 level.
3 小结与讨论
本研究对采自北京市5个区县的60株草莓灰霉病菌转座子类型进行检测,共发现3种转座子类型,transposa、Boty和Flipper,且transposa型的菌株所占比例最多,达63.3%。这与湖北省不同寄主上的灰葡萄孢菌株以transposa型最多的报道一致[10],但本研究中,Boty型菌株的比率高于湖北省,而Flipper类型的菌株比率低于湖北省,没有检测到vacuma型。其他一些国家关于灰霉病菌转座子类型的报道中,transposa型菌株的比率均占到了群体的65%以上。例如,在美国加利福尼亚地区来自无花果、葡萄、猕猴桃、豌豆和南瓜上的234株灰葡萄孢中,transposa型菌株占83.3%[8];匈牙利的109株灰葡萄孢中,transposa型菌株占67.9%,vacuma型菌株占9.2%,其余菌株为Boty型或Flipper型[9]。德国的209株灰葡萄孢中,transposa型、vacuma型和Boty型菌株所占百分比分别为62.7%、14.4%和23.5%[16]。在智利,葡萄上的457株灰葡萄孢中,transposa型菌株占绝大多数,其次是Boty型,vacuma型菌株较少,没有发现Flipper型[17]。
本研究对北京市昌平、通州、海淀、房山和大兴5个区草莓上的灰葡萄孢菌株转座子类型进行了检测和分析,发现除大兴区只采到1个菌株外,其他4个区的优势转座子类型与北京总体情况一致,但各区之间又略有差异,昌平区和房山区的菌株有3种转座子类型,通州区和海淀区只有transposa型和Flipper型,未发现有Boty型。根据黄燕等[12]的研究结果,灰葡萄孢转座子基因型分布有明显的地域性,如江苏的菌株为Flipper型,重庆、四川、甘肃和河北的菌株为Boty型,而青海的菌株为transposa型。可见,国内的灰霉病菌中vacuma型菌株所占比例较少[11]或不存在[12]。本研究在北京市5个区的草莓灰霉病菌中未发现vacuma型菌株,其他省市的草莓灰霉病菌是否存在vacuma型还有待进一步检测。
对北京市草莓灰霉病菌转座子类型与致病力分析发现,transposa型菌株对草莓的致病力较弱,而Boty型菌株致病力较强。草莓灰霉病菌的转座子类型与致病力是否存在必然联系,还有待进一步扩大菌株数量进行验证和研究。
在群体遗传学研究中,转座子的出现被认为是发生重组的间接证明;同时,转座子还为追踪群体的变化提供了途径,这将有助于分析一段时间内的种群动态[18]。另外,转座子是一类跳跃性的元件,可以插入到基因组的某一位点,从而在真菌基因组中的分布、插入位置、拷贝数不同[11],因此它还是研究丝状真菌群体多样性的有力工具。Martinez等[3]发现法国葡萄上灰葡萄孢vacuma型菌株的生长速率明显快于transposa型菌株。据我们的观察,同是来自草莓的灰葡萄孢在菌落生长速度、菌核的大小和产量、致病力及抗药性等多个方面均存在差异,表现出多样性(本实验室未发表结果),这些差异是否与转座子有关还需要进一步研究。
[1]Mass J L. 草莓病虫害概论[M]. 张运涛, 张国珍,译. 第2版. 北京: 中国农业出版社, 2012.
[2]Dean R, Van Kan J A L, Pretorius Z A, et al. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(4): 414-430.
[3]Martinez F, Blancard D, Lecomte P, et al. Phenotypic differences between vacuma and transposa subpopulations ofBotrytiscinerea[J]. European Journal of Plant Pathology, 2003, 109: 479-488.
[4]Giraud T, Fortini D, Levis C, et al. Two sibling species of theBotrytiscinereacomplex, transposa and vacuma,are found in sympatry on numerous host plants [J]. Phytopathology, 1999, 89(10): 967-973.
[5]Giraud T, Fortini D, Levis C, et al. RFLP markers show genetic recombination inBotryotiniafuckeliana(Botrytiscinerea) and transposable elements reveal two sympatric species [J]. Molecular Biology and Evolution, 1997, 14(11): 1177-1185.
[6]Diolez A, Marches F, Fortini D, et al. Boty, a long-terminal-repeat retroelement in the phytopathogenic fungusBotrytiscinerea[J]. Applied and Environmental Microbiology, 1995, 61(1): 103-108.
[7]Levis C, Fortini D, Brygoo Y. Flipper, a mobile Fot1-like transposable element inBotrytiscinerea[J]. Molecular and General Genetics, 1997, 254(6): 674-680.
[8]Ma Z, Michailides T J. Genetic structure ofBotrytiscinereapopulations from different host plants in California[J]. Plant Disease, 2005, 89(10): 1083-1089.
[9]Váczy K Z, Sándor E, Karaffa L, et al. Sexual recombination in theBotrytiscinereapopulations in Hungarian Vineyards [J]. Phytopathology, 2008, 98(12): 1312-1319.
[10]Samuel S, Veloukas T, Papavasileiou A, et al. Differences in frequency of transposable elements presence inBotrytiscinereapopulations from several hosts in Greece[J]. Plant Disease, 2012, 9(96): 1286-1290.
[11]张静. 湖北省灰霉病病菌区系和灰葡萄孢菌多样性研究[D].武汉:华中农业大学, 2010.
[12]黄燕, 朱振东, 段灿星, 等. 灰葡萄孢蚕豆分离物的遗传多样性[J]. 中国农业科学, 2014, 47(12): 2335-2347.
[13]陈帅民, 芦帆, 张璨, 等. 北京地区草莓灰霉病菌对异菌脲的抗性及抗性分子机制[J]. 植物保护, 2015,41(5):100-104.
[14]Bainbridge B W, Spreadbury C L, Scalise F G, et al. Improved methods for the preparation of high molecular weight DNA from large and small scale cultures of filamentous fungi [J]. FEMS Microbiology Letters, 1990, 66: 113-118.
[15]Munoz G, Hinrichsen P, Brygoo Y, et al. Genetic characterisation ofBotrytiscinereapopulations in Chile [J]. Mycological Research, 2002, 106: 594-601.
[16]Kretschmer M, Hahn M. Fungicide resistance and genetic diversity ofBotrytiscinereaisolates from a vineyard in Germany [J]. Journal of Plant Diseases and Protection, 2008, 115(5): 214-219.
[17]Esterio M, Muoz G, Ramos C, et al. Characterization ofBotrytiscinereaisolates present in Thompson seedless table grapes in the central valley of Chile [J]. Plant Disease, 2011, 95(6): 683-690.
[18]Arkhipova I, Meselson M. Transposable elements in sexual and ancient asexual taxa [J]. Proceedings of the National Academy of Sciences USA, 2000, 97: 14473-14477.
(责任编辑:杨明丽)
Presence and frequency distribution of transposable elements in
Botrytiscinereafrom strawberry in Beijing
Zhang Jia,Zhang Xiaoge,Zhang Can,Zhang Guozhen
This study was conducted primarily to investigate the presence and frequency distribution of the transposable elements Boty and Flipper in populations ofBotrytiscinereafrom 12 strawberry gardens in Beijing. A total of 60 isolates were collected from diseased strawberry fruits during 2012-2013, and the presence of transposable elements was analyzed by specific PCR. The results showed that there were three types (transposa,BotyandFlipper) of transposable elements. Thetransposatype isolates carrying both elements were predominant with frequency of 63.3%, and bothBotytype andFlippertype isolates were present with low frequencies of 28.3% and 8.4%, respectively, whilevacumatype isolate was not detected in this study. The pathogenicity analysis of 18 isolates selected from three types demonstrated thatBotytype isolates showed the highest pathogenicity to strawberry leaves, with the larger lesion size thanFlippertype andtransposatype isolates. The relationship between transposon types and pathogenicity ofB.cinereais needed to study. Detection of transposable elements provides the bases for further study of genetic diversity and variation inB.cinerea.
strawberry;Botrytiscinerea;transposon;Boty;Flipper
2015-01-30
2015-02-14
公益性行业(农业)科研专项(201303025);北京市教委-科学研究与研究生培养共建项目(201502911110426)
E-mail: zhanggzh@cau.edu.cn
S 436.63
A
10.3969/j.issn.0529-1542.2016.02.032
