国外引进甘蔗材料白叶病植原体巢式PCR检测及其序列分析
2016-09-14王晓燕李文凤黄应昆张荣跃单红丽
王晓燕, 李文凤, 黄应昆, 张荣跃, 单红丽
(云南省农业科学院甘蔗研究所,云南省甘蔗遗传改良重点实验室, 开远 661699)

国外引进甘蔗材料白叶病植原体巢式PCR检测及其序列分析
王晓燕,李文凤,黄应昆*,张荣跃,单红丽
(云南省农业科学院甘蔗研究所,云南省甘蔗遗传改良重点实验室, 开远661699)
为有效防止引起重要危险性检疫病害甘蔗白叶病(SCWL)的植原体病原随引进甘蔗材料侵入我国,确保我国甘蔗生产安全,本研究对从缅甸、菲律宾、法国和泰国引进的22个甘蔗材料进行了SCWL植原体巢式PCR检测,并对阳性样品的巢式PCR产物进行了测序及序列分析。结果表明,18个甘蔗材料呈SCWL植原体阳性,阳性检出率为81.8%。所有SCWL阳性样品的16S-23S 基因间隔区片段长210 bp,与GenBank中已有的其他SCWL植原体分离物(登录号HQ917068、AB646271)的同源性为99.8%~100%,并在系统发育树中聚为一个类群。根据SCWL的巢氏PCR检测及其序列分析结果,对呈阳性的材料及时进行了集中销毁处理。
国外甘蔗材料;甘蔗白叶病;巢式PCR检测;序列分析
甘蔗白叶病(sugarcane white leaf, SCWL)是由植原体引起的甘蔗重要病害之一[1-5]。该病于1954年首先在泰国北部南邦府发生[6],现已广泛发生于印度、斯里兰卡、日本、缅甸、菲律宾、老挝和越南等亚洲国家[7-13];我国台湾于1958年报道了该病的发生[14]。SCWL对甘蔗的危害是毁灭性的,在泰国SCWL发病率达5%~35%,每年导致超过2 000万美元的损失[4]。在新几内亚,该病害造成栽培品种‘拉格纳’损失高达100%[7,15],给当地甘蔗和制糖产业造成了巨大的经济损失。
SCWL植原体存在于病株韧皮部筛管中,甘蔗是无性繁殖作物[16],SCWL可通过带病蔗种进行远距离传播,且传播性极强,是重要的检疫对象。近年来,云南省农业科学院甘蔗研究所结合云南省建设面向西南开放桥头堡的发展战略,深入开展与东南亚国家在甘蔗科技方面的合作交流,每年都从缅甸、菲律宾、泰国等东南亚国家引进甘蔗品种和资源材料。为了防止危险性检疫病害SCWL随引进的甘蔗材料侵入我国境内并扩散蔓延,对甘蔗生产造成严重威胁,笔者利用已建立的巢式PCR技术对从国外引进的甘蔗材料进行了SCWL植原体检测,同时对SCWL阳性样品的16S-23S基因间隔区序列(16S-23S ISR)进行了克隆和同源性分析。
1 材料与方法
1.1材料
从缅甸引进的7个甘蔗材料k95-205、k95-282、k95-89、k91-2-056、k95-87、01-89、09-02;从菲律宾引进的4个甘蔗材料PSR03-48、PSR03-128、PSR03-147、PSR02-237;从法国引进的7个甘蔗材料DB71060、CP99-1534、CP99-1894、CP00-1101、CP00-1252、Ho95-988、PSR97-092;从泰国引进的4个甘蔗材料KK3、UT6、SP50、SP72。阳性对照为感染SCWL的甘蔗材料UT3的叶片总基因组DNA,由云南省甘蔗遗传改良重点实验室提供,阴性对照为健康甘蔗叶片基因组DNA,空白对照为灭菌双蒸水。
1.2巢式PCR检测
1.2.1引物序列
扩增SCWL植原体16S rDNA的引物序列参照文献[2,5,17],委托上海生工生物工程公司合成。MLOX:5′-GTTAGGTTAAGTCCTAAAACGAGC-3′,MLOY:5′-GTGCCAAGGCATCCACTGTATGCC-3′;P1: 5′-GTCGTAACAAGGTATCCCTACCGG-3′,P2:5′-GGTGGGCCTAAATGGACTTGAACC-3′。预期扩增产物长度为210 bp。
1.2.2样品DNA的提取
参照Harrison等[18]的方法,改进后提取叶片基因组DNA。称取0.2 g甘蔗样品叶组织,加入液氮研磨成粉并转入2.0 mL离心管,加入1 mL 经65℃预热的CTAB抽提缓冲液,65℃水浴30 min,12 000 r/min离心10 min;取上清液加入等体积氯仿/异戊醇(24∶1)摇匀,12 000 r/min离心10 min;取750 μL上清液加入2/3体积异丙醇,缓慢翻转混匀,于-20℃放置4 h,12 000 r/min离心10 min;沉淀用500 μL 95%乙醇清洗2次,12 000 r/min离心5 min;室温下干燥1.5 h;加入180 μL灭菌双蒸水,室温放置1.5 h,充分混匀;加入200 μL 5 mmol/L NaCl和200 μL 95%乙醇,混匀,12 000 r/min离心5 min;沉淀加入500 μL 70%乙醇,12 000 r/min离心5 min;沉淀于室温下风干,溶于40 μL灭菌双蒸水中,置于-20℃保存备用。
1.2.3植原体的巢式PCR检测
参考卢文洁等[19]建立的SCWL植原体巢式PCR检测体系,对待测样品进行检测。以待测样品DNA为模板,MLOX/MLOY为第1次PCR引物,反应体系为20 μL:10×PCR buffer 2.5 μL,10 mmol/L dNTPs 1 μL,25 mmol/L MgCl20.5 μL,5 U/μLTaq酶0.2 μL,20 μmol/L MLOX和MLOY 各1 μL,模板总基因组DNA 1 μL,ddH2O 13.8 μL。扩增程序为:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,25个循环;最后72℃延伸10 min。取1 μL第1次PCR扩增产物,稀释100倍作为模板,P1/P2为引物,进行巢氏PCR扩增。巢氏PCR反应体系为20 μL: 20 μmol/L P1和P2各1 μL,其他试剂用量同第1次PCR扩增。第2次PCR扩增程序为:94℃预变性5 min;94℃变性1 min,62℃退火1 min,72℃延伸1 min,35个循环;最后72℃延伸10 min。
取10 μL 巢式PCR产物经2%琼脂糖凝胶(胶里预先加入0.005%的GoldView核酸染料),在0.5×TBE缓冲液,100 V的电压下电泳40 min后,用Bio-Rad凝胶成像系统观察,扩增到210 bp条带的为阳性,反之为阴性。
1.2.4巢式PCR产物克隆、测序及序列分析
阳性巢式PCR产物用快捷型琼脂糖DNA回收试剂盒(天根生化科技公司)纯化。纯化后的PCR产物与克隆载体pMD18-T(TaKaRa公司)于16℃下过夜连接,连接产物转化大肠杆菌DH5ɑ感受态细胞,涂布于含Amp的LB固体培养基,于37℃培养箱中倒置培养。挑取平板上的单克隆菌落于LB液体培养基中振荡培养,取适量的培养产物用于PCR检测。每个分离物挑选6个经PCR鉴定为阳性的克隆,送交北京六合华大基因科技股份有限公司测序。将所测序列提交GenBank并进行BLAST比对检索,与NCBI上已知序列进行同源性比较,采用DNAMAN 6.0和MEGA 4.0软件进行序列分析并构建系统进化树。
2 结果与分析
2.1SCWL植原体巢式PCR检测
利用巢式PCR技术对从缅甸、菲律宾、法国和泰国引进的22个甘蔗材料进行检测,结果显示:从缅甸引进的5个材料 k95-282、k91-2-056、k95-87、01-89、09-02,从菲律宾引进的3个材料PSR03-48、PSR03-128、PSR02-237,从法国引进的6个材料CP99-1534、CP99-1894、CP00-1101、CP00-1252、Ho95-988、PSR97-092,和从泰国引进的4个材料 KK3、UT6、SP50和SP72 等共18个材料都扩增出约210 bp的目的片段,阳性检出率为81.8%。从缅甸引进的k95-205、k95-89,从菲律宾引进的PSR03-147和从法国引进的DB71060等4个材料未出现特异性扩增条带。图1为部分检测样品的电泳结果。
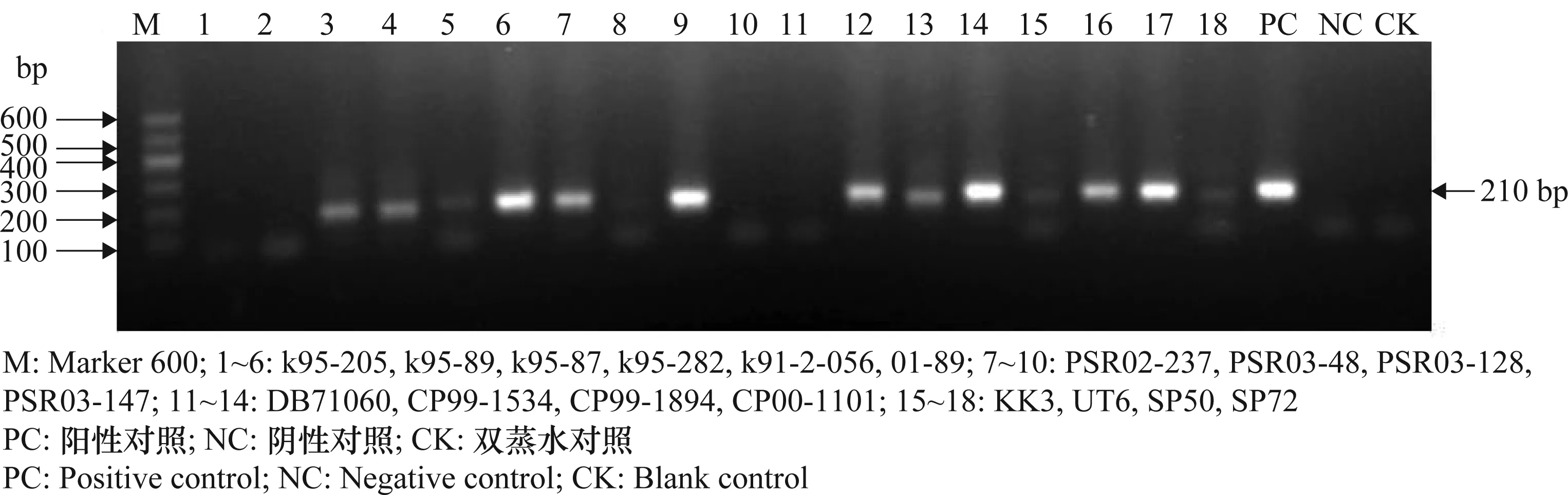
图1 部分国外引进甘蔗品种材料SCWL巢式PCR检测结果Fig.1 Nested PCR detection result of SCWL in some exotic sugarcane materials
2.2巢式PCR扩增产物测序结果及序列分析
对18个SCWL阳性样品的巢式PCR产物进行回收、克隆、测序。结果表明,来源于缅甸、菲律宾、法国和泰国的18个SCWL样品的16S-23S ISR序列长度都为210 bp。从每个国家的供试样品中随机选择1个样品序列提交到GenBank,序列号分别为KC662511(缅甸k95-282)、KC662512(菲律宾PSR03-48)、KC662510(法国CP99-1534)和KF431838(泰国UT6)。经NCBI BLAST比对发现,缅甸‘k95-282’、菲律宾‘PSR03-48’、法国‘CP99-1534’和泰国‘UT6’SCWL分离物16S-23S ISR核苷酸序列与GenBank中公布的泰国和缅甸SCWL植原体分离物(登录号HQ917068、AB646271)相应序列同源性高达99.8%~100%,而与其他组植原体相应序列的同源性低于89.9%。表明检测的片段是甘蔗白叶病植原体。
2.3系统进化树构建与分析
将GenBank中植原体16Sr各组代表性16S-23S ISR序列下载下来,与本研究测定的4个SCWL 16S-23S ISR序列进一步进行同源性分析,利用MEGA 4.0软件构建系统发育树,以Acholeplasmalaidlawii(登录号JQ390342)为外群(图2)。由系统发育树可以看出,缅甸、菲律宾、法国和泰国SCWL植原体分离物与GenBank中已有的SCWL植原体分离物(登录号HQ917068、AB646271)归为一个类群,都属于16Sr Ⅺ组植原体。
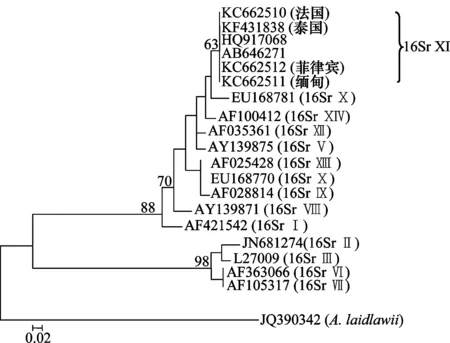
图2 基于16S-23S ISR序列的缅甸、菲律宾、法国和泰国甘蔗 白叶病植原体及其他相关植原体株系的系统进化发育树Fig.2 Phylogenetic tree based on the 16S-23S ISR sequences of SCWL phytoplasma from Myanmar, the Philippines,France, Thailand and other representative phytoplasma
3 讨论
随着云南桥头堡建设发展战略的深入实施,与东南亚国家在甘蔗科技方面的合作交流加强,国际甘蔗种质资源引进交换工作不断深入,引种国家数量增加,规模、范围不断扩大,由国外引种导致的病害侵入风险也在不断增加。因此,切实加强甘蔗引种检疫检测工作将是有效防止外来危险性有害生物随引种传入我国蔗区造成灾害隐患的首要任务和安全保障措施。
SCWL是甘蔗上分布广泛,危害严重的重要病害[4,7],极大地威胁着甘蔗的生产和发展[15]。本研究利用已建立的巢式PCR技术,对从缅甸、菲律宾、法国和泰国引进的22个甘蔗材料进行了危险性检疫病害SWCL的检测,结果有18个甘蔗材料呈阳性,阳性检出率为81.8%,其余呈阴性。本文所测SCWL阳性样品的16S-23S ISR序列与其他GenBank中已公布的SCWL植原体分离物16S-23S ISR序列同源性高达99.8%~100%,且在系统发育树中所有的SCWL植原体都归为一个类群。进一步证实了18份国外引进甘蔗材料中存在SCWL植原体。根据巢氏PCR检测及序列分析结果,对呈阳性的甘蔗材料及时进行了销毁处理,为国际合作甘蔗材料交换的顺利开展和实施提供了安全保障。本研究结果显示从缅甸、菲律宾和泰国等东南亚国家引进的甘蔗材料SWCL阳性检出率高,这与有关研究报道相吻合,SCWL近年在东南亚国家发生尤为普遍和严重,且SCWL易随蔗种进行远距离传播。这就要求我们今后在加强与东南亚国家深入开展甘蔗科技交流合作,进行甘蔗材料交换工作中,要重点加强对引进甘蔗材料的SCWL检疫检测,有效防止其随引进材料侵入我国境内扩散蔓延,确保我国蔗糖产业的安全可持续发展,推进国际合作的长远发展。
[1]Nakashima K, Chaleeprom W, Wongkaew P, et al. Detection of mycoplasma-like organisms associated with white leaf disease of sugarcane in Thailand using DNA probes [J]. Japan International Research Center for Agricultural Sciences, 1994(1): 57-67.
[2]Wongkaew P, Hanboonsong Y, Sirithorn P, et al. Differentiation of phytoplasmas associated with sugarcane and gramineous weed white leaf disease and sugarcane grassy shoot disease by RFLP and sequencing[J]. Theoretical and Applied Genetics, 1997, 95(4): 660-663.
[3]Wongkaew P, Fletcher J. Sugarcane white leaf phytoplasma in tissue culture: long-term maintenance, transmission, and oxytetracycline remission [J]. Plant Cell Reports, 2004, 23(6): 426-434.
[4]Hanboonsong Y, Ritthison W, Choosai C, et al. Transmission of sugarcane white leaf phytoplasma byYamatotettixflavovittatus, a new leafhopper vector [J]. Journal of Economic Entomology, 2006, 99(5): 1531-1537.
[5]Hanboonsong Y, Choosai C, Panyim S, et al. Transovarial transmission of sugarcane white leaf phytoplasma in the insect vectorMatsumuratettixhiroglyphicus(Matsumura)[J]. Insect Molecular Biology, 2002, 11(1): 97-103.
[6]Marcone C. Phytoplasma diseases of sugarcane [J]. Sugar Tech, 2002, 4: 79-85.
[7]Rao G P, Singh A, Singh H B, et al. Phytoplasma diseases of sugarcane: characterization, diagnosis and management[J]. Indian Journal of Plant Pathology, 2005, 23(1/2): 1-21.
[8]Kumarasinghe N C, Jones P. Identification of white leaf disease of sugarcane in Sri Lanka [J]. Sugar Tech, 2001, 3(1/2): 55-58.
[9]Thein M M, Jamjanya T, Kobori Y, et al. Dispersal of leafhoppersMatsumuratettixhiroglyphicusandYamatotettixflavovittatus(Homoptera: Cicadellidae), vectors of sugarcane white leaf disease [J].Applied Entomology and Zoology, 2012, 47(3): 255-262.
[10]Edison S, Ramakrishnan K, Narayanasamy P. Comparison of grassy shoot disease (India) with the white leaf disease (Taiwan) of sugarcane[J]. Sugarcane Pathologists’Newsletter, 1976(17): 30-35.
[11]Tran-Nguyen L, Blanche K R, Egan B, et al. Diversity of phytoplasmas in northern Australian sugarcane and other grasses [J]. Plant Pathology, 2000, 49(6): 666-679.
[12]Nakashima K, Murata N. Destructive plant diseases caused by mycoplasma-like organisms in Asia[J]. Outlook on Agriculture, 1993, 22(1): 53-58.
[13]Nakashima K, Wongkaew P, Sirithorn P. Molecular detection and characterization of sugarcane white leaf phytoplasmas [M]∥Rao G P, Ford R E, Tosir M, et al.Sugarcane pathology, Vol II: Virus and phytoplasma diseases. Enfield: Science Publishers, 2001: 157-175.
[14]Ling K C. White leaf disease of sugarcane [J]. Taiwan Sugar, 1962, 9: 1-5.
[15]Cronje C P R, Bailey R A, Jones P, et al. The phytoplasma associated with Ramu stunt disease of sugarcane is closely related to the white leaf phytoplasma group [J]. Plant Disease, 1999, 83(6): 588.
[16]李文凤, 蔡青, 黄应昆, 等. 甘蔗野生资源对蔗茅柄锈菌的抗性鉴定[J]. 植物保护, 2005, 31(2): 51-53.
[17]Namba S, Oyaizu H, Kato S, et al. Phylogenetic diversity of phytopathogenic mycoplasmalike organisms[J]. International Journal of Systematic Bacteriology, 1993, 43(3): 461-467.
[18]Harrison N A, Richardson P A, Jones P, et al. Comparative investigation of MLOs associated with Caribbean and African Coconut lethal decline diseases by DNA hybridization and PCR assays [J]. Plant Disease, 1994, 78(5): 507-511.
[19]卢文洁, 黄应昆, 李文凤, 等. 甘蔗白叶病植原体巢式PCR检测方法的建立及初步应用[J]. 植物病理学报, 2012, 42(3): 311-314.
(责任编辑:杨明丽)
Nested PCR detection and sequence analysis of phytoplasma causing white leaf disease in imported sugarcane materials
Wang Xiaoyan,Li Wenfen,Huang Yingkun,Zhang Rongyue,Shan Hongli
(Sugarcane Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Key Laboratory of Sugarcane Genetic Improvement, Kaiyuan661699, China)
To effectively prevent invasion of sugarcane white leaf disease (SCWL), an important quarantine disease caused by phytoplasma, into China through introduction of sugarcane materials, and to secure sugarcane production, phytoplasma causing SCWL was detected by nested PCR in 22 imported sugarcane materials from Myanmar, the Philippines, France and Thailand. Then, the nested PCR products of SCWL positive samples were sequenced and analyzed. The results showed that 18 of 22 materials (81.8%) were positive. The 16S-23S intergenic region of all SCWL positive samples were all 210 bp long, and shared 99.8% to 100% identity with other published SCWL phytoplasma sequences (GenBank accession number HQ917068, AB646271), and they were clustered together in a group in phylogenetic tree. Based on the nested PCR detection and sequence analysis results, the SCWL positive materials were destroyed immediately.
imported sugarcane materials;sugarcane white leaf disease;nested PCR detection;sequence analysis
2015-02-14
2015-04-22
国家现代农业产业技术体系(CARS-20-2-2);云南省现代农业产业技术体系
E-mail:huangyk64@163.com
S 435.661, Q 939.34
A
10.3969/j.issn.0529-1542.2016.02.025
