杨树溃疡病生防菌株的抑菌机理研究
2016-09-14周国英
杨 蕾, 周国英, 梁 军*
(1.中南林业科技大学,经济林培育与保护教育部重点实验室, 长沙 410004; 2. 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林保护重点实验室, 北京 100091)
杨树溃疡病生防菌株的抑菌机理研究
杨蕾1,2,周国英1,梁军1,2*
(1.中南林业科技大学,经济林培育与保护教育部重点实验室, 长沙410004; 2. 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林保护重点实验室, 北京100091)
黄绿木霉YGF9菌株和木贼镰刀菌LX6F2菌株分别为分离自杨树组织和杨树林土壤中的2株生防菌。为了研究黄绿木霉和木贼镰刀菌对杨树溃疡病菌葡萄座腔菌的生防抑菌机制,从生防菌株对病原菌代谢系统和生理生化的影响2个方面研究了生防菌株的抑菌机制。结果表明,两生防菌株发酵液的正丁醇提取物可降低病原菌菌体的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、多酚氧化酶(PPO)、己糖激酶(HK)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)、苹果酸脱氢酶(MDH)、琥珀酸脱氢酶(SDH)与辅酶I的活性,使Na+,K+-ATP酶、Mg2+-ATP酶和Ca2+-ATP酶的活性急剧下降;两生防菌株可显著提高病原菌菌丝体的电导率和丙二醛(MDA)含量,降低病原菌蛋白质含量。说明两生防菌株可通过影响病原菌的代谢系统和生理过程来发挥其抑菌作用。
杨树溃疡病;黄绿木霉;木贼镰刀菌;生防菌株;抑菌机理
杨树溃疡病是危害杨树生长的主要枝干病害,大面积杨树溃疡病的发生会破坏生态环境,带来巨大的经济损失。杨树溃疡病是一种寄主主导型病害,在防治上存在较大难度。生防菌不仅在抑制病原菌生长方面具有很强的专一性、持久性和有效性,而且可以增强寄主植物的抗性,是目前林木病虫害防治的主要研究方向。
植物在长期的进化过程中形成了抵御真菌、细菌和病毒等病原菌侵袭的防卫机制。主要包括:系统获得性抗性(systemic acquired resistance, SAR),它是寄主植物被病原菌侵染后增强抵抗力做出的主要防御反应[1];诱导系统抗性(induced systemic resistance, ISR),它是指某些生防菌除了能直接抵御病原菌的侵入,还能诱导植物对病原菌产生抗性[2]。生防菌株抑制病原菌的机理包括通过竞争、重寄生、产生抗性物质、引起病原菌生理生态变化等[3]直接的拮抗机制来抑制植物病害的发生,同时在其他一些防御措施有限或是缺失的情况下,SAR和ISR的联合作用可以作为其他保护防御措施的补充。研究认为在有机物复杂的生态系统中,多种防病机制的交错联合作用与单一的作用相比更能适应环境,效果更持久,这也是很多人工合成的化学农药不能达到的效果[4-5]。生物防治作用机制的多样性和复杂性,为其良好的防治效果提供了前提条件。
在前期的研究中,本实验室以杨树溃疡病病原葡萄座腔菌(Botryosphaeriadothidea)为靶标菌株,分别从杨树组织和杨树林土壤中分离筛选到2株对杨树溃疡病有良好生防效果的生防菌株YGF9和LX6F2。经鉴定,菌株YGF9是一株黄绿木霉(Trichodermaaureoviride)[6],菌株LX6F2是一株木贼镰刀菌(Fusariumequiseti)[7]。为明确菌株YGF9和LX6F2对病原菌的作用机理,本研究从生防菌株对病原菌代谢系统的影响以及对病原菌生理生化的影响这两方面对生防菌株的抑菌机制进行探索研究,以期掌握2株生防菌的作用机理,为杨树溃疡病的生物防治提供参考。
1 材料与方法
1.1试验材料
病原菌:葡萄座腔菌(Botryosphaeriadothidea)由中国林业科学研究院森林保护重点实验室菌种保藏中心提供,编号为72②B,在PDA培养基上繁殖保存;生防菌株YGF9和LX6F2由本实验室分离筛选获得,在PDA培养基上繁殖保存。生防菌YGF9采用的液体发酵培养基配方为:土豆浸汁200 g/1 000 mL,果糖1%,牛肉浸粉1.4%,KCl 0.1%;发酵条件为:起始pH 7.0,温度34℃,转速190 r/min,接种量3.5%,装液量100 mL/250 mL。生防菌LX6F2采用的液体发酵培养基配方为:土豆浸汁200 g/1 000 mL,果糖1%,牛肉浸粉1.4%,KCl 0.1%;发酵条件为:起始pH 7.0,温度32℃,转速180 r/min,接种量4%,装液量100 mL/250 mL。
马铃薯琼脂糖培养基(potato dextrose agar, PDA):马铃薯200 g、葡萄糖20 g、琼脂 15~20 g、加水定容至 1 000 mL,高压蒸汽灭菌20 min。
试剂:培养基所需试剂购于北京福尔彻科技有限公司,酶活性测定试剂盒购于南京建成生物工程研究所。
仪器:MLS-3750全自动高压蒸汽灭菌锅,日本SANYO公司;全能台式高速冷冻离心机,美国Thermo Fisher Scientific公司;MD2000微量紫外分光光度计,北京托摩根生物科技有限公司;BEC-11AW电导仪,贝尔分析仪器有限公司。
1.2试验设计
1.2.1生防菌株发酵液预处理及高效抑菌活性物质的提取
1.2.1.1生防菌株发酵液预处理
取600 mL发酵4 d的发酵液,用1 mol/L草酸调节pH至3.0,室温下静置3 h,再用1 mol/L NaOH调pH为7.0,10 000 r/min离心10 min,保留上清液待用。离心后的菌体沉淀用200 mL 0.85%无菌生理盐水悬浮,置于4℃冰箱静置过夜。将处理后的菌体沉淀悬液进行细胞超声破碎,破碎条件为450 W,破碎15 s,间歇10 s,破碎90次,保护温度20℃。取超声破碎后的上清液进行生物活性测定。
生物活性测定方法为:取超声破碎后的上清液0.1 mL与冷却至40℃左右的已灭菌PDA培养基混合均匀制成平板,接入直径为4 mm 预先活化好的指示菌块,以不加上清液的PDA培养基为对照,设3个重复。28℃下培养5 d后测量菌落直径,计算抑菌率,如抑菌效果良好则证明发酵液预处理方法得当。
1.2.1.2生防菌株发酵液活性物质提取方法的选择
将破碎后的细胞悬液6 000 r/min离心10 min,得到的上清液与细胞破碎前的上清液合并,弃沉淀。以石油醚、正己烷、乙酸乙酯、丙酮、异戊醇和正丁醇6种有机溶剂作为萃取剂,按发酵液∶萃取剂=1∶3(V/V)常温浸泡上述发酵液,48 h后分液去除无机相,减压旋转蒸发去除有机相。用进行萃取的超声破碎上清液和发酵上清液的1/10体积的5% Tween 80溶液溶解萃取物,同时将未萃取的发酵液旋转蒸发浓缩到原体积的1/10,备用。为减少活性物质丢失,需进行3次萃取,合并萃取后的有机相,减压浓缩待用。通过测定抑菌率来确定最适宜的提取剂。
抑菌活性测定:采用菌丝生长抑制法,取上述提取物添加到PDA培养基中,摇匀,使提取物终浓度达到20%。倒平板,接入病原菌,以不添加提取物而只添加5% Tween 80溶液的PDA平板培养作为对照,25℃ 恒温培养。采用十字交叉法,每8 h测1次菌落直径,计算生防菌株发酵液不同溶剂提取物对病原菌生长的抑制率,每处理3次重复。抑菌率(%)=[(对照净生长量-处理净生长量)/对照净生长量]×100。
1.2.2生防菌株对病原菌代谢系统酶和生理生化指标的影响
根据1.2.1.2的筛选结果,选择最佳溶剂提取物进行如下试验。将PD培养基中培养5 d的直径约为2 cm病原菌菌丝团用无菌水洗净后置于20 mL含10%生防菌株发酵液提取物的无菌水中,静置。分别于2、4、6、8、10、12、24、48 h后测定各项代谢酶活性和生理生化指标,以5% Tween 80代替发酵液作为空白对照[8],每个时间段的处理重复3次,测定指标时再重复3次。
测定的病原菌代谢系统的重要酶包括:保护酶系统中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO);糖酵解途径中己糖激酶(Pexokinase,HK)、丙酮酸激酶(pyruvate kinase,PK)与乳酸脱氢酶(lactate dehydrogenase,LDH);TCA循环中琥珀酸脱氢酶(succinatedehydrogenase,SDH)与苹果酸脱氢酶(malate dehydrogenase,MDH);辅酶I含量和ATP酶。酶活力测定均采用南京建成生物工程研究所提供的试剂盒进行测定,具体方法详见说明书。
测定的病原菌生理指标包括电导率、丙二醛(malondialdehyde,MDA)含量和蛋白质含量等3个指标。电导率测定利用电导仪完成,丙二醛含量测定采用硫代巴比妥酸法,蛋白质含量测定采用考马斯亮蓝染色法。
2 结果与分析
2.1生防菌株发酵液活性物质的初步提取
2.1.1生防菌株预处理效果
将发酵过滤液、超声破碎后的上清液及超声破碎后的菌泥分别进行抑菌活性的测定,各组分的抑菌效果见表1。结果表明,各处理组分的抑菌效果呈极显著差异(P=0.000),经超声破碎后,菌株YGF9的超声破碎上清液的抑菌率为84.85%,菌株LX6F2的超声破碎上清液的抑菌率为86.68%,高于未经处理的原始发酵液过滤液,说明预处理使生防菌株胞内的部分抑菌活性物质得到了有效的释放。

表1 发酵液预处理各组分抑菌效果1)Table 1 Antifungal effects of each component of the pretreated fermentation liquids
1) 表中数据为平均值±标准差。“-”表示无抑菌活性。同列数据后不同字母表示经Duncan氏新复极差法多重比较在P<0.05水平差异显著。
Data are mean±SD. “-”indicates no inhibition effect. Different letters in the same column indicate significant difference at 0.05 level by Duncan’s new multiple range test.
2.1.2生防菌株抑菌活性成分的有效萃取剂
通过双因素方差分析和同质性检验,发现两菌株经不同有机溶剂萃取后的病原菌直径及抑菌率均呈极显著差异(P=0.000)。结果表明(表2),不同有机溶剂对两生防菌株抑菌活性物质的萃取效果各不相同,但在用正丁醇进行萃取时,两菌株的抑菌活性均达到最佳,明显优于其他5种萃取剂。因此,确定正丁醇是两株生防菌株抑菌活性物质最有效的萃取剂。此外,根据“相似相容”原理,可以初步判定菌株YGF9和LX6F2有效抑菌成分极性较弱。

表2 不同有机溶剂提取物对病原菌生长的影响1)Table 2 Effects of different extracts on pathogen’s growth
1) 数据为平均值±标准差,同列数据后不同小写字母分别代表经LSD最小显著差异性分析在P<0.05水平下差异显著。
The data are mean±SD. Different lowercase letters in the same column represent significant difference at 0.05 level by LSD.
2.2生防菌株对病原菌代谢系统相关酶的影响
2.2.1对病原菌保护酶的影响
由图1可知,经YGF9 和LX6F正丁醇提取物处理后的前8 h中,病原菌SOD酶活性与未经处理的对照组活性均呈平缓升高趋势,在8 h时酶活性达到最大,经菌株YGF9提取液处理的病原菌SOD酶活性为37.00 U/(g·min),经菌株LX6F2提取液处理的病原菌SOD酶活性为43.00 U/(g·min)。8 h后,处理组的酶活性大幅持续降低,在48 h时酶活性达到最小,经菌株YGF9提取液处理的病原菌SOD酶活性为3.33 U/(g·min),经菌株LX6F2提取液处理的病原菌SOD酶活性为8.47 U/(g·min)。经生防菌株发酵液处理后,病原菌的SOD酶活性呈现先上升后大幅下降的趋势,表明病原菌细胞膜脂的过氧化程度加重。
经YGF9和LX6F2发酵提取液处理后的前8 h中,病原菌CAT酶活性与未经处理的对照组活性的变化趋势相似(图1b),均呈升高趋势,且每个时间段的增加幅度有一定差异;在处理后8 h时酶活性达到最大,经菌株YGF9提取液处理的病原菌CAT酶活性为0.054 7 U/(g·s),经菌株LX6F2提取液处理的病原菌CAT酶活性为0.051 2 U/(g·s)。8 h后,处理组的CAT活性快速下降,在24 h时,YGF9提取液处理组的CAT酶活性为0.011 9 U/(g·s),LX6F2提取液处理组的CAT酶活性为0.011 0 U/(g·s),在24 ~48 h中,酶活的下降速度减慢并趋于平稳。
经YGF9和LX6F2发酵提取液处理后的2~8 h中,处理组和对照组的POD活性均呈平稳缓慢上升(图1),在8~12 h中,POD活性大幅增加,在12 h时,处理组的酶活性达到最大,分别为5.176 7 U/(g·s)和5.470 0 U/(g·s),而对照组酶活性的最大值则出现在24 h,为5.490 0 U/(g·s)。在处理12 h后,处理组的酶活性大幅快速下降,在48 h时降到最低。PPO酶活性的变化趋势与SOD和CAT的变化趋势相似,都呈现出先上升后下降的规律(图1)。
2.2.2对糖酵解途径中HK、PK与LDH活性的影响
如图2所示,病原菌菌丝团经YGF9和LX6F2提取液浸泡后,其HK、PK与LDH的活性随处理时间的增加而不断降低,而未经处理的对照组酶活性则逐渐升高。HK、PK与LDH活性的显著下降,说明生防菌株发酵液提取物严重干扰了病原菌糖酵解途径的顺利进行。
2.2.3对TCA循环中SDH与MDH活性的影响
试验结果显示经生防菌株发酵提取物浸泡处理后,病原菌的SDH和MDH酶活性均呈现逐渐降低并几乎接近于零的趋势(图3),与对照组酶活性的不断升高形成鲜明对比。上述结果说明,提取物抑制和破坏了病原菌的SDH和MDH酶活性,从而导致病原菌的TCA循环无法正常进行。

图1 生防菌株对病原菌保护酶活力的影响Fig.1 Effects of the biocontrol strains on pathogen’s protective enzyme activities

图2 生防菌株对病原菌糖代谢途径中关键酶活力的影响 Fig.2 Effects of the biocontrol strains on pathogen’s key enzyme activities in sugar metabolic pathways
2.2.4对辅酶I含量和ATP酶活性的影响
由图4可以看出,在用生防菌株发酵液提取物处理的初始阶段,处理组的辅酶I含量略高于对照组;随着处理时间的延长,处理组辅酶I含量不断降低并趋于0,而对照组辅酶I的含量不断增加。两个生防菌株间的差异不显著。结果说明,在病原菌菌体内以NAD为辅酶的脱氢酶将不能正常完成氢质子的传递,代谢活动将会出现紊乱。

图3 生防菌株对病原菌TCA循环中关键酶活力的影响 Fig.3 Effects of the bio-control strains on pathogen’s key enzymes activities in TCA cycle
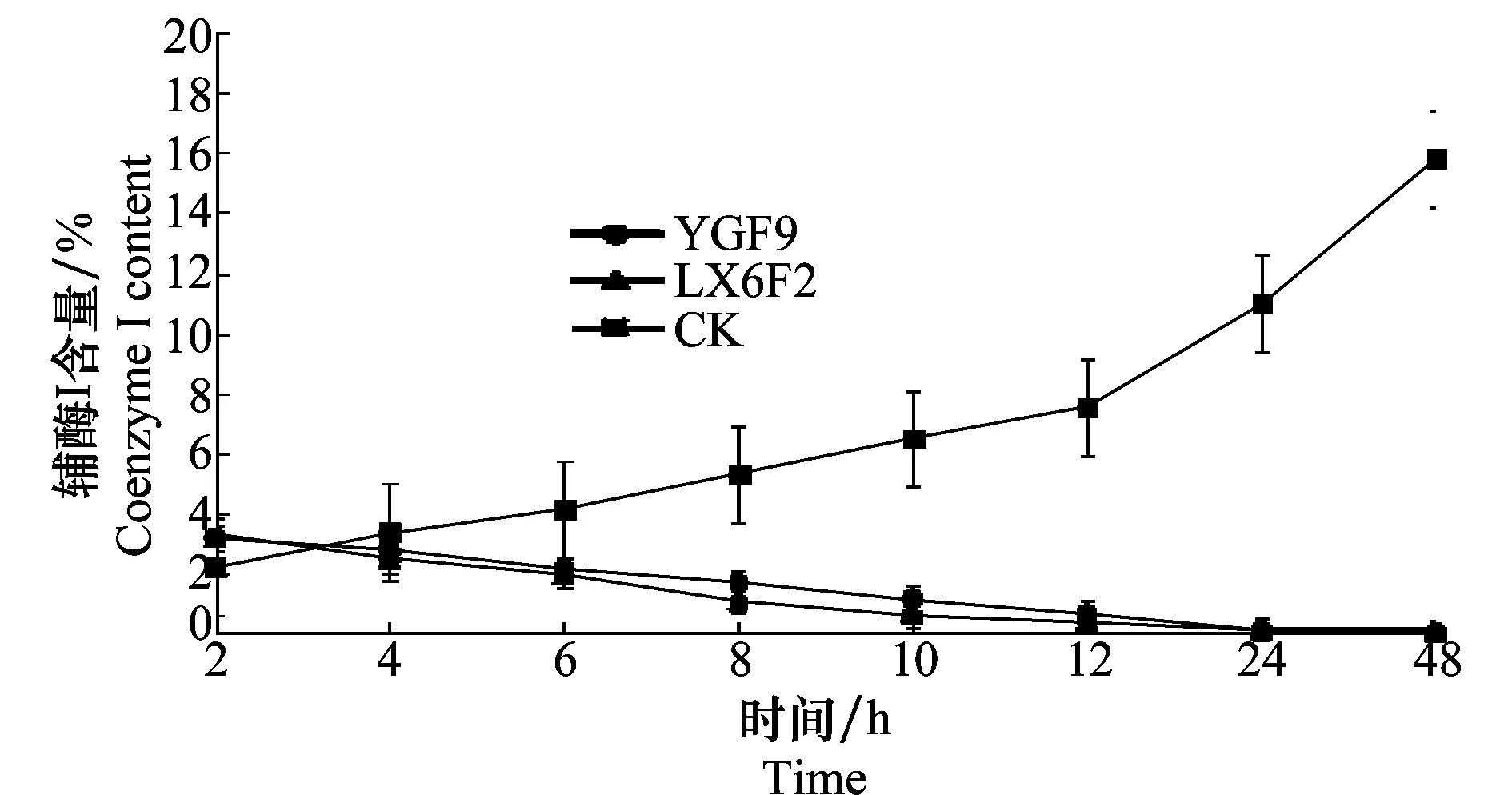
图4 生防菌株对病原菌辅酶I含量的影响Fig.4 Effects of the biocontrol strains on the content of pathogen’s coenzyme I
由图5可知,对照组的Na+,K+-ATP酶、Mg2+-ATP酶和Ca2+-ATP酶的活性从试验开始至48 h内一直呈平稳上升趋势,在48 h时基本达到最高值。而生防菌株发酵液提取物处理组的Na+, K+-ATP酶、Mg2+-ATP酶和Ca2+-ATP酶活性呈先缓慢上升后急剧下降趋势。提取物处理组酶活性在8 h或10 h时达到峰值,此时处理组的酶活性略高于对照组。在处理组酶活性达到最高值后的试验时间内,3种ATP酶活性受到提取物的胁迫作用急剧下降,这势必会使病原菌细胞内的能量供给出现不足,从而影响病原菌正常的生理活动。

图5 生防菌株对病原菌ATP酶活力的影响 Fig.5 Effects of the biocontrol strains on ATP enzyme activities
2.3生防菌株对病原菌生理生化指标的影响
杨树溃疡病菌经提取物处理后,电导率随着处理时间的增加而明显增加(图6)。说明病原菌的电解质外渗量增多,菌体膜的完整性遭到很大程度的破坏。
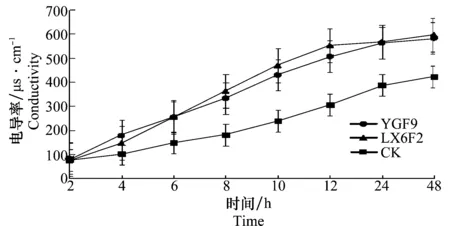
图6 生防菌株对病原菌电导率的影响Fig.6 Effects of the biocontrol strains on pathogen’s conductivity
杨树溃疡病菌菌丝团经YGF9和LX6F2正丁醇提取物处理后2 h 开始,处理组的丙二醛(MDA)含量上升速度显著高于对照组,处理组 MDA 含量呈现先上升后下降的趋势,8 h 时达到最高值,而后平缓下降,48 h时降到最低值(图7),对照组MDA含量随处理时间的延长而呈现平缓增加的趋势。此结果说明,生防菌株发酵液提取物使病原菌菌丝体细胞膜严重过氧化,严重影响了病原菌细胞膜的正常功能。

图7 生防菌株对病原菌丙二醛含量的影响Fig.7 Effects of the biocontrol strains on pathogen’s MDA contents
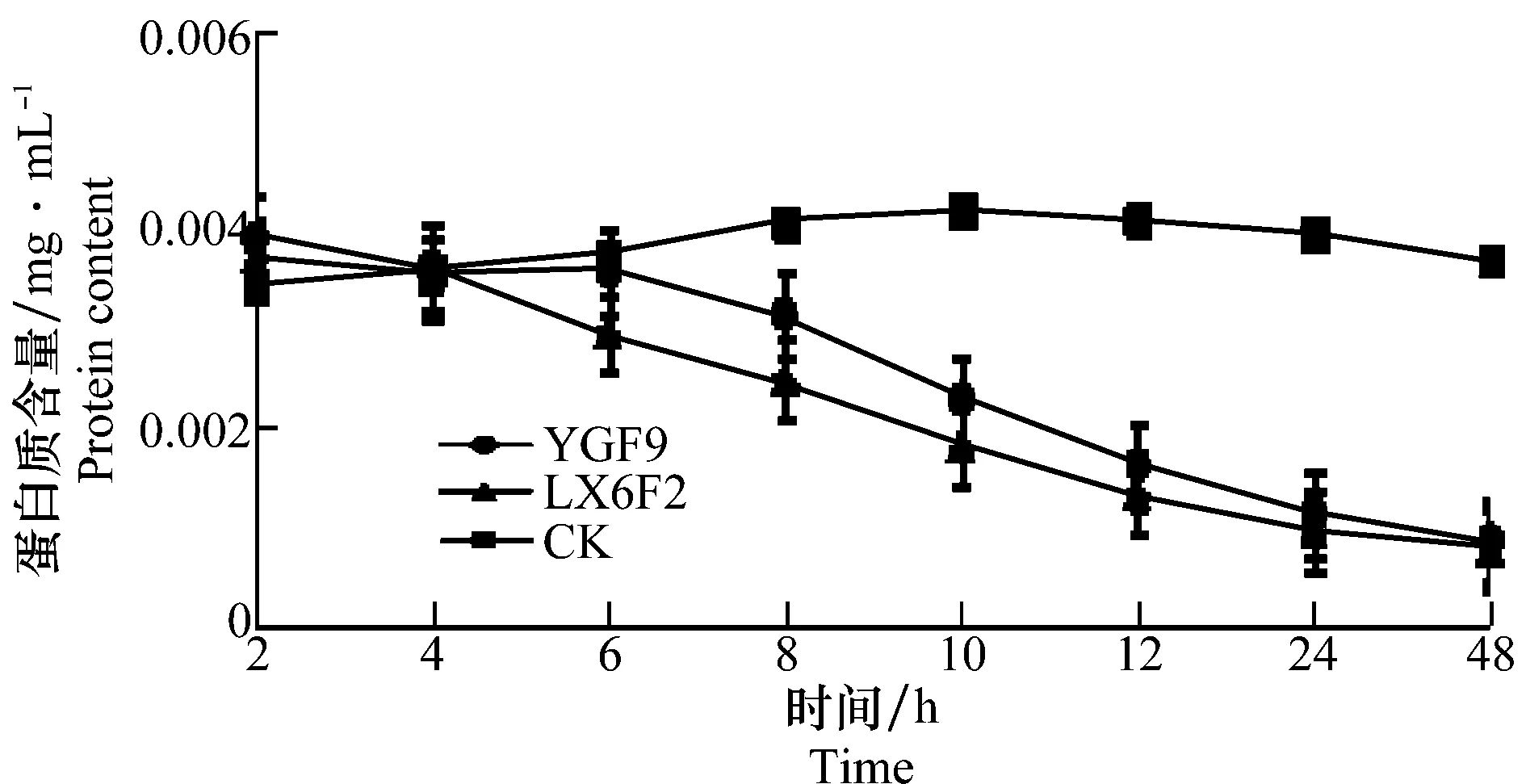
图8 生防菌株对病原菌蛋白质含量的影响Fig.8 Effects of the biocontrol strains on pathogen’s protein contents
处理组的蛋白质含量呈现显著的下降趋势(图8),而对照组蛋白质含量变化较为平稳,说明提取物抑制了病原菌菌丝体蛋白质的合成。
3 结论与讨论
本文研究了生防菌株YGF9和LX6F2对杨树溃疡病病原菌的抑菌机理,取得以下主要结论:①2株生防菌株均可降低病原菌代谢系统中关键酶的活性,使得病原菌代谢无法正常进行;②生防菌株使病原菌的电导率和MDA增加,使蛋白质含量降低,从而破坏病原菌的生理生化过程。
3.1代谢系统酶活性
生防菌株能够抑制病原菌的生长,必然是破坏了菌丝体正常的生理代谢途径,抑制了代谢途径中各种重要酶的活性。很多生防菌株可诱导寄主防御保护酶活性的升高或者抑制病原菌保护酶的活性。由于超氧化歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、多酚氧化酶(PPO)等作为生物体内抗氧化系统的组成部分,起到保护机体组织细胞免受氧化剂的损害,具有抗组织细胞发生膜脂过氧化作用[9]。在本研究中,SOD、CAT、POD和PPO 4种酶对生防菌株提取物均比较敏感,都呈现出先上升后下降的趋势。这种变化趋势表明,病原菌菌体在提取物的逆境胁迫下,前期细胞内的SOD、CAT、POD和PPO 4种保护酶互相协调一致,呈现上升趋势,以此来发挥它们对菌体的保护作用,但后期由于氧自由基的增加、H2O2毒害作用增强、膜脂过氧化的加重、菌体的保护屏障遭到破坏,最终导致各种酶含量的降低或消失。柳凤等[10]发现经过红树内生细菌RS261菌株培养液处理后,辣椒苗体内MDA含量和SOD、POD以及CAT的活性等均较仅接种疫霉病菌的处理低,但可显著诱导辣椒体内PAL的活性。植物在抵御病原微生物侵染的过程中,抗性相关酶发挥了重要作用,其中就包括了酚类代谢系统中的多酚氧化酶[11]。PPO通过催化木质素及醌类化合物形成,构成保护性屏蔽而使细胞免受病菌的侵害,也可以通过形成醌类物质直接发挥抗病作用。高效木霉菌株T-43 发酵液的乙酸乙酯提取物对病原菌的主要保护酶SOD、POD、CAT和PPO影响作用显著,提取物通过破坏病原菌的防护系统,抑制病原菌生长[12]。
3.2生理生化指标
很多植物的病原真菌细胞壁及细胞膜是真菌的保护屏障,当真菌遇到强抑菌剂而使细胞膜遭到破坏时,菌体的保护屏障被打破,使其内部电解质外泄至培养液中,进而使培养液的电导率上升。膜透性的增大是膜系统被破坏的表现之一,膜透性的大小可用电解质渗漏率即电导率的变化来衡量。因此,菌液电导率的变化反映了真菌细胞膜通透性的变化[13]。张慧茹等研究发现绞股蓝内生真菌JY25发酵液可以使致病大肠杆菌的电导率增加,是细胞膜受到明显破坏[14]。类似地,本研究中生防菌株YGF9和LX6F2使病原菌的电导率明显增大,破坏了病原菌细胞膜,影响了细胞膜的屏障功能。MDA是膜脂过氧化的产物,其含量的大小是衡量膜脂过氧化程度一个非常重要的生理指标,反映了膜结构受害程度的大小[15]。本研究中,经生防菌株发酵液提取物处理后病原菌的MDA含量增大,说明MDA对细胞的毒害作用增强,细胞膜脂严重氧化,细胞膜完整性受到破坏。蛋白质是肌体重要的组成部分,它能缓解和调节肌体在胁迫条件下引起的伤害[16]。葡萄座腔菌在提取物的胁迫作用下蛋白质含量降低,说明蛋白质对细胞的支撑和保护作用减弱,使病原菌更易受到损伤。
本试验仅研究了生防菌株对病原菌代谢系统中各种关键酶的影响,如要了解其深层次的作用机理,则需要对各种酶对应的基因表达与否和表达量进行探索研究。此外,本研究的切入点是生防菌株对病原菌的影响,而对于生防菌株对寄主抗性诱导方面的研究以及寄主-病原菌-生防菌株三者的交互作用还没有涉及,以后可以从这些方面进行深入研究。
[1]Friedrich L, Lawton K, Reuss W, et al. A benzothiadiazole derivative induces systemic acquired resistance in tobacco [J]. Plant Journal, 1996, 10(1):61-70.
[2]刘晓光, 高克祥, 康振生, 等. 生防菌诱导植物系统抗性及其生化和细胞学机制[J]. 应用生态学报, 2007, 18(8): 1861-1868.
[3]Rajesh Ramarathnam. Mechanisms of phyllosphere biological control of leptosphaeria maculans, the blackleg pathogen of canola, using antagonistic bacteria [D]. Manitoba Canada: University of Manitoba Winnipeg, 2007.
[4]Cook R J. Making greater use of introduced microorganisms for biological control of plant pathogens[J]. Phytopathology, 1993, 31:53-80.
[5]Weller D M. Pseudomonas biocontrol agents of soilborne pathogens: Looking back over 30 years [J]. Phytopathology, 2007, 97(2):250-256.
[6]杨蕾, 周国英, 梁军, 等. 防治杨树溃疡病内生菌的分离筛选及鉴定[J]. 植物保护学报, 2014, 41(4): 438-446.
[7]杨蕾, 梁军, 周国英, 等. 土壤中杨树溃疡病生防菌株的分离鉴定[J]. 林业科学, 2015, 51(4):116-125.
[8]李冲伟, 杨立宾, 邓勋, 等. 木霉菌株对金黄壳囊孢菌的抑菌效应及机制[J]. 林业科学, 2012, 48(9): 87-94.
[9]计红芳, 宋瑞清, 杨谦. 绒白乳菇发酵液提取物对杨树叶枯病菌保护酶活性、丙二醛含量及电导率的影响[J]. 北京林业大学学报, 2007, 29(6): 156-160.
[10]柳凤, 欧雄常, 何红, 等. 红树内生细菌RS261防治辣椒疫病机理的初步研究[J]. 植物病理学报, 2010, 40(1): 74-80.
[11]孙彩云, 潘军, 陈秀兰, 等. 抑制姜瘟青枯假单胞菌的木霉菌株的筛选及其抑菌机理[J]山东大学学报(理学版), 2002, 37(4): 373-376.
[12]邓勋, 宋瑞清, 宋小双, 等. 高效木霉菌株对樟子松枯梢病的抑菌机理[J]. 中南林业科技大学学报, 2012, 32(11): 21-27.
[13]钱丽红, 陶妍, 谢晶. 茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J]. 微生物学通报, 2010, 37(11): 1628-1633.
[14]张慧茹, 孟素香, 曹健, 等. 绞股蓝内生真菌抗大肠杆菌抗菌机制的研究[J]. 微生物学通报, 2015, 42(1): 157-162.
[15]王建书, 朱云枝, 赵敏, 等. 画眉草弯孢霉菌株QZ-2000与低剂量化学除草剂复配增效机制研究[J]. 河南农业科学, 2010(10): 65-70.
[16]孔治有, 刘叶菊, 覃鹏. 人工加速老化对小麦种子CAT、POD、SOD活性和可溶性蛋白质含量的影响[J]. 中国粮油学报, 2010, 25(10): 24-27.
(责任编辑:田喆)
Antifungal mechanism of two biocontrol strains on poplar canker
Yang Lei1,2,Zhou Guoying1,Liang Jun1,2
(1. Key Laboratory of Non-wood Forest Cultivation and Conservation of Ministry of Education, Central South University of Forestry & Technology, Changsha410004, China; 2. Key Laboratory of Forest Protection of State Forestry Administration, Research Institute of Forest Ecological Environment and Protection, Chinese Academy of Forestry, Beijing100091, China)
Trichodermaaureoviridestrain YGF9 andFusariumequisetistrain LX6F2 were two biocontrol strains which were respectively isolated from poplar tissues and soils. In order to explore the mechanisms of these strains in preventing disease, their biocontrol efficacies to poplar canker caused byBotryosphaeriadothidea, their disturbance to the pathogen’s metabolic pathways and influence on the pathogen’s physiological function were investigated. It showed that the N-butanol extract from the fermented liquids of strains YGF9 and LX6F2 could reduce the activities of SOD, CAT, POD, PPO, HK, PK, LDH, MDH, SDH and coenzyme Ⅰ, and caused the enzyme activities of Na+, K+-ATP, Mg2+-ATP and Ca2+-ATP enzyme to decline sharply. The two strains were able to increase the electrical conductivity and MDA content of the pathogen significantly, and reduce the protein content of the pathogen. In addition, it was found that the two biocontrol strains could destroy the metabolic pathways and affect the physiological function of the pathogen, which might be the reasons why the strains YGF9 and LX6F2 could prevent poplar canker.
poplar canker;Trichodermaaureoviride;Fusariumequiseti;biocontrol strain;antifungal mechanism
2015-04-15
2015-05-15
“十二五”国家科技支撑计划课题(2012BAD19B08);湖南省研究生科研创新项目(CX2014B328)
E-mail:liangjun@caf.ac.cn
S 476.1,S 763.1
A
10.3969/j.issn.0529-1542.2016.02.008
