基于黄酮类成分聚类分析的苦荞粉掺兑检测方法研究
2016-09-13王景富王静霞黄艳菲张绍山
王景富,王静霞,3,左 旭,黄艳菲,滕 云,张绍山,刘 圆
(1.西南民族大学化学与环境保护工程学院,四川成都 610041;2.西南民族大学民族医药研究院,四川成都 610041;3.四川工商职业技术学院酒类与食品工程系,四川都江堰 611830;4.湖北中医药大学教育部中药资源和中药复方重点实验室,湖北武汉 430065)
基于黄酮类成分聚类分析的苦荞粉掺兑检测方法研究
王景富1,王静霞1,3,左旭1,黄艳菲2,4,滕云1,张绍山1,刘圆2,*
(1.西南民族大学化学与环境保护工程学院,四川成都 610041;2.西南民族大学民族医药研究院,四川成都 610041;3.四川工商职业技术学院酒类与食品工程系,四川都江堰 611830;4.湖北中医药大学教育部中药资源和中药复方重点实验室,湖北武汉 430065)
采用超高效液相色谱法建立苦荞粉的色谱指纹图谱。以芦丁为参照峰,根据共有特征峰的相对峰面积,应用系统聚类分析法,对模拟分别掺入不含黄酮类的大麦粉和小麦粉的苦荞粉进行指纹图谱分析,区分和鉴别掺兑苦荞粉。结果表明:当掺兑量达到2%时,掺兑不含黄酮类的大麦粉和小麦粉的苦荞粉均可以与纯苦荞粉明显地区分开;且市场购买的苦荞粉与纯苦荞粉通过聚类分析法也能将两者明显区分。该方法操作简便、灵敏度高,稳定性、重复性好,可用于掺入不含黄酮类的大麦、小麦等样品的快速鉴别。
苦荞粉,掺兑检测,聚类分析,超高效液相色谱法
苦荞Fagopyrumtataricum(L.)Gaench,为蓼科Polygonaceae荞麦属Fagopyrum植物[1],为药食同源植物。作为食物,苦荞营养丰富,富含蛋白质、脂肪、多糖、维生素、微量元素和多种氨基酸等;作为药物,苦荞具有降糖降脂、抗疲劳、抗衰老及防治高血压、冠心病的作用[2-5]。
由于苦荞的食用价值、营养价值和药用价值都较高,深受消费者的青睐,市场需求量大,但是常常发现商家为了牟取利益,以假乱真,用伪劣品以次充好,所以商品苦荞粉的纯度和质量已经让民众不放心。HPLC(高效液相色谱)技术在食品类的成分检测、食品添加剂的检测及食品掺假检测中已得到广泛应用[6-8],超高效液相色谱(UPLC)技术是在HPLC的技术上进一步的发展,具有超高的分离度、分析速度及灵敏度的特点,在食品安全、药物分析、环境分析等领域都有不断的应用与发展。因此,本课题拟对苦荞粉掺兑情况,采用超高效液相色谱法(UPLC)建立苦荞粉以及掺兑苦荞粉的UPLC指纹图谱[9-11],计算所测样品的指纹图谱与对照品指纹图谱的相似度,明确不同来源的苦荞粉样品间是否具有相同的超高效液相指纹特征。应用系统聚类分析法[12],对模拟掺入大麦粉与小麦粉的苦荞粉掺兑样品进行指纹分析,以此对纯苦荞粉和掺兑苦荞粉样品进行鉴别,以期对苦荞及其部分苦荞食品的质量评价和掺兑情况提供实验数据和科学参考,为苦荞安全、可靠、高效的开发利用提供科学依据。
1 材料与方法
1.1材料与仪器
苦荞样品22批不同农业栽培品种均采自成都大学苦荞实验田,经西南民族大学民族医药研究院刘圆教授鉴定为蓼科荞麦属植物苦荞Fagopyrumtataricum(L.)Gaench的种子;大麦粉南阳兴农种业有限公司;小麦粉武威市西部粮油土产经销有限责任公司;苦荞粉Z1成都人民营养食品厂;苦荞粉Z2三绿有机食品有限公司;苦荞粉Z3天津市港保税区爱信食品有限公司;苦荞粉Z4凉山州跨克苦荞食品有限责任公司;苦荞粉Z5山西雁门清高食业有限责任公司;芦丁对照品(批号:MUST-12040302)和山奈酚对照品(批号:MUST-11041101)四川省成都市曼斯特生物科技有限公司;槲皮素对照品(批号:100081-200907)中国食品药品检定研究院;色谱甲醇美国Fisher Scientific公司;甲醇分析纯;磷酸(色谱纯)科密欧试剂公司;蒸馏水香港屈臣氏公司。
Waters Acquity UPLC H-Class System型超高效液相色谱仪,包括Acquity UPLC QSM,Acquity UPLC Sample Manager FTN,Acquity UPLC PDA Detector(美国Waters公司),工作站为Empower 3;Milli-Q美国Millipore公司;METTLER AE240电子分析天平梅特勒-托利多(上海)仪器有限公司;W210B恒温水浴锅上海申顺生物科技有限公司。
1.2实验方法
1.2.1对照品溶液的制备分别精密称取对照品芦丁10 mg、槲皮素1 mg和山柰酚1 mg,于10 mL容量瓶中,用甲醇定容,配成浓度分别为1,0.1和0.1 mg/mL的对照品贮备液。
1.2.2供试品溶液的制备自采的苦荞种子用打粉机打粉,过药典5号筛;购买的商品苦荞粉直接称取,分别精密称取各样品0.2 g,置于具塞锥形瓶中,加入70%甲醇(v/v)20 mL,在室温条件下超声(250 W,40 kHz)30 min,静置5 min后,过滤,取续滤液,将滤液离心15 min取上清液为供试品溶液,进样前用0.22 μm有机滤膜过滤。
1.2.3色谱条件色谱柱:ACQUITY UPLC HSS T3(1.8 μm,2.1×100 mm);流动相组成:甲醇-0.1%磷酸水线性梯度洗脱;流速:0.2 mL/min;检测波长:280 nm;进样量:0.8 μL;柱温:30 ℃;洗脱程序见下表:
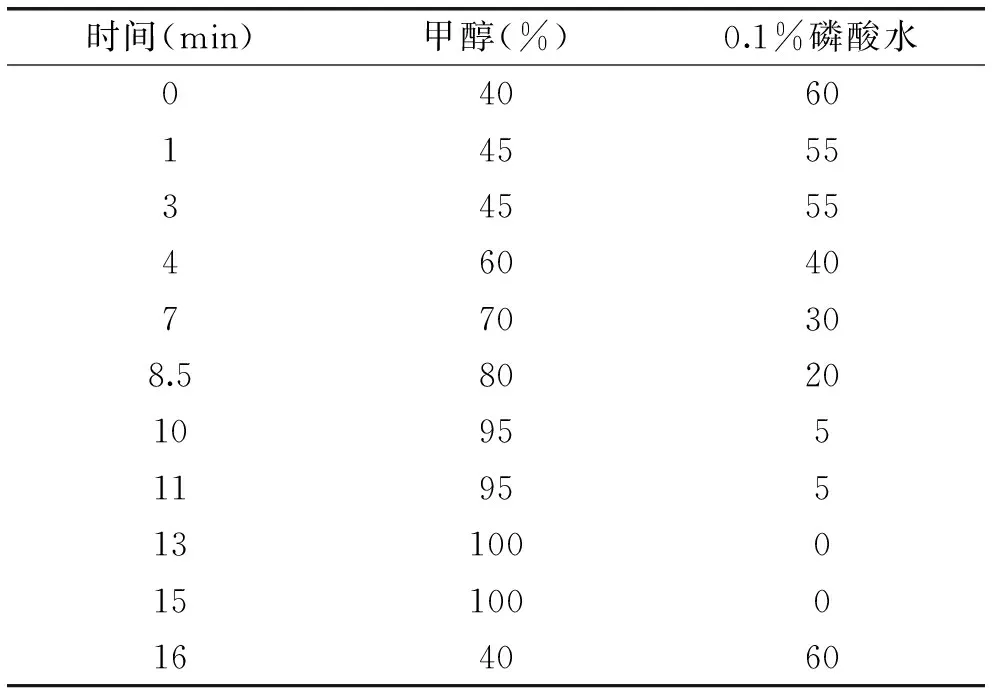
表1 梯度洗脱程序
1.2.4方法学考察
1.2.4.1重复性实验精密称取苦荞粉样品西荞1号5份,按照“1.2.2”项方法制备供试品溶液并进行测定,以芦丁的相对保留时间和相对峰面积为参照,计算各个共有峰相对保留时间和相对峰面积的相对标准差(RSD)均小于4%,说明该方法的重复性良好。
1.2.4.2精密度实验精密吸取“1.2.4.1”项的苦荞粉样品西荞1号供试品溶液,连续进样5次,以芦丁的相对保留时间和相对峰面积为参照,计算各个共有峰相对保留时间和相对峰面积的RSD均小于2.7%,说明该仪器精密度良好。
1.2.4.3稳定性实验精密吸取“1.2.4.1”项的苦荞粉样品西荞1号供试品溶液分别于0、4、8、16、32 h进行测定,以芦丁的相对保留时间和相对峰面积为参照标准,各个共有峰的相对保留时间和相对保留峰面积的RSD均小于3%,说明该供试液在32 h内稳定。
2 结果与讨论
2.1苦荞粉UPLC指纹图谱的构建
2.1.1苦荞粉UPLC指纹图谱的建立对22批次苦荞粉按照“1.2.2”项下方法制备供试液,按照“1.2.3” 项下方法进行UPLC分析,采集UPLC色谱图,混合对照品见图1,峰1、2、3分别依次对应的标准品为芦丁、槲皮素、山奈酚。利用中药色谱指纹图谱相似度评价软件(2004A版),采用自动匹配方式生成了22批苦荞粉样品的指纹图谱(S1~S22),用中位数法生成22批苦荞粉样品的对照指纹图谱(R),得到22批苦荞粉的指纹图谱的7个共有峰,见图2,其中3号、5号峰对应混合对照品的峰是芦丁、槲皮素。
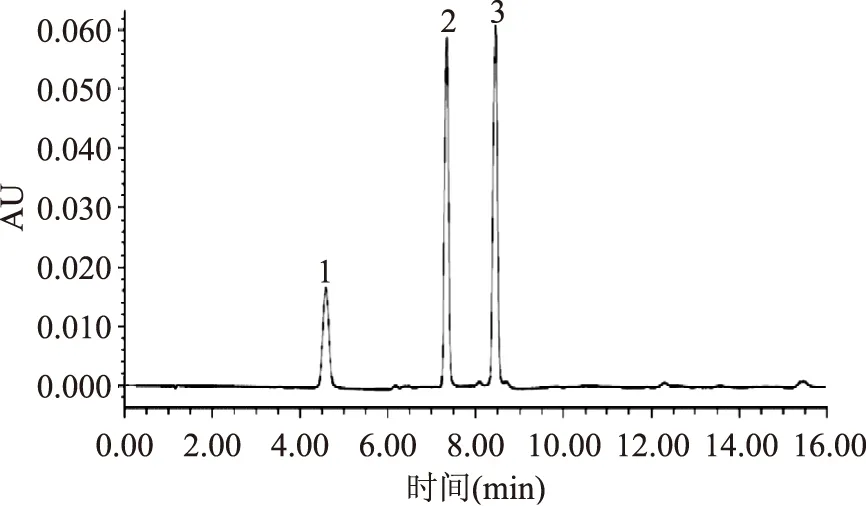
图1 混合对照品的UPLC色谱图Fig.1 UPLC chromatograms of hybrid reference substance注:1.芦丁;2.槲皮素;3.山奈酚。
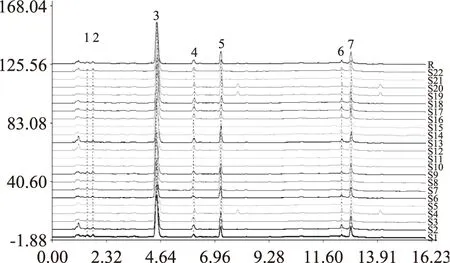
图2 22批次纯苦荞粉的指纹图谱以及生成的共有模式Fig.2 UPLC fingerprints of 22 batches of Buckwheat 注:3.芦丁,5.槲皮素,图4、图6、图9同。
2.1.2苦荞粉UPLC指纹图谱的相似度分析指纹图谱相似度是中药质量控制的一个重要参数,中药指纹图谱相似度常用于中药的真伪鉴别研究和质量控制。本实验利用中药色谱指纹图谱相似度评价系统(2004A版)对所测样品之间的指纹图谱进行评价,以22批纯苦荞粉样品的指纹图谱数据生成对照指纹图谱,并以此对各批次样品的指纹图谱的相似度进行评价。其结果(表2)表明:样品指纹图谱与对照指纹图谱的相似度都大于0.954,即22批纯苦荞粉样品具有相似的UPLC 指纹特征。
2.2纯苦荞粉与掺兑大麦、小麦粉后的指纹图谱比较分析
2.2.1掺兑大麦粉后的指纹图谱比较分析对掺兑大麦粉的样品及纯苦荞粉样品采用“1.2.2”项下的方法制备供试液及“1.2.3”项下的色谱条件进行测定,采集UPLC指纹图谱进行指纹图谱分析,图3为大麦粉UPLC色谱图,掺兑大麦粉样品与纯苦荞粉的指纹图谱见图4,S1~S7为纯苦荞粉,S8~S13为掺兑大麦的苦荞粉,在大约14 min处,掺兑苦荞粉都出现了纯苦荞粉不具有的峰,可以以此峰作为苦荞粉是否掺兑大麦粉的鉴别依据。

图3 大麦粉UPLC色谱图Fig.3 UPLC chromatograms of barley powder

图4 7个不同种的纯苦荞粉与掺兑大麦粉的指纹图谱和对照指纹图谱Fig.4 UPLC fingerprints of the pure buckwheat powder and the buckwheat powder mixing barley
2.2.2掺兑小麦粉后的指纹图谱比较分析对掺兑小麦粉的样品及纯苦荞粉样品采用“1.2.2”项下的方法制备供试液及“1.2.3”项下的色谱条件进行测定,采集UPLC指纹图谱进行指纹图谱分析,图5为小麦粉UPLC色谱图,掺兑小麦粉样品与纯苦荞粉的指纹图谱见图6,S1~S7为7个不同农业栽培品种的纯苦荞粉,S8~S13为掺兑小麦的苦荞粉,在大约14 min处,掺兑苦荞粉都出现了纯苦荞粉不具有的峰,可以以此峰作为苦荞粉是否掺兑小麦粉的鉴别依据。
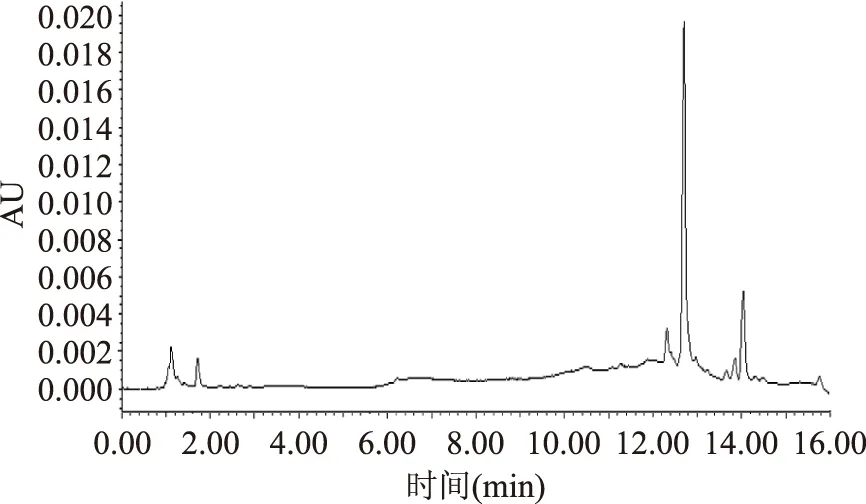
图5 小麦UPLC图谱Fig.5 UPLC chromatograms of wheat powder

图6 7个不同种的纯苦荞粉与掺兑小麦粉的指纹图谱和对照指纹图谱Fig.6 UPLC fingerprints of the pure buckwheat powder and the buckwheat powder mixing wheat

表2 22批次的苦荞粉的指纹图谱相似度
2.3系统聚类分析
2.3.1掺入大麦粉的掺兑苦荞粉的鉴别因大麦粉中不含有芦丁等黄酮类物质,故拟在纯苦荞粉中掺入大麦粉,苦荞粉中的黄酮类成分含量会降低。因此本实验模拟制备6个掺兑2%、5%、10%、15%、20%、25%的大麦粉的苦荞粉样品(A1~A6)。按照“1.2.2” 项下的方法制备供试液,并按照“1.2.3”项下的色谱条件进行测定。以3号峰(芦丁峰)为参照峰的7个共有峰的相对峰面积组成的矩阵采用DPS软件以规格化转换-兰氏距离-可变平均法对数据进行标准化统计分析,所得的聚类分析树状图见图7。
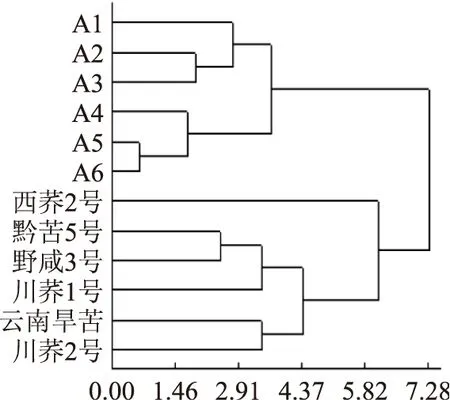
图7 纯苦荞粉与掺兑大麦粉的聚类分析树状图Fig.7 Hierachical clustering analysis of the pure buckwheat and the buckwheat powder mixing barley
从图7上可知:西荞2号、黔苦5号、野咸3号、川荞1号、云南旱苦、川荞2号可划分为一类,这一类皆是纯苦荞粉;A1、A2、A3、A4、A5、A6可划分为一大类,这一类皆为掺兑大麦粉的苦荞粉。由此,当掺兑量达到2%时掺兑大麦粉的苦荞粉与纯苦荞粉被明显地区分开。
2.3.2掺入小麦粉的掺兑苦荞粉的鉴别因小麦粉中不含有芦丁等黄酮类物质,故拟在纯苦荞粉中掺入小麦粉,苦荞粉中的黄酮类成分含量会降低。因此本实验模拟制备6个掺兑2%、5%、10%、15%、20%、25%的小麦粉的苦荞粉样品(B1~B6)。按照“1.2.2” 项下的方法制备供试液,并按照“1.2.3”项下的色谱条件进行测定。以3号峰(芦丁峰)为参照峰的7个共有峰的相对峰面积组成的矩阵采用DPS软件以规格化转换-兰氏距离-可变平均法对数据进行标准化统计分析,所得的聚类分析树状图见图8。

图8 纯苦荞粉与掺兑小麦粉的聚类分析树状图Fig.8 Hierachical clustering analysis of the purebuckwheat and the buckwheat powder mixing wheat
从图8上可知:西荞1号、西荞2号、黔苦5号、野咸3号、川荞1号、云南旱苦、川荞2号可划分为一类,这一类皆是纯苦荞粉;B1、B2、B3、B4、B5、B6可划分为一大类,这一类皆为掺兑小麦粉的苦荞粉。由此,当掺兑量达到2%时掺兑小麦粉的苦荞粉与纯苦荞粉明显地区分开。
2.4纯苦荞粉与商品苦荞粉的质量评价研究
2.4.1待测样品的制备及检测分析取适量的纯苦荞粉与商品苦荞粉按照“1.2.2” 项下的方法制备供试液,并按照“1.2.3”项下的色谱条件进行测定,采集纯苦荞粉与商品苦荞粉的UPLC色谱图,按照“2.3”项下的方法对检测数据进行聚类分析。
2.4.2纯苦荞粉与商品苦荞粉的UPLC指纹图谱比较分析该指纹图谱以S1号样品峰为参照峰,采用多点对照、自动匹配的方式生成对照指纹图谱。由图9可知,S1~S6为纯苦荞粉,S7~S11为商品苦荞粉,在约12.8 min处,商品苦荞粉与纯苦荞粉的出峰情况明显不同,纯苦荞粉有明显的峰出现,而商品苦荞粉没有峰出现,可以以此峰作为苦荞质量评价的一个标准。
2.4.3纯苦荞粉与商品苦荞粉的鉴别采用DPS2000聚类分析软件,以不转换数据转换方式,绝对值聚类距离,平均法聚类方法进行聚类分析。从聚类分析图10上可知:西荞2号、黔苦5号、野咸3号、川荞1号、云南旱苦、川荞2号可被划分为一类,Z1、Z2、Z3、Z4、Z5被划分为一类,这两大类能明显地区分开。
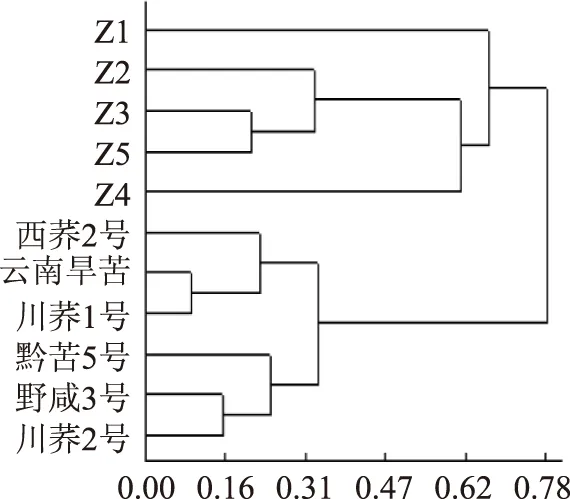
图10 纯苦荞粉与商品苦荞粉的聚类分析树状图Fig.10 Hierachical clustering analysis of the buckwheatpowder from the market and the pure buckwheat powder
3 结论
建立了苦荞粉的UPLC指纹图谱,测定结果表明22批样品的指纹图谱与对照品指纹图谱的相似度均大于0.954,说明不同品种的苦荞粉样品间具有相似的UPLC指纹特征。应用系统聚类分析(HCA)法,对模拟掺入大麦粉与小麦粉的苦荞粉掺兑样品进行指纹分析,实验结果表明:掺入质量分数2%及以上大麦粉或小麦粉的掺兑苦荞粉样品可予以鉴别。从大麦、小麦掺兑的指纹图谱与纯苦荞粉的指纹图谱上可以直观地看出两者有明显的区别,而通过聚类分析也得出同样的结论。通过对纯苦荞粉与商品苦荞粉的比较分析可以发现,在指纹图谱中可以清楚的观察到在12.8 min处商品苦荞粉与纯苦荞粉的出峰情况明显不同,纯苦荞粉有明显的峰出现,而商品苦荞粉没有峰出现,以此峰可作为苦荞粉质量评价的一个标准;再通过聚类分析发现西荞2号、黔苦5号、野咸3号、川荞1号、云南旱苦、川荞2号6个纯苦荞粉可被划分为一类,Z1、Z2、Z3、Z4、Z5等5个商品苦荞粉被划分为一类,这两大类能明显地区分开,说明纯苦荞粉与商品苦荞粉在成分含量或者是黄酮类成分的含量上可能存在差异。该方法操作简便、灵敏度高且稳定性好、重复性好,可用于掺入大麦、小麦等样品的鉴别检测。
[1]中国科学院中国植物志编辑委员会.中国植物志:第25(1)卷[M].北京:科学出版社,1998.
[2]朱云辉,郭元新.我国苦荞资源的开发利用研究进展[J].食品工业科技,2014,24:360-365.
[3]Jin HM,Wei P.Anti-fatigue properties of tartary buckwheat extracts in mice[J].International Journal of Molecular Sciences,2011,12(8):4770-80.
[4]Lee CC,Shen SR,Lai YJ,et al.Rutin and quercetin.bioactive compounds from tartary buckwheat,prevent liver inflammatory injury[J].Food & Function,2013,4(5):794-802.
[5]Guo XD,Ma YJ,Parry J,et al.Phenolics content and antioxidant activity of tartary buckwheat from different locations[J]. Molecules,2011,16(12):9850-9867.
[6]李灿,陈英,李培,等.HPLC-ELSD同时分离检测食品中十种单糖、双糖和低聚果糖[J].食品工业科技,2013,34(7):309-313,318.
[7]顾宇翔,葛宇,印杰,等.聚酰胺吸附-HPLC测定饮料和糖果中的20种水溶性色素[J].食品与发酵工业,2012,38(1):161-164.
[8]Jun Dai,Yan Wu,Shang-wei Chen,et al.Sugar Compositional Determination of Polysaccharides from D. Salina by Modified RP-HPLC Method of Precolumn Derivatization with 1-phenyl-3-methyl-5-pyrazolone[J]. Carbohydrate Polymer,2010,82(3):629-635.
[9]韩燕全,洪燕,夏伦祝,等.UPLC指纹图谱技术结合毒性成分含量优选苍耳子的炮制工艺[J].中国中药杂志,2014,39(7):1248-1254.
[10]Guo Y,Hua Y,Du T,et al.Quality control and discrimination of angelica different processed products based on HPLC fingerprints combined chemometrics methods[J]. China Journal of Chinese Materia Medica,2010,35(12):1551-1555.
[11]李欣,王步军.超高效液相色谱-串联四级杆质谱法测定苦荞麦中黄酮类化合物[J].食品工业科技,2011,32(4):383-385,388.
[12]李小亭,李瑞盈,相海恩,等.基于HPLC指纹图谱及聚类分析对不同产地枸杞质量评价研究[J].现代食品科技,2012,28(9):1251-1253,1261.
Adulteration detection of buckwheat powder by clustering analysis of flavonoid components
WANG Jing-fu1,WANG Jing-xia1,3,ZUO Xu1,HUANG Yan-fei2,4,TENG Yun1,ZHANG Shao-shan1,LIU Yuan2,*
(1.School of Chemistry and Environmental Protection Engineering,Chengdu 610041,China;2.Ethnic Medicine Institute,Southwest University for Nationalities,Chengdu 610041,China;3.Department of Alcohol And Food Engineering,Sichuan Technology And Business College,Dujiangyan 611830,China;4.Key laboratory of Traditional Chinese Medicine Resource and Compound Prescription,Hubei University of Traditional Chinese Medicine,Wuhan 430065,China)
In order to establish a detection method of buckwheat powder adulteration,chromatographic fingerprint of Ultra High Performance Liquid Chromatography(UPLC)method was used. Rutin as reference peak,according to relative peak area of the characteristic peak,simulated buckwheat powder samples adulterated respectively with barley powder or wheat flour were identified by System Clustering Analysis method. The results showed that buckwheat powder,which was adulterated with more than 2% barley powder or wheat flour,could be identified. The buckwheat powder from the market and the pure buckwheat powder could be clearly distinguished by clustering analysis method. The method was simple,high sensitivity and good stability,good repeatability,detection could be used to incorporate the identification of flavonoid-free barley,wheat and other samples.
buckwheat powder;adulteration detection;clustering analysis;ultra performance liquid chromatography
2015-12-08
王景富(1986-),男,在读硕士研究生,从事民族药物学研究,E-mail:xnmdwjf@139.com。
刘圆(1968-),女,博士,教授,从事民族药物学研究,E-mail:yuanliu163@aliyun.com。
国家十三五科技支撑计划(2015BAC05B02);四川省科技计划项目(2015SZ0062)。
TS207.3
B
1002-0306(2016)13-0309-06
10.13386/j.issn1002-0306.2016.13.055
