对大肠杆菌异源表达乳酸片球菌素包涵体复性方法的研究
2016-09-13檀茜倩肖华志周志江
檀茜倩,韩 烨,肖华志,周志江
(天津大学化工学院食品科学与工程系,食品生物技术实验室,天津 300072)
对大肠杆菌异源表达乳酸片球菌素包涵体复性方法的研究
檀茜倩,韩烨,肖华志,周志江*
(天津大学化工学院食品科学与工程系,食品生物技术实验室,天津 300072)
本研究对E.coliBL21(DE3)基因工程菌高效表达的乳酸片球菌素融合蛋白包涵体进行了提取和变性溶解,并采用稀释复性,反稀释复性,透析复性,CTAB辅助复性和CTAB和β-CD结合辅助复性五种方法对乳酸片球菌素融合蛋白包涵体的变性溶液进行了复性的研究。结果表明CTAB和β-CD结合辅助复性的复性方法优于其它的复性方法,可以实现以较高浓度的包涵体变性蛋白溶液,较小体积的复性液来获得较高浓度的复性产物和达到相对稳定的复性率。
包涵体,复性,片球菌素
采用基因工程方法构建大肠杆菌重组表达系统已经成为现代生物技术的一种常用手段。但是由于大肠杆菌表达系统的高效表达,很容易使被表达的蛋白在细胞内形成水不溶性包涵体。包涵体(Inclusion body)是指在某些生长条件下,大肠杆菌积累某种特殊的生物大分子并且致密地集聚在细胞内,或被膜包裹或形成无膜裸露的水不溶性结构,一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、外膜蛋白OmpC、OmpF和OmpA等,环状或缺口的质粒DNA,以及脂体、脂多糖等[1-2]。
大肠杆菌内积聚的包涵体一般通过菌体破碎,配合离心和一定程度的洗涤从菌体中初步分离出来[3-4]。为了获得有活性的蛋白,通常需要对包涵体进行复性。包涵体的复性方法很多[5],国内外文献针对包涵体的复性有诸多报道。Wang[6-7]等利用CTAB即十六烷基三甲基溴化胺和β-CD即β环糊精作为分子伴侣辅助重组溶菌酶复性获得了比传统的稀释复性更好的效果。Lu等人[8]提出的利用PNIPAAm聚N-异丙基丙烯酰胺作为分子伴侣辅助复性,此外还有利用离子交换色谱[9]、分子排阻色谱[10-11]等对变性蛋白进行复性。虽然如此,包涵体蛋白复性仍是对大肠杆菌表达系统表达蛋白纯化的瓶颈因素,且对不同包涵体蛋白的复性条件也有所不同。
乳酸片球菌素是由乳酸菌产生的一类具有抑菌功能的细菌素,对革兰氏阳性菌有抑制作用[12]。野生型乳酸片球菌产量较低[13],利用大肠杆菌表达系统可以实现乳酸片球菌素的异源表达并获得乳酸片球菌素融合蛋白包涵体。为了获得有活性的片球菌素,本实验分别采用稀释复性,透析复性,CTAB辅助复性,CTAB和β-CD辅助复性对乳酸片球菌素融合蛋白包涵体进行了复性,并对这几种复性方法的复性率进行了比较分析,为乳酸片球菌素融合蛋白包涵体复性方法的选择提供了依据。
1 材料与方法
1.1材料与仪器
乳酸片球菌素融合蛋白包涵体由含有pedA基因的E.coliBL21(DE3)基因工程菌产生,单核细胞增多症李氏杆菌CVCC1595中国兽医药品监察所。E.coliBL21(DE3)基因工程菌培养采用LB培养基(amp+),单核细胞增多症李氏杆菌的培养采用LB培养基。基因工程菌生长培养基为MDG培养基(amp+),自动诱导培养基为ZYM-5052(amp+)培养基,各培养基添加的amp+的终浓度均为50 μg/mL。
包涵体溶解液0.1 mol/LTris·HCl,8 mol/L 尿素,30 mmol/L DTT,1 mmol/L EDTA;包涵体复性液100 mmol/L Tris·HCl,100 mmol/L NaCl,0.4 mmol/L/4 mmol/L GSSG/GSH,1 mmol/L EDTA。
SDS-PAGE电泳、Tricine-SDS-PAGE电泳所用试剂Sigma;氨苄青霉素由genview分装,尿素、氧化型谷胱甘肽、还原型谷胱甘肽、咪唑北京普博欣公司;重组肠激酶(rEK-B)广州中大南海生物技术有限公司;其他试剂天津大学科威公司均为分析纯。
DYCZ-24D双垂直电泳槽北京市六一仪器厂;GIS-2009紫外凝胶成像仪Tanon公司;JY88-IIN 超声波细胞破碎仪宁波新芝;UV-1102 紫外可见分光光度计上海天美;D2004W电动搅拌器上海梅颖浦仪器制造有限公司。
1.2实验方法
1.2.1包涵体的制备采用自动诱导方法诱导大肠杆菌表达系统表达片球菌素融合蛋白,参考Studier方法并做适当改变[14]。挑取甘油冻存E.coliBL21(DE3)基因工程菌于含有amp+的LB平板上划线,过夜培养。次日挑取平板上茁壮单菌落接入5 mL含amp+的MDG培养基中,37 ℃,170 r/min,过夜培养。次日将菌液按1∶500比例接入含适量amp+的ZYM-5052培养基中在37 ℃,将摇菌速度提升到190 r/min过夜培养,待菌体变浑浊转移入20 ℃摇床在同样转速下继续培养,每间隔1 h取样测定菌液的OD600值,当OD600值在1~2 h不发生变化时收集菌液,将菌液离心,弃去上清液,收集菌体沉淀,重悬于PBS缓冲液(pH7.4)中,采用溶菌酶处理,溶菌酶终浓度为2 mg/mL,在20、40、60、80、100、120 min分别取样500 μL稀释10倍后使用紫外-可见分光光度计测量其OD280、OD260和OD600值后两者可以反映内容物的溶出情况。将经溶菌酶处理的菌体溶液在超声破碎仪上,于200 W,超声开3 s,关3 s的条件下破碎20 min。在4 ℃,8000 r/min离心20 min。弃去上清液,保留沉淀。
1.2.2包涵体的洗涤和溶解包涵体的洗涤和溶解参考Singh的方法[3]。包涵体用PBS缓冲液(pH=7.4)洗涤两次,用2 mol/L的尿素溶液洗涤一次,用0.05% Triton100溶液洗涤一次。每次洗涤后保留样品进行SDS-PAGE凝胶电泳分析以评价洗涤的效果。采用包涵体溶解液溶解洗涤后的包涵体蛋白,将包涵体蛋白沉淀重新悬于溶解液中,在4 ℃下,采用磁力搅拌器进行搅拌12 h后,将溶解液离心,取上清液,采用考马斯亮蓝法测定其蛋白浓度,以牛血清蛋白为标准品。
1.2.3包涵体的复性
1.2.3.1稀释复性直接稀释复性:将最终蛋白浓度分别为0.0472、0.0944、0.1415、0.1887 mg/mL的包涵体溶解后的变性溶液5 mL分别逐滴加入25 mL的复性液中,并不断搅拌,在4 ℃的条件下复性12 h。反稀释复性:将25 mL复性液逐渐加入到含有5 mL最终蛋白浓度分别0.0472、0.0944、0.1415、0.1887 mg/mL的包涵体溶解后的变性溶液中,并不断搅拌,在4 ℃的条件下复性12 h。
1.2.3.2透析复性将蛋白浓度为0.2359 mg/mL的包涵体变性蛋白溶液5 mL装于截留量为8000 ku的透析膜中,在50 mL复性液中于4 ℃下透析24 h复性,中间更换多次复性液。
1.2.3.3CTAB辅助复性参考Wang等方法[6-7]。将CTAB终浓度为10、20、30、40 mmol/L的复性液各25 mL,分别各自逐滴加入5 mL蛋白浓度为0.2539 mg/mL的包涵体变性蛋白溶液中,加入时不断搅拌,于4 ℃复性12 h。
1.2.3.4CTAB和β-CD结合辅助复性参考Wang等方法[6-7]。将蛋白浓度为0.2359 mg/mL的包涵体变性蛋白溶液5 mL逐滴加入10 mL含有10 mmol/L CTAB的复性液中,加入时不断搅拌,在室温复性1 h。逐滴加入β-CD溶液使溶液中的β-CD的浓度值达到15 mmol/L,在室温并磁力搅拌条件下复性30 min,后于4 ℃磁力搅拌的条件下复性12 h。
1.2.4复性后重组蛋白的纯化复性后重组蛋白在缓冲液中做透析处理。采用Ni-IDA柱对重组蛋白进行纯化。按照产品使用手册,纯水洗柱,并用缓冲液平衡10个柱体积,蛋白溶液样品经0.45 μm的滤膜过滤后上样,保持流速为1 mL/min,用缓冲液平衡10个柱体积,使用含50 mmol/L咪唑的平衡溶液进行第一次洗脱,保持流速为1 mL/min,使用含有500 mmol/L咪唑的平衡液进行第二次洗脱,保持流速为1 mL/min。此时收集目的蛋白。将目的蛋白透析后采用冷冻干燥法缩小样品体积。将样品重新溶于肠激酶缓冲液中(20 mmol/L Tris·HCl,100 mmol/L NaCl,pH=7.6),测定样品的蛋白浓度,加入适量的肠激酶酶切。采用考马斯亮蓝方法测定蛋白浓度。产物采用Tricine-SDS-PAGE电泳分析。
1.2.5复性后蛋白活性分析基因工程片球菌素的活性测定采用牛津杯法,指示菌为单核细胞增多症李氏杆菌。对野生型乳酸菌产生的片球菌素使用Yang的方法[15]进行粗提,采用考马斯亮蓝的方法测定粗提液的浓度。将粗提液按如下比例:不稀释,1∶2、1∶4、1∶6、1∶7、1∶8、1∶9、1∶10、1∶11稀释后,进行牛津杯抑菌实验,判断乳酸片球菌素的浓度与抑菌圈与牛津杯直径之差间的趋势关系,做出标准曲线。根据复性后的片球菌素的抑菌圈直径与牛津杯的直径差在标准曲线上查出复性后的片球菌素的蛋白浓度。
1.2.6数据处理实验中每次实验重复三次,采用origin软件进行作图和数据分析。
2 结果与讨论
2.1包涵体的制备和洗涤溶解
菌体细胞的破碎效果的好坏与细胞内容物释放的多少有直接关系。大肠杆菌在600 nm处有最大的吸光度值,而在280 nm和260 nm下,蛋白质的色氨酸、酪氨酸和苯丙氨酸以及核酸中的大量碱基在紫外条件下有最大量的吸收。图1为在室温下溶菌酶处理后菌体细胞的酶解情况。经溶菌酶处理后的细胞胞壁逐渐溶解,细胞内容物大量释放。对此菌液进行超声破碎处理后,菌液的OD600值下降到0.0188,表明此时菌液中的菌体细胞已经被大量降解,包涵体蛋白被很好释放。使用溶菌酶加超声破碎处理细胞,可以缩短细胞的破碎时间,改善细胞的破碎效果,缺点是引入了溶菌酶这种杂蛋白。对破碎后的包涵体的洗涤不仅可以除去菌体细胞中除目的包涵体蛋白以外的蛋白,同时还可以较大程度的除去溶菌酶蛋白,为后续的纯化提供方便。

图1 室温下的酶解过程Fig.1 The process of enzymolysis in room temperature
图2为包涵体蛋白经多次洗涤后电泳图谱。21 ku处为乳酸片球菌素融合蛋白包涵体蛋白条带,14 ku处为溶菌酶条带。泳道1,2显示菌体中许多杂蛋白被除去,但溶菌酶蛋白仍然存在。泳道3显示溶菌酶蛋白大部分被除去,溶液中的其他杂蛋白进一步被除去。泳道4基本呈现单一包涵体条带,说明包涵体蛋白的洗涤比较彻底,纯度较高。
包涵体蛋白在本实验所采用的溶解液中完全溶解,经离心后只有较少的沉淀产生。

图2 包涵体蛋白洗涤后电泳图Fig.2 SDS-PAGE of inclusion body after washing注:M为标准蛋白分子量;泳道1,2为经PBS洗涤以后的蛋白电泳;泳道3为经2 mol/L尿素洗涤后的包涵体蛋白;泳道4为经1% Triton洗涤后的蛋白电泳图。
2.2包涵体的复性
包涵体的复性是指经变性的包涵体蛋白重新折叠成为正确的形式的过程,这个过程包含有复杂的动力学反应,包涵体蛋白的复性可能需要几秒种也可能需要几天的时间,这取决于不同种类的蛋白的复性的难易的程度[16]。稀释复性的方法是最简单也是在工业中经常所使用的方法,将包涵体的变性溶液逐渐加入复性液中,蛋白浓度的降低,可以使变性蛋白在复性液中逐渐重新折叠为有活性的结构形式。其他方法都是针对解决稀释复性后复性液体积过大的缺点产生的。包涵体复性的复性液多为氧化型谷胱甘肽/还原性谷胱甘肽体系溶液。在复性的过程中添加一些多元醇类和其他分子伴侣是为了防止蛋白聚集[17]。
对经过不同的复性方法的复性后产物经过N柱纯化并肠激酶酶切后的Tricine-SDS-PAGE电泳的分析图如图3所示,可以看出,经过Ni柱纯化后的片球菌素基因工程菌的纯度较高,且肠激酶酶切的程度也比较完全,可以清楚的看到两条条带,杂蛋白含量极低,在电泳图谱上不可见。产生两条条带分别为在16 ku左右的硫氧还蛋白条带,和在5 ku左右的乳酸片球菌素条带,与预期的条带相符。

图3 经不同复性方法并经酶切的复性后蛋白电泳图Fig.3 SDS-PAGE of the enzyme cleaved refolding protein under different refolding methods注:M为标准蛋白分子量,泳道1~5分别为稀释复性,反稀释复性,透析复性,CTAB辅助复性,CTAB和β-CD结合辅助复性。
为了进一步评定复性效果,对不同复性方法复性后并经肠激酶酶切后的产物以单核细胞增多症李氏杆菌作为指示菌进行抑菌实验,其抑菌效果如图4所示。实验表明未经肠激酶酶切连有硫氧还蛋白的复性后基因工程产物却不具备抑菌活性,其它几种复性方法产生的片球菌素的抑菌圈直径见表1所示。CTAB和β-CD结合辅助复性的效果最优,稀释复性,反稀释复性的复性效果次之,而透析复性的复性效果最差,基本无法观测到明显的抑菌圈。CTAB的浓度对复性效果影响不大,本文采用的CTAB浓度为10 mmol/L,这个浓度的CTAB对单核细胞增多症李氏杆菌没有抑菌作用,充分避免了CTAB对抑菌实验的干扰。

图4 不同复性方法的酶切后复性产物的抑菌效果Fig.4 The inhibition effect of gene engineering product after enzyme cleavage

复性方法抑菌圈抑菌圈直径(mm)稀释复性+15.02±0.12反稀释复性+14.00±0.04透析复性--CTAB辅助复性+14.36±0.09CTAB和β-CD结合辅助复性+16.42±0.11
注:+有可见抑菌圈,-无可见抑菌圈。
2.3包涵体复性率分析
根据乳酸片球菌素的浓度和抑菌圈与牛津杯的直径差值之间存在线性的趋势关系作出乳酸片球菌素浓度和抑菌圈与牛津杯直径差的标准曲线,如图5所示,根据此标准曲线并结合经过酶切后的基因工程片球菌素对单核细胞增多症李氏杆菌产生的抑菌圈的大小,本研究确定了复性并酶切后片球菌素基因工程产物的浓度如图6所示。
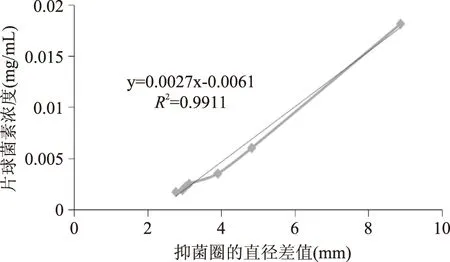
图5 抑菌圈直径与片球菌素蛋白浓度的关系Fig.5 The relationship between the diameter of inhibition circle and the concentration of pediocin
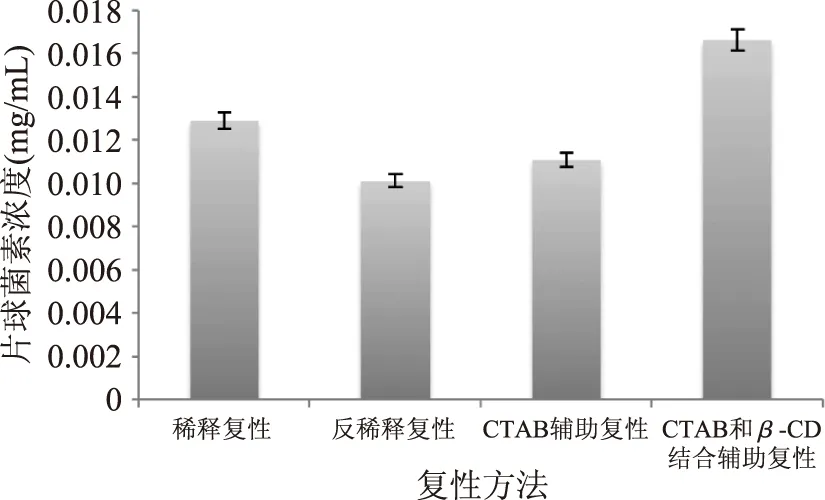
图6 不同复性方法得到的片球菌素的浓度Fig.6 The concentration of pediocin under different refolding methods
本研究定义复性率的计算公式为:复性率(%)=溶液中复性后有活性的基因工程产物的浓度/溶液的总蛋白浓度。故采用不同复性方法复性基因工程产物后,各自的复性率用在图7表示出来。因透析复性因复性率极低不在图中表示。采用稀释复性方法所包涵体蛋白的复性率最高,采用CTAB辅助复性的复性率最低。但是稀释复性加入的变性蛋白浓度很低,且复性液体积较大,为复性后蛋白的纯化带来了困难。CTAB辅助复性和CTAB与β-CD结合辅助复性则允许加入初始蛋白浓度较大的变性蛋白溶液,优于稀释复性。CTAB与β-CD结合辅助复性的复性率为CTAB复性的2倍左右。

图7 不同复性方法的复性率Fig.7 The refolding rate of different refolding method
3 结论
本研究对由含有pedA基因的大肠杆菌表达系统表达的片球菌素的包涵体蛋白的制备,变性溶解和不同复性方法进行了比较研究。通过研究发现稀释复性的复性率高于其他复性方法,但是产生的复性产物的浓度很低,复性液体积大不利于后续纯化;CTAB与β-CD结合辅助复性可以以较高浓度的包涵体变性蛋白溶液,较小体积的复性液来获得较高浓度的复性产物和达到相对稳定的复性率,可以用于对乳酸片球菌素包涵体蛋白的大量复性,以便于后续的分离纯化。
[1]Singh A,Upadhyay V,Upadhyay A K,et al. Protein recovery from inclusion bodies of Escherichia coli using mild solubilization process[J]. Microbial cell factories,2015,14(1):1-10.
[2]Khan M A,Sadaf S,Sajjad M,et al. Production enhancement and refolding of caprine growth hormone expressed in Escherichia coli[J]. Protein expression and purification,2009,68(1):85-89.
[3]Singh S M,Panda A K. Solubilization and refolding of bacterial inclusion body proteins[J]. Journal of bioscience and bioengineering,2005,99(4):303-310.
[4]Singh S M,Sharma A,Upadhyay A K,et al. Solubilization of inclusion body proteins using n-propanol and its refolding into bioactive form[J]. Protein expression and purification,2012,81(1):75-82.
[5]Yamaguchi H,Miyazaki M. Refolding techniques for recovering biologically active recombinant proteins from inclusion bodies[J]. Biomolecules,2014,4(1):235-251.
[6]Wang J,Lu D,Lin Y,et al. How CTAB assists the refolding of native and recombinant lysozyme[J]. Biochemical engineering journal,2005,24(3):269-277.
[7]Dong X Y,Wu X Y,Sun Y. Refolding of denatured lysozyme assisted by artificial chaperones in reverse micelles[J]. Biochemical engineering journal,2006,31(1):92-95.
[8]Lu D,Liu Z,Zhang M,et al. Dextran-grafted-PNIPAAm as an artificial chaperone for protein refolding[J]. Biochemical engineering journal,2006,27(3):336-343.
[9]Wang C,Geng X. Refolding and purification of recombinant human granulocyte colony-stimulating factor using hydrophobic interaction chromatography at a large scale[J]. Process Biochemistry,2012,47(12):2262-2266.
[10]Guan Y X,Pan H X,Gao Y G,et al. Refolding and purification of recombinant human interferon-γ expressed as inclusion bodies inEscherichia coli using size exclusion chromatography[J]. Biotechnology and Bioprocess Engineering,2005,10(2):122-127.
[11]Chen Y C,Liu H S. Chaperon solvent plug design in size-exclusion chromatography protein refolding process[J]. Enzyme and microbial technology,2011,49(2):203-208.
[12]周志江,韩烨,韩雪,等. 从酸白菜中分离出一株产细菌素的乳酸片球菌[J]. 食品科学,2006,27(4):89-92.
[13]李亚玲,周志江,韩烨,等. 乳酸片球菌细菌素的分离纯化及理化性质[J]. 食品工业科技,2007,28(8):94-97.
[14]Studier F W. Protein production by auto-induction in high-density shaking cultures[J]. Protein expression and purification,2005,41(1):207-234.
[15]Yang R,Johnson M C,Ray B. Novel method to extract large amounts of bacteriocins from lactic acid bacteria[J]. Applied and Environmental Microbiology,1992,58(10):3355-3359.
[16]Yu Z,Mao H. Non-B DNA Structures Show Diverse Conformations and Complex Transition Kinetics Comparable to RNA or Proteins—A Perspective from Mechanical Unfolding and Refolding Experiments[J]. The Chemical Record,2013,13(1):102-116.
[17]Yamaguchi S,Yamamoto E,Mannen T,et al. Protein refolding using chemical refolding additives[J]. Biotechnology journal,2013,8(1):17-31.
Research of the refolding of a heterologous pediocin expressed inEscherichiacoli
TAN Xi-qian,HAN Ye,XIAO Hua-zhi,ZHOU Zhi-jiang*
(Department of Food Science and Engineering,School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
The inclusion body of the recombinant pediocin fusion protein was produced by the excess expression of gene engineeringE.coliBL21(DE3). The inclusion body was separated,denatured,and then refolded using direct dilution,reversed dilution,dialysis,CTAB assisted,and CTAB andβ-CD assisted refolding. The results showed that CTAB andβ-CD assisted refolding have advantage over other refolding methods. Through this method,a higher concentration of denatured inclusion protein and a smaller volume renatured solution were used. And a higher concentration of refolding product and a relatively stable refolding rate were achieved.
inclusion body;refolding;pediocin
2015-12-14
檀茜倩(1985-),女,博士研究生,研究方向:食品生物技术,E-mail:xiqiantan@tju.edu.cn。
周志江(1960-),男,博士,教授,研究方向:食品生物技术,E-mail:zzj@tju.edu.cn。
天津科技支撑计划重点项目(13ZCDNC01900)。
TS201.3
A
1002-0306(2016)13-0173-05
10.13386/j.issn1002-0306.2016.13.026
