具有抑制大肠杆菌作用的乳酸菌的初步筛选及其益生潜能的研究
2016-09-13杜金城李柏良丁秀云霍贵成
杜金城,徐 敏,李柏良,丁秀云,霍贵成
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
具有抑制大肠杆菌作用的乳酸菌的初步筛选及其益生潜能的研究
杜金城,徐敏,李柏良,丁秀云,霍贵成*
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
为了筛选出具有抑制致病性大肠杆菌作用的乳酸菌,本实验以大肠杆菌ATCC25922作为指示菌,抑菌实验采用牛津杯法。通过发酵上清液对大肠杆菌ATCC25922的抑菌实验,初步筛选出三株乳酸菌发酵上清液对大肠杆菌ATCC25922具有抑制作用,经过对16S rRNA基因进行系统发育分析,发现这三株乳杆菌均为嗜酸乳杆菌。随后又对这三株嗜酸乳杆菌进行了耐酸、耐胆盐及抗生素敏感性实验。结果表明:KLDS1.0901酸耐受性最强,而KLDS1.0902和KLDS1.1003与LactobacillusacidophilusNCFM酸耐受性接近;对照菌株LactobacillusacidophilusNCFM胆盐耐受能力最强,KLDS1.0901和KLDS1.1003与LactobacillusacidophilusNCFM胆盐耐受能力差异不显著,KLDS1.0902胆盐耐受能力最弱;对于抗生素敏感性,三株嗜酸乳杆菌展现出类似的结果,对氨基糖苷类的抗生素展现出耐受;相比于KLDS1.0902,KLDS1.0901和KLDS1.1003有着更好的益生作用潜能,因此随后将对这两株菌在细胞和动物模型中对抗病原菌的作用进行进一步的研究。
嗜酸乳杆菌,16SrRNA,ATCC25922,牛津杯法,益生作用潜能
肠道疾病主要是由病原微生物引起的,在发展中国家,有志贺氏杆菌、霍乱弧菌、病原性大肠杆菌及轮状病毒所造成感染对人的生命造成了严重威胁[1]。世界范围内,每年有四百万的学龄前儿童死于急性感染的痢疾,并且大多数发生在发展中国家[2]。对于大肠杆菌所造成的感染,传统方法是服用抗生素进行治疗,但抗生素的使用也随之带来了一些问题,抗生素在使用过程中会使菌株出现耐药性,并且病原菌的耐药性基因存在着水平基因转移的风险,再加上服用抗生素一段时间之后常会出现抗生素相关的痢疾,既二次腹泻[3]。因此急需替代的解决方法,乳酸菌一些种属是肠道的固有菌群,加上长期安全使用的历史,使得乳酸菌来治疗大肠杆菌引起的腹泻就成为了研究的热点[4],加上乳酸菌可以应用于发酵乳制品中,拥有巨大的商业价值潜能,更是促进这一领域的研究发展。在体外筛选出能抑制致病性大肠杆菌的乳酸菌就显得尤为重要。因此本实验通过体外抑菌实验,来筛选出能够抑制致病性大肠杆菌的乳酸菌,并对筛选出的乳酸菌进行酸耐受性、胆盐耐受性及抗生素敏感性的实验,研究其在人和动物体能发挥对抗病原菌作用的潜能。
1 材料与方法
1.1材料与仪器
KLDS1.0901、KLDS1.0902、KLDS1.1003东北农业大学教育部重点实验室工业微生物菌种保藏中心(KLDS-DICC)。指示菌大肠杆菌ATCC25922和对照菌株LactobacillusacidophilusNCFM来源于东北农业大学食品学院姜毓君教授的友情赠送。
盐酸国产分析纯;牛胆粉Biotopped公司;氯化钠上海惠世生化试剂有限公司;95%乙醇天津市富宇精细化工有限公司;胰蛋白胨和酵母提取物英国Oxoid公司;MRS液体培养基;磷酸二氢钾和磷酸氢二钠天津基准化学试剂有限公司;DNA提取试剂盒天根生物试剂有限公司;抗生素的药敏纸片按YY/T1191-2011抗菌剂药敏纸片标准制备杭州滨和微生物试剂有限公司。
离心机GL-21M上海市离心机研究所;洁净工作台VD-1320北京东联哈尔仪器制造有限公司;电热恒温培养箱DHP-9272上海一恒科技有限公司;DYY-10C电泳仪北京六一仪器厂;远红外恒温干燥箱YH-2S天津市中环实验电炉有限公司;快速混匀器XK96-A姜堰市新康医疗器械有限公司;DU800紫外分光光度计美国Beckman公司。
1.2实验方法
1.2.1上清液的抑菌实验
1.2.1.1无细胞上清液的制备将过夜培养的乳酸菌以2%的接种量接种于液体MRS培养基中,在37 ℃下静置培养到稳定期。离心(8000 r/min,4 ℃,12 min),收集上清液。之后用0.22 μm滤器过滤上清液,以除去菌体及其它杂质。无细胞上清液装入无菌的1.5 mL的离心管中,-4 ℃冰箱中备用。
1.2.1.2抑菌实验采用牛津杯法[5]测定乳酸菌对大肠杆菌ATCC25922生长繁殖的抑制作用,先在平板内加入15 mL含1.5%琼脂的无菌水,在灭菌台中静置60 min,之后在平板上放入牛津杯,接下来调整大肠杆菌的浓度为1×108CFU/mL,将指示菌菌悬液注入用中试管分装好的,温度在50~55 ℃的10 mL灭菌LB培养基中,充分震荡混匀后,将混合物倾倒于已放有牛津杯的平板中,并在无菌台中室温保持60 min待培养基凝固后,无菌条件下将上清液200 μL加入牛津杯中。在4 ℃冰箱中放入2 h后,放入37 ℃培养箱中培养24 h。当培养结束后,记录培养基上小孔周围抑菌圈的直径,作为乳酸菌抑制指示菌生长的指标。当实验孔周围形成2 mm宽清晰可见的抑菌圈时,可认为有抑菌效果。每株菌做3次重复,取平均值。以抑菌圈的大小表示菌株抑制病原菌生长能力的强弱[6]。
1.2.2利用16S rRNA的基因对三株嗜酸乳杆菌进行鉴定
1.2.2.1细菌基因组DNA的提取根据细菌DNA提取试剂盒的说明,进行细菌DNA的提取。
1.2.2.2对16S rRNA的基因进行PCR扩增以三株乳杆菌DNA为模板,利用通用引物27F和1492R对菌株的16S rRNA的基因片段进行扩增,正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3,反向引物1492R:5′-GGTTACCTTGTTACGACTT-3′。扩增体系具体如下:灭菌ddH2O,9.5 μL;2×TaqPCR MasterMix,12.5 μL;基因组DNA,1 μL;上游引物,1 μL;下游引物,1 μL。PCR反应条件如下:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 5 min;4 ℃保温。
1.2.2.3PCR结果检测PCR反应结束后取5 μL反应产物,利用琼脂糖凝胶电泳进行检测。
1.2.2.4对16S rRNA基因进行系统发育分析将测序获得的基因序列与GenBank中已知16S rRNA基因序列进行比对,并利用Mega5.0进行系统发育分析。其中,系统发育树构建采用Neighbor-Joining法,随机抽样1000次[7]。
1.2.3嗜酸乳杆菌的酸耐受性实验三株嗜酸乳杆菌在MRS培养基中生长16 h后,进行离心(8000 r/min,4 ℃,12 min)收集菌体,菌体用pH为7.2的磷酸盐的缓冲溶液重悬两次。处理后的菌体分别放入装有pH为2和3的无菌磷酸盐缓冲溶液的试管中,并调整菌体的浓度在109CFU/mL。之后将试管放在37 ℃的恒温培养箱中,并在0、1、2、3 h分别取样进行菌落计数,根据不同时间段嗜酸乳杆菌的菌体浓度与各自0 h的菌体浓度作比较,来评价嗜酸乳杆菌对酸耐受能力的强弱[8]。同时用LactobacillusacidophilusNCFM作为对照。
1.2.4嗜酸乳杆菌的胆盐耐受性实验通过以嗜酸乳杆菌NCFM作为对照菌株,将三株对大肠杆菌具有抑菌能力的嗜酸乳杆菌及对照菌株以2%接种量,接种在含有0.3%牛胆粉的MRS的营养肉汤中,同时以不加牛胆粉的MRS的营养肉汤作为对照。将其放在37 ℃的恒温培养箱中,每隔一小时测定OD620 nm处的吸光度,连续测定8 h。分别记录乳酸菌在含有0.3%牛胆粉和不含有牛胆粉的MRS的营养肉汤中,OD620 nm的吸光度增加0.3个单元所需的时间。胆盐耐受能力用含有0.3%牛胆粉MRS的营养肉汤中,OD620 nm处的吸光度达到0.3个单元所需的时间,减去不加牛胆粉的MRS的营养肉汤中OD620 nm处的吸光度达到0.3个单元所需的时间来表示,又称滞后时间[9]。
1.2.5嗜酸乳杆菌的抗生素敏感性实验抗生素敏感性实验采用琼脂片扩散法,对三株嗜酸乳杆菌分别进行青霉素G(10 μg/片)、阿莫西林(10 μg/片)、庆大霉素(10 μg/片)、链霉素(10 μg/片)、卡那霉素(30 μg/片)、红霉素(15 μg/片)、四环素(30 μg/片)、利福平(5 μg/片)、万古霉素(30 μg/片)、氯霉素(30 μg/片)的敏感性实验。先将含有1.5%琼脂的MRS固体培养基灭菌,待其温度降至50~55 ℃时,再将培养16 h以后达到稳定期的嗜酸乳杆菌加入MRS固体培养基中,保证嗜酸乳杆菌在MRS固体培养基中的浓度为107CFU/mL,之后向平板倒入20 mL的混合液。放置1 h待其凝固之后,用无菌镊子将按YY/T1191-2011抗菌剂药敏纸片标准制备的药敏纸片贴在MRS固体培养基上,随后放入37 ℃的恒温培养箱中,36 h之后用游标卡尺测定抑菌圈的直径,参照CLSI标准[10]确定菌株对抗生素是敏感、中介或者耐受。
2 结果与讨论
2.1上清液抑菌实验
利用双层琼脂平板打孔法,对乳酸菌的发酵上清液进行抑菌实验,其中KLDS1.0901、KLDS1.0902和KLDS1.1003的发酵上清液对大肠杆菌ATCC25922展现出抑制,抑菌圈的直径分别为22.1±0.5 mm、20.3±0.4 mm和21.6±0.6 mm。抑菌实验结果如图1~图3。普遍公认的起抑菌作用的物质有有机酸(主要是乳酸和乙酸)、过氧化氢、细菌素和类细菌素物质[11],在接下来的实验会对起抑菌作用的物质进行进一步的验证。

图1 KLDS1.0901发酵上清液对ATCC25922的抑菌实验结果Fig.1 The inhibition of the culture supernatant from KLDS1.0901 against ATCC25922
图2 KLDS1.0902发酵上清液对ATCC25922的抑菌实验结果Fig.2 The inhibition of the culture supernatant from KLDS1.0902 against ATCC25922

图3 KLDS1.1003发酵上清液对ATCC25922的抑菌实验结果Fig.3 The inhibition of the culture supernatant from KLDS1.1003 against ATCC25922
2.2菌株鉴定的结果
2.2.116S rRNA基因片段的PCR扩增产物由图4可知,KLDS1.0901、KLDS1.0902和KLDS1.1003的16S rRNA基因片段的PCR产物的条带清晰,说明该扩增具有特异性,PCR产物片段的大小分别约为1500 bp,与预期要求的序列大小相符,可以进行纯化和测序。
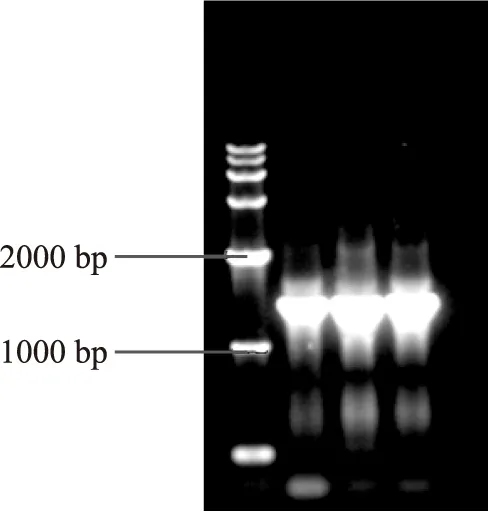
图4 菌株KLDS1.0901、KLDS1.0902和KLDS1.1003的16S rRNA基因PCR扩增产物电泳图Fig.4 Electrophoresis of PCR products of 16S rRNA gene of the strains KLDS1.0901,KLDs1.0902 and KLDS4.1102注:Lane M,Maker DL5000;Lane 1,KLDS1.0901的16S rRNA gene;Lane 2,KLDS1.0902的16S rRNA gene;Lane 3,KLDS1.1003的16S rRNA gene。
2.2.2三株嗜酸乳杆菌16S rRNA基因序列同源性分析16S rRNA基因系统发育树如图,根据16S rRNA基因序列分析,三株乳杆菌KLDS1.0901、KLDS1.0902和KLDS1.10003均与LactobacillusacidophilusNCFM聚群,并且可信度值为100,由此可以鉴定三株菌均为嗜酸乳杆菌。

图5 基于16S rRNA基因序列建立的系统发育树Fig.5 Phylogenetic tree based on 16S rRNA gene sequences
2.3三株嗜酸乳杆菌的酸耐受性结果
由图6所示,当受试菌在pH2的PBS缓冲液中孵育1 h后,四株菌的活菌数都在104以上,表现出较强的酸耐受性。KLDS1.0902和KLDS1.1003展现出与LactobacillusacidophilusNCFM相似的酸耐受性,但KLDS1.0901酸耐受性更强,在pH为2的磷酸盐缓冲溶液中2 h和3 h分别展现出103和102以上的活菌数。

图6 嗜酸乳杆菌对pH2的酸耐受性Fig.6 The tolerance of Lactobacillus acidophilus to pH2
由图7所示,在pH3时,所有菌株均表现出了良好的酸耐受能力。在pH3的PBS缓冲液中孵育3 h后,所有菌株的存活量仍均超过109CFU/mL,在pH为3的PBS缓冲溶液中展现出相似的酸耐受性结果。

表1 四株嗜酸乳杆菌对胆盐耐受能力的结果
注:每组观测值都为平均值±标准差,同列数据之间标字母不同表示差异显著(p<0.05)。

图7 嗜酸乳杆菌对pH3的酸耐受性Fig.7 The tolerance of Lactobacillus acidophilus to pH3
2.4三株嗜酸乳杆菌的胆盐耐受性
表1展示了四株嗜酸乳杆菌的胆盐耐受性结果,所有菌株都能在含有0.3%胆盐的MRS培养基上生长,展现出良好的胆盐耐受能力。在滞后时间上KLDS1.0901、KLDS1.1003和LactobacillusacidophilusNCFM差异不显著,表明三株菌有相似的胆盐耐受能力.但KLDS1.0902的滞后时间与其它三株菌差异显著(p<0.05),明显落后于其它三株菌,表明KLDS1.0902有较弱的胆盐耐受能力。
2.5三株嗜酸乳杆菌的抗生素敏感性实验结果
菌株对抗生素的敏感性被认为是能安全使用的先决条件[12],因此本实验对三株嗜酸乳杆菌进行抗生素敏感性实验。抗生素的敏感性实验结果参照CLSI的标准[10],分别选取了β-内酰胺类、氨基糖苷类、大环内酯类、四环素类和其它等5类10种抗生素,进行抗生素敏感性实验,结果如表2。KLDS1.0901、KLDS1.0902和KLDS1.1003都表现出对氨基糖苷类中庆大霉素和卡那霉素耐受。而对于氨基糖苷类中的链霉素,KLDS1.0901和KLDS1.1003表现出耐受,KLDS1.0902表现出敏感。对于其它的七种抗生素,三株嗜酸乳杆菌均表现出敏感。三株嗜酸乳杆菌表现出对氨基糖苷类抗生素耐受这可能和菌体存在天然抗药性基因有关,Soliman A. H.等人[13]对嗜酸乳杆菌抗生素敏感性测试,结果也展现出对庆大霉素、链霉素和卡那霉素的耐受。
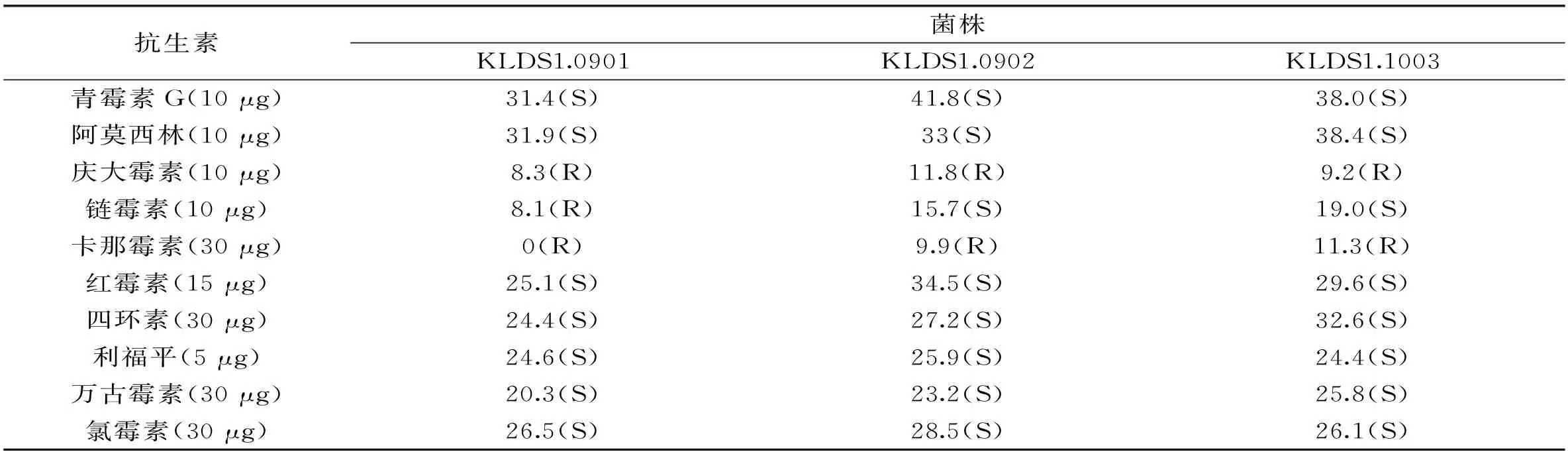
表2 三株嗜酸乳杆菌对10种抗生素的敏感性实验结果
注:其中S表示敏感,I表示中介(表格中没有此结果),R表示耐受,数字代表抑菌圈的直径,单位是mm。
3 结论
本文主要对能抑制致病性大肠杆菌的乳酸菌进行初步筛选,并对益生潜能进行研究。通过以上实验可得到以下结论。筛选出三株嗜酸乳杆菌KLDS1.0901、KLDS1.0902和KLDS1.1003的上清液均能抑制大肠杆菌ATCC25922,抑菌能力KLDS1.0901>KLDS1.1003>KLDS1.0902;通过16S rRNA基因进行系统发育分析,得出三株菌均为嗜酸乳杆菌;对于酸耐受性结果可以得出KLDS1.0901酸耐受性最强,强于KLDS1.0902、KLDS1.1003和LactobacillusacidophilusNCFM;对于胆盐耐受性结果可以得出对照菌株LactobacillusacidophilusNCFM对胆盐的耐受性最强,KLDS1.0902胆盐耐受能力最弱。但KLDS1.0901和KLDS1.1003与LactobacillusacidophilusNCFM胆盐耐受能力差异不显著(p>0.05),表现出相似的胆盐耐受能力;对于抗生素敏感性的结果表明:KLDS1.0901、KLDS1.0902和KLDS1.1003对大部分抗生素均表现出敏感,而对一些氨基糖苷类抗生素表现耐,这是嗜酸乳杆菌普遍存在的现象。以上实验表明KLDS1.0901和KLDS1.1003有着更强的抑菌作用及益生作用潜能,接下来会在细胞和动物模型中,KLDS1.0901和KLDS1.1003对抗病原菌作用进行进一步的研究。
[1]Nomoto K. Prevention of infections by probiotics[J]. Journal of Bioscience and Bioengineering,2005,100(6):583-592.
[2]Szymański H,Chmielarczyk A,Strus M,et al. Colonisation of the gastrointestinal tract by probiotic L. rhamnosus strains in acute diarrhoea in children[J]. Digestive and Liver Disease,2006,38:S274-S276.
[3]Wright K,Wright H,Murray M. Probiotic treatment for the prevention of antibiotic-associated diarrhoea in geriatric patients:A multicentre randomised controlled pilot study[J]. Australasian Journal on Ageing,2015,34(1):38-42.
[4]De Vuyst L,Leroy F. Bacteriocins from lactic acid bacteria:production,purification,and food applications[J]. Journal of Molecular Microbiology and Biotechnology,2007,13(4):194-199.
[5]Schillinger U,Lücke F K.Antibacterial activity of Lactobacillus sake isolated from meat[J].Applied and Environmental Microbiology,1989,55(8):1901-1906.
[6]Anastasiadou S,PaPagianni M,Filiousis G,et al.Growth and metabolism of a meat isolated strain of pediococcus pentosaceus in submerged fermentation:Purification,characterization and properties of the produced pediocin SM-1[J].Enzyme and Microbial Technology,2008,43(6):448-454.
[7]孙懿琳. 弱后酸化保加利亚乳杆菌菌株的筛选及其后酸化机理[D].哈尔滨:东北农业大学,2013.
[8]Buntin N,Chanthachum S,Hongpattarakere T. Screening of lactic acid bacteria from gastrointestinal tracts of marine fish for their potential use as probiotics[J]. Sonklanakarin Journal of Science and Technology,2008,30(1):141.
[9]Guo L,Li T,Tang Y,et al. Probiotic properties of Enterococcus strains isolated from traditional naturally fermented cream in China[J]. Microbial biotechnology,2015.
[10]Wikler M A. Performance standards for antimicrobial susceptibility testing:Sixteenth informational supplement[M]. Clinical and Laboratory Standards Institute,2006.
[11]Varalakshmi S,Balasubramanyam B V,Surendranath B,et al. Use of novel lactic acid bacterial strains with antagonistic activity for the preparation of safe indigenous fermented dairy foods(Dahi and Raita)[J]. Journal of Food Safety,2014,34(1):26-33.
[12]Dixit G,Samarth D,Tale V,et al. Comparative studies on potential probiotic characteristics of Lactobacillus acidophilus strains[J]. EurAsian Journal of BioSciences,2013,7:1-9.
[13]Soliman A H S,Sharoba A M,Bahlol HEM. Evaluation of Lactobacillus acidophilus,Lactobacillus casei and Lactobacillus plantarum for probiotic characteristics[J]. Middle East Journal of Applied Science,2015.
Preliminary screening of lactic acid bacteria againstEscherichiacoliand the research of probiotic potential for the screening bacteria
DU Jin-cheng,XU Min,LI Bai-liang,DING Xiu-yun,HUO Gui-cheng*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
In order to select lactic acid bacteria which have the ability to inhibit the growth ofEscherichiacoli,ATCC25922 was used as the indicator bacterium,the culture supernatant from lactic acid bacteria were used to determine if there were antimicrobial activities to the pathogenicEscherichiacoli,using Oxford-cup tests. Three lactic acid bacteria were screened and all of these were determined asLactobacillusacidophilusby phylogenetic analyses of 16S rRNA gene. Subsequently,the tolerance to gastric acidity and bile salts and antibiotic sensitivity of theLactobacillusacidophiluswere further evaluated. The results showed that KLDS1.0901 had the best tolerance to gastric acidity,KLDS1.0902 and KLDS1.1003 had the closer tolerance ability to gastric acidity,comparedLactobacillusacidophilusNCFM. For the tolerance to bile salts,LactobacillusacidophilusNCFM had the best bile tolerance ability and KLDS1.0902 had the weakest ability,there were no considerable differences among KLDS1.0901,KLDS1.1003 andLactobacillusacidophilusNCFM for bile tolerance ability. All of strains showed similar results in the sensitivity to antibiotics,showing tolerance to aminoglycoside antibiotics. Therefore KLDS1.0901 and KLDS1.1003 had the better probiotic potential,compared KLDS1.0902. The antimicrobial effects of KLDS1.0901 and KLDS1.1003 against the pathogenicEscherichiaColishould be further studied in cellular and animal models.
Lactobacillusacidophilus;16S rRNA;ATCC25922;Oxford-cup tests;probiotic potential
2016-01-27
霍贵成(1958-),男,博士,教授,研究方向:食品微生物与生物技术,E-mail:gchuo58@126.com。
杜金城(1991-),男,硕士研究生,研究方向:食品科学,E-mail:dujincheng@126.com。
国家863计划(2012AA022108)。
TS201.3
A
1002-0306(2016)13-0152-05
10.13386/j.issn1002-0306.2016.13.022
