盐胁迫对黄花补血草幼苗叶片抗坏血酸-谷胱甘肽循环的影响
2016-09-13杨颖丽吕丽荣李翠祥滕玉瑾
杨颖丽,马 婷,吕丽荣,李翠祥,滕玉瑾
(西北师范大学生命科学学院,甘肃兰州 730070)
盐胁迫对黄花补血草幼苗叶片抗坏血酸-谷胱甘肽循环的影响
杨颖丽,马婷,吕丽荣,李翠祥,滕玉瑾
(西北师范大学生命科学学院,甘肃兰州730070)
以盐生植物黄花补血草幼苗为供试材料,研究了不同浓度NaCl(0,25,50,100,150mmol·L-1)胁迫下叶片抗坏血酸-谷胱甘肽(AsA-GSH)循环中抗氧化物质含量和抗氧化酶活性的变化.结果显示:150mmol·L-1NaCl处理诱导幼苗叶片AsA和总抗坏血酸含量增加;所有盐浓度诱导脱氢抗坏血酸(DHA)含量、GSH/氧化型谷胱甘肽(GSSG)比值升高,谷胱甘肽还原酶(GR)、抗坏血酸酶(AAO)和脱氢抗坏血酸还原酶(DHAR)活性增强,而AsA/DHA比值、GSSG含量和单脱氢抗坏血酸还原酶(MDHAR)活性降低.此外,低浓度盐胁迫下幼苗叶片GSH含量升高,而高浓度盐处理诱导叶片GSH含量降低.表明盐胁迫下黄花补血草幼苗叶片提高了非酶抗氧化物质含量和抗氧化酶活性,增强了幼苗清除活性氧的能力,增强了对盐胁迫的耐受能力.
盐胁迫;黄花补血草;抗坏血酸-谷胱甘肽循环;活性氧
黄花补血草(Limonium aureum(L)Hill)又称黄花矶松、金色补血草、金匙叶草,是蓝雪科补血草属多年生泌盐植物,具有耐干旱、耐盐碱、耐土壤瘠薄的优良特性,多分布于我国呼伦贝尔沙地、腾格里沙漠地区、甘肃河西走廊沙地和兰州等地[1-2].该物种具有良好的经济价值,在保护生态环境方面也有很好的生态价值[3].目前,关于黄花补血草的组织培养[4]、化学成分[5]、器官结构解剖学[6]等方面有较多的研究报道.我们在研究中发现,黄花补血草在盐胁迫下通过积累渗透调节物和提高抗氧化酶活性,使其具有较强的渗透调节能力和抗氧化能力,从而增强对盐环境的适应性[7].但有关盐胁迫对黄花补血草抗坏血酸-谷胱甘肽(AsA-DSH)循环影响的研究报道较少.
土壤盐渍化问题广泛存在于我国的西北地区,可导致生态环境恶化,并使农作物的生长速率降低,农作物产量减少.盐胁迫是影响植物生长发育的主要环境因子,也是阻碍农业产量的主要因素之一[8].植物受到盐胁迫时会产生大量的活性氧自由基,引起膜脂过氧化伤害.活性氧如不能被及时清除就会造成氧化胁迫,影响植物正常的生理功能[9].植物体可通过维持AsA-GSH循环的快速有效运转,减轻逆境胁迫下植物的活性氧伤害[10].AsA和GSH为AsA-GSH循环系统中的抗氧化剂型非酶组成成分,而谷胱甘肽还原酶(GR)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)为该系统中重要的酶促组成成分,在增强植物的抗氧化防御系统方面发挥着重要的作用.除此之外,氧化型谷胱甘肽(GSSG)在GR的催化作用下生成GSH,而抗坏血酸酶(AAO)则是依赖于AsA的活性氧清除剂[11].本研究以黄花补血草幼苗为供试材料,探究盐胁迫对黄花补血草幼苗叶片内AsA-GSH循环中抗氧化酶的活性和抗氧化物质含量的影响,旨在进一步了解盐胁迫下植物体内AsA-GSH循环的变化机制,为研究植物耐盐性的生理机制奠定基础.
1 材料与方法
1.1植物材料的培养及处理
将籽粒饱满的黄花补血草(Limonium aureum(Linn)Hill)种子(由甘肃省民勤县沙生植物园提供)浸泡在10%的次氯酸钠溶液中10min,并分别用无菌水冲洗3次,75%的乙醇浸泡约30s,无菌水连续冲洗5~7次后,将种子移到1/4Hoagland固体培养基中,在其萌发4d后,挑选生长程度接近的幼苗依次转入含有0,25,50,100和150mmol·L-1NaCl的1/4Hoagland固体培养基上(每个处理设3个重复),置于恒温光照培养箱中,光暗周期12h/12h,光照强度1 500~2 000lx,昼夜温度(25±2)℃,处理21d后取叶片进行各生理指标的检测.
1.2AsA,DHA和总抗坏血酸(AsA+DHA)含量的测定
参照Kampfenkel等[12]的方法测定AsA和AsA+DHA含量.1g幼苗叶片加入4mL6%的三氯乙酸(TCA)冰浴研磨,13 000r·min-1离心10min后,提取上清液备用.AsA含量检测时,取0.2mL上清液依次加入0.6mL0.2mol·L-1磷酸缓冲液(PBS,pH7.4)、0.2mLH2O、1.0mL10%TCA、0.8mL42%磷酸和0.8mL4%2,2′-联吡啶,最后加入3%三氯化铁(FeCl3),42 ℃水浴40min后于525nm处测定OD.AsA+DHA含量测定时,在0.2mL上清液中依次加入0.2mmol·L-1二硫苏糖醇(DTT)和0.4mL0.2mol·L-1PBS(pH7.4),于42 ℃水浴15min,加入0.2mL0.5%N-乙基马来酰亚胺(NEM),室温放置1min,而后重复AsA含量的检测方法,以nmol·g-1鲜重(FW)为单位.DHA的含量为AsA+DHA和AsA的差值,并计算AsA/DHA比值.
1.3GSH和GSSG含量的测定
依据Hissin和Hilf[13]的方法,用荧光光度计检测GSH和GSSG含量,1g叶片加入3.75mL0.1mol·L-1PBS(pH8.0,含有5mmol·L-1乙二胺四乙酸二钠(EDTA))和1mL25%磷酸,冰浴研磨,并以15 000r·min-1离心30min.GSH测定时,0.5mL上清中加入4.5mL0.1mol·L-1PBS(pH8.0,含有5mmol·L-1EDTA),取稀释的上清100μL,加入1.8mL0.1mol·L-1PBS(pH8.0,含有5mmol·L-1EDTA)和100μL0.1%的邻苯二甲醛,混匀后室温放置15min,于420nm发射光和350nm激发光下测定荧光值.GSSG测定时,在0.5mL上清中加入200μL0.04mol·L-1NEM,室温放置30min后,加入4.3mL0.1mol·L-1NaOH,混匀后于420nm发射光和350nm激发光下测定荧光值.GSH和GSSG含量均以ng·mg-1FW为单位.
1.4GR,AAO,MDHAR和DHAR活性的测定
参照Foster[14]的方法检测GR的活性.0.5g叶片,加入2mL50mmol·L-1Tris-HCl(pH7.5,含0.1mmol·L-1EDTA和0.1%聚乙烯吡咯烷酮(PVP)),12 000r·min-1离心30min,取上清液150μL加入3mL50mmol·L-1Tris-HCl(pH7.5,含3mmol·L-1MgCl2,0.5mmol·L-1GSSG和0.15mmol·L-1NADPH)中,混匀后立即于340nm处以30s为间隔做3min时间扫描.以1min内OD340值变化的0.1为一个酶活单位(U).
参照Shen等[15]的方法检测AAO的活性.1g叶片材料加入4mL50mmol·L-1PBS(pH7.2,含2mmol·L-1EDTA,2mmol·L-1DTT,20%甘油和2%PVP),10 000r·min-1离心30min,上清液用于检测蛋白含量.AAO测定时,取0.1mL上清加入2.5mL50mmol·L-1PBS(pH5.6,含1mmol·L-1AsA和5mmol·L-1EDTA),混匀后在265nm处以20s为间隔做2min时间扫描.以1min内OD265值变化的0.1为一个酶活单位(U).参照Ma和Cheng[16]的方法检测MDHAR和DHAR的活性.MDHAR测定时,0.1mL上清中加入2.9mL50mmol·L-1Hepes-NaOH(pH7.6,含0.1mmol·L-1NADH,0.25mmol·L-1AsA和0.3U抗坏血酸氧化酶),混匀后于340nm处以20s为间隔做2min时间扫描.以1min内OD340值变化的0.01为一个酶活单位(U).DHAR测定时,取0.1mL上清加入2.9mL100mmol·L-1Hepes-NaOH(pH7.0,含2.5mmol·L-1GSH和0.6mmol·L-1DHA),混匀后于265nm处以20s为间隔做2min时间扫描.以1min内OD265值变化的0.01为一个酶活单位(U).
以上酶活性单位均用U·mg-1protein表示.
1.5蛋白含量的测定
参照Bradford[17]的方法检测蛋白含量,在波长595nm处测定吸光值,并以牛血清白蛋白为标准计算蛋白含量.
1.6数据分析
利用SPSS17.0进行实验数据的统计分析,并用Excel和CorelDraw9.0进行制图与图表处理.每个处理均设置3个重复,数据用平均值±标准误表示,用Duncan多重比较的方法进行差异显著性检验分析,检验显著性水平为0.05.
2 结果与分析
2.1盐胁迫对黄花补血草幼苗叶片AsA,DHA,AsA+DHA含量和AsA/DHA比值的影响
如表1所示,在25,50和100mmol·L-1NaCl胁迫下,黄花补血草幼苗叶片中AsA含量没有显著变化,而在最高浓度150mmol·L-1NaCl处理下,叶片中AsA的含量显著增加,相比于对照组升高了19.51%.
幼苗叶片中DHA的含量与对照组相比均有不同程度的升高,并分别升高了8.96%,11.94%,2.99%和20.90%(表1),可见在150mmol·L-1NaCl胁迫下这一趋势较为显著.
幼苗叶片中AsA+DHA含量在25和50mmol·L-1NaCl胁迫下没有明显的变化,而在100mmol·L-1NaCl胁迫下减小,150mmol·L-1NaCl胁迫下增大,与对照组相比分别变化了6.71%和20.13%(表1).
由表1可知,25,50和100mmol·L-1NaCl胁迫诱导幼苗叶片的AsA/DHA比值显著降低,而150mmol·L-1NaCl胁迫不影响AsA/DHA比值.
2.2盐胁迫对黄花补血草幼苗叶片GSH,GSSG含量和GSH/GSSG比值的影响
由图1A可知,盐胁迫诱导黄花补血草幼苗叶片中的GSH含量呈先升高后降低的变化趋势.与对照组相比较,25和50mmol·L-1NaCl处理诱导幼苗叶片中GSH含量分别升高约4.9%和16.99%,而在100和150mmol·L-1NaCl处理下,幼苗叶片中GSH含量分别降低约15.59%和16.46%.不同的是,幼苗叶片中的GSSG含量在盐处理下呈现逐渐减小的变化趋势(图1B),在25,50,100和150mmol·L-1NaCl处理下,较对照组分别降低约13.42%,20.13%,28.19%和28.86%.此外,所有盐浓度均导致幼苗叶片的GSH/GSSG比值升高,且在50mmol·L-1NaCl处理时达到最大值(图1C).

表1 不同浓度NaCl对黄花补血草幼苗叶片AsA,DHA,AsA+DHA含量和AsA/DHA比值的影响
注:不同字母表示差异显著P<0.05.
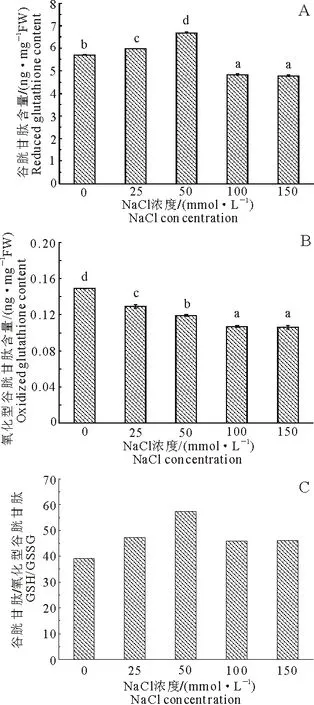
图1 不同浓度NaCl对黄花补血草幼苗叶片GSH、GSSG和GSH/GSSG比值的影响Fig 1 Effects of different NaCl concentrations on GSH,GSSG and GSH/GSSG in L aureum seedling leaves
2.3盐胁迫对黄花补血草幼苗叶片GR,AAO,MDHAR和DHAR活性的影响
由表2可知,所有盐浓度诱导黄花补血草幼苗叶片GR活性显著增强,此效应具有浓度依赖性.与未处理幼苗相比,25,50,100和150mmol·L-1NaCl胁迫诱导幼苗叶片中的GR活性分别增强约1.76倍、1.76倍、2.24倍和4.59倍.
黄花补血草幼苗叶片的AAO活性在25,50和100mmol·L-1NaCl胁迫下显著增强,且分别升高为对照组的1.67倍、1.84倍和1.42倍,但在最高浓度(150mmol·L-1)NaCl处理时与对照比没有明显变化(表2).
幼苗叶片的MDHAR活性在盐处理下较对照均有所降低,但50mmol·L-1NaCl处理时的变化与对照比无明显差异,而25,100和150mmol·L-1NaCl处理下分别降低约45.4%,49.58%和70.08%.
所有盐胁迫均诱导幼苗叶片DHAR的活性显著增强,且在25,50,100和150mmol·L-1NaCl胁迫下,分别增强为对照组的1.63倍、3.81倍、3.75倍和2.43倍.
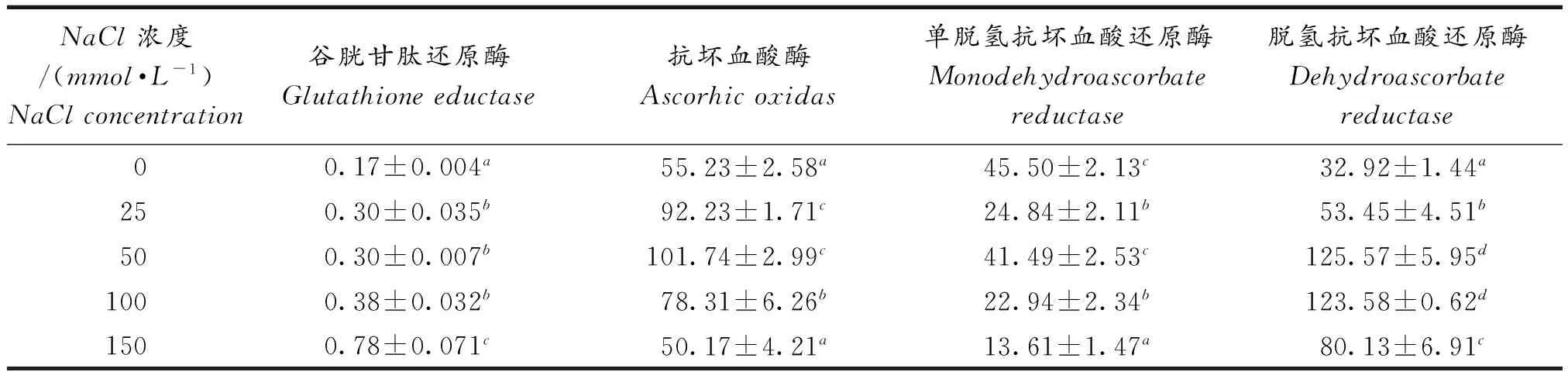
表2 不同浓度NaCl对黄花补血草幼苗叶片GR,AAO,MDHAR和DHAR活性的影响
注:不同字母表示差异显著P<0.05.
3 讨论
盐胁迫对植物的破坏作用主要是通过渗透胁迫、离子毒害、营养失衡,并导致盐胁迫的次级反应如氧化胁迫等的产生[18].AsA-GSH在植物抵抗氧化胁迫、清除活性氧自由基方面具有重要作用[10],其中AsA含量、氧化还原状态(AsA/DHA比值)及其相关代谢合成酶的活性变化与植物对生态环境胁迫的响应息息相关[19].盐处理(NaCl)罗勒叶片30d后,对AsA+DHA含量没有影响,且叶片内AsA含量和AsA/DHA比值保持不变[20].而NaCl胁迫下番茄幼苗叶片AsA含量显著提高,AsA/DHA比值降低[21].本研究中NaCl胁迫下黄花补血草幼苗叶片AsA,DHA和AsA+DHA的含量在25,50和100mmol·L-1NaCl胁迫下并没有发生明显变化,而在最高浓度(150mmol·L-1)处理时均明显升高,但AsA/DHA比值在25,50和100mmol·L-1NaCl处理时均显著低于对照组(表1).表明高浓度盐胁迫下黄花补血草幼苗通过增加叶片中AsA和DHA的积累,调节叶片内的氧化还原状态来响应盐胁迫,使幼苗的抗逆境胁迫能力增强.
GSH与AsA都是植物调节细胞功能的必需代谢物,在植物抗氧化防御中发挥着关键作用[22].有研究者指出,AsA/DHA和GSH/GSSG的比值变化可能与植物的耐盐性有关,有助于植物有效防止氧化损伤,在植物细胞抵抗氧化应激方面比AsA和GSH的含量更具有重要意义[23].盐胁迫导致葡萄叶片中GSH含量、GSH/GSSG比值明显降低,而GSSG含量明显升高[24].而水稻幼苗叶片中GSH含量在150 和250mmol·L-1NaCl胁迫下显著增加,GSH/GSSG比值在两种盐浓度处理下显著下降[25].本研究中黄花补血草幼苗叶片GSH含量在低浓度(25和50mmol·L-1)NaCl胁迫下升高,而高浓度(100和150mmol·L-1)NaCl胁迫下降低,此外,所有盐浓度均诱导幼苗叶片GSH/GSSG比值的升高,此效应在(25和50mmol·L-1)NaCl处理时更加显著,但幼苗叶片中GSSG含量在盐胁迫下呈下降趋势.这些结果表明,在盐胁迫下黄花补血草幼苗叶片通过提高GSH的含量和GSH/GSSG的比值,并降低GSSG的含量,来维持细胞相对稳定的氧化还原平衡,增强幼苗清除活性氧的能力,从而提高了植株抗盐胁迫的能力,缓解了盐胁迫对幼苗造成的伤害,而高盐浓度下GSH含量降低可能是由于GSH的合成代谢过程受到了破坏.
盐胁迫下植株体内会产生大量自由基引起植株代谢失衡,AsA和GSH在盐胁迫下的再生,使得AsA-GSH循环快速高效运转,进而维持了植物较强的氧化还原力和高水平的抗氧化物质,使过量产生的活性氧可以及时被清除[26].GR,AAO,MDHAR和DHAR是AsA-GSH系统中重要的酶促组成成分,控制着植物细胞中抗坏血酸的含量.文献报道,盐处理增强了菜豆叶片GR的活性,降低了其叶片MDHAR和DHAR的活性.不同的是,水稻幼苗叶片的GR,MDHAR和DHAR活性在盐胁迫下均逐渐增强[23,25].除此之外,非生物胁迫诱导黄瓜幼苗叶片中AAO活性增强,随着胁迫时间的延长,酶活性又慢慢降低[11].本实验盐胁迫诱导黄花补血草幼苗叶片GR和DHAR的活性增强,MDHAR活性降低,而幼苗叶片AAO的活性在25,50和100mmol·L-1NaCl条件下显著增强,但150mmol·L-1NaCl处理不影响AAO的活性.这些结果表明,GR活性的增强有效实现了黄花补血草幼苗体内AsA的再生,在清除活性氧的过程中起到重要的作用.此外,在AsA-GSH循环中,AsA也可通过MDHAR和DHAR利用NADPH和GSH作为电子供体由DHA再生[25].因此,黄花补血草幼苗叶片中较高的DHAR活性保证了幼苗叶片中AsA含量的增加,促进了AsA的再生,实现抗坏血酸的循环再利用,而幼苗叶片AAO活性的增强赋予了幼苗在盐胁迫下较强的活性氧清除能力.由此可见,保持较高的抗氧化酶活性可清除过量活性氧,且能较好地维持AsA-GSH循环系统的完整性,这也可能是黄花补血草幼苗耐NaCl胁迫的主要原因之一.
综上可知,盐胁迫下黄花补血草幼苗叶片可能通过提高非酶抗氧化物质AsA,GSH含量和GSH/GSSG比值,并增强GR,DHAR和AAO等抗氧化酶活性,进而增强幼苗的抗氧化能力,缓解了NaCl对幼苗造成的氧化损伤.
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1998.
[2]王玲,刘宇,华兰英,等.黄花补血草的研究进展及利用潜力分析[J].中兽医学杂志,2009(增刊):492.
[3]YEG,HANGCG.FlavonoidsofLimoniumaureum[J].Chemistry of Natural Compounds,2006,42(2):232.
[4]王方琳,崔建国,尉秋实,等.黄花矶松组织培养及培养基筛选研究[J].中国农学通报,2014,30(13):45.
[5]龙玲,王军平,陈世恩,等.黄花补血草多糖的抗肿瘤作用研究[J].西北农林科技大学学报(自然科学版),2012,40(11):18.
[6]倪细炉,麻力,岳延峰,等.黄花补血草营养器官结构解剖学研究[J].中国农学通报,2012,28(22):71.
[7]尤佳,张菁,王文瑞,等.NaCl处理下黄花补血草幼苗生理特性的变化[J].植物研究,2013,33(1):45.
[8]杨颖丽,张菁,杨帆,等.盐胁迫对两种小麦渗透性调节物及脯氨酸代谢的影响[J].西北师范大学学报(自然科学版),2013,49(1):72.
[9]张腾国,寇明刚,王圆圆,等.盐胁迫对两种油菜叶片生理指标的影响[J].西北师范大学学报(自然科学版),2014,50(5):85.
[10]MILLERG,SUZUKIN,CIFTCI-YILMAZS,etal.Reactiveoxygenspecieshomeostasisandsignallingduringdroughtandsalinitystresses[J].Plant Cell and Environment,2010,33(4):453.
[11]孙艳,徐伟君.高温胁迫对不同黄瓜品种幼苗中抗坏血酸代谢的影响[J].西北农业学报,2007,16(6):164.
[12]KAMPFENKELK,VANMONTAGUM,INZED.Extractionanddeterminationofascorbateanddehydroascorbatefromplanttissue[J].Analytical Biochemistry,1995,225(1):165.
[13]HISSINPJ,HILFR.Afluorometricmethodfordeterminationofoxidizedandreducedglutathioneintissues[J].Analytical Biochemistry,1976,74(1):214.
[14]FOSTERJG,HESSJL.Responsesofsuperoxidedismutaseandglutathionereductaseactivitiesincottonleaftissueexposedtoanatmosphereenrichedinoxygen[J].Plant Physiology,1980,66(33):482.
[15]SHENCH,KRISHNAMURTHYR,YEHKW.DecreasedLascorbatecontentmediatingboltingismainlyregulatedbythegalacturonatepathwayinOncidium[J].Plant Cell Physiology,2009,50(5):935.
[16]MAFW,CHENGLL.Thesun-exposedpeelofapplefruithashigherxanthophyllcycle-dependentthermaldissipationandantioxidantsoftheascorbate-glutathionepathwaythantheshadepeel[J].Plant Science,2003,165(4):819.
[17]BRADFORDMM.Arapidandsensitivemethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebinding[J].Analytical Biochemistry,1976,72(1):248.
[18]ZHUJK.Saltanddroughtstresssignaltransductioninplants[J].Annual Review of Plant Biology,2002,53:247.
[19]陈坤明,宫海军,王锁民.植物抗坏血酸的生物合成、转运及其生物学功能[J].西北植物学报,2004,24(2):329.
[20]TARCHOUNEI,SGHERRIC,IZZOR,etal.ChangesintheantioxidativesystemsofOcimum basilicumL(cv.Fine)underdifferentsodiumsalts[J].Acta Physiologiae Plantarum,2012,34(5):1873.
[21]何晓玲,王松,王沛,等.外源硒对NaCl胁迫下番茄幼苗叶片氧化损伤的保护效应[J].石河子大学学报(自然科学版),2015,33(3):281.
[22]TALAATNB,SHAWKYBT.24-Epibrassinolidealleviatessalt-inducedinhibitionofproductivitybyincreasingnutrientsandcompatiblesolutesaccumulationandenhancingantioxidantsysteminwheat(Triticum aestivumL)[J].Acta Physiologiae Plantarum,2013,35(3):729.
[23]TALAATNB.Effectivemicroorganismsenhancethescavengingcapacityoftheascorbateeglutathionecycleincommonbean(Phaseolus vulgarisL)plantsgrowninsaltysoils[J].Plant Physiology and Biochemistry,2014,80:136.
[24]赵宝龙,刘鹏,王文静,等.5-氨基乙酰丙酸(ALA)对盐胁迫下葡萄叶片中AsA-GSH循环的影响[J].植物生理学报,2015,51(3):385.
[25]MOSTOFAMG,HOSSAINMA,FUJITAM.Trehalosepretreatmentinducessalttoleranceinrice(Oryza sativaL)seedlings:oxidativedamageandco-inductionofantioxidantdefenseandglyoxalasesystems[J].Protoplasma,2015,252(2):461.
[26]宰学明,郝振萍,张焕仕,等.NaCl胁迫下AM真菌对滨梅叶片中抗坏血酸-谷胱甘肽循环的影响[J].植物生理学报,2013,49(1):41.
(责任编辑俞诗源)
Effects of salinity stress on ascorbate-glutathione cycleintheleavesofLimonium aureum(L)Hillseedlings
YANGYing-li,MATing,LÜLi-rong,LICui-xiang,TENGYu-jin
(CollegeofLifeScience,NorthwestNormalUniversity.Lanzhou730070,Gansu,China)
HalophyteLimonium aureum(L)Hillseedlingsareusedtoinvestigatethechangesofantioxidantsubstancecontentsandantioxidantenzymeactivitiesassociatedwithascorbate-glutathione(AsA-GSH)cycleinresponestodifferentNaClconcentrations(0,25,50,100,150mmol·L-1).Theamountofascorbicacid(AsA)andtotalascorbicacidcontentsriseduetoonly150mmol·L-1NaCl.Differently,allsalinityconcentrationsleadtotheincreasesofdehydroascorbate(DHA)content,GSH/oxidizedglutathione(GSSG)andglutathionereductase(GR),ascorhicoxidas(AAO)anddehydroascorbatereductase(DHAR)activities,butthedecreasesofAsA/DHA,GSSGlevelandmonodehydroascorbatereductase(MDHAR)activities.Inaddition,GSHcontentincreasesinresponsetolowNaClconcentrationsbutdecreasestohighsalinityintheleavesofLimonium aureum(L)Hillseedlings.Takentogether,salinitystressresultsintheincreasesofnon-enzymaticantioxidantlevelsandantioxidantenzymeactivitiesintheleavesofLimonium aureum(L)Hillseedlings,whichmightenhancetheabilityofreactiveoxygenspeciesscavengingandstrengthenseedlingresistancetosaltstress.
saltstress;Limonium aureum(L)Hill;ascorbate-glutathionecycle;reactiveoxygenspecies
10.16783/j.cnki.nwnuz.2016.03.016
2015-10-20;修改稿收到日期:2015-11-12
国家自然科学基金资助项目(31360094,31470464)
杨颖丽(1971—),女,甘肃漳县人,教授,博士,博士研究生导师.主要研究方向为植物生理与分子生物学.
E-mail:yangyingli2006@sohu.com
S512.1+2
A
1001-988Ⅹ(2016)03-0084-06
