地鳖多糖提取物的体内外抗氧化作用
2016-09-13谢梦蕊邱思奇沈红
谢梦蕊,邱思奇,沈红
(北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京102206)
地鳖多糖提取物的体内外抗氧化作用
谢梦蕊,邱思奇,沈红*
(北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京102206)
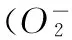
地鳖多糖提取物;自由基;抗氧化酶;小鼠
地鳖(Eupolyphage sinensisWalker,ESW)是我国传统活血化瘀类中药,在众多医药典籍中均有记载。近年来,随着对地鳖化学成分的深入研究,从中分离出蛋白质、糖类、有机酸、生物碱、氨基酸等有机物及多种微量元素[1]。研究表明,地鳖具有溶解血栓、抗凝血、抗肿瘤、促进骨折愈合、调节血脂、抗突变、耐缺氧等十分广泛的药理作用[2]。
自由基参与体内多种病理、生理过程,其平衡的破坏是多种疾病发生的一个重要因素[3]。同时,机体通过超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽等抗氧化物质来清除有害过氧化物、减轻和阻断脂质过氧化反应。由于对多糖的研究越来越深入,且天然抗氧化剂比合成抗氧化剂安全性更高,近年来对多糖抗氧化活性的研究日益增加。
昆虫作为地球上种类最多、数量最大的生物类群[4],目前对其研究主要集中在甲壳素、蛋白质类等的提取和应用,而对多糖的研究相对不足[5],有关地鳖多糖抗氧化功能鲜有报道。本研究通过体内外试验研究地鳖多糖提取物体内抗氧化活性,以期为地鳖多糖的深入研究和开发应用提供试验依据,为利用昆虫来源多糖,拓宽昆虫资源利用奠定基础。
1 材料与方法
1.1材料
6~8周龄清洁级KM小鼠40只,体重20~22g,购于中国军事医学科学院实验动物中心【SCXK-(军)2012-0004】。无菌手术在北京农学院实验动物示范中心屏障动物实验室进行 【SYXK(京)2015-0004】,并按实验动物使用的3R原则给予人道的关怀。
邻二氮菲、1,1-二苯基-2-三硝基苯肼(DPPH)、二硫苏糖醇(DTT)、硫代巴比妥酸(TBA)、抗坏血酸(Vc)等购于美国Sigma公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、总蛋白定量试剂盒购于南京建成生物科技有限公司,地鳖多糖提取物由本实验室制备。UV-3紫外可见分光光度计购于上海美普达有限公司。1.2方法
1.2.1实验分组
小鼠随机分成4组,每组10只,不同剂量地鳖多糖提取物(0、40、80、160mg/kg)灌胃给药(根据预实验及参考文献确定)[6~7],连续灌服20d。
1.2.2地鳖多糖提取物对自由基清除的测定
(1) 分光光度法测定二苯代苦味酰基自由基(DPPH·)的清除
取1.2mL0.2mmol/LDPPH溶液、2.6mL双蒸水于试管内混匀,加入0.2mL不同浓度地鳖多糖提取物(0、0.4、0.8、1.2、1.6、2.0mg/mL)和1mg/mLVc溶液,混匀后室温静止避光反应30min,测定517nm处吸光度值。根据公式计算清除率(%)=[1-(A1- A2)]/ A0× 100%,A0为未加样品管吸光度值,A1为样品反应管吸光度值,A2为样品本身吸光度值。
取25℃预热的4.9mLPBS溶液 (pH8.2)、40μL25mmol/L邻苯三酚和30μL不同浓度地鳖多糖提取物(0、0.4、0.8、1.2、1.6、2.0mg/mL)于试管内,25℃反应3min,然后迅速向各管滴加50mg/mLDTT50μL,室温静置5min,测定322nm处吸光度值。根据公式计算清除率(%)=[1-(A1- A2)]/ A0× 100%, A0为未加样品管吸光度值,A1为样品反应管吸光度值,A2为样品本身吸光度值。
(3)Fe2+-邻二氮菲氧化法测定羟自由基(·OH)的清除
取1mL0.75mmol/L邻二氮菲、1mL0.75mmol/LFeSO4、2mLpH7.4PBS、1mL不同浓度地鳖多糖提取物(0、1、3、5、7、9mg/mL)于试管内混匀,然后加入1mL0.01%H202,37℃水浴反应60min,测定536nm处吸光度值。根据公式计算清除率(%)=(A3-A2-A1)/(A0-A1) × 100%,A0为未加样品和H202管吸光度值,A1为未加样品管吸光度值,A2为样品本身吸光度值,A3为样品反应管吸光度值。
1.2.3红细胞氧化溶血的测定
取1mL1%红细胞悬液、50μL不同浓度地鳖多糖提取物(0、1、2、4、8、16mg/mL)、50μL100mmol/LH2O2和4mL生理盐水于试管制备样品反应管,37℃水浴反应1h,迅速冷却,2000r/min离心5min,检测415nm处吸光度值。细胞溶血率(%)=A1/ A0× 100%,A0和A1分别为对照和样品反应管吸光度值。
1.2.4小鼠组织中MDA含量和肝线粒体肿胀度的测定
取1mL1%肝、肾组织匀浆液、100μL6mmol/L硫酸亚铁溶液、40μL60mmol/LH2O2及不同浓度地鳖多糖提取物(0、0.04、0.08、0.16、0.32、0.64mg/mL)于试管内,37℃水浴反应1h,加入1mL15%的三氯乙酸终止反应,再加入1mL0.6%硫代巴比妥酸(TBA)置于沸水中显色15min,冷却后检测A532值。计算MDA生成抑制率=(1-A1/ A0)× 100%,A0和A1分别为对照和样品反应管吸光度值。
制备小鼠肝线粒体液,总蛋白定量试剂盒测定蛋白浓度,将其调整浓度为0.5mg/mL。取3mL线粒体液(0.5mg/mL)、0.1mmol/LFeSO4溶液50μL、0.1mmol/LVC溶液50μL、2mg/mL地鳖多糖提取物1mL混匀制备样品反应管,测定A520值。
1.2.5抗氧化酶(SOD、CAT、GSH-Px)活力及MDA含量的测定
末次给药24h后小鼠眼眶采血,制备抗凝全血。迅速分离肝肾,用预冷生理盐水冲洗,制成10%组织匀浆备用。根据SOD、CAT、GSH-Px和MDA试剂盒说明,检测组织和血液中SOD、CAT、GSH-Px活力及MDA含量。
1.2.6统计分析
实验数据以平均数±标准差表示,采用t检验分析比较各组数据,方差不齐时用t’检验,P<0.05和P<0.01为差异有显著性。
2 结果
2.1地鳖多糖提取物对自由基的清除
结果如图1所示,地鳖多糖组对三种自由基的清除率均低于阳性对照组,地鳖多糖提取物浓度在0.4~2mg/mL范围内随着浓度升高对DPPH·和超氧阴离子自由基的清除率逐渐提高,呈现剂量效应关系,多糖浓度在2mg/mL时,自由基清除率接近阳性对照组;地鳖多糖在9mg/mL时羟自由基清除率达到81.7%,当浓度高于7mg/mL时,清除率上升缓慢趋于平稳。

图1 地鳖多糖提取物对自由基的清除作用Fig.1 Effects of polysaccharide extraction from ESW on free radical scavenging
2.2地鳖多糖提取物抗氧化活性的分析
结果如图2所示,正常对照组体外红细胞溶血率为20.74%,说明正常红细胞有一定程度的溶血,而地鳖多糖组红细胞溶血率高于40%且明显高于正常对照组,地鳖多糖浓度在1~4mg/mL范围内随着浓度提高,红细胞氧化溶血率呈降低趋势,当浓度大于4mg/mL时红细胞溶血率下降趋于平稳。自由基攻击线粒体膜易引起线粒体膜肿胀,吸光度值改变,通过测定吸光度值变化,分析地鳖多糖提取物对线粒体肿胀的影响。结果随着自由基对线粒体作用时间延长,正常组吸光度值稍有下降,肿胀组吸光度值显著降低,地鳖多糖组吸光度值逐渐降低,低于正常对照组但高于肿胀组(图3)。

图2 地鳖多糖提取物对红细胞氧化溶血的影响Fig.2 Effects of polysaccharide extraction from ESW on hemolysis of erythrocytes
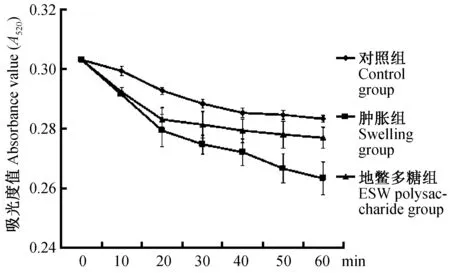
图3 地鳖多糖提取物对肝线粒体肿胀的影响Fig.3 Effects of polysaccharide extraction from ESW on liver mitochondria swelling
2.3地鳖多糖提取物对组织脂质过氧化的作用
由图4可知,地鳖多糖提取物浓度在0.04~0.64mg/mL范围内,随着浓度增加,肝肾组织中MDA生成抑制率均呈明显升高趋势,肾中MDA生成抑制率明显高于肝组织(图4A)。与对照组比较,随着地鳖多糖提取物剂量的增加,小鼠肝肾中MDA含量明显降低,肝中MDA含量降低显著且明显高于肾(图4B)。
2.4地鳖多糖提取物对抗氧化酶活力的影响

图4 地鳖多糖提取物对体外(A)和体内(B)小鼠肝肾组织中MDA生成的影响Fig.4 Effects of polysaccharide extraction from ESW on the production of MDA in mouse liver and kidney tissues in vitro (A) and in vivo (B)
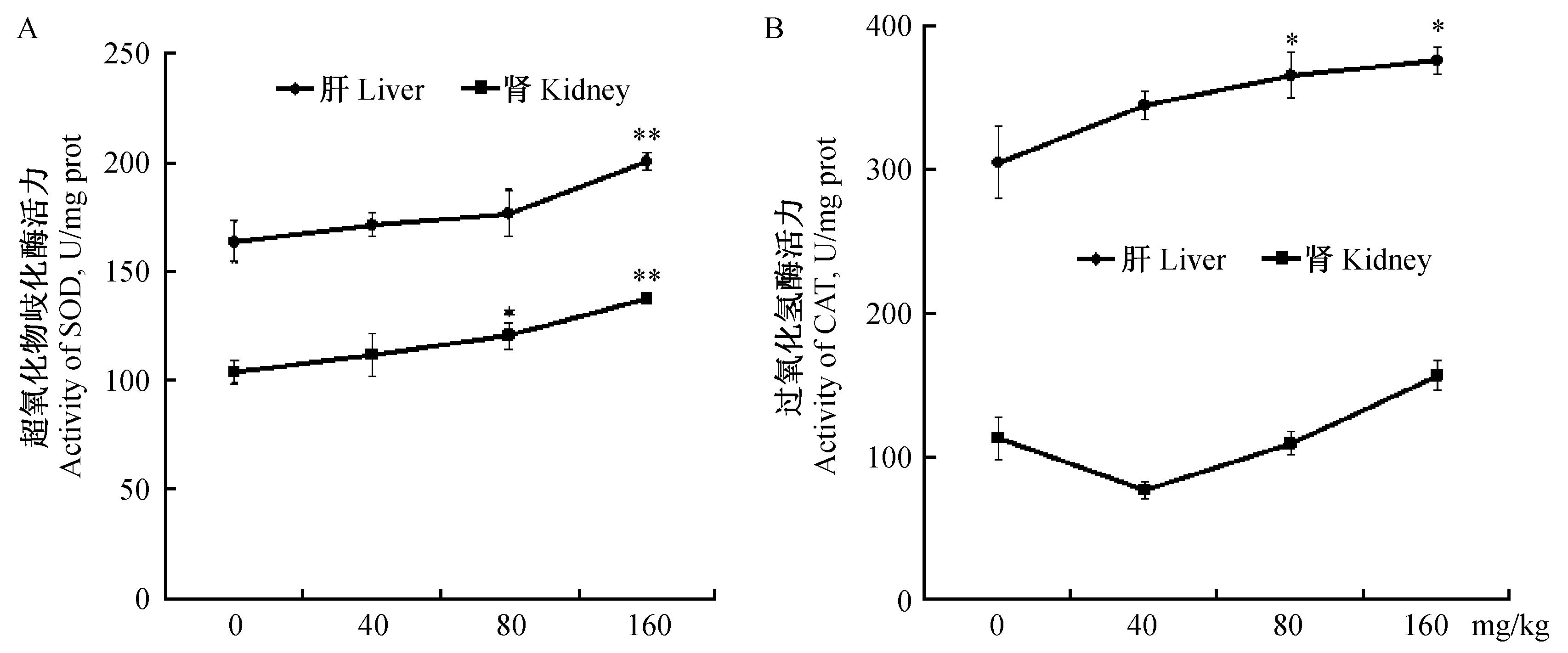
与对照组比较,随着地鳖多糖提取物剂量升高,小鼠肝肾中SOD活力逐渐增强,其中高剂量组极显著高于对照组;肝中SOD活力明显高于肾(图5A)。随着地鳖多糖剂量升高,肝中CAT活力逐渐提高;肾CAT活力低中剂量组降低,高剂量组明显高于对照组;组织之间比较,肝中CAT活力最高明显高于肾(图5B)。地鳖多糖组小鼠肝和血液中GSH-Px活力明显高于对照组,且随着地鳖多糖剂量增加GSH-Px活力显著升高(图6)。
3 讨论

MDA是细胞膜不饱和脂肪酸脂质过氧化的终产物,其化学性质极其活泼,易与蛋白质、核酸等反应,其含量常用来表示机体内脂质过氧化水平及细胞的受损程度[12]。红细胞在体外与H2O2反应后也可产生MDA,MDA可使红细胞膜受损,发生溶血;线粒体膜在自由基攻击下极易发生脂质过氧化反应,破坏膜脂的结构,出现线粒体肿胀等异常现象。张德华等[13]研究发现,夏枯草多糖具有防止膜脂质过氧化的作用,减少红细胞溶血和降低MDA的生成。梁俊等[14]研究结果表明,石榴皮多酚能有效抑制体外金属离子诱导的脂质过氧化,并且具有良好的剂量效应关系。本试验结果发现,地鳖多糖提取物能够显著减少红细胞溶血和脂质过氧化产物丙二醛(MDA) 的生成量,显著降低脂质过氧化物产生。
注:与对照组相比,*P<0.05,**P<0.01。图5 地鳖多糖提取物对小鼠肝肾组织中SOD(A)和CAT(B)中活力的影响Note. Compared with the control group, *P<0.05,**P<0.01.Fig.5 Effects of polysaccharide extraction from ESW on the activity of SOD (A) and CAT (B) in mouse liver and kidney tissues
注:与对照组相比,*P<0.05,**P<0.01。图6 地鳖多糖提取物对小鼠肝(A)和血液(B)中GSH-Px活力的影响Note. Compared with the control group, *P<0.05,**P<0.01.Fig.6 Effects of polysaccharide extraction from ESW on the activity of GSH-Px in mouse liver (A) and blood (B)

综上所述,地鳖多糖提取物可能是通过提高抗氧化酶活性,清除自由基,抑制脂质过氧化,从而增强机体抗氧化能力,但其抗氧化作用机理仍需探讨。本研究为地鳖多糖抗氧化作用的深入研究提供实验依据,以及为昆虫资源充分利用奠定一定的科学基础。
[1]田军鹏, 黄文, 雷朝亮, 等. 地鳖虫药理作用研究概况 [J].时珍国医国药, 2006, 17(3): 418-419.
[2]周彦钢, 任玉翠, 江月仙.地鳖虫的营养成分分析 [J].食品研究与开发, 1998, 19(2): 51-53.
[3]李勇, 孔令青, 高洪, 等.自由基与疾病研究进展 [J].动物医学进展, 2008, 29(4): 85-88.
[4]DosseyAT.Insectsandtheirchemicalweaponry:Newpotentialfordrugdiscovery[J].NaturalProductReports, 2010, 27(12): 1737-1757.
[5]GarenauxE,MaesE,LevêqueS,etal.StructuralcharacterizationofcomplexO-linkedglycansfrominsect-derivedmaterial[J].CarbohydrateRes, 2011, 346(9): 1093-1104.
[6]唐静. 不同剂量川牛膝多糖对小鼠抗氧化活性的影响 [D]. 四川: 四川农业大学, 2013.
[7]侯潇, 刘剑利, 常浩, 等.香蕉皮多糖对小鼠抗氧化损伤作用 [J].中国公共卫生, 2008, 24(11): 1398-1399
[8]李勇, 孔令青, 高洪, 等. 自由基与疾病研究进展 [J].动物医学进展, 2008, 29(4): 85-88.
[9]XuWT,ZhangFF,LuoYB,etal.Antioxidantactivityofawater-solublepolysaccharidepurifiedfrompteridiumaquilinum[J].CarbohydrateRes, 2009, 344:217-222.
[10]赵昕, 吴子龙, 陈立凤, 等.香菇菌柄基部多糖的提取及其清除DPPH自由基作用的研究 [J].北方园艺, 2012, 24: 165-168.
[11]聂少平, 谢明勇, 罗珍.茶叶多糖的抗氧化活性研究 [J].天然产物研究与开发, 2005, 17(5): 549- 552.
[12]GawelS,WardasM,NiedworokE,etal.Malongdialdehyde(MDA)asalipidperoxidationmarker[J].WiadLek, 2004, 57(9-10): 453-455
[13]张德华.夏枯草多糖德分离纯化与抗氧化活性研究 [J].云南植物研究, 2006, 28(4):410- 414.
[14]梁俊, 李建科, 赵伟, 等.石榴皮多酚体外抗脂质过氧化作用研究 [J].食品与生物技术学报, 2012, 31(2): 102-108.
[15]张彬, 谭琼, 李丽立, 等.金属硫蛋白对奶牛血液抗氧化酶GSH-Px和CAT基因表达的影响 [J].草业学报, 2010, 19(3): 132-138.
[16]晏涛, 陈世保, 徐蕾, 等.灵芝多糖对阿尔茨海默病大鼠学习记忆和氧化应激的影响[J].陕西医学杂志, 2011, 40(4): 387-389.
Antioxidant effects of polysaccharide extraction from Eupolyphaga sinensisWalker(ESW) in vitroandin vivo
XIEMeng-rui,QIUSi-qi,SHENHong*
(CollegeofAnimalScienceandTechnology/BeijingKeyLaboratoryofTraditionalChineseVeterinaryMedicine,BeijingUniversityofAgriculture,Beijing102206,China)
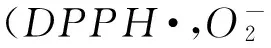
PolysaccharideextractionfromESW;Freeradicals;Antioxidantenzymes;Mice
SHENHong.E-mail:shenhong912@sina.com
北京市教委项目 (PXM2013014207000067);北京农学院科技创新团队科研能力提升工程项目 (KCT2014012)。
谢梦蕊(1991-),女,硕士研究生,研究方向为免疫药理。Email:xiemr_2010@126.com
沈红(1961-),女,教授。E-mail:shenhong912@sina.com
研究报告
Q95-33
A
1005-4847(2016)04-0427-06
10.3969/j.issn.1005-4847.2016.04.017
2016-01-29
