黄河裸裂尻鱼MSTN基因RNA干扰研究
2016-09-13孔庆辉晁燕夏明哲祁得林
孔庆辉,晁燕,夏明哲,祁得林*
(1. 青海大学 农牧学院动物科学系,西宁 810016;2. 青海大学 生态环境工程学院,西宁 810016)
黄河裸裂尻鱼MSTN基因RNA干扰研究
孔庆辉1,晁燕1,夏明哲2,祁得林1*
(1. 青海大学 农牧学院动物科学系,西宁810016;2. 青海大学 生态环境工程学院,西宁810016)
目的 利用反义寡合甘酸技术抑制肌肉生长抑制素(myostatin, MSTN)的表达,评估MSTN基因的沉默效果,并检测RNA干扰后对下游基因的影响。方法 通过构建黄河裸裂尻鱼(Schizopygopsispylzovi)MSTN基因RNA干扰(RNAi)重组腺病毒载体1P3(DSP MSTN 273+250+1737)和1P2(DSP MSTN 195+1670),并将其注射黄河裸裂尻鱼肌肉组织,进行活体RNA干扰;利用real-time PCR和Western blotting评估MSTN基因的沉默效果,并检测MSTN基因RNA干扰后肌肉肌酸激酶(muscle-type creatine kinase, M-CK)基因转录水平的调控作用。结果real-time PCR分析结果表明,与HK组(病毒通用阴性对照组)和N组(空白对照组)相比,重组腺病毒载体1P3对黄河裸裂尻鱼肌肉MSTN基因的转录具有明显的干扰作用(P<0.05),抑制率达53.5%;而重组腺病毒载体1P2对MSTN基因的转录无明显干扰作用(P>0.05)。Western-blotting分析结果与real-time PCR结果相一致。同时,经1P3干扰后随着MSTN基因转录水平的下降,其肌肉肌酸激酶M-CK基因表达水平显著上升。结论 通过RNAi技术能够有效的抑制MSTN基因的表达,并能够上调M-CK基因的表达量。因此,证明了在黄河裸裂尻鱼中MSTN能够抑制M-CK的转录。揭示高原土著鱼类MSTN基因的对肌肉的生长发育起到调控作用。
黄河裸裂尻鱼;RNA干扰;肌肉生长抑制;肌酸激酶;表达
黄河裸裂尻鱼(Schizopygopsispylzovi)隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae),在青藏高原东北部黄河干支流和湖泊以及柴达木水系中广泛分布[1],同其他裂腹鱼亚科鱼类一样,黄河裸裂尻鱼具有性成熟迟、繁殖力低、生长期短、生长缓慢的典型生物学特性。加之受人类干扰和环境恶化的影响,导致黄河裸裂尻鱼种群数量一再减少,栖息地日益片断化[2]。鱼类肌肉组织是鱼类的组织结构和运动器官,也是为人类提供食物的重要蛋白源。以鱼类为重要养殖对象的水产养殖和自然环境的保护,实质上就是按照实际的生态环境和条件,利用合适的技术,最大限度的加快肌肉纤维细胞的快速增殖,从而促使肌肉快速生长发育。所以,鱼类在生长发育过程中肌肉的分化、生长是重要的环节,受许多环境、激素和分子水平等因素的调控。在分子水平上,除了通过与肌肉分化和生成有关的正向调控的生肌决定因子外[3],肌肉的生长还受到一些负调控因子,特别是肌肉生长抑制素(myostatin, MSTN)的影响[4]。
肌肉生长抑制素,又称GDF-8(growth differentiation factor 8),是1997年由Mcpherron等[4]发现在骨骼肌的发育和生长中特异性表达且功能比较专一的肌肉负调控因子,属于转化因子β(transforming growth factor beta, TGF-β)超家族中的一员。MSTN同TGF-β超家族的其他成员一样,在近N-末端的前肽序列具有疏水性,是分泌用信号肽序列;N-末端和C-末端之间的蛋白酶水解加工位点(RXXR)以及C-末端的成熟肽活性区。成熟肽在被切割后可负向调节肌肉的生长发育,MSTN前肽在骨骼肌中可与MSTN成熟肽结合,抑制MSTN成熟肽的活性,促进肌肉的生长。有研究表明,MSTN基因过度表达,将通过下调肌肉肌酸激酶(muscle-type creatine kinase, M-CK)的活性,可逆的抑制生肌的过程。同时,降低MSTN的表达水平,可以提高M-CK的转录,从而促进生肌过程[5]。肌酸激酶(creatine kinase, CK)能够催化二磷酸腺苷ADP和磷酸肌酸之间磷酸基的可逆转移[6],是一个存在于动物的脑组织、心脏及骨骼肌的细胞质和线粒体中的重要激酶,与细胞内能量转运、能量代谢、肌肉收缩密切相关[7,8]。2014年王景圆等[9]研究发现,肌肉细胞中Rheb基因上调可以引起MSTN表达量的上调,M-CK有不同程度的下降。肌肉中MSTN基因的变化能够引起M-CK不同程度的变化。所以,肌肉肌酸激酶不仅参与能量代谢过程,还与个体发育过程中肌肉的生长有密切联系[5,10,11]。
国内外很多学者将目光投向了RNA干扰(RNA interference, RNAi)技术。从20 世纪90年代,Carolyn研究组发现矮牵牛花花瓣的深紫色的决定因素是花青素[12],到1995 Guo 等[13]从线虫中发现 RNA 干扰现象。RNA干扰都是研究功能基因的有力工具。1997年首次在小鼠骨骼肌中发现了该基因, 通过基因敲除的方法发现敲除MSTN基因的小鼠骨骼肌重量大幅度增加。对MSTN基因敲除的小鼠研究发现, 脂肪沉积能力随着年龄的增加而降低[4]。通过对小鼠[14,15]、鱼类[16,17]、鸡[18,19]、猪[20]和牛[21]的MSTN基因及其多克隆的抗体的研究表明,利用肌肉生长抑制素的拮抗物可以有效的阻断肌肉生长抑制素的分子通路,并且能够有效地促进动物肌肉的生长和发育。本研究以黄河裸裂尻鱼为研究对象,通过前期获得的肌肉生长抑制素基因序列设计引物、构建获得反义寡核苷酸序列。利用反义寡合甘酸技术抑制MSTN基因表达,获得相关数据,为突破高原冷水鱼类生长缓慢的瓶颈、推动土著鱼类的保护利用研究提供科学依据。
1 材料与方法
1.1材料
1.1.1样本采集
黄河裸裂尻鱼共24尾,雌性各半,体重为25.01~15.33 g。采集于青海省大通县湟水河支流—宝库河(37o14′24.72′′N, 101o28′36.12′′E)。将野外采集得到的样品,迅速带回实验室。通过外观、解剖、显微镜检查选择其体型体态体色正常、无疖疮、无囊肿、无充血、无出血、无溃疡、无寄生虫或胞囊及其他病理变化的鱼。在实验室饲养3 d适应其环境,为后续实验做准备。
1.1.2主要仪器与试剂
小型垂直电泳槽(Mini-PROTEAN Tetra Cell, Bio-Rad);小型Trans-Blot转印槽(Bio-Rad);全蛋白提取试剂盒(生工生物工程有限公司);Pierce(R)BCA Protein Assay Kit(碧云天生物技术公司);Tris-base(Biotopped)、SDS(Wolsen);冰乙酸、甲醇、异丙醇、氯化钠(均为:天津市富宇精细化工);Tris-HCl(pH 8.8; 1.0 M)、Tris-HCl(pH 6.8; 1.5 M)、AP、TEMED、4×蛋白上样缓冲液、Tween-20、考马斯亮蓝、PVDF膜、Pierce ECL Western Blotting Substrate、甘氨酸(均为:Solarbio);蛋白marker、 RNAprep Pure Tissue Kit、SuperReal PreMix Plus (SYBR Green)、FastQuant RT Kit(Tiangen Biotech Co., Ltd);封闭用脱脂奶粉、Anti-GAPDH(Sigma)、辣根酶标记山羊抗兔lgG(中杉金桥)、Anti-MSTN(上海英基生物);KOD FX(TOYOBO)、HEK 293(ATCC)、内切酶BsaI、XbaI(TaKara)、MetafecteneTM(Biontex公司)。
1.2方法
1.2.1构建shRNA重组腺病毒载体
(1)干扰质粒的构建
根据前期获得的黄河裸裂尻鱼MSTN基因序列[22],利用晶赛公司Adenovirus Expression System重组腺病毒构建系统,针对靶基因分别设计并合成两种shRNA干扰载体。针对MSTN基因编码区(1号:273-292;2号:250-268;3号:1737-1755;4号:1670-1688;5号:195-215)设计特异性插入片段序列。1P3:在1、2、3号区域设计三条干扰片段;1P2:在4、5号区域设计两条干扰片段,横线部位为基因特异性序列(见表1)。以pGenesil-10为底物进行重组PCR,获得干扰质粒。

表1 黄河裸裂尻鱼MSTN基因 shRNA 干扰片段
(2)包装腺病毒载体
所需的shRNA表达框已成功构建在pGenesil上。从pGenesil上通过LR体外同源重组将shRNA表达框转移至有荧光蛋白的腺病毒表达载体pad上。用DNA纯化试剂盒(天根)提取质粒,用XbaI单酶切进一步鉴定提取的质粒。准备进行转染的线性化腺病毒DNA,用PacI酶切重组腺病毒质粒。从而可以用PacI线性化的腺病毒DNA转染HEK 293和放大培养重组腺病毒,检测重组腺病毒的滴度。
1.2.2黄河裸裂尻鱼活体注射重组腺病毒
将前期饲养并已适应实验室环境的黄河裸裂尻鱼,进行分组:1P3组(RNA干扰组1,6尾);1P2组(RNA干扰组2,6尾);HK组(腺病毒通用阴性对照组,6尾);N组(正常空白对照组,6尾)。对1P3组和1P2组进行右侧背鳍部肌肉注射腺病毒载体溶液20 μL,重组腺病毒滴度为5.0×1010pfu/mL。在相同的时间点,对HK组背鳍右侧肌肉注射相同量的空病毒载体溶液。N组不做任何处理,饲养条件同以上三组。在注射10 d后分取各组实验鱼右侧背鳍肌肉,用real-time PCR和Western blotting 检测MSTN的表达量,分析干扰效率。
1.2.3Real-time PCR检测RNA干扰后MSTN基因表达以及对下游基因M-CK的影响
分别取四组黄河裸裂尻鱼右侧背鳍部肌肉组织,提取总RNA,利用FastQuant RT Kit试剂盒反转录合成cDNA。依照SuperReal PreMix Plus (SYBR Green)试剂盒进行real-time PCR分析。Real-time PCR反应体系20 μL:2× SuperReal PreMix Plus10 μL、上下游引物(10 μmol/L)各0.6 μL、cDNA模板1 μL、ddH2O 8.4 μL。Real-time PCR时,每份样品重复3次,GAPDH为内参基因,引物见表2。结果采用2-ΔΔct法分析[23]。
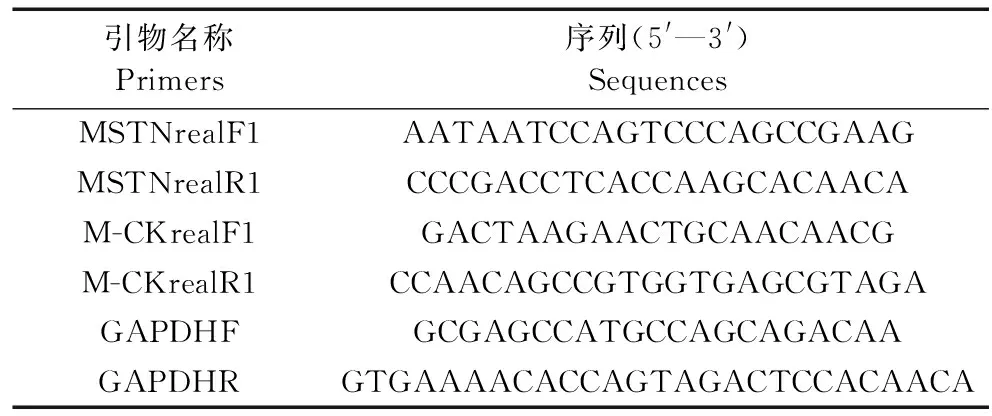
表2 黄河裸裂尻鱼RNA干扰分析引物
1.2.4Western-blotting检测RNA干扰后MSTN基因的表达量
取4组黄河裸裂尻鱼背鳍部肌肉组织,利用全蛋白提取试剂盒,提取总蛋白质,依照Pierce(R)BCA Protein Assay Kit进行蛋白浓度测定。4×蛋白上样缓冲液与蛋白按照1∶3的比例进行混合后,99℃ 变性10 min, -80℃保存。统一上样量,利用SDS-PAGE试剂盒使用说明,配制10% SDS-PAGE进行电泳检测。60 V恒压电泳25 min左右,样品到达分离胶与浓缩胶分界处时调整电压为120 V恒压电泳65 min左右。利用甲醛溶液侵泡1 min激活PVDF膜,用于转印。转膜时100 mA恒流转印50 min左右。将固定好的PVDF膜置于5% TBST配制的脱脂奶粉溶液,37℃封闭2 h。将PVDF膜和TBST 1∶1000配制好的一抗置于孵育袋12 h。PVDF膜洗涤10次,每次6 min。置于TBTS 1-5000配置好的二抗孵育液,室温孵育2 h,用TBST洗涤5次,每遍6 min。将蛋白转到PVDF膜,用ECL显色。以GAPDH为内参基因,进行胶片曝光。
2 结果与分析
2.1腺病毒载体的构建
2.1.1shRNA干扰载体的构建
1P3载体以pGenesil-10为底物进行重组PCR,获得1P3干扰质粒PG10-3P-MSTN (Mir30 3’-DSP MSTN 273- Mir30 5’-EGFP-CMV-U6 Promoter- DSP MSTN 250-DSP MSTN 1737-H1 Promoter)。1P2载体,以 pGenesil-10为底物进行重组PCR,获得干扰质粒PG10-2P-MSTN(Mir30 3’-DSP MSTN 195-Mir30 5’-EGFP-CMV-U6-DSP MSTN 1670)(见图1)。
2.1.2包装重组腺病毒
从pGenesil上通过LR体外同源重组将shRNA表达框转移至腺病毒表达载体pad上。提取质粒并用XbaI进行单酶切进一步鉴定提取的质粒,1% agarose凝胶电泳。酶切结果分析:正确的克隆将切出一条约2.5 kb的小条带,且大条带大于15 kb (说明载体为腺病毒载体),从上图可知目的克隆是正确的(见图2)。目的重组腺病毒中有荧光蛋白真核表达框。所以,在PacI线性化的腺病毒DNA转染HEK 293和放大培养重组腺病毒的过程中有明显的荧光蛋白表达,即说明有感染能力的重组腺病毒包装成功(见图3)。
2.2Real-time PCR 检测黄河裸裂尻鱼RNA干扰后MSTN的相对表达量
Real-time PCR分析结果表明,当以N组表达量作为参考时,1P3和1P2组表达量分别是N组表达量的0.465和0.89倍。所以,与HK组和N组相比,重组腺病毒载体1P3对黄河裸裂尻鱼肌肉MSTN基因的转录具有明显的干扰作用(P<0.05),抑制率达53.5%;而重组腺病毒载体1P2对MSTN基因的转录无明显干扰作用(P>0.05)(见图4)。
2.3Western-blotting测定RNA干扰对MSTN蛋白相对表达情况
Western-blotting结果表明,当以N组表达量作为参考时,1P3和1P2组表达量分别是N组表达量的0.479和0.765倍。所以,与N组和HK组相比,重组腺病毒载体1P3对黄河裸裂尻鱼肌肉MSTN基因的转录具有明显的干扰作用(P<0.05),干扰效率可达52.1%。 P2组干扰效率不明显(P>0.05)(见图5)。
2.4Real-time PCR 检测黄河裸裂尻鱼MSTN基因RNA干扰后对下游基因M-CK的表达调控
经1P3干扰后随着MSTN基因转录水平的下降,其肌肉肌酸激酶M-CK基因表达水平显著上升(P<0.05),以N组表达量作为参考时(见图6),1P3组M-CK表达量是N组表达量2.437倍。
3 讨论
本研究通过设计两种shRNA分别为1P3和1P2,并成功包装成重组腺病毒。将重组腺病毒注射到黄河裸裂尻鱼右侧背鳍部,检测RNA干扰后MSTN基因的表达量。Real-time PCR分析结果表明,与HK组和N组相比,重组腺病毒载体1P3对黄河裸裂尻鱼肌肉MSTN基因的转录具有明显的干扰作用(P<0.05),抑制率达53.5%;而重组腺病毒载体1P2对MSTN基因的转录无明显干扰作用(P>0.05)。Western-blotting分析结果与real-time PCR结果相一致。表明,RNA干扰后MSTN基因转录水平和翻译水平是一致的。经1P3干扰后随着MSTN基因转录水平的下降,其肌酸激酶M-CK基因表达水平显著上升。能够有效的干扰MSTN基因,这对今土著鱼的生长发育提供基础资料。有助于高原土著鱼类生态适应机制、保护生物学、发育生物学的深入研究。
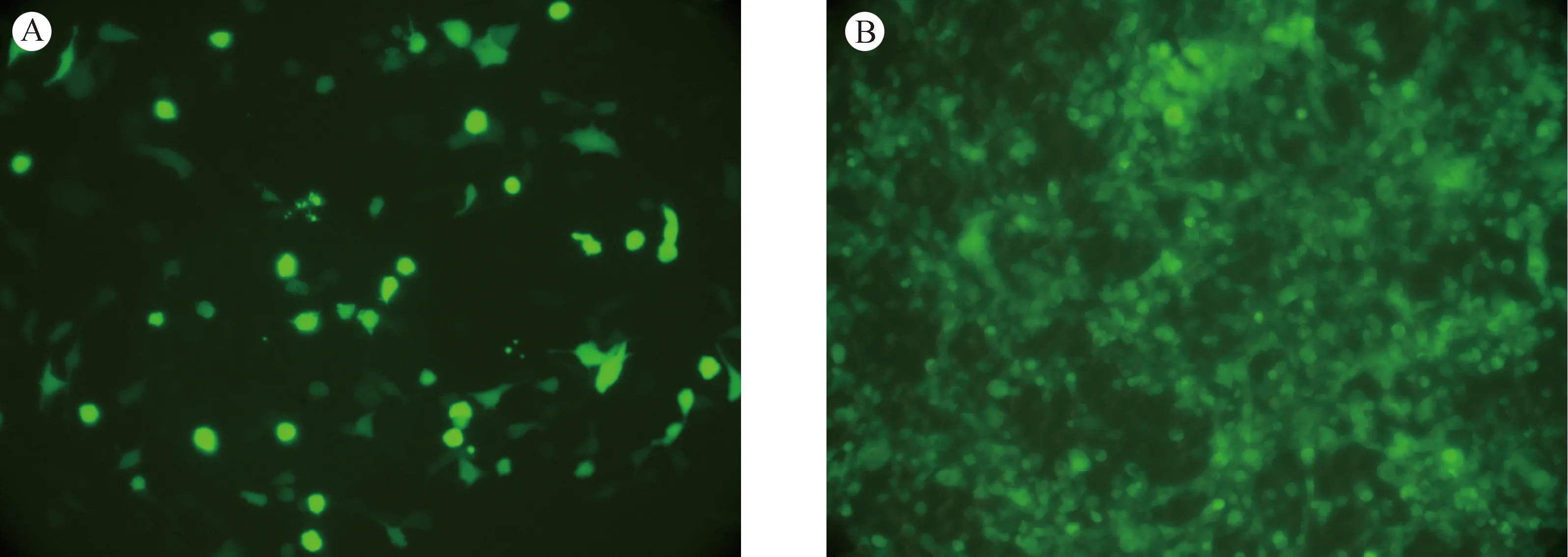
注:A:质粒转染后荧光显微镜图;B:扩大培养重组腺病毒后荧光显微镜图。图3 荧光显微镜检测腺病毒转染HEK 293细胞Note: A: Plasmid transfection with fluorescence microscopy; B: Expanded culture of recombinant adenovirus with fluorescence microscopy.Fig.3 Adenovirus-transfected HEK 293 cells were detected by fluorescence microscopy

图1 构建质粒图谱Fig.1 Construction of the plasmid profiles

注:M1: 2000 marker (Takara):从上到下依次为2×103、1×103、750、500、250、100 bp;M2: 500-15 000 marker (Takara):从上到下依次为:15、8、5、2.5、1 kb;A: pad- DSP MSTN 273+250+1737 XbaI单酶切鉴定结果;B: pad- DSP MSTN 195+ 1670 XbaI单酶切鉴定结果。图2 shRNA质粒XbaI单酶切检测Note. M1: 2000 marker (Takara): 2 kb, 1 kb, 750 bp, 500 bp, 250 bp, 100 bp; M2: 500-15000 marke r(Takara): 15 kb, 8 kb, 5 kb, 2.5 kb, 1 kb, 0.5 kb; A: pad- DSP MSTN 273+250+1737 XbaI single enzyme identification results; B: pad- DSP MSTN 195+ 1670 XbaI single enzyme identification results.Fig.2 Detection of shRNA plasmids using XbaI single enzyme digestion
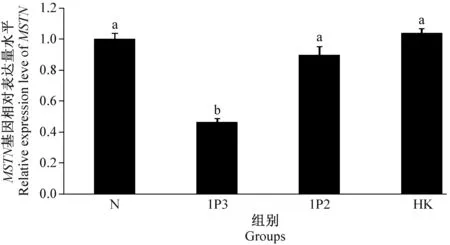
注:上标不同字母表示差异有显著性(P<0.05)。图4 RNA干扰后肌肉组织cDNA样品中MSTN基因表达量Note. Different letters in superscript indicate significant difference (P<0.05).Fig.4 Relative expression of MSTN gene in the cDNA samples of muscle after RNA interference

注:上标不同字母表示差异有显著性(P<0.05)。图5 RNA干扰后黄河裸裂尻鱼MSTN蛋白的表达结果Note. Different letters in superscript indicate significant difference (P<0.05).Fig.5 Expression of MSTN protein from Schizopygopsis pylzovi after RNA interference.

注:上标不同字母表示差异有显著性(P<0.05)。图6 MSTN基因RNA干扰后M-CK基因的相对表达量Note. Different letters in superscript indicate significant difference (P<0.05).Fig.6 The relative expression of M-CK gene after RNA interference of MSTN gene
肌肉的生长和发育除了与细胞分化因子(myogenic differentiation, MyoD)家族特异基因启动子上的E-box结合而激活肌肉特异蛋白的转录进而调控肌肉分化和发育外,还受到特异性肌细胞增强子结合因子2(myocyte enhancer-binding factor 2, MEF2)的调控。MEF2能够在肌肉发育过程中介导细胞的分化,控制肌细胞分化过程中的基因转录,可与大多数肌肉的启动子和增强子直接结合而调控肌肉的发育[24]。转录因子 MEF2 的DNA 结合位点是一段保守的序列, 该序列广泛存在于肌肉组织特异性表达基因的调控区, MEF2 与MyoD 基因家族成员具有协同作用, 共同调节肌肉发育[25]。由于MEF2具有DNA的结合活性,所以可与肌肉肌酸激酶基因启动子中的A/T DNA序列结合,能够调节肌肉的生长和发育[26]。肌肉肌酸激酶的另一重要生物学功能就是与动物骨骼肌的形成和生长有关,M-CK作为MyoD和MEF2的下游靶基因,启动与肌细胞分化和肌肉生长有关的基因的表达[11]。同时,2002 年Spiller等[27]发现MSTN启动子序列上存在肌肉增强子因子 2的结合位点,它们对MSTN基因的转录和表达起到一定的调控作用[27]。本研究通过对黄河裸裂尻鱼MSTN基因进行RNA干扰后。结果表明,抑制MSTN基因的表达,在一定程度上能够上调M-CK基因的表达量。因此,证明了在黄河裸裂尻鱼中MSTN的表达在一定程度上能够抑制M-CK的转录。但是,M-CK基因表达量的上升是否能够引起肌细胞的增生和增殖?是否能够促进肌肉的生长和发育?还需进一步研究。
黄河裸裂尻鱼是裂腹鱼亚科鱼类的代表种,在青藏高原淡水生态系统的食物链中具有重要的地位。但是,同裂腹鱼亚科鱼类一样,黄河裸裂尻鱼固有的生物学特性,如生长期短、生长缓慢、性成熟迟、繁殖力低等,极大地限制了该种群的发展。本研究通过RNA干扰技术首次对黄河裸裂尻鱼MSTN基因进行干扰,并检测MSTN表达水平和下游基因的转录水平。这对今后研究高原土著鱼类MSTN基因在肌肉生长发育中的作用机理奠定了理论基础,具有一定的科学意义。
[1]武云飞, 吴翠珍. 青藏高原鱼类 [M]. 成都: 四川科学技术出版社, 1991.
[2]Qi DL, Guo SC, Zhao XQ, et al. Genetic diversity and historical population structure of Schizopygopsispylzovi(Teleostei: Cyprinidae) in the Qinghai-Tibetan Plateau [J]. Freshwater Biol, 2007, 52(6): 1090-1104.
[3]Zhu X, Topouzis S, Liang L F, et al. Myostain signaling through smad2, smad3 and smad4 is regulated by the inhibitory smad7 by a negative feed back mechanism [J]. Cytokine, 2004, 26(6): 262-272.
[4]Mcpherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member [J]. Nature, 1997, 387(6628): 83-90.
[5]Rios R, Cameiro I, Arce VM, et al. Myostatin is an inhibitor of myogenic differentiation [J]. Am J Physiol Cell Physiol, 2002, 282(5): C993-C999.
[6]石耀华, 刘 军, 夏建红, 等. 银鲫肌酸激酶M3-CK cDNA的克隆及其表达特征 [J]. 动物学报, 2003, 49(5): 637-645.
[7]Hammerschmidt S, Bell M, Büchler N, et al. Acute changes of myocardial creatine kinase gene expression under bata-adrenergic stimulation [J]. Biochim Biophys Acta, 2000, 1502(3): 471-480.
[8]Abraham MR, Selivanov VA, Hodgson DM, et al. Coupling of cell energetics with membrane metabolic sensing: integrative signaling through creatine kinase phosphotransfer disrupted by M-CK gene knock-out [J]. J Biol Chem, 2002, 277(27): 24427-24434.
[9]王景圆. Rheb基因对绒山羊骨骼肌卫星细胞的影响 [D]. 呼和浩特: 内蒙古大学, 2014.
[10]Weintraub H, Davis R, Tapscott S, et al. The MyoD gene family: nodal point during specification of the muscle cell lineage [J]. Science, 1991, 251(4995): 761-766.
[11]Olson EN, Perry M, Schulz RA. Regulation of muscle differentiation by the MEF2 family of MADS box transcription factors [J]. Dev Biol, 1995, 172(1): 2-14.
[12]Carolyn N, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression or homologous genes in trans [J]. Plant Cell, 1990, 2(4): 279-289.
[13]Guo S, Kemphues KJ. Par I, a gene required for establishing polarity in C. elegans embryos, encodes a putavtive ser/thr kinase that is asmmetrically distributed [J]. Cell, 1995, 81(4): 611-620.
[14]Murphy KT, Koopman R, Naim T, et al. Antibody-directed myostatin inhibition in 21-mo-old mice reveals novel roles for myostatin signaling in skeletal muscle structure and function [J]. FASEB J, 2010, 24(11): 4433-4442.
[15]Murphy KT, Cobani V, Ryall JG, et al. Acute antibody-directed myostatin inhibition attenuates disuse muscle atrophy and weakness in mice [J]. J Appl Physiol, 2011, 110(4): 1065-1072.
[16]张宁宁, 白俊杰, 李胜杰, 等. 大口黑鲈肌肉生长抑制素多克隆抗体的制备及其对仔鱼生长影响 [J]. 生物技术通报, 2009, 12: 129-133.
[17]Lee SB, Kim YS, Oh MY, et al. Improving rainbow trout (Oncorhynchusmykiss) growth by treatment with a fish (Paralichthysolivaceus) myostatin prodomain expressed in soluble forms inE.coli[J]. Aquaculture, 2010, 302(3): 270-278.
[18]蓝赐华, 刘为民, 梁梓森. 鸡肌抑素基因的原核表达及蛋白纯化 [J]. 黑龙江畜牧兽医, 2008, 27(7): 18 -20.
[19]Kim YS, Bobbili NK, Paek KS, et al. Production of a monoclonal anti-myostatin antibody and the effects of in ovo administration of the antibody on posthatch broiler growth and muscle mass [J]. Poult Sci, 2006, 85(6): 1062-1071.
[20]鲍淑青, 张克英, 陈代文. 猪肌肉生长抑制素基因的克隆及原核表达 [J]. 动物营养学报, 2007, 19(5): 617-621.
[21]Mcpherron AC, Lee SJ. Doubling muscling in cattle due to mutations in the myostatin gene [J]. Proc Natl Acad Sci, 1997, 94(23): 12457-12461.
[22]晁燕, 赵兰英, 李长忠, 等. 黄河裸裂尻鱼肌肉生长抑制素基因克隆及表达分析 [J]. 动物学研究, 2012, 33(5): 473-480.
[23]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408.
[24]程波, 李利, 王林杰, 等. MEF2基因家族的研究进展 [J]. 中国畜牧杂志, 2012, 48(15): 70-74.
[25]Wu W, de Folter S, Shen X, et al. Vertebrate paralogous MEF2 genes: origin, conservation, and evolution [J]. PLoSe One, 2011, 4(6): e17334.
[26]Brand N J. Myocyte enhancer factor 2 (MEF2) [J]. Int J Biochem Cell Biol, 1997, 29 (12): 1467-1470.
[27]Spiller MP, Kambadur R, Jeanplong F, et al. The myostatin gene is a downstream target gene of basic helix-loop-helix transcription factor MyoD [J]. Mol Cell Biol, 2002, 22(20): 7066-7082.
Inhibitory effect of RNA interference of MSTN gene expression on the downstream genes inSchizopygopsispylzovi
KONG Qing-hui1, CHAO yan1, XIA Ming-zhe2, QI De-lin1*
(1.Animal Science Department of Agriculture and Animal Husbandry College, Qinghai University, Xining 810016, China;2.College of Eco-Environmental Engineering, Qinghai University, Xining 810016)
Objective To investigate the silencing effect of RNA interference onMSTNgene (myostatin, MSTN) expression, and detect the effects on the downstream genes inSchizopygopsispylzovi. MethodsTo construct the recombinant adenovirus vector 1P3 (DSP MSTN 273+250+1737) and 1P2 (DSP MSTN 195+ 1670) for RNA interference of theMSTNgene inSchizopygopsispylzovi, and to conduct the RNA interference in vivo experiment by injecting the vector into the muscle tissue ofSchizopygopsispylzovi. Real-time PCR and Western blotting were used to evaluate the silencing effects onMSTNgene expression, and to detect the regulatory function ofM-CKat gene transcription level after RNA interference of the MSTN gene. ResultsThe result of real-time PCR showed that compared with the HK team (Virus general negative control group) and N team (blank control group), the 1P3 had significant interference effect on theMSTNgene transcription inSchizopygopsispylzovi(P<0.05), with an inhibition rate of 53.5%, but the 1P2 had no significant interference effect on the MSTN gene transcription. The result of Western blotting was consistent with the results of real-time PCR. At the same time, after the 1P3 interference, the level ofMSTNgene transcription was declined, and the level ofM-CKgene expression was significantly increased. ConclusionsOur results demonstrate that the expression ofMSTNgene can be effectively suppressed, and the expression ofM-CKgene can be up-regulated through the RNA interference. Therefore, it proves thatMSTNgene can inhibit the transcription ofM-CKgene inSchizopygopsispylzovi, and reveals the regulatory role of MSTN gene in the muscle growth and development in the plateau fishSchizopygopsispylzovi.
Schizopygopsispylzovi; RNA interference; Myostatin; Creatine kinase; Expression
QI De-lin. E-mail: delinqi@126.com
国家自然科学基金项目(No. 31160226; No. 31460094 )。
孔庆辉 (1990-),女,在读硕士研究生,研究方向:基础兽医。 E-mail: kc1008611@163.com
祁得林,男,博士,教授;研究方向:动物分子遗传与生态学。 E-mail: delinqi@126.com
研究报告
Q95-33
A
1005-4847(2016)04-0344-07
10.3969/j.issn.1005-4847.2016.04.003
2016-01-08
