基于CRISPR/Cas9技术构建严重联合免疫缺陷小鼠
2016-09-13赵亚李红武师长宏张彩勤赵勇刘佩娟白冰唐娟白杰英张海
赵亚,李红武,师长宏,张彩勤,赵勇,刘佩娟,白冰,唐娟,白杰英,张海*
(1.第四军医大学实验动物中心,西安 710032;2.北京艾德摩生物技术有限公司,北京 101111;3.第四军医大学细胞工程中心,西安 710032; 4.军事医学科学院实验动物中心,北京 100071)
基于CRISPR/Cas9技术构建严重联合免疫缺陷小鼠
赵亚1,李红武2,师长宏1,张彩勤1,赵勇1,刘佩娟1,白冰1,唐娟3,白杰英4,张海1*
(1.第四军医大学实验动物中心,西安710032;2.北京艾德摩生物技术有限公司,北京101111;3.第四军医大学细胞工程中心,西安710032; 4.军事医学科学院实验动物中心,北京100071)
目的应用CRISPR/Cas9技术靶向敲除编码小鼠T、B细胞的Rag2基因及编码NK细胞的IL2rg基因,构建T、B细胞及NK细胞联合免疫缺陷小鼠。方法根据Genbank报道的Rag2及IL2rg基因序列,分别针对其外显子设计25 bp左右的sgRNA并进行合成, sgRNA退火后克隆入pX330载体。Rag2-sgRNA、IL2rg-sgRNA及Cas9重组质粒体外转录为mRNA后显微注射入BALB/c小鼠受精卵细胞,受精卵细胞移植到受体动物获得子代小鼠,首建鼠(F0)与野生型小鼠交配获得F1代小鼠,突变的F1代小鼠互交后筛选F2代纯合子小鼠。通过基因测序、流式细胞技术及接种人源性肿瘤细胞系方法检测子代小鼠基因型和表型。结果成功构建了Rag2-sgRNA、IL2rg-sgRNA重组质粒并对其进行了体外转录,mRNA显微注射并移植后获得57只F0小鼠。连续交配后,获得F2代纯合子小鼠。序列分析表明子代小鼠中IL2rg有两个基因型,分别是10 bp和11 bp的缺失突变;而Rag2只有一个基因型,为8 bp的缺失突变。与野生型BALB/c小鼠相比,小鼠外周血中CD3、B220及NKp46阳性细胞数量明显降低。接种人乳腺癌细胞系SKBR-2HL后,肿瘤生长良好,且随着时间延长肿瘤组织逐渐增大。结论利用CRISPR/Cas9技术可有效实现BABL/c小鼠体内Rag2、IL2rg基因突变,并导致小鼠T、B及NK细胞功能异常。
CRISPR/Cas9;基因敲除;免疫缺陷小鼠
1966年,研究者发现Foxn1基因突变后小鼠T细胞功能障碍,不能产生细胞特异性免疫反应,由此开辟了自发性免疫缺陷动物研究的先河[1]。随之B细胞缺陷的Beige小鼠、T细胞及B细胞联合缺陷SCID小鼠也相继被发现并在生物医学研究多个领域得到广泛应用[1]。尽管T细胞和/或B细胞功能障碍后形成的免疫缺陷小鼠在生物医学研究中取得了很多重大研究成果,但其体内残存的NK细胞、巨噬细胞、中性粒细胞等介导的先天性免疫应答反应仍然会对移植物产生免疫排斥反应,从而影响肿瘤在其体内存活。近年来,研究者进行了许多努力,试图找到免疫缺陷程度更高、免疫包容性更强的实验用小鼠以替代裸鼠或SCID小鼠。随着体外同源重组技术和胚胎干细胞技术的不断完善,尤其是随着TALEN技术和CRISPR/Cas9技术的诞生使得这种可能成为现实[3]。
Rag2(recombination activating gene 2)基因缺失或突变后,阻滞T细胞和B细胞发育,从而影响T细胞和B细胞功能[4]。而IL2rg(interleukin 2 receptor gamma chain)基因与NK细胞功能有关,当其缺失或突变后,NK细胞功能发生障碍[5]。本研究以CRISPR/Cas9技术为基础,分别设计针对Rag2和IL2rg基因的sgRNA,体外转录后与Cas9 mRNA共同显微注射BALB/c小鼠受精卵以期获得T细胞、B细胞及NK细胞功能联合缺陷的基因修饰动物。
1 材料与方法
1.1材料
120只SPF级BALB/c 小鼠和ICR小鼠,6~8周龄,雌雄各半,由第四军医大学实验动物中心提供[SCXK(陕)2014-002],饲养于该单位屏障设施[SYXK(陕)2014-001]。RNA体外转录试剂盒购自Ambion公司,DNA凝胶回收试剂盒购自天根生物科技有限公司。LongAmp Taq DNA聚合酶由NEB公司提供。小鼠FITC-CD3、PE-NKp46及APC-B220抗体由Biolegend公司提供。鼠尾基因组DNA提取试剂盒购自于成都福际生物技术有限公司。
1.2方法
1.2.1寡核苷酸合成及质粒构建
根据Genbank报道的Rag2(NM_009020)和IL2rg(NM_013563)基因序列,应用http://crispr.mit.edu/网站工具进行分析,分别针对IL2rg基因第1外显子和Rag2基因第2外显子设计两个各25 bp左右的sgRNA用于基因打靶(图1,下划线为靶序列,大写为PAM区)。sgRNA合成后退火,以T4连接酶克隆入经BbsI酶切线性化的pX330载体,构建含有sgRNA的pX330重组质粒。测序正确后,扩大培养并提取质粒用于体外转录模板。
1.2.2体外转录
以pX330-Rag2-sgRNA和pX330-IL2rg-sgRNA重组质粒为模板,PCR法克隆含T7启动子的Rag2-sgRNA和IL2rg-sgRNA。相同方法克隆Cas9基因,纯化后回收,DNA溶于DEPC水中保存。分别取200 ng的Rag2-sgRNA、IL2rg-sgRNA及Cas9纯化后产物进行体外转录,定量后-80℃保存。
1.2.3mRNA显微注射及受精卵细胞移植
8周龄BALB/c小鼠雄性与雌性小鼠使用前一天合笼,24 h后取见栓的雌性小鼠解剖,在输卵管部位获取受精卵细胞。分别取已转录好的20 μg/μL Rag2-sgRNA及10 μg/μL IL2rg-sgRNA和5 μg/μL Cas9 mRNA混合,以Eppendorf NK2显微注射仪注射到受精卵细胞胞质中。受精卵细胞在37℃ 5% CO2培养箱中继续培养2~3 h,取生长状态良好,发育至2细胞期受精卵细胞移植到ICR假孕鼠输卵管部位。
1.2.4基因敲除小鼠品系建立及基因型鉴定
取出生1周左右的F0代小鼠尾组织,裂解后以试剂盒提取小鼠基因组DNA,PCR方法克隆F0代小鼠Rag2和IL2rg基因。PCR反应条件为:94℃预变性3 min,94℃变性30 s,50℃退火40 s,65℃延伸40 s,共进行35个循环。循环结束后以65℃延伸6 min。取10 μL PCR产物进行电泳,大小正确后进行测序。突变的F0代小鼠与野生型小鼠交配,获得F1代杂合子小鼠,F1代杂合子小鼠互交即可获得双基因突变的纯合子小鼠。
1.2.5流式细胞术鉴定小鼠表型
通过剪尾方法取50 μL F0代小鼠外周血,红细胞裂解液裂解后以FACS缓冲液洗脱,加入1∶1000稀释的FITC-CD3、PE-NKp46及APC-B220抗体室温避光染色30 min。FACS缓冲液洗脱后上机检测小鼠外周血白细胞中CD3、B220及NKp46的表达情况。
1.2.6肿瘤移植模型鉴定小鼠表型
SKBR-2HL人乳腺癌细胞培养至对数生长期,消化后取1×107个细胞接种至4周龄 F0代小鼠腹外侧皮下,接种肿瘤细胞的F0代小鼠继续饲养3周,期间在不同时间观察瘤体大小。
2 结果
2.1质粒构建及RNA转录
根据Genbank报道的Rag2和IL2rg基因序列,分别针对Rag2基因第2个外显子及IL2rg基因第1个外显子设计具有靶向作用的sgRNA,sgRNA序列见表1。sgRNA合成后经退火,连入pX330载体,构建含有sgRNA的pX330重组质粒。质粒小提并经测序后表明质粒构建正确。sgRNA及Cas9克隆后,在T7启动子作用下进行体外转录,转录产物经电泳鉴定后为单一条带,且A260/280>1.9,A260/230>2.3。

表1 sgRNA靶点及寡核苷酸序列
2.2基因敲除小鼠品系的建立及基因型鉴定
共收集BALB/c小鼠胚胎数740枚,其中609枚为受精卵细胞,显微注射后有249枚存活,移植到ICR受体鼠后制备F0代首建鼠。测序后取F0代突变小鼠与野生型BALB/c小鼠交配获得F1代小鼠,突变的F1代小鼠互交后获得Rag2和IL2rg双基因突变的F2代纯合子小鼠。F0、F1及F2代小鼠出生约1周后,剪取小鼠尾尖3~5 mm组织用于基因组DNA提取。取1 μL DNA为模板进行PCR反应,1% 凝胶电泳鉴定后发现Rag2基因片段大小为821 bp,IL2rg片段大小为686 bp,与预期大小相符(图2A)。测序结果表明F0、F1及F2代小鼠IL2rg基因有两个突变型,分别是10 bp和11 bp的缺失突变;而Rag2基因只有一个突变型,为8 bp的缺失突变(图2B)。
2.3基因敲除小鼠表型鉴定
突变小鼠尾尖处取血50 μL进行流式分析。与正常野生型小鼠比较,基因敲除小鼠CD3+T细胞、B220+B细胞及NKp46+NK细胞数量下降明显(图3A),表明CRISPR/Cas9技术对Rag2和IL2rg基因进行编辑后影响到这两个基因编码的生物学功能,导致T细胞、B细胞及NK细胞数量降低。进一步通过复制人肿瘤模型验证基因敲除小鼠生物学特性,人乳腺癌细胞SKBR-2HL分别接种3只基因敲除小鼠, 1周后可见肿瘤细胞在小鼠体内生长,且随着时间延长,肿瘤体积不断增大(图3B)。结合流式检测结果,我们认为Rag2和IL2rg基因敲除小鼠不仅T细胞、B细胞及NK细胞数量下降,而且其免疫功能缺陷,移植物可在其体内增殖。
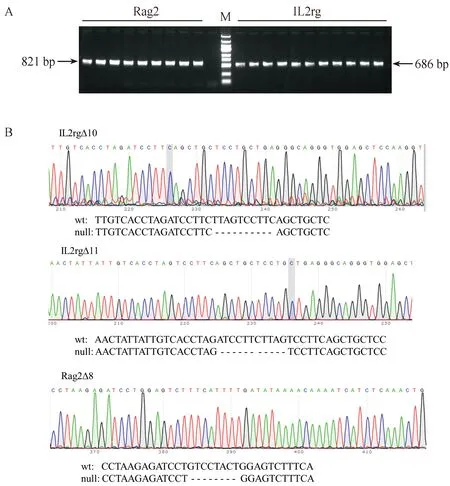
注:A. 突变小鼠PCR鉴定;B. 靶基因测序结果。图2 基因敲除小鼠基因型鉴定Note. A. PCR identification of the mutant mice. B. Sequence results of the target geneFig.2 Identification of the genotype of knockout mice
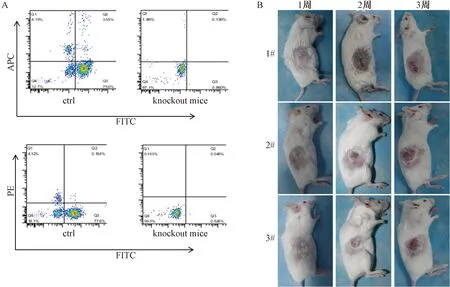
注:A.流式细胞检测T细胞、B细胞及NK细胞数量; B.基因敲除小鼠接种SKBR-2HL细胞后肿瘤生长情况。图3 基因敲除小鼠表型鉴定Note.A:Flow cytometry to detect the T,B and Nk cells.B:Tumor growth of the knokout mice after implantation of SKBR-2HL cells.Fig.3 Identification of the phenotype of the knockout mice
3 讨论
BALB/c小鼠由于其生物学特性明确,是目前免疫学、微生物学等研究领域常用的近交系小鼠。nude基因导入BALB/c小鼠后可培育成传统的免疫缺陷小鼠品系BALB/c-nu/nu,该类小鼠T细胞缺陷,因而T细胞介导的细胞免疫功能严重下降[6]。但该类小鼠B细胞及其他免疫细胞正常,这些细胞介导的免疫反应常会影响动物模型复制效果。如人类肿瘤模型复制时,一些人类肿瘤模型难以在BALB/c-nu/nu裸鼠中建立,除过肿瘤细胞致瘤性外,BALB/c-nu/nu裸鼠免疫细胞状态也是影响肿瘤模型复制的关键因素之一。为了克服以上弊端,有必要研究出免疫缺陷程度更高、免疫包容性更强、且遗传背景来源于BALB/c小鼠的动物用于免疫学、微生物学、肿瘤学等领域研究。基于此目的,本研究以BALB/c小鼠为对象,通过CRISPR/Cas9技术对其进行遗传修饰,研究制备出免疫缺陷程度更高的BALB/c小鼠。
超数排卵是获取受精卵细胞的常用技术方法,但BALB/c小鼠对PMSG和hCG不敏感,难以用这两种激素对其进行超排[7]。本研究中我们采用8周龄 BALB/c雌性小鼠与7周龄雄性小鼠进行自然交配,尽管在交配前挑取雌性发情小鼠,但获取小鼠受精卵细胞数量仍然很低,平均每只小鼠只能收获2个细胞,因此在以后研究中需摸索出最佳交配条件以提高BALB/c小鼠卵细胞收集率。收集的卵细胞生长状态良好,740枚卵细胞中有609枚为受精卵细胞,受精率82%,显微注射后有249枚受精卵细胞存活,存活率为41%,移植到12只ICR受体鼠后出生57只F0代首建鼠,每只小鼠平均产仔4.8只。这些数据表明尽管通过自然交配方式获取BALB/c小鼠卵细胞数量少,但这种方式获取的受精卵细胞能完全满足基因修饰动物的构建。
传统基因敲除主要是应用同源重组原理通过插入突变和基因靶向技术使目的基因功能丧失,但这些方法对技术要求高,制作周期长,只能在一些专业实验室才能完成。CRISPR/Cas9技术就是利用sgRNA与同源性的DNA能特异性结合的原理,sgRNA发挥靶向作用,引导核酸内切酶Cas9 在靶点处进行切割,从而达到基因修饰的目的[8]。因此与特定位点同源的sgRNA和核酸内切酶Cas9是CRISPR/Cas9技术中不可或缺的两个要素。Rag2和II2rg基因序列分析表明,这两个基因紧邻其上、下游分子,且有部分重叠,如对其进行大片段缺失突变将会影响到上、下游分子表达。针对这种情况,本研究以Rag2和II2rg基因外显子为靶点进行小片段突变,这种突变不仅可导致Rag2和II2rg基因功能失活,而且也对其上、下游基因表达无明显影响。与传统基因敲除方法相比,CRISPR/Cas9技术具有快速、可靠及敲除效率高等特点,本研究采用CRISPR/Cas9技术一步敲除了两个不同基因,敲除后T细胞、B细胞及NK细胞不仅数量下降明显,而且细胞功能也发生障碍,接种人乳腺癌细胞系后肿瘤细胞生长良好,表现出与传统免疫缺陷动物相似的生物学特性。
[1]Baxter RM, Brissette JL. Role of the nude gene in epithelial terminal differentiation [J]. J Invest Dermatol, 2002, 118(2): 303-309.
[2]Romano R, Palamaro L, Fusco A, et al. From murine to human nude/SCID: the thymus, T-cell development and the missing link [J]. Clin Dev Immunol, 2012, 2012: 467101.
[3]Pattanayak V, Guilinger JP, Liu DR. Determining the specificities of TALENs, Cas9, and other genome-editing enzymes [J]. Methods Enzymol, 2014, 546: 47-78.
[4]Lavender KJ, Pang WW, Messer RJ, et al. BLT-humanized C57BL/6 Rag2-/-gammac-/-CD47-/-mice are resistant to GVHD and develop B- and T-cell immunity to HIV infection [J]. Blood, 2013, 122(25): 4013-4020.
[5]Chung YS, Son JK, Choi B, et al. Co-transplantation of human fetal thymus, bone and CD34(+) cells into young adult immunodeficient NOD/SCID IL2Rgamma(null) mice optimizes humanized mice that mount adaptive antibody responses [J]. Clin Immunol, 2015, 157(2): 156-165.
[6]Croy BA, Linder KE, Yager JA. Primer for non-immunologists on immune-deficient mice and their applications in research [J]. Comp Med, 2001, 51(4): 300-313.
[7]Luo C, Zuniga J, Edison E, et al. Superovulation strategies for 6 commonly used mouse strains [J]. J Am Assoc Lab Anim Sci, 2011, 50(4): 471-478.
[8]杜建勇, 邓然, 高虹, 等. 一种gRNA快速合成及检测方法的建立 [J]. 中国实验动物学报, 2015, 23(03): 267-271.
Construction of severe combined immunodeficiency mice based on CRSIPR/Cas9 technology
ZHAO Ya1, LI Hong-wu2, SHI Chang-hong1, ZHANG Cai-qin1, ZHAO Yong1,LIU Pei-juan1, BAI Bing1, TANG Juan3, BAI Jie-ying4, ZHANG Hai1*
(1. Laboratory Animal Center, Fourth Military Medical University, Xi’an 710032, China;2. Beijing IDMO Co., Ltd, Beijing 101111; 3. Cell Engineering Research Center, Fourth Military Medical University, Xi’an 710032; 4. Laboratory Animal Center, Academy of Military Medical Sciences, Beijing 100071 )
ObjectiveTo knockout Rag2 and IL2rg genes and construct severe combined immunodeficiency mice based on CRISPR/Cas9 technology. MethodDesign and synthesis of 25 bp sgRNA were made according to the Rag2 and IL2rg sequences in Genbank. After annealing, sgRNA was cloned into pX330 vector. Recombination plasmid Rag2-sgRNA, IL2rg-sgRN and Cas9 were then transcribed into RNA, these RNA were microinjected into zygotes and the zygotes were transplanted into recipient ICR mice. F0 founders were born and mutated F0 founders mated with wild type mice to obtain F1 generation heterozygous mice. Mutated F1 mice were crossed and got F2 generation homozygous mice. Genotype and phenotype of the knockout mice were identified by sequencing, flow cytometry and xenograft model. ResultsRag2-sgRNA and IL2rg-sgRNA recombination plasmids were constructed and transcribed into RNA. After microinjection and mating, F0 founders were born and F2 homozygous mice were obtained. The results of sequencing showed that there were two types of genotype in IL2rg gene, 10 bp or 11 bp deletion; however, there was only one genotype in Rag2 gene, which was 8 bp deletion. Compared with wild-type BALB/c mice, the number of CD3+, B220+and NKp46+cells in peripheral blood of the knockout mice was reduced significantly. After inoculation of human breast cancer cell line SKBR-2HL cells, tumor size in the xenograft mouse model was increased gradually along with time extension. Conclusion CRISPR/Cas9 is an efficient way to mutate Rag2 and IL2rg gene in miceinvivo, leading to aberrant T cells, B cells and NK cells.
CRISPR/Cas9; Knockout; Severe combined immunodeficiency mice
ZHANG Hai. E-mail: hzhang@fmmu.edu.cn
军队重点研究课题(NO:BWS14J058); 国家自然科学基金面上项目(NO:81272385);陕西省科技资源统筹项目(NO:2014FWPT-11)。
赵亚(1988-),女,技术员。研究方向:动物模型。E-mail: 1587041791@qq.com
张海(1971-),副教授,研究方向:动物模型。E-mail: hzhang@fmmu.edu.cn
研究报告
Q95-33
A
1005-4847(2016)04-0339-05
10.3969/j.issn.1005-4847.2016.04.002
2016-05-06
