Pin1在皮肤组织中的表达以及可诱导转基因小鼠模型的建立
2016-09-13向建陈鹏张莉卢坤平廖新化
向建,陈鹏,张莉,卢坤平,3*,廖新化*
(1. 福建医科大学癌症和神经退行性疾病转化研究省重点实验室,福建医科大学转化医学研究院,福州 350108;2.福建医科大学消化道恶性肿瘤教育部重点实验室,福州 350108;3.哈佛医学院Beth Israel Deaconess 医学中心,医学系和肿瘤中心,转化治疗部,马萨诸塞州 02215 美国)
Pin1在皮肤组织中的表达以及可诱导转基因小鼠模型的建立
向建1,2,陈鹏1,2,张莉1,2,卢坤平1,2,3*,廖新化1,2*
(1. 福建医科大学癌症和神经退行性疾病转化研究省重点实验室,福建医科大学转化医学研究院,福州350108;2.福建医科大学消化道恶性肿瘤教育部重点实验室,福州350108;3.哈佛医学院Beth Israel Deaconess 医学中心,医学系和肿瘤中心,转化治疗部,马萨诸塞州02215 美国)
目的观察Pin1在皮肤中的表达情况,构建Pin1在皮肤中可诱导表达的转基因小鼠模型。方法将小鼠Pin1基因克隆到改造过的可与Myc标签蛋白融合的pTRE2载体中,并将线性化的DNA通过显微注射的方式构建TRE-Pin1小鼠。结果成功获得TRE-Pin1转基因首建鼠,该小鼠与上皮特异的K14-rtTA转基因小鼠配繁,获得Pin1在皮肤上皮特异性可诱导表达的双转基因鼠;通过将多西霉素(又名强力霉素,Doxycycline)加入饮水的方式诱导Pin1基因的表达,并通过Western blot,免疫组织化学等方式证明了Pin1蛋白在皮肤上皮中能特异性地过表达。我们还发现内源的Pin1在皮肤中主要表达于上皮细胞。结论成功构建了Pin1在皮肤中可诱导表达的转基因小鼠模型,为后续研究Pin1在皮肤中的功能奠定基础。
Pin1;多西霉素;转基因小鼠;Tet-on,皮肤
肽脯氨酰顺反异构酶(peptidyl-prolylcis/transisomerase,PPIase)Pin1通过特异地结合并催化磷酸化的Ser-Pro(丝氨酸-脯氨酸)或者Thr-Pro(苏氨酸-脯氨酸)的顺反异构,调控一系列蛋白质的活性、稳定性、亚细胞定位、磷酸化水平、与其他蛋白质的相互作用等[1]。Pin1通过调控底物蛋白质进而调控多种细胞功能,包括细胞周期和细胞增殖、胁迫应答、神经功能以及免疫反应等[1]。
Pin1调控精原细胞的维持[2]、神经干细胞的分化[3]、牙髓干细胞的分化[4]、心脏前体细胞的增殖和衰老[5]等。Pin1在多种癌症类型中都发现有上调[6]。Pin1调控乳腺干细胞的干细胞性、增殖和数量;Pin1还调控乳腺癌干细胞的增殖能力、侵染能力、上皮-间质转化(epithelial-mesenchymal transition,EMT),促进乳腺癌干细胞的致瘤能力[7-8]。
乳腺也是在胚胎期由单层上皮细胞内陷而成,它在发育和致病的分子机理在相当程度上与皮肤相似[9]。Pin1全身敲除小鼠显示出早衰和皮肤萎缩的症状[10]。Pin1在皮肤照射紫外后高表达,抑制Pin1可以降低紫外照射导致的细胞增殖以及促进皮肤癌发生的COX-2蛋白质的表达[1112]。Pin1在皮肤梅克尔细胞癌[13]和部分皮肤鳞状细胞癌中高表达[6]。这些发现暗示Pin1在皮肤正常和疾病状态下可能扮演重要角色。
为了研究Pin1在皮肤干细胞和皮肤癌发生中的功能,我们利用Tet-on系统[14]构建可诱导皮肤组织特异性过表达Pin1的转基因小鼠模型,探索将多西霉素(又名强力霉素,Doxycycline)加入饮水的方式诱导Pin1表达,并通过Western blot,免疫组化等方式证明了Pin1在皮肤上皮中能特异地过表达。此小鼠模型的建立为进一步研究Pin1在皮肤中的功能奠定了基础,同时这一转基因鼠还可以与其他组织特异的工具小鼠杂交繁育,研究Pin1在其他组织中的功能。
1 材料与方法
1.1材料
pTRE2质粒,FVB/N背景的K14rtTA小鼠[15]来自于美国贝勒医学院Hoang Nguyen博士的馈赠。Pin1敲除小鼠来源本实验室[10]。Anti-Myc抗体来自于中科院生物化学与细胞生物学研究所周金秋博士的馈赠。本文所有小鼠均为FVB/N背景,均饲养在福建医科大学实验动物中心【SYXK(闽)2014-0003】,所有涉及的动物实验经过中心伦理委员会的批准[(2015)福医伦理审字第(27)号]。
DNA marker(3591A;Takara),小鼠尾巴基因型鉴定试剂盒TransDirect Animal Tissue PCR Kit(AD201-02,北京全式金生物技术有限公司),OCT冷冻切片包埋剂Sakura Tissue-Tek O.C.T. Compound(4583,美国樱花Sakura),多聚甲醛Paraformaldehyde(416780010,Thermo Fisher Scientific),PBS磷酸盐缓冲液(ZLI-9062,北京中杉金桥生物技术有限公司),Citrate抗原修复液(ZLI-9065,北京中杉金桥生物技术有限公司),anti-Pin1抗体(10495-1-AP,武汉三鹰生物技术有限公司),DAPI(D8417,Sigma), MaxVision TM HRP-Polymer anti-Mouse/Rabbit IHC Kit(kit-5010,福州迈新生物技术开发有限公司),DAB显色试剂盒(DAB0031,福州迈新生物技术开发有限公司),强力霉素(D9891,Sigma)。本文所用的引物序列见表1。
1.2方法
1.2.1转基因质粒的改造
包含3XMyc的互补长引物3MycF和3MycR在退火溶液中(10 mmol/L Tris, pH 7.5~8.0, 50 mmol/L NaCl, 1 mmol/L EDTA)混匀,95℃变性后放置在室温中自然复性。复性后的双链末端含有XbaI酶切位点的粘末端,与XbaI酶切后的pTRE2载体连接后获得含有3XMyc的载体pTRE2-Myc。插入片段通过测序验证其序列和方向正确。
1.2.2Pin1的克隆
以小鼠的皮肤cNDA为模板,用引物Pin1F和Pin1R扩增小鼠Pin1基因;PCR DNA产物经纯化后用BamHI和HindIII酶切后插入用相同酶切过的pTRE2-Myc载体,获得转基因质粒pTRE2-Pin1-Myc。Pin1 DNA插入片段通过测序验证DNA序列正确。
1.2.3转基因小鼠的构建
转基因动物载体DNA显微注射由南京大学模式动物研究所完成。pTRE2-Pin1-Myc质粒用XhoI和SapI内切酶酶切后回收目的DNA片段,该目的DNA通过原核显微注射的方式导入小鼠胚胎,最后将胚胎移植到代孕鼠,获得了TRE-Pin1的转基因首建鼠。

表1 引物序列表
1.2.4双转基因鼠的繁育
TRE-Pin1鼠与K14-rtTA工具鼠[15]杂合,获得K14-rtTA,TRE-Pin1的双转基因鼠。转基因鼠的基因型鉴定如下:剪取少量子代小鼠尾组织,用TransDirect Animal Tissue PCR Kit先后分别以55℃/0.5 h和95℃/3 min解裂鼠尾组织以提取全基因组DNA,K14-rtTA用引物对rtTA-F和 rtTA-R进行PCR扩增,TRE-Pin1用引物F1和R1,以及F2和R2进行PCR扩增,通过电泳所显示片段的有无和大小来鉴定子代小鼠的基因型。
1.2.5转基因鼠的诱导表达
分别以单转基因小鼠和双转基因小鼠为对照组和实验组,同时提供含有2 mg/mL强力霉素以及5%蔗糖的饮用水。诱导一定时间后,分别取0.05 g小鼠的皮肤组织,液氮研磨提取蛋白质,利用Western印迹方法检测目的蛋白的表达量。
1.2.6免疫组化
取小鼠皮肤组织置于4%的PFA中4℃固定过夜。第2天1×PBS清洗3次,后酒精梯度脱水与二甲苯透明,60℃石蜡包埋。组织以5 μm切片,40℃展片,60℃烤片1 h,二甲苯60℃脱蜡10 min,柠檬酸修复液微波修复15 min,室温冷却后置于3%的H2O2中处理5 min,封闭液封闭1 h,一抗孵育过夜。次日用相应的二抗室温孵育40 min,DAB显色,苏木素复染,脱水封片后在显微镜下观察。
2 结果
2.1Pin1在皮肤中的表达
Pin1全身敲除小鼠显示出早衰和皮肤萎缩的症状[10]。这提示Pin1在皮肤中有重要的调控功能。免疫组化的结果显示,Pin1主要表达在皮肤的上皮细胞中,包括毛囊间基底细胞和毛囊细胞中,而在真皮细胞中表达量较低(图1)。毛囊的皮脂腺中有比较强的染色信号,但是由于皮脂腺的油脂类通常有较强的非特异性结合,尚不能判断是否能代表皮脂腺有较强的Pin1表达(图1)。由于Pin1在皮肤上皮中有特异的过表达,推论它在上皮中有重要的调控功能。为了研究Pin1在皮肤的功能,我们着手构建Pin1在皮肤上皮特异性过表达的转基因鼠。
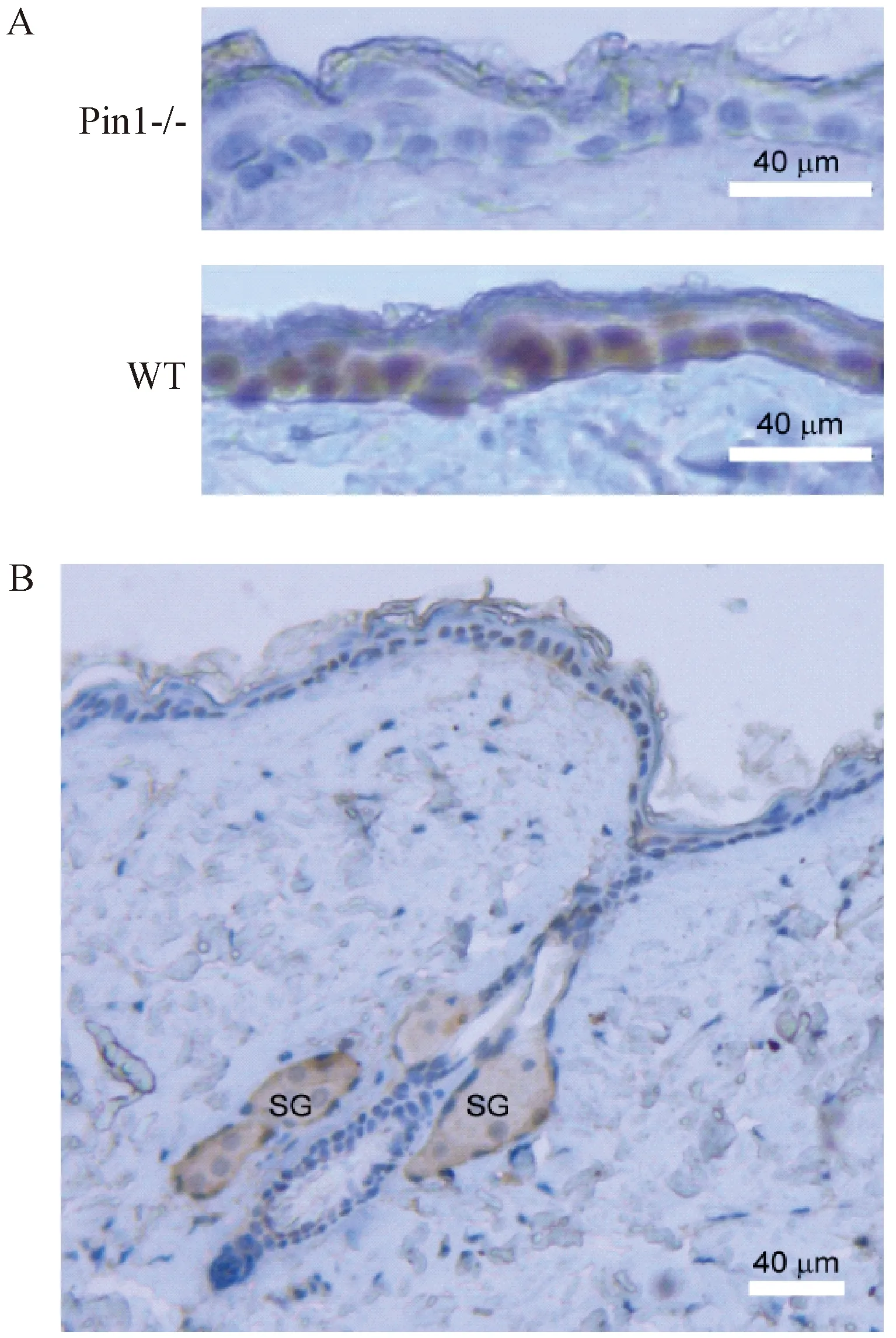
注:A. 取Pin1敲除和野生型的小鼠皮肤用Pin1抗体做免疫组化,结果显示Pin1抗体特异性很高。B. Pin1在皮肤和毛囊的表达情况。SG:皮脂腺。所用皮肤来源于7周龄的小鼠。图1 Pin1在正常小鼠皮肤组织的免疫组化检测Note. (A) Immunohistochemitry results of Pin1 knockout or WT mouse skins showed specificity of the Pin1 antibody. (B) Pin1 expression pattern in skin including hair follicle. SG:sebaceous gland; the skin was harvested from a 7-week old mouse.Fig.1 Immunohistochemical examination of Pin1 expression in normal mouse skin
2.2转基因质粒pTRE2-Myc的构建
在过表达基因时,同时要把外源过表达的蛋白与内源的蛋白区分开来,以分辨过表达的倍数。将3个重复的编码Myc的DNA序列通过引物双链合成、退火,插入到pTRE2的多克隆位点XbaI上,并加入了终止密码子,最后测序验证,构建了新的转基因载体pTRE2-Myc。这样,任何基因以同阅读框的方式克隆到该质粒上,都能在C端加上3XMyc标签蛋白(图2)。标签蛋白的加入不仅将外源过表达的蛋白与内源蛋白区分开来,还有利于进行后继的例如免疫共沉淀等生化实验。
2.3转基因小鼠TRE-Pin1的构建
以小鼠皮肤组织的cDNA为模板PCR扩增Pin1后克隆到改造后的转基因载体pTRE2-MycF,构建成功pTRE2-Pin1-Myc。该质粒用XhoI和SapI酶切后回收目的DNA片段。该目的DNA通过显微注射的方式导入FVB/N背景的小鼠胚胎,最后将胚胎移植到代孕鼠,子代小鼠出生后通过剪取小鼠尾巴做基因型鉴定,获得6只TRE-Pin1的首建鼠。部分鉴定结果见图3。
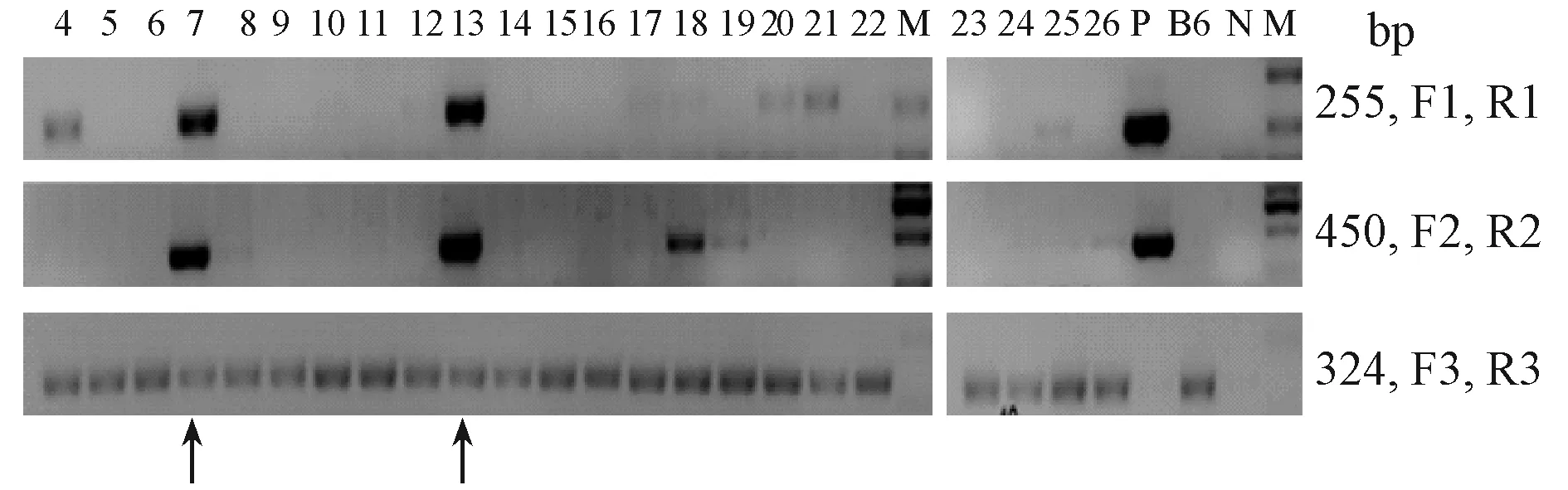
注:将小鼠尾部组织裂解后用不同引物对PCR扩增目的片段。其中F1和R1,F2和R2为Pin1转基因特异的引物对;F3和R3引物对扩增小鼠内源基因组DNA。箭头指向的7号和13号小鼠是Pin1转基因首建鼠。P,阳性对照;N,阴性对照;M,DNA Marker;B6,C57/B6小鼠的尾部基因组DNA。图3 转基因小鼠TRE-Pin1的基因型PCR鉴定。Note. The mouse tail lysates were used to PCR amplify the target DNA fragments with corresponding primer pairs. Primer pairs F1 and R1, F2 and R2 were used to detect transgenic Pin1 gene. F3 and R3 were used as PCR positive control to amplify endogenous genomic DNA sequence. The No. 7 and No. 13 mice pointed by arrows were founder mice. P, positive control; N, negative control; M, DNA marker; B6,C57/B6 mice.Fig.3 PCR genotyping of the TRE-Pin1 transgenic mice
2.4双转基因K14-rtTA,TRE-Pin1的构建
我们将TRE-Pin1首建鼠分别与上皮特异表达的FVB/N背景的K14-rtTA工具鼠杂合,通过剪取小鼠尾巴做基因型鉴定,获得K14-rtTA,TRE-Pin1的双转基因鼠。双转基因鼠杂合的原理见图4A,基因型鉴定的部分结果见图4B。

注:A.双转基因小鼠杂合和基因诱导的原理图。多西霉素与上皮特异表达的rtTA相互结合后作用于TRE元件,启动Pin1基因的表达。B. 双转基因鼠的基因型鉴定结果。箭头指向的是K14-rtTA,TRE-Pin1双转基因小鼠。图4 双转基因鼠的杂合和基因型鉴定Note. Schematic of transgenic mice mating and gene induction. (A) The rtTA protein is capable of binding the operator TRE element to induce Pin1 expression only if bound to tetracycline. (B) The genotyping results of double transgenic mice. The arrows point to the K14-rtTA,TRE-Pin1 double transgenic mice.Fig.4 Mating and genotyping of the double transgenic mice
2.5多西霉素对Pin1蛋白的诱导作用
在小鼠水中加入2 mg/mL的多西霉素诱导K14-rtTA,TRE-Pin1的双转基因鼠表达Pin1。由于多西霉素味苦,在饮水中同时添加5%的蔗糖以保证小鼠的正常饮水。多西霉素在水中不稳定且光敏感,在饮水瓶外包扎了避光的锡箔纸,并每3 d更换一次水,以保证水中的多西霉素的活性。
取诱导5周的小鼠皮肤用Western检测Pin1的内源和过表达蛋白。从结果可以看出,无论用Myc的抗体还是用Pin1的抗体都可以检测到外源Pin1的表达,其表达量大约为内源Pin1表达量的5倍以上,证明我们构建的转基因小鼠非常成功(图5A)。作为对照,单转基因小鼠K14-rtTA在用同样的多西霉素的诱导下检测不到Pin1-Myc外源蛋白的表达(图5A)。
虽然Western blot可以看到Pin1-Myc的过表达,但是无法看到Pin1是否在皮肤上皮表达。我们通过免疫组化技术观察到双转基因鼠经过诱导后在皮肤上皮中,包括毛囊间上皮细胞和毛囊细胞中大量过表达Pin1蛋白(图5B)。单转基因小鼠K14-rtTA的Pin1表达模式与野生型小鼠的表达模式类似(比较图5B和图1)。
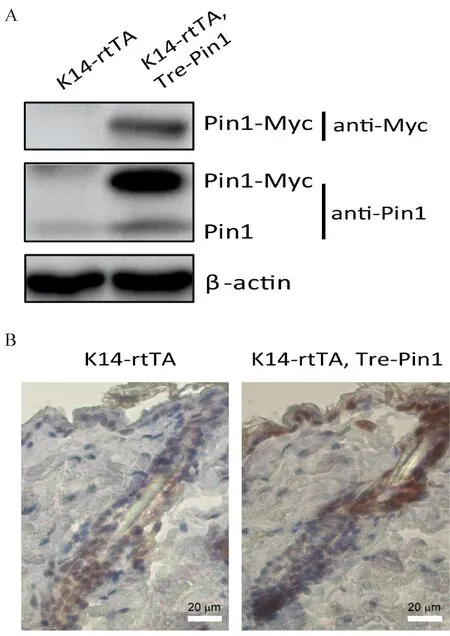
注: A. 小鼠饮用含有2 mg/mL多西霉素水5周,取小鼠的皮肤组织分别用Myc和Pin1的抗体做Western blot,显示出外源Pin1-Myc相较于内源Pin1有了显著的上调。B.同A,小鼠皮肤用免疫组化的方法显示双转基因小鼠Pin1在皮肤上皮组织中特异过表达。两张图中的曝光参数一致。单转基因和双转基因小鼠来源于11周龄同一窝小鼠。图5 双转基因鼠Pin1-Myc的诱导表达Note. (A) The doxycycline was dissolved in the mouse drinking water for Pin1 induction, and the mouse skin tissues were harvested after induction for 5 weeks. The Western blot result shows that Pin1-Myc was significantly induced in the transgenic mice compared with the control mice. (B) As in (A), Immunohistochemistry results showed that Pin1 is specifically overexpressed in epidermal cells in the double transgenic mice. The exposure parameters are the same for both pictures. Single or double transgenic 11-week old mice were obtained from the same liter.Fig.5 Induction of expression of Pin1-Myc in the double transgenic mice
3 讨论
基于四环素(Tet-based)诱导的小鼠基因表达系统(Tet-based)已经广泛地应用于实验研究中[16-18]。此系统利用多西霉素(doxycycline,四环素类似物,也称强力霉素)可逆地对目的蛋白表达进行自由地开和关,非常方便地在小鼠任何发育阶段观察小鼠的表型变化;而且对于基因的可控开关还有效避免了持续表达基因引起的转基因小鼠传代后的基因沉默[14]。
Pin1的全身敲除小鼠出现早衰和皮肤变薄的性状,但是由于其他器官的异常通过改变小鼠的营养状况等也能间接影响皮肤的表型,所以全身敲除小鼠的表型尚不能直接证明Pin1在皮肤中发挥重要功能。为了在皮肤中特异观察Pin1的功能,我们构建了组织特异的TRE-Pin1转基因鼠。此转基因小鼠与K14-rtTA工具小鼠杂交后获得了可在皮肤上皮中特异性地诱导表达的双转基因鼠。同理,TRE-Pin1与其他组织特异表达的rtTA工具鼠杂交,也可以获得其他组织特异过表达Pin1的双转基因鼠。这为研究Pin1在不同组织中的功能奠定了坚实的基础。
通过在饮水中添加多西霉素的方式,用Western blot和免疫组化的方法显示出Pin1在皮肤组织中特异地高表达,证明所构建的模型获得成功。未来我们将利用这个双转基因鼠模型进一步探讨Pin1在皮肤干细胞、皮肤代谢、皮肤损伤修复、毛发生长以及皮肤癌等的功能。
[1]Lu KP, Zhou XZ. The prolyl isomerase PIN1: a pivotal new twist in phosphorylation signalling and disease [J]. Nat Rev Mol Cell Biol, 2007, 8(11): 904-916.
[2]Atchison FW, Means AR. Spermatogonial depletion in adult Pin1-deficient mice [J]. Biol Reprod, 2003, 69(6): 1989-1997.
[3]Nakamura K, Kosugi I, Lee DY, et al. Prolyl isomerase Pin1 regulates neuronal differentiation via beta-catenin [J]. Mol Cell Biol, 2012, 32(15): 2966-2978.
[4]Lee YM, Shin SY, Jue SS, et al. The role of PIN1 on odontogenic and adipogenic differentiation in human dental pulp stem cells [J]. Stem Cells Dev, 2014, 23(6): 618-630.
[5]Toko H, Hariharan N, Konstandin MH, et al. Differential regulation of cellular senescence and differentiation by prolyl isomerase Pin1 in cardiac progenitor cells [J]. J Biol Chem, 2014, 289(9): 5348-5356.
[6]Bao L, Kimzey A, Sauter G, et al. Prevalent overexpression of prolyl isomerase Pin1 in human cancers [J]. Am J Pathol, 2004, 164(5): 1727-1737.
[7]Rustighi A, Zannini A, Tiberi L, et al. Prolyl-isomerase Pin1 controls normal and cancer stem cells of the breast [J]. EMBO Mol Med, 2014, 6(1): 99-119.
[8]Luo ML, Gong C, Chen CH, et al. Prolyl isomerase Pin1 acts downstream of miR200c to promote cancer stem-like cell traits in breast cancer [J]. Cancer Res, 2014, 74(13): 3603-3616.
[9]Mikkola ML, Millar SE. The mammary bud as a skin appendage: unique and shared aspects of development [J]. J Mammary Gland Biol Neoplasia, 2006, 11(3-4): 187-203.
[10]Lee TH, Tun-Kyi A, Shi R, et al. Essential role of Pin1 in the regulation of TRF1 stability and telomere maintenance [J]. Nat Cell Biol, 2009, 11(1): 97-105.
[11]Han CY, Hien TT, Lim SC, et al. Role of Pin1 in UVA-induced cell proliferation and malignant transformation in epidermal cells [J]. Biochem Biophys Res Commun, 2011, 410(1): 68-74.
[12]Quyen BT, Choi HK, Kang KW. Pin1 is required for ultraviolet A-stimulated cyclooxygenase-2 induction in mouse epidermal cells [J]. Cancer Lett, 2013, 335(1): 31-40.
[13]Van Keymeulen A, Mascre G, Youseff KK, et al. Epidermal progenitors give rise to Merkel cells during embryonic development and adult homeostasis [J]. J Cell Biol, 2009, 187(1): 91-100.
[14]Gossen M, Bujard H. Tight control of gene expression in mammalian cells by tetracycline-responsive promoters [J]. Proc Natl Acad Sci U S A, 1992, 89(12): 5547-5551.
[15]Nguyen H, Rendl M, Fuchs E. Tcf3 governs stem cell features and represses cell fate determination in skin [J]. Cell, 2006, 127(1): 171-183.
[16]Zhu Z, Zheng T, Lee CG, et al. Tetracycline-controlled transcriptional regulation systems: advances and application in transgenic animal modeling [J]. Semin Cell Dev Biol, 2002, 13(2): 121-128.
[17]杨国柱,陈系古. 基于四环素调控系统的ApoE-rtTA/TRE-HCV-C双转基因小鼠的制备 [J]. 中国实验动物学报, 2007, 15(5): 321-325.
[18]张成香,程言信, 薛整风. Tet-on诱导表达c-myc和SV40Tag的转基因小鼠肿瘤模型 [J]. 中国实验动物学报, 2008, 16(4): 277-281.
Pin1 expression in the skin and establishment of an inducible transgenic mouse model
XIANG Jian1,2, CHEN Peng1,2, ZHANG Li1,2, LU Kun-ping1,2,3*, LIAO Xin-hua1,2*
(1. Fujian Key Laboratory for Translational Research in Cancer and Neurodegenerative Diseases, Institute for Translational Medicine, Fujian Medical University, Fuzhou 350108, China; 2.Key Laboratory of Ministry of Education for Gastrointestinal Cancer, Fujian Medical University, Fuzhou 350108; 3.Division of Translational Therapeutics, Department of Medicine and the Cancer Center, Beth Israel Deaconess Medical Center,Harvard Medical School, MA 02215, USA)
ObjectiveTo observe the Pin1 expression pattern in skin and to establish an inducible skin specific Pin1 overexpression mouse model.MethodsThe mousePin1 gene was cloned into modified vectorpTRE2 with C-terminal Myc tag. The linearizedpTRE2-Pin1 DNA was micro-injected into one-cell embryos followed by implantation into foster mice to produceTRE-Pin1 transgenic mice. ResultsTRE-Pin1 transgenic founder mice were successfully created. These mice were crossed with transgenic tool miceK14-rtTAto create epithelial specific double transgenic progenies.Pin1 gene was induced by incorporating doxycycline into drinking water of the mice. Pin1 protein overexpression in the skin was confirmed by Western blot and immunohistochemistry. The endogenous Pin1 protein was predominantly expressed in epidermal cells in the skin. ConclusionsThe inducible skin specific Pin1 overexpression mouse model is successfully established which may serve as a useful model for further study of Pin1 functions in the skin.
Pin1, Doxycycline, Transgenic mice, Tet-on, Skin
LIAO Xin-hua, Email: xinhualiao@foxmail.com; LU Kun Ping, Email: klu@bidmc.harvard.edu
国家自然科学基金(编号:81573029);福建省自然科学基金(编号:2015J01312);福建省2011计划干细胞转化医学协同创新中心。
向建(1989-),男,硕士研究生,E-mail:xiangjianyl@foxmail.com
廖新化,教授,E-mail:xinhualiao@foxmail.com;卢坤平,教授,E-mail: klu@bidmc.harvard.edu
研究报告
Q95-33
A
1005-4847(2016)04-0333-06
10.3969/j.issn.1005-4847.2016.04.001
2016-04-07
