加压运动对羊骨髓间充质干细胞增殖、分化的影响
2016-09-13杨玉辉孙绍骞佐藤义昭刘吉平王宗强
杨玉辉,孙绍骞,佐藤义昭,刘吉平,张 军,王宗强*
(1.吉林大学中日联谊医院,吉林 长春130033;2.日本加压运动学会,日本加压医疗学会;3.东方朝日运动发展(北京)有限公司)
加压运动对羊骨髓间充质干细胞增殖、分化的影响
杨玉辉1△,孙绍骞1,佐藤义昭2△,刘吉平3,张军3,王宗强1*
(1.吉林大学中日联谊医院,吉林 长春130033;2.日本加压运动学会,日本加压医疗学会;3.东方朝日运动发展(北京)有限公司)
目的探索加压运动对羊骨髓间充质干细胞增值、分化的影响。方法将60只波尔山羊随机分成实验组和对照组,实验组每周进行2次加压运动,对照组非加压下运动,6个月后获取羊骨髓,然后采用percoll密度梯度离心法分离并吸取上中层界面间以单个核细胞为主的白色云雾层进行培养,观察细胞形态和增殖速率;两组细胞均用5-氮杂胞苷诱导其定向分化为心肌样细胞,对诱导后的细胞进行免疫荧光检测细胞上心肌特异性抗原a-actin表达情况。结果从骨髓中分离出的白色云雾层中的细胞能贴壁、能传代且生长状态良好。此外,经过5-氮杂胞苷诱导后细胞均表达心肌细胞特异性抗原。实验组骨髓间充质干细胞在培养过程中细胞多呈小而圆的形态,且增殖速率比对照组骨髓间充质干细胞快,而对照组细胞多呈多角形或梭形且增殖速率相对较慢。结论成功的分离并培养了骨髓间充质干细胞,并在体外成功诱导了骨髓间充质干细胞向心肌样细胞的分化。长期处于加压运动条件下的骨髓间充质干细胞比非加压运动条件下更倾向于增殖,而分化能力相对弱一些。
加压运动;骨髓间充质干细胞;增殖;分化
(ChinJLabDiagn,2016,20:1240)
骨髓间充质干细胞 (BMSCs)是中胚层来源的具有高度增殖、自我更新的能力及多向分化潜能的多能干细胞。进一步研究证明骨髓间充质干细胞体外还可以向心肌、神经元、神经胶质细胞分化[1],体内移植后可以迁移至损伤部位(多数为缺血、缺氧的环境)修复相应的组织。细胞移植治疗为不可逆性心脏疾病提供了全新的治疗策略[2],骨髓间充质干细胞目前被认为是一类最理想的进行细胞移植治疗的种子细胞[3],常被用作基因治疗的载体细胞[4,5]。异体骨髓间充质干细胞移植会产生免疫排斥反应。自体血干细胞数量有限,如何促进自体骨髓间充质干细胞的增殖并释放入血就变得至关重要,尤其是大型哺乳动物,近几年关于鼠、兔等小型动物骨髓间充质干细胞的研究较多[6,7],对大型动物羊的骨髓间充质干细胞的研究报道还较少[8],因此对大型动物羊骨髓间充质干细胞体外如何更好诱导其定向分化的研究具有重要意义。
1 材料与方法
1.1实验材料
实验动物:健康波尔山羊;5-氮杂胞苷 (sigma,美国),一抗:鼠源抗α骨骼肌肌动蛋白抗体(anti alpha skeletal muscle actin antibody) (abcam,英国),二抗:驴抗小鼠免疫球蛋白g (Dylight 488 affinipure donkey anti-mouse IgG(H+L))(EarthOx,llc,美国),0.25%胰酶(GIBCO,美国),IMDM (GIBCO,美国),胎牛血清(Hyclon,美国)
1.2方法
1.2.1加压运动选取24-30月龄健康波尔山羊60只,体重在30-35 kg,随机分成实验组和对照组,每组30只。采用日本佐藤义昭先生发明的KAATSU加压运动设备将实验组山羊左侧后肢根部绑缚加压带,压力范围60-100 mmHg,压力值上限以不引起山羊跛行为准。两组山羊每周进行两次行走训练,每次持续15 min,其余时间统一圈养,饮食无差别。
1.2.2取羊骨髓,分离培养骨髓间充质干细胞 6个月后无菌条件下取羊左后肢股骨及胫骨,剖开骨干,用IMDM培养液冲出骨髓。分离出的骨髓用1.082 g/ml比重的 Percoll 细胞分离液,500×g/min 速度下密度梯度离心 25 min,取中间单核细胞层,用0.01M PBS充分洗涤,加入培养基制成单细胞悬液;计数,按 1.0×106/ml 浓度接种于完全培养基(含体积分数为10%FBS的IMDM和青、链霉素各 100 U/ml)中。置于37℃细胞培养箱中培养,24 h后去除非贴壁细胞,每3天换液 1 次。
1.3羊骨髓间充质干细胞传代培养
待细胞达80%-90%融合后,加入PBS洗一遍后,用浓度为0.25% 胰蛋白酶在37℃条件下消化细胞,待细胞形态开始皱缩,用含10%胎牛血清的IMDM培养基终止消化,移入离心管,1 200 r/min离心5 min后,传至两皿中继续培养,约每3天换液一次,直至贴壁细胞接近80%-90%融合,再重复上述操作,反复传代扩增。
1.4生长曲线
骨髓间充质干细胞用含10% 胎牛血清的IMDM培养基培养,每隔24 h 在倒置显微镜下观察并进行计数,每个样品测3次,取平均值,分别计算实验组和对照组所有样品平均值的均数。连续观察12 d以存活细胞数(万/ml) 对培养时间(d) 作图,即得生长曲线。
1.5诱导羊骨髓间充质干细胞向肌源细胞定向分化
取培养至第二代的羊骨髓间充质干细胞,加入10 μ mol/L 5-氮杂胞苷诱导24 h后,更换新的含10% FBS的IMDM培养基,培养14 d后,免疫荧光法检测心肌细胞特异性抗原a- actin表达情况.
1.6免疫荧光实验
取来诱导后的细胞弃去培养液,用4%甲醛室温固定30 min后用磷酸盐缓冲液洗3次,每次15 min;然后用1% (vol/vol) Triton配成含5% (wt/vol) BSA抗体稀释液,用抗体稀释液1∶100比例稀释鼠源抗a- actin抗体,将稀释好的抗体加到细胞中,4度孵育过夜;第二天用磷酸盐缓冲液洗3次,每次15 min。再用抗体稀释液1∶200比例稀释二抗(驴抗小鼠免疫球蛋白g),将二抗加到细胞中室温避光孵育1 h,再用磷酸盐缓冲液洗3次,每次15 min,然后用5%甘油封片,置于荧光显微镜下观察。
2 结果
2.1实验过程中实验组和对照组分别有9只、10只羊因为疾病死亡而脱落,实际严格完成实验的羊分别是实验组21只、对照组20只。
2.2羊骨髓形态学特征和加压运动对骨髓间充质干细胞分化的影响
骨髓间充质干细胞在培养48 h内贴壁,细胞形态不一、呈圆形和梭形,随着培养时间延长,细胞形态以梭形居多,细胞增长速度较快,3-5 d传代一次。实验组和对照组的骨髓间充质干细胞同样条件进行培养,随着培养时间延长,细胞间形态差异逐渐增大,培养第12 d时显微镜下观察,发现实验组更多比例的细胞呈圆形,而对照组圆形细胞比例较少,大部分细胞呈梭形,见图1。
2.3生长曲线
计数结果显示,培养第1-2 d时细胞数目没有变化为增殖潜伏期,第3-9 d细胞数目快速增加,进入指数生长期,在9-12 d细胞数目增长缓慢,见图2。
2.4免疫荧光检测心肌特异性抗原表达情况
经5-氮杂胞苷诱导24 h后培养14 d时免疫荧光染色发现,细胞呈纤维性,且均呈绿色,表明经诱导后的细胞均强表达心肌细胞特异性抗原α-actin,提示羊骨髓间充质干细胞正处于或已完成向心肌样细胞分化过程,见图3。

图1 实验组和对照组的骨髓间充质干细胞培养第12天的形态图(X 4倍)
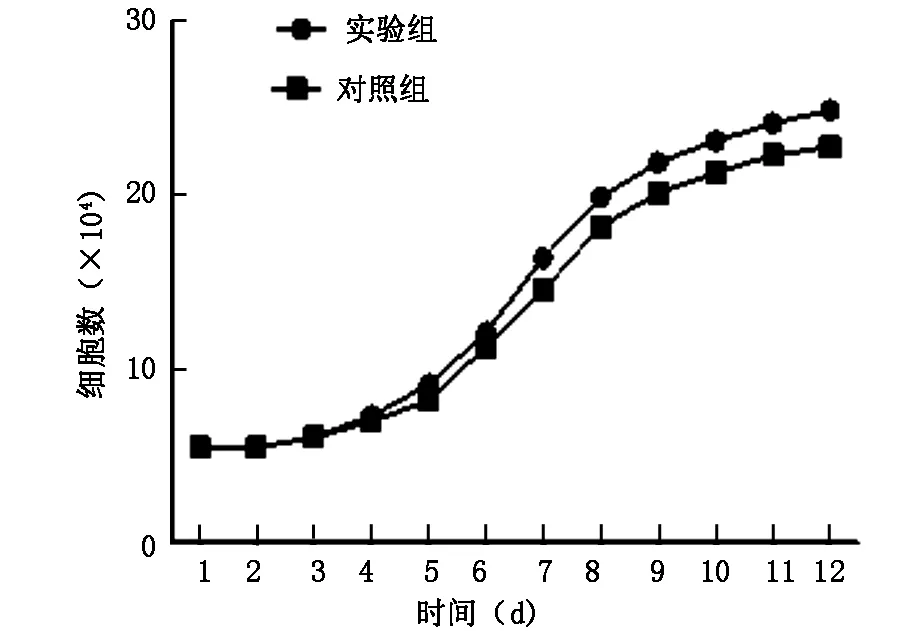
图2 实验组和对照组羊骨髓间充质干细胞的生长曲线图
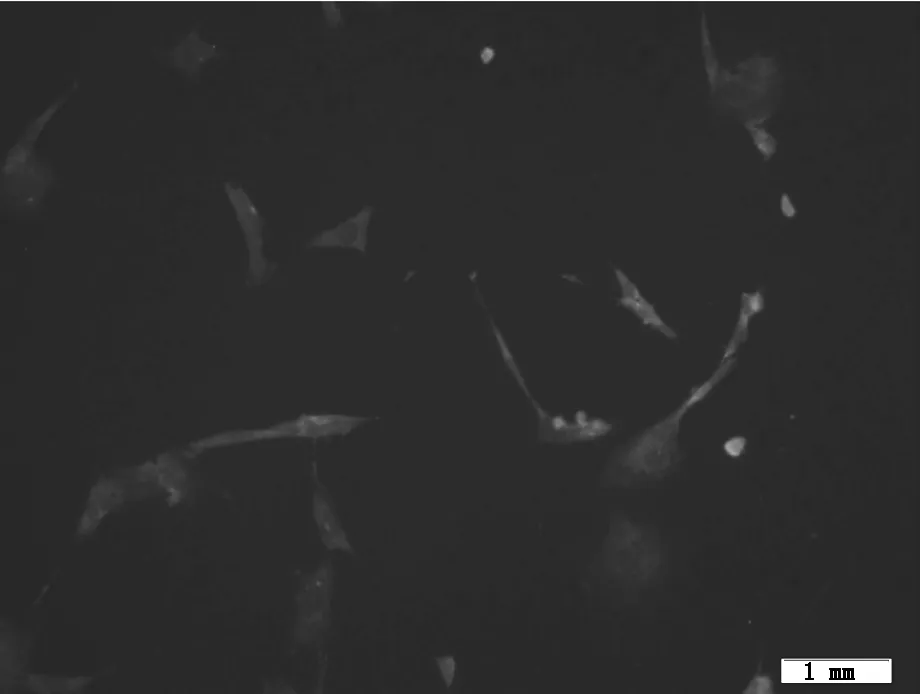
图3 骨髓间充质干细胞经5-氮杂胞苷诱导14天后免疫荧光检测图 (X 40倍)
3 讨论
从羊骨髓中分离提取的细胞,能贴壁,且能传代,并且在适宜的条件下诱导能定向分化,提示已经成功培养羊骨髓间充质干细胞。羊骨髓间充质干细胞在5-氮杂胞苷诱导下表达出心肌特异性抗原α-actin,提示骨髓间充质干细胞正处于或已完成向心肌样细胞分化,对于骨髓间充质干细胞经5-氮杂胞苷诱导后向心肌样细胞分化的机制还不明确,目前研究认为:5-氮杂胞苷是一种去甲基化药物,能够引起DNA 中某些胞嘧啶去甲基化,从而诱导 BMSCs 向心肌细胞分化[9,10]。上述实验结果表明羊骨髓间充质干细胞在体外培养时表现出较高的增殖速率和定向分化的潜能,为大型动物的骨髓间充质干细胞在体外在适宜的条件下诱导其定向分化提供了一定的可行性,为其在动物医学和人类医学的临床应用提供参考。此外,另有研究表明羊骨髓间充质干细胞免疫原性弱,且易于外源基因的导入和表达,因而在组织工程、细胞和基因治疗等领域得到广泛的应用,羊与其它哺乳动物如人、牛、兔、大鼠等类似,对于以后利用羊骨髓间充质干细胞作转基因克隆供体细胞的选择及胚胎发育的研究奠定了基础,将成为具有广阔应用前景的一类成体干细胞。同时发现实验组和对照组的骨髓间充质干细胞在培养过程中出现了生长形态上的差异,实验组的骨髓间充质干细胞经多次传代培养后形态上多呈小而圆形,与刚从骨髓中分离的原代细胞形态更接近,更倾向于增殖。骨髓间充质干细胞主要来源于骨髓,骨髓是一典型的低氧环境,同时实验组动物经过加压运动造成了一种低氧代谢的状态。缺氧条件下可能通过反馈刺激使骨髓基质干细胞增殖能力增强,但是分化能力受到抑制,而对照组动物未经加压运动,常氧条件下的骨髓间充质干细胞多呈梭形,经诱导后向心肌样细胞分化,提示我们常氧条件下的骨髓间充质干细胞比其在缺氧条件下更倾向于分化。有关加压运动对骨髓间充质干细胞影响的研究还需深入探讨,如加压运动的压力值、运动时间和频次为多少更利于其增殖或分化,这样就可以根据临床需要设计加压运动的各种条件,以调控骨髓间充质干细胞的增殖和分化。
[1]Jori FP,Napolitano MA,Melone MA,et al.Molecular pathways involved in neural in vitro differentiation of marrow stromal stem cells[J].Journal of Cellular Biochemistry,2005,94 (4):645.
[3]Okuyama H,Krishnamachary B,Zhou YF,et al.Expression of vascular endothelial growth factor receptor 1 in bone marrow-derived mesenchymal cells is dependent on hypoxia-inducible factor 1[J].J Biol Chem,2006,281 (22):15554.
[4]Studeny M,Marini FC,Champlin RE,et al.Bone Marrow-derived Mesenchymal Stem Cells as Vehicles for Interferon-β Delivery into Tumors[J].Cancer Research,2002,62 (13):3603.
[5]Potapova I,Plotnikov A,Lu Z,et al.Human Mesenchymal Stem Cells as a Gene Delivery System to Create Cardiac Pacemakers[J].Circulation Research,2004,94 (7):952.
[6]Nagaya N,Kangawa K,Itoh T,et al.Transplantation of Mesenchymal Stem Cells Improves Cardiac Function in a Rat Model of Dilated Cardiomyopathy[J].Circulation,2005,112 (8) :1128.
[7]Dai W,Hale SL,Martin BJ,et al.Allogeneic Mesenchymal Stem Cell Transplantation in Postinfarcted Rat Myocardium:Short- and Long-Term Effects[J].Circulation,2005,112(2):214.
[9]Chapel A,Bertho JM,Bensidhoum M,et al.Mesenchymal stem cells home to injured tissues when co-infused with hematopoietic cells to treat a radiation-induced multi-organ failure syndrome[J].The Journal of Gene Medicine,2003,5(12):1028.
[10]Chavakis E,Urbich C,Dimmeler S.Homing and engraftment of progenitor cells:A prerequisite for cell therapy[J].Journal of Molecular and Cellular Cardiology,2014,45(4):514.
Effects of KAATSU Training on proliferation and differentiation of goat bone marrow mesenchymal stem cells
YANG Yu-hui,SUN Shao-qian,Sato Voshiaki,et al.
(China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
ObjectiveTo explore the effects of KAATSU Training on proliferation and differentiation of goat bone marrow mesenchymal stem cells.Methods60 Boer goats were randomly divided into experimental group and control group,the experimental group were given KAATSU Training twice a week,non-KAATSU Training twice a week for the control group,6 months later,we got the goat bone marrow,and then separated and absorbed the white cloud layer which mainly contained the mononuclear cell in the upper-middle interface with the method of percoll-density gradient centrifugation,cultured and observed the cell morphology and the proliferation rate;the cells of the two groups were induced into cardiomyocyte like cells by the 5-azacytidine,The cells which had been differentiated were detected the expression of the cardiac specific antigen a-actin by immunofluorescence assay.ResultsThe cells isolated from the bone marrow in the white cloud layer were adherent,generated and grew well,in addition,the cells which induced by 5-azacytidine could express the cardiac specific antigen.The bone marrow mesenchymal stem cells of the experimental group were small and round,and their proliferation rate was faster than the control group’s,though the shape of the cells in the control group were polygonal or triangular,and the proliferation rate were slow.ConclusionIt has been succeeded both in separation and cultivation of the bone marrow mesenchymal stem cells,and also induced the proliferation of turning into cardiomyocyte like cells in vitro.The bone marrow mesenchymal stem cells in pressurization motion for a long period of time were more easy to proliferate than the cells in non-pressurization motion,but the differentiative capability were low.
KAATSU Training;Bone marrow mesenchymal stem cells;Proliferation,Differentiation
1007-4287(2016)08-1240-04
Q813
A
2015-12-20)
△并列为第一作者
