啶虫脒和海岛素(φ=5%氨基寡糖素)对棉蚜应激防御酶活性的影响
2016-09-12陈丽慧帕提玛乌木尔汗崔燕华冯宏祖
陈丽慧,帕提玛·乌木尔汗,崔燕华,李 勇,冯宏祖
(1.塔里木大学 植物科学学院,农业部阿拉尔作物有害生物科学观测实验站,塔里木大学 南疆农业有害生物综合治理重点实验室,新疆 阿拉尔 843300;2.阿克苏地区农业技术推广中心,新疆 阿克苏 833000)
啶虫脒和海岛素(φ=5%氨基寡糖素)对棉蚜应激防御酶活性的影响
陈丽慧1,帕提玛·乌木尔汗1,崔燕华2,李勇1,冯宏祖1
(1.塔里木大学 植物科学学院,农业部阿拉尔作物有害生物科学观测实验站,塔里木大学 南疆农业有害生物综合治理重点实验室,新疆 阿拉尔843300;2.阿克苏地区农业技术推广中心,新疆 阿克苏833000)
为探讨棉蚜取食喷施啶虫脒和海岛素的棉花后对体内保护酶和解毒酶活性的影响,以温室内饲养的1~2龄棉蚜为研究对象,测定用啶虫脒和海岛素喷施棉花后棉蚜体内保护酶和解毒酶的活性。结果表明,棉蚜取食棉花后,啶虫脒和海岛素处理对初期棉蚜体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性均表现为抑制作用;96 h内,啶虫脒和海岛素处理对棉蚜体内的羧酸酯酶(CarE)活性表现为先抑制再激活后抑制,对谷胱甘肽S-转移酶(GSTs)和乙酰胆碱酯酶(AchE)均有激活作用。说明:用啶虫脒和海岛素喷施棉花后,可扰乱棉蚜的保护和解毒系统,起到较好的防治效果。
棉蚜;棉花;保护酶活性;解毒酶活性
棉蚜(AphisgossypiiGlover)属同翅目蚜科,是一种重要的多食性刺吸式口器害虫,为害棉花、南瓜、西瓜和豇豆等多种植物,广泛分布于世界各地。棉蚜的发生和为害严重影响棉花的产量和品质[1-2],化学防治是目前控制棉蚜的重要手段。化学农药施于田间可杀死大部分害虫,但由于寄主植物不同部位受药量、温度、湿度、光照、风等多因素的影响,害虫不同个体间接触的药量有较大差异,可能对害虫产生一定的亚致死效应,从而对其生物学、生殖力和生理代谢等多方面产生影响。有研究显示,亚致死效应对害虫的抗药性发展有促进作用[3]。也有研究表明,在正常环境条件下,生物细胞内自由基在超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的协调下处于动态平衡,昆虫摄入化学农药后可能会破坏其平衡,使昆虫受到伤害[4-5]。昆虫体内应激防御酶除保护酶系外还有解毒酶系,如羧酸酯酶(CarE)、谷胱甘肽-S-转移酶(GSTs)和乙酰胆碱酶(AchE)等,这些酶对分解外源毒素和维持昆虫自身正常生理代谢有重要作用[6]。研究发现,棉蚜的吡虫啉、啶虫脒抗性品系和敏感品系的CarE、GSTs活性有显著差异,在棉蚜对啶虫脒的抗性中CarE、AchE起很大作用,GSTs作用较小[7-8]。研究棉蚜体内保护酶和解毒酶活性对探讨棉蚜抗药性发展机制及其有效治理具有重要意义。
啶虫脒属于氯化烟酰亚胺类杀虫剂,高效低毒,对昆虫天敌和生态环境均较安全,应用较为广泛,目前多用于防治蚜虫类害虫。但由于啶虫脒使用频率和使用量的增加,棉蚜对啶虫脒的抗药性不断增强[9],有研究表明,棉蚜对新烟碱类杀虫剂存在较大的抗药性风险[10]。海岛素(φ=5%氨基寡糖素)是新型植物免疫诱抗剂,能诱导激活植物的免疫系统调节植物的生长,提高植物抗病性。近年来,在棉花等多种作物上进行大量的田间试验显示,海岛素对多种作物病害具有诱导抗病和防控作用,对叶螨和蚜虫也表现出一定的抑制作用[11]。因此,本研究在生化水平上对啶虫脒亚致死浓度处理和海岛素田间推荐浓度处理后的棉蚜应激防御酶的活性变化进行研究,分析酶活性的变化动态,为深入研究棉蚜的抗药性发展机制及其有效治理提供理论依据。
1 材料与方法
1.1试验材料
供试棉花:‘新陆中37’。
供试虫源:采自塔里木大学试验站棉田,于植保站温室内用新鲜棉花苗饲养,饲养70代左右。选择发育至1~2龄的棉蚜用于试验。
供试药剂:啶虫脒(w=20%啶虫脒可溶粉剂,南京盟兴化学有限公司),海岛素(φ=5%氨基寡糖素,海南正业中农高科股份有限公司)。
试验设计:棉花植株达5~6叶期时接虫,接虫前先将棉蚜饥饿处理4~6 h。设置3种处理:A.笼喷施海岛素(φ=5%氨基寡糖素)800倍液;B.笼喷施0.1 mg/L啶虫脒(w=20%啶虫脒可溶粉剂),试验前配制啶虫脒的系列质量浓度,对棉蚜进行毒力测定,以清水为对照,分别计算2 d内的亚致死剂量LC25;C.笼喷清水对照,每处理重复3次。将1~2龄棉蚜分散于真叶,任其为害,并在子叶下方涂抹凡士林,防止棉蚜逃逸。分别于接虫后24、48、72、96 h取样测定棉蚜体内保护酶和解毒酶活性。取样时用毛笔挑取棉叶上的棉蚜,迅速放入冰盒带回实验室,-70 ℃超低温冰箱保存,备用。
1.2保护酶液的制备
分别取不同处理的棉蚜成虫40头,加少量聚乙烯吡咯烷酮(pvp),1.5 mL 0.05 mol/L磷酸缓冲液(pH7.0)及少许石英砂,冰浴条件下充分研磨成匀浆,转入离心管,4 ℃、12 000 r/min离心15 min,取上清液,备用。
1.2.1SOD活性测定参考刘素琪等[12]的方法。3 mL NBT反应液:1.5 mL 50 mmol/L磷酸缓冲液(pH 7.0),0.3 mL 75 μmol/L氮蓝四唑(NBT),0.3 mL 13 mmol/L蛋氨酸,0.3 mL 0.1 mmol/L乙二胺四乙酸(EDTA)和50 μL酶液,最后加4 μmol/L核黄素0.55 mL。置于3 000 lx日光灯下进行光反应, 25 ℃照光15 min后关灯,黑暗终止反应,于560 nm测定吸光值,以内装NBT反应液但不加酶液进行光照的试管为对照,以内装NBT反应液不加酶液但置于暗处的试管为参比。1个酶活单位为相当于引起3 mL反应液达到50%抑制所需的酶量。
1.2.2CAT活性测定参考刘素琪等[12]的方法。取粗酶液0.1 mL,加入φ=0.2% H2O21 mL,蒸馏水1.9 mL,混匀反应3 min,测定反应液在240 nm的吸光值,1 min读1次,读3次,以不加酶液的反应液为空白对照。酶活性单位为U/(mg·min)。
1.2.3POD活性测定参考Simon等[13]的方法。反应体系中含2 mL 0.05 mol/L磷酸缓冲液、0.5 mL 0.05mol/L愈创木酚、φ=2% H2O21.0 mL和0.15 mL酶液,作用5 min,于470 nm测定吸光值,1 min读1次,读3次,以不加酶液的反应液为空白对照。酶活性单位为U/(mg·min)。
1.3解毒酶液的制备
取棉蚜成虫40头,加入1.5 mL预冷的相应的酶缓冲液,羧酸酯酶通过0.04 mol/L磷酸缓冲液(pH 7.0)提取;乙酰胆碱酯酶通过0.1 mol/L磷酸缓冲液(pH 7.4)提取。棉蚜成虫在冰浴中匀浆,转入离心管,4 ℃、12 000 r/min离心10 min,取上清液作为酶液。
1.3.1CarE活性测定参考 Van Asperen[14]的方法。取3.6 mLα-乙酸萘酯(α-NA)和0.1 mL酶液,混匀,30 ℃水浴15 min,再加1 mL DBLS试剂(w=1%固蓝B与w=5%十二烷基硫酸钠以体积比2∶5混合),反应15 min后,以不加酶液的反应液为空白对照,于600 nm测定吸光值。酶活性单位为μmol/(mg·min)。
α-乙酸萘酯贮液配制方法:取5.58 mgα-乙酸萘酯、8.25 mg毒扁豆碱和1 mL丙酮溶于适量0.04 mol/L磷酸缓冲液(pH 7.0),并将其转移至100 mL容量瓶,再取适量0.04 mol/L磷酸缓冲液定容,即获得α-乙酸萘酯贮液。
1.3.2GSTs活力测定参考Booth等[15]的方法。反应混合液含0.1 mL酶液,2.9 mL 0.1 mol/L的磷酸缓冲液(pH 8.0),50 μL 0.1 mol/LCDNB液,0.7 mL 0.03 mol/L谷胱甘肽溶液,30 ℃水浴30 min,加热使其失活,以不加酶液的反应液为空白对照,在350 nm测定吸光值,酶活性单位为μmol/(mg·min)。
1.3.3AchE活力测定参考Ellman等[16]的方法。反应混合液含0.1 mL酶液,2.8 mL 0.1 mol/L磷酸缓冲液(pH 8.0),0.1 mL 0.01 mol/L DNTB液,50 μL 0.075 mol/L碘化乙酰胆碱,30 ℃水浴15 min,加入0.1 mL 10-5mol/L毒扁豆碱,以不加酶液的反应液为对照,410 nm测定吸光值,酶活单位为μmol/(mg·min)。
1.4数据分析
采用Excel 2003 软件和DPS 7.05软件处理分析数据;采用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1对棉蚜体内保护酶活性的影响
由表1可知,同一时间下,3种处理的SOD活性存在极显著差异(P<0.01)。随棉蚜取食时间的延长,对照组的SOD活性呈波浪式变化,变化幅度不大,且取食72 h时活性达到最大值。海岛素和啶虫脒处理组棉蚜的SOD活性均呈下降的趋势,取食24 h时活性达到最大值。从棉蚜取食经不同药剂处理棉花的SOD活性变化趋势可以看出,药剂处理前期能够刺激棉蚜作出相应的氧化排毒反应,随着时间的延长,SOD活性变化趋缓。

表1 棉蚜取食不同药剂处理的棉花后其SOD、CAT和POD的活性
注:数据为“平均值±标准差”,第1组不同小写字母表示同行数据经Duncan’s新复极差法检验在P<0.05水平差异显著,大字字母表示在P<0.01水平差异显著;第2组不同小写字母表示同列数据经Duncan’s新复极差法检验在P<0.05水平差异显著,大字字母表示在P<0.01水平差异显著。下同。
Note: Data in table is the “mean value ± the standard deviation”.Different lowercase letters of first group showing in the same row data indicate significant difference at the level ofP<0.05 by the Duncan’s new multiple range method,uppercase letters indicate significant difference at the level ofP<0.01.Different lowercase letters of second group showing in the same column data indicate significant difference at the level ofP<0.05 by the Duncan’s new multiple range method,uppercase letters indicate significant difference at the level ofP<0.01,same as below table.
随棉蚜取食时间的延长,对照组的CAT活性呈波浪式变化,72 h时活性达到最大值;海岛素处理组的CAT活性呈先降低后升高的趋势,啶虫脒处理组的CAT活性呈降低的趋势,均在24 h时CAT活性达到最大值。2个药剂处理组的CAT酶活性变化趋势表明,药剂处理后棉蚜的CAT活性受到抑制。
3种处理棉蚜的POD活性均在取食24 h时达到最大,且处理间存在极显著差异(P<0.01)。随棉蚜取食时间的延长,对照组的POD活性呈波浪式变化;海岛素处理和啶虫脒处理的POD活性均呈下降趋势,且不同时间段海岛素处理组的POD活性存在极显著性差异(P<0.01)。2个药剂处理组的POD活性变化趋势表现,药剂处理可能会促使氧自由基在蚜虫体内积聚,从而阻碍POD的合成。
2.2对棉蚜体内解毒酶活性的影响
由表2可知,同一时间下,3种处理的CarE活性均存在极显著性差异(P<0.01)。随棉蚜取食时间的延长,对照组的CarE活性呈先升高后降低的变化趋势,且取食72 h时活性达到最大值;海岛素处理的CarE活性呈升高的变化趋势,在取食96 h时活性达到最大值;啶虫脒处理的CarE活性呈先上升后下降的变化趋势,在取食72 h时活性达到最大值。2个药剂处理的CarE酶活性变化趋势表明,药剂处理可促进棉蚜体内CarE活性升高。
棉蚜取食棉花后,处理组的GSTs活性均高于对照组,取食后24 h时不同处理间的GSTs活性存在极显著差异(P<0.01),其他时间段差异均不显著(P>0.05)。3种处理的GSTs活性均在取食96 h后达到最大值。随棉蚜取食时间的延长,3种处理的GSTs活性均呈升高的趋势,且GSTs活性峰值变化表现为海岛素处理组>啶虫脒处理组>对照组。
棉蚜取食棉花72、96 h后,海岛素处理和啶虫脒处理的AchE活性均存在极显著差异(P<0.01),且在96 h时达到最大值。随棉蚜取食时间的延长,3种处理的AchE活性均呈升高的趋势,AchE活性峰值变化表现为啶虫脒处理组>海岛素处理组>对照组。
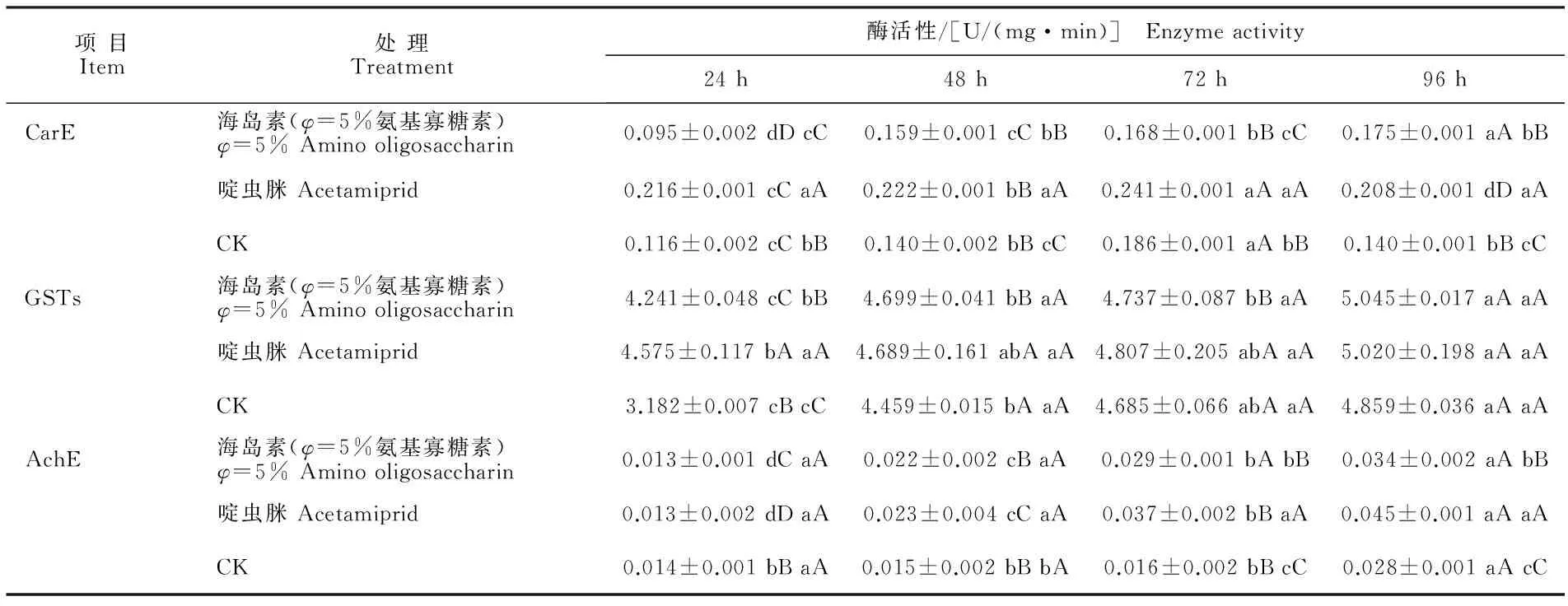
表2 取食不同药剂处理的棉花后棉蚜体内CarE、GSTs、AchE的活性
3 讨论与结论
药剂进入昆虫体内,可激发其体内保护酶和解毒酶在逆境下的应激反应[3]。SOD、CAT、POD是昆虫体内重要的保护酶,可清除昆虫体内的氧自由基,从而保护昆虫的正常生理活动[17-18]。已有研究证实,当虫体受到刺激或胁迫后,能激活体内的氧自由基清除机制,保护酶活性上升,使虫体不受危害[19-20]。也有研究显示,昆虫受到外界刺激后,体内CAT和POD活性在前期均受到抑制[21]。本研究表明,棉蚜取食经海岛素和啶虫脒处理的棉叶,并随取食时间的延长,其体内SOD、CAT、POD活性呈现下降趋势,但均高于对照组,表明,在海岛素和啶虫脒的胁迫下,棉蚜体内的氧自由基开始积累,阻碍保护酶的合成,扰乱棉蚜体内保护酶的平衡,使机体防御力下降,引起棉蚜死亡。
CarE、GSTs、AchE是昆虫体内重要的解毒酶,可分解外源毒物,从而维持昆虫的正常生理代谢[22]。已有研究证实,不同植物的次生物质和不同寄主植物均可诱导昆虫体内CarE、GSTs、AchE活性增加[1,23]。邓小霞[24]、孟丽峰[25]研究结果表明,不同药剂处理可使昆虫体内AchE活性降低;鄢杰明等[5]研究也发现,甲氧虫酰肼能抑制舞毒蛾5龄幼虫体内CarE和GSTs活性。本研究表明,取食海岛素和啶虫脒处理的棉叶后,随时间延长,棉蚜体内CarE、GSTs、AchE活性均有所升高,推测CarE、GSTs、AchE可能参与棉蚜对海岛素和啶虫脒的解毒代谢,在棉蚜的抗药性进化过程中起重要作用。
综上所述,啶虫脒主要作用于棉蚜,使棉蚜体内系统失衡而死亡;而海岛素主要作用于棉花,诱导棉花产生抗性,起到抑制棉蚜的作用。在防治棉蚜过程中,啶虫脒和海岛素可交替使用,从而减少农药的使用,保持棉田生态平衡,也对棉田合理用药提供一定指导意义。
Reference:
[1]吕敏,孙婳婳,王丽红,等.植物次生物质对棉蚜谷胱甘肽S-转移酶和羧酸酯酶活性的诱导作用[J].中国农学通报,2012,28(3):253-256.
LÜ M,SUN H H,WANG L H,etal.Effects of secondary metabolites on activities of glutathione S-transferases,carboxylesterase in Aphid[J].ChineseAgriculturalScienceBulletin,2012,28(3):253-256(in Chinese with English abstract).
[2]任明勇,梁革梅,张永军,等.几种药剂对棉苗蚜、伏蚜的毒力测定和药剂试验[J].棉花学报,2007,19(3):199-204.
REN M Y,LIANG G M,ZHANG Y J,etal.Toxicity mensurationes and efficacy trials of several insecticides against cotton aphidAphisgossypii(Glover)[J].CottonScience,2007,19(3):199-204(in Chinese with English abstract).
[3]韩文素,王丽红,孙婳婳,等.杀虫剂对昆虫的亚致死效应的研究进展[J].中国植保导刊,2011,31(11):15-20.
HAN W S,WANG L H,SUN H H,etal.Research progress on sublethal effects of insecticides on insect[J].ChinesePlantProtection,2011,31(11):15-20(in Chinese with English abstract).
[4]刘丹,严善春,曹传旺,等.多杀菌素对黄褐天幕毛虫解毒酶及保护酶的影响[J].林业科学,2012,48(4):67-74.
LIU D,YAN SH CH,CAO CH W,etal.Effect of spinosad on the detoxifying and protective enzymes ofMalacosomaneustriatestacea[J].ScientiaSilvaeSinicae,2012,48(4):67-74(in Chinese with English abstract).
[5]鄢杰明,廖月枝,严善春,等.甲氧虫酰肼对舞毒蛾解毒酶和保护酶活性的影响[J].东北林业大学学报,2010,38(11):112-114.
YAN J M,LIAO Y ZH,YAN SH CH,etal.Effects of methoxyfenozide(RH-2485) on the activities of detoxifying enzymes and protective enzymes inLymantriadispar(Lepidoptera:Lymantriidae)[J].JournalofNortheastForestryUniversity,2010,38(11):112-114(in Chinese with English abstract).
[6]蒋晴,苏宏华,杨益众.昆虫对Bt毒素的抗性与中肠蛋白酶、解毒酶及保护酶系活性的关系[J].环境昆虫学报,2013,35(1):95-101.
JIANG Q,SU H H,YANG Y ZH.Relationship between midgut proteinases,detoxification enzymes,protective enzymes in insect and the resistance to Bt[J].JournalofEnvironmentalEntomology,2013,35(1):95-101(in Chinese with English abstract).
[7]郭天凤.新疆棉区棉蚜对新烟碱类杀虫药剂抗性监测、风险评估及抗性机制的研究[D].北京:中国农业大学,2014.
GUO T F.Monitoring,risk assessment and mechanisms ofAphisgossypii(Glover) resistance to neonicotinoid insecticides in Xinjiang[D].Beijing:China Agricultural University,2014(in Chinese with English abstract).
[8]郭天凤,周晶,叶玉霞,等.棉蚜啶虫脒不同品系解毒酶活性测定和增效剂作用的研究[J].新疆农业科学,2015,52(7):1334-1339.
GUO T F,ZHOU J,YE Y X,etal.Study on the activity of the detoxification enzymes and synergist synergism of cotton aphid(Aphisgossypii) on acetamiprid of different strains[J].XinjiangAgriculturalSciences,2015,52(7):1334-1339(in Chinese with English abstract).
[9]张学涛,柳建伟,李芬,等.北疆地区棉蚜对不同杀虫剂敏感度水平测定[J].植物保护,2012,38(2):163-166.
ZHANG X T,LIU J W,LI F,etal.Susceptible level ofAphisgossypiito different insecticides in the north of Xinjiang[J].PlantProtection,2012,38(2):163-166(in Chinese with English abstract).
[10]雷虹,张战利.棉蚜对啶虫脒的抗性汰选与风险评估[J].西北农业学报,2007,16(6):238-241.
LEI H,ZHANG ZH L.Resistance selection of cotton aphid to acetamiprid and its risk assessment[J].ActaAgriculturaeBoreali-occidentalisSinica,2007,16(6):238-241(in Chinese with English abstract).
[11]杨栋,刘敏,高永健,等.氨基寡糖素在新疆的应用实践及使用技术探讨[J].中国植保导刊,2015,35(10):67-71.
YANG D,LIU M,GAO Y J,etal.Application and use technology research of amino oligosaccharin in Xinjiang[J].ChinesePlantProtection,2015,35(10):67-71(in Chinese).
[12]刘素琪,王海香,郝晓娟,等.地肤子活性组分对山楂体内保护酶活性的影响[J].山西农业大学学报(自然科学版),2011,31(2):126-129.
LIU S Q,WANG H X,HAO X J,etal.Effects of the chloroform extracts ofKochiascoparia(L.) on the activity of protective enzymes inTetranychusviennensis[J].JournalofShanxiAgriculturalUniversity(NaturalScienceEdition),2011,31(2):126-129(in Chinese with English abstract).
[13]SIMON L M,FATRAI Z,JONAS D E,etal.Study of peroxide metabolism enzymes during the development ofPhaseolusvulgaris[J].BiochemistryPhysiology,1974,166:387-392.
[14]VAN ASPEREN K.A study of housefly esterase by means of a sensitive colorimetric method[J].JournalofInsectPhysiology,1962,8(4):401-416.
[15]BOOTH J,BOYLAND E,SINS P.An enzyme from the rat liver catalyzing conjugation with glutathione[J].JournalofBiochemistry,1961,79:516-523.
[16]ELLMAN G,COURTNEY K,ANDRES V,etal.A new and rapid colorimetric determination of acetylcholinesterase activity[J].BiochemicalPharmacology,1961,7(2):88-92.
[17]蒋继宏,吴薇,曹小迎,等.苦豆碱对杨小舟蛾体内保护酶系统活力的影响[J].南京林业大学学报(自然科学版),2005,29(5):91-93.
JIANG J H,WU W,CAO X Y,etal.Effects of aloperine on the activities of endogenous enzymes of protective system in the larva ofMicroelalophatrogloyta[J].JournalofNanjingForestryUniversity(NaturalScienceEdition),2005,29(5):91-93(in Chinese with English abstract).
[18]乔利,秦道正,卢兆成,等.温度对茶小绿叶蝉成虫存活率及保护酶系的影响[J].植物保护学报,2015,42(2):223-228.
QIAO L,QIN D ZH,LU ZH CH,etal.Effects of temperature on survival rate and protection enzymes ofEmpoascaonukiiMatsuda[J].JournalofPlantProtection,2015,42(2):223-228(in Chinese with English abstract).
[19]雒珺瑜,崔金杰.单宁酸对绿盲蝽体内3种保护酶活力的影响[J].中国棉花,2013,40(7):20-23.
LUO J Y,CUI J J.Effect of tannin to the activity of three protective enzymes inApolyguslucorumMeyer-dur[J].ChinaCotton,2013,40(7):20-23(in Chinese with English abstract).
[20]杨步莲.高温对抗性和敏感小菜夜蛾体内保护酶系的影响[D].福州:福建农林大学,2012.
YANG B L.Effects of high temperature on protective enzyme in resistant and susceptiblePlutellaxylostella[D].Fuzhou:Fujian Agriculture and Forest University,2012(in Chinese with English abstract).
[21]张文成,王开运,牛芳,等.虫螨腈胁迫对甜菜夜蛾保护酶系和解毒酶系的诱导效应[J].植物保护学报,2009,36(5):455-460.
ZHANG W CH,WANG K Y,NIU F,etal.Induction of chlorfenapyr on endogenous protective and detoxifying enzymes in beetarmyworm,Spodopteraexigua[J].ActaPhytophylacicaSinica,2009,36(5):455-460(in Chinese with English abstract).
[22]牟少飞,梁沛,高希武.槲皮素对B型烟粉虱羧酸酯酶和谷胱甘肽S-转移酶活性的影响[J].昆虫知识,2006,43(4):491-495.
MU SH F,LIANG P,GAO X W.Effects of quercetin on specific activity of carboxylesterase and glutathione S-transferases inBemisiatabaci[J].ChineseBulletinofEntomology,2006,43(4):491-495(in Chinese with English abstract).
[23]尹姣,冯红林,李克斌,等.寄主植物对草地螟中肠解毒酶及保护酶活性的影响[J].植物保护,2012,38(1):35-39.
YIN J,FENG H L,LI K B,etal.Effects of host plants on the activities of some detoxification enzymes and protective enzymes in the meadow moth[J].PlantProtection,2012,38(1):35-39(in Chinese with English abstract).
[24]邓小霞.缩节胺诱导棉花防御棉蚜的机理研究[D].新疆石河子:石河子大学,2013.
DENG X X.The study on defenseAphisgossypiiGlover of cotton induced by mepiquat chloride[D].Shihezi Xinjiang:Shihezi University,2013(in Chinese with English abstract).
[25]孟丽峰.吡虫啉对蜜蜂解毒酶和生长发育的影响[D].北京:中国农业科学院,2013.
MENG L F.Effects of imidacloprid on activities of detoxifying enzymes and development onApismellifera[D].Beijing:Chinese Academy of Agricultural Sciences,2013(in Chinese with English abstract).
Corresponding authorFENG Hongzu,male,professor.Research area: integrated pest management.E-mail: fhzzky@163.com
(责任编辑:郭柏寿Responsible editor:GUO Baishou)
Effect of Acetamiprid andφ=5% Amino Oligosaccharin onAphisgossypiiActivity of Stress Defence Enzyme
CHEN Lihui1,Patima Wumuerhan1,CUI Yanhua2,LI Yong1and FENG Hongzu1
(1.College of Plant Science,Tarim University; Scientific Observing and Experimental Station of Crop Pests in Alar,Ministry of Agriculture,P.R.China; Southern Xinjiang Key Laboratory of IPM of Tarim University,Alar Xinjiang843300,China;2.Aksu Agriculture-Technical Extension Center,Aksu Xinjiang833000,China)
Study the effect of aphid gossypii fed with acetamiprid and cotton treated byφ=5% amino oligosaccharin on protective enzyme activity and detoxifying enzyme activity in internalAphisgossypii,it provided theoretical basis for the resistance mechanism and effective prevention ofAphisgossypii.1-2 ageAphisgossypiiin greenhouse as objects,we determined the activities of three kinds of protective enzymes(superoxide dismutase,catalase and peroxidase) and three kinds of detoxifying enzymes(carboxylesterase,acetylcholinesterase and glutathione-s-transferase) in internalAphisgossypiiafter different medicament spraying.The results showed that SOD,CAT,POD,CarE,GSTs and AchE activities in internalAphisgossypiihad a trend to inhibition at initial stage of treatments of acetamiprid andφ=5% amino oligosaccharin afterAphisgossypiifed with the cotton;CarE activity behaved inhibition effect as first then activation and inhibition at last within 96h,it had activation effect on GSTs and AchE activity.This proved that acetamiprid andφ=5% amino oligosaccharin disturbed the protection and detoxification system ofAphisgossypii,and had better control efficiency.
Aphisgossypii; Cotton; Protective enzymes activity; Detoxifying enzymes activity
2015-12-11Returned2016-03-05
Corps Project for Technology Transfer(2014BD031); Research Innovation Program for Graduate Students of Tarim University(TDGRI201507).
CHEN Lihui,female,master student.Research area: integrated pest management.E-mail: clh030201@163.com
2015-12-11
2016-03-05
兵团技术转移计划(2014BD031);塔里木大学研究生科研创新项目(TDGRI201507)。
陈丽慧,女,硕士,研究方向:害虫综合治理。E-mail:clh030201@163.com
冯宏祖,男,教授,研究方向:害虫综合治理。E-mail:fhzzky@163.com
S435.622+
A
1004-1389(2016)08-1257-06
网络出版日期:2016-07-14
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160714.1105.042.html
