杀虫活性化合物杠柳新苷P对东方粘虫中肠细胞上结合蛋白的影响
2016-09-12何振宇李任丰胡兆农
齐 猛,何振宇,李任丰,胡兆农
(1.西北农林科技大学 农药研究所,陕西杨凌 712100; 2.陕西省植物源农药研究与开发重点实验室,陕西杨凌 712100)
杀虫活性化合物杠柳新苷P对东方粘虫中肠细胞上结合蛋白的影响
齐猛1,2,何振宇1,2,李任丰1,2,胡兆农1,2
(1.西北农林科技大学 农药研究所,陕西杨凌712100; 2.陕西省植物源农药研究与开发重点实验室,陕西杨凌712100)
杠柳新苷P是从杠柳根皮提取物中分离得到的一种甾体糖苷类化合物,对东方粘虫表现出较好的杀虫活性。为了进一步研究其杀虫机理,探究杠柳新苷P作用于东方粘虫中肠疑似作用位点,通过对杠柳新苷P进行结构修饰,与东方粘虫幼虫中肠刷状缘膜囊泡(BBMV)组织体外孵育,利用其结构修饰后增强的紫外吸收特性,经蛋白分离、纯化,进而得到杠柳新苷P作用于粘虫中肠BBMV上的结合蛋白。结果表明:在粘虫中肠BBMV上存在杠柳新苷P的疑似结合蛋白,且经分离鉴定得到5种疑似结合蛋白,分别为类异翅盘蛋白、氨肽酶、二硫键异构酶、苯基贮存蛋白以及精氨酸激酶;通过进一步的分析推测,氨肽酶可能是杠柳新苷P作用于东方粘虫幼虫中肠BBMV上的结合蛋白。初步明确杠柳新苷P作用于东方粘虫中肠的疑似作用位点,但仍需进一步的验证工作进行确认,为今后研究杠柳新苷类化合物的作用机理及靶标提供依据。
杠柳新苷P;东方粘虫;刷状缘膜囊泡;结合蛋白
杠柳(PeriplocasepiumBunge)是萝藦科(Asclepias)杠柳属的一种蔓生性灌木,是一种具有祛风湿、强心、强筋骨的传统中草药。《中国土农药志》记载了杠柳根皮可毒杀二十八星瓢虫、菜青虫、蚜虫、孑孓、黑盖子虫等,因此,民间也一直将杠柳根皮作为杀虫土农药使用[1]。国内亦有关于其杀虫活性的报道,史清华等[2]、朱九生等[3-4]报道杠柳根皮的提取物对小菜蛾幼虫、菜青虫、粘虫具有较强的胃毒活性,对麦二叉蚜有较好的触杀活性。
近10 a来,西北农林科技大学农药研究所采用生物活性追踪方法对杠柳根皮提取物开展一系列关于其杀虫活性物质的基础研究,并且分离出一系列杠柳新苷类化合物[5-8]。在对东方粘虫(Mythimnaseparata)室内毒力测定中,发现杠柳新苷P具有较好的杀虫活性,中毒试虫腹部明显肿胀、发黑,不能弯曲,不能爬行。为进一步研究杠柳新苷类化合物的作用机理,采用激光共聚焦显微镜及透射电镜观察病变试虫的中肠组织结构,粘虫幼虫中肠细胞膜,细胞器膜及其他超微结构都被破坏[6-8],因此,推测在东方粘虫幼虫中肠肠壁细胞膜和细胞器膜上可能存在与杠柳新苷P特异性结合的靶标蛋白。另外,根据苏云金芽孢杆菌(Bt)的相关研究表明,Bt毒素的受体蛋白主要存在于刷状缘膜囊泡(BBMV)上,例如V-ATP 酶(V-ATPase)、氨肽酶 N(Aminopeptidase N,APN)及碱性磷酸酶(Alkaline Phosphatase)等[9-12]。根据前期进一步的组织病理学研究及胶体金免疫定位研究表明,杠柳新苷类化合物可能作用于东方粘虫中肠上的BBMV[13]。因此,猜测认为杠柳新苷P的结合蛋白存在于粘虫中肠的BBMV中。
鉴于杠柳新苷P极其微弱的紫外吸收不利于检测,本试验拟通过N-甲基靛红酸酐(N-Methylisatoic anhydride,MIA)对杠柳新苷P进行修饰,利用蛋白分离纯化手段,对东方粘虫中肠BBMV上的疑似结合蛋白进行检测分离,为进一步研究杠柳新苷类化合物作用于东方粘虫幼虫中肠上的靶蛋白的鉴定提供参考。
1 材料与方法
1.1材 料
杠柳新苷P(纯度≥95%),化学结构如图1所示,由西北农林科技大学农药研究所提供。
东方粘虫(Mythimnaseparata),由西北农林科技大学农药研究所养虫室提供,常规方法饲养于温度22~25 ℃、相对湿度为70%~80%的条件下,是以小麦或玉米叶饲养、室内人工累代饲养(18 a)的敏感品系,试验时挑取整齐一致的刚蜕皮6龄幼虫。
1.2杠柳新苷P标记物的合成
称取34 mg杠柳新苷P,5.6 mg N-甲基靛红酸酐(MIA),5.3 mg 4-二甲氨基吡啶(DMAP)于25 mL干燥的反应瓶中,用6 mL无水N, N-二甲基甲酰胺(DMF)溶解,常温下磁力搅拌反应过夜,TLC监测反应完全,向体系中加入1 mL甲醇进行淬灭反应,减压蒸出溶剂,经高效液相色谱制备得到杠柳新苷P标记物(图1)。
1.3粘虫中肠BBMV的提取
采取SPSS11.0软件进行分析,计量资料(均数±标准差)表示,t检验,计数资料(n,%)表示,x2检验,P<0.05差异存在统计学意义。
参照Wolfersberger 等[14]的差速离心法(Mg2+/EGTA法),具体操作步骤如下:(1)将饥饿处理之后的6龄幼虫置于冰上15 min,从幼虫后部的第3、4节之间纵剖开,取中肠,用w=0.7%的NaCl冲洗中肠,吸干水,称量后置于-70 ℃冰箱中保存(最长不可超过6个月)或直接制备BBMV;(2)加9倍质量的冰冷缓冲液A(300 mmol/L D-mannotil,5 mmol/L EGTA,17 mmol/L Tris,1 mmol/L PMSF,PH 7.5)于玻璃匀浆器中,在冰上与中肠进行充分的匀浆,每匀浆1 min冰冷1 min,重复5~6次;(3)往匀浆液中加入等体积24 mmol/L MgCl2,混匀置于冰上15 min,4 ℃、4 500 r/min离心15 min,保留上清;(4)将上一步所得沉淀重悬于4.5倍体积的冰冷缓冲液A,后加等体积的24 mmol/L MgCl2,重复步骤(3),再次收集上清;(5)将2次所得上清合并,4 ℃、30 000g离心30 min,保留沉淀;(6)将所得沉淀加入等体积的冰冷缓冲液B(150 mmol/L D-mannotil,2.5 mmol/L EGTA,8.5 mmol/L Tris,1 mmol/L PMSF,pH 7.5)冰浴4 h,重悬混匀,4 ℃、30 000g离心15 min;(7)弃上清,取沉淀重悬于冰冷缓冲液C(150 mmol/L NaCl,5 mmol/L EGTA,20 mmol/L Tris,w=1%的 CHAPS ,1 mmol/L PMSF,pH 7.5),即为提取的BBMV,分装,-80 ℃保存。
1.4Q-Sepharose阴离子交换柱层析
(1)用Tris-HCl(pH 7.5,2 mmol/L) 缓冲液平衡Q-Sepharose阴离子交换柱;(2)样品的处理:上样前,蛋白样品(BBMV)分别与DMSO、杠柳新苷P,杠柳新苷标记物P-MIA、邻甲氨基苯甲酸甲酯(MIA与羟基反应生成物)在29 ℃体外孵育1 h;(3)将过滤后的BBMV以每次6 mL的上样量上样于AKTA蛋白纯化仪(Amashia)的进样阀,流速为0.5 mL/min;(4)在UV 350 nm下监测吸收值,收集未与交换柱结合的蛋白;(5)待样品完全吸附于交换柱后,用含1 mol/L NaCl 的Tris-HCl(pH 7.5,2 mmol/L)缓冲液以1 mL/min的流速梯度洗脱,盐离子体积分数上限为50%,每管1 mL收集洗脱馏分,分别标记为A1、A2、A3、…、An,洗脱总体积为50 mL;(6)在UV 350 nm波长的吸收值下进行监测,选取差异馏分保存待用。
1.5差异馏分的处理
透析袋的预处理:φ=50%乙醇煮沸1~2 h,用0.01 mol/L的NaHCO3,1 mmol/L的EDTA,φ=50%乙醇依次煮脱10 min。将差异馏分分别置于处理好的透析袋中,用0.02 mol/L 的Tris-HCl(pH=7.5)的透析液4 ℃下透析12 h,后将透析完全的蛋白溶液在低温真空冷冻干燥机(Labogene, 型号CS110-4)冻干。
1.6SDS-PAGE电泳
配制10%分离胶,5%浓缩胶,在电泳槽中加1 L电极缓冲液(14.4 g甘氨酸,3 g Tris,1 g SDS)取相同体积(20 μL)的各样品上样于点样孔中,浓缩胶80V、25 min,分离胶120 V、90 min。卸胶后考马斯亮蓝染色液染色2 h,脱色液[V(甲醇)∶V(冰醋酸)∶V(水)=1∶1∶8]过夜脱色,用凝胶成像系统(型号BIO-RAD)扫描照相。
1.7LC-MS-MS蛋白质谱(Q-TOF)分析
将电泳所得到的疑似结合蛋白条带,送到北京华大蛋白质研发中心有限公司进行检测。
2 结果与分析
2.1杠柳新苷P标记物的鉴定
杠柳新苷P标记物为白色粉末,熔点167~169 ℃,ESI-MS质谱显示准分子离子峰[M+Na]+为m/z1 412.51,表明该化合物的相对分子质量为1 389.52,与理论值相符。结合核磁共振谱图分析,1H NMR谱(500 MHz, CDCl3)显示杠柳新苷P标记物较原料杠柳新苷P多出δH:7.88(1H,m),7.30(1H,m),6.70(2H,m),3.46(3H,s)等2-N-甲基苯甲酰基上的氢信号,13C NMR谱(125 MHz, CDCl3)显示多出,δC:168.61,150.46,134.08,131.24,116.70, 116.30, 110.83, 31.94等2-N-甲基苯甲酰基的碳信号,表明杠柳新苷P标记物P-MIA结构是正确的。
2.2不同处理组BBMV的紫外色谱图
由图2中4个不同处理在350 nm的紫外色谱图可以看出,图2-a、2-b、2-d 3个处理的紫外色谱图的趋势是大体相同的,而MIA标记过的杠柳新苷P处理组(图2-c)的第2个洗脱峰的峰值要明显高于其他3组,此处的紫外吸收明显增强,并且由图2-c可知A7、A8馏分是该差异峰的主要组分。
由电导率方面来看,4个图谱中样品的电导率趋势以及数值均一致,表明在同一体系下,同一紫外吸收波长下,不同处理组的洗脱峰值上显示明显差异,该洗脱峰中可能存在杠柳新苷P的结合蛋白。

a.不作处理的对照组Control group;b.杠柳新苷P处理组Periplocoside P treatment group;c.杠柳新苷P标记物P-MIA处理组Periplocoside P-MIA treatment group;d.邻甲氨基苯甲酸甲酯处理组Dimethyl anthranilat treatment group;图中横坐标上部的A1、A2等字母表示洗脱馏分The A1,A2 and other letters on the upper part of the abscissa in the picture show the elution fractions
图2离体孵育BBMV各处理组的紫外色谱图
Fig.2 UV chromatogram for different treatment groups of BBMV (in vitro)
2.3BBMV差异组分的SDS-PAGE电泳
由图3可看出,A7、A8馏分中各有2条蛋白条带(图3所示1、2),未结合蛋白跟高盐洗脱出的蛋白并没有相对应的这2条带,而在BBMV对照蛋白条带中却是存在的,再结合图2的紫外吸收差异图谱,馏分中存在蛋白条带能够结合到柱子上引起紫外吸收增强,可推测这2条蛋白带即疑似结合蛋白所在的条带。
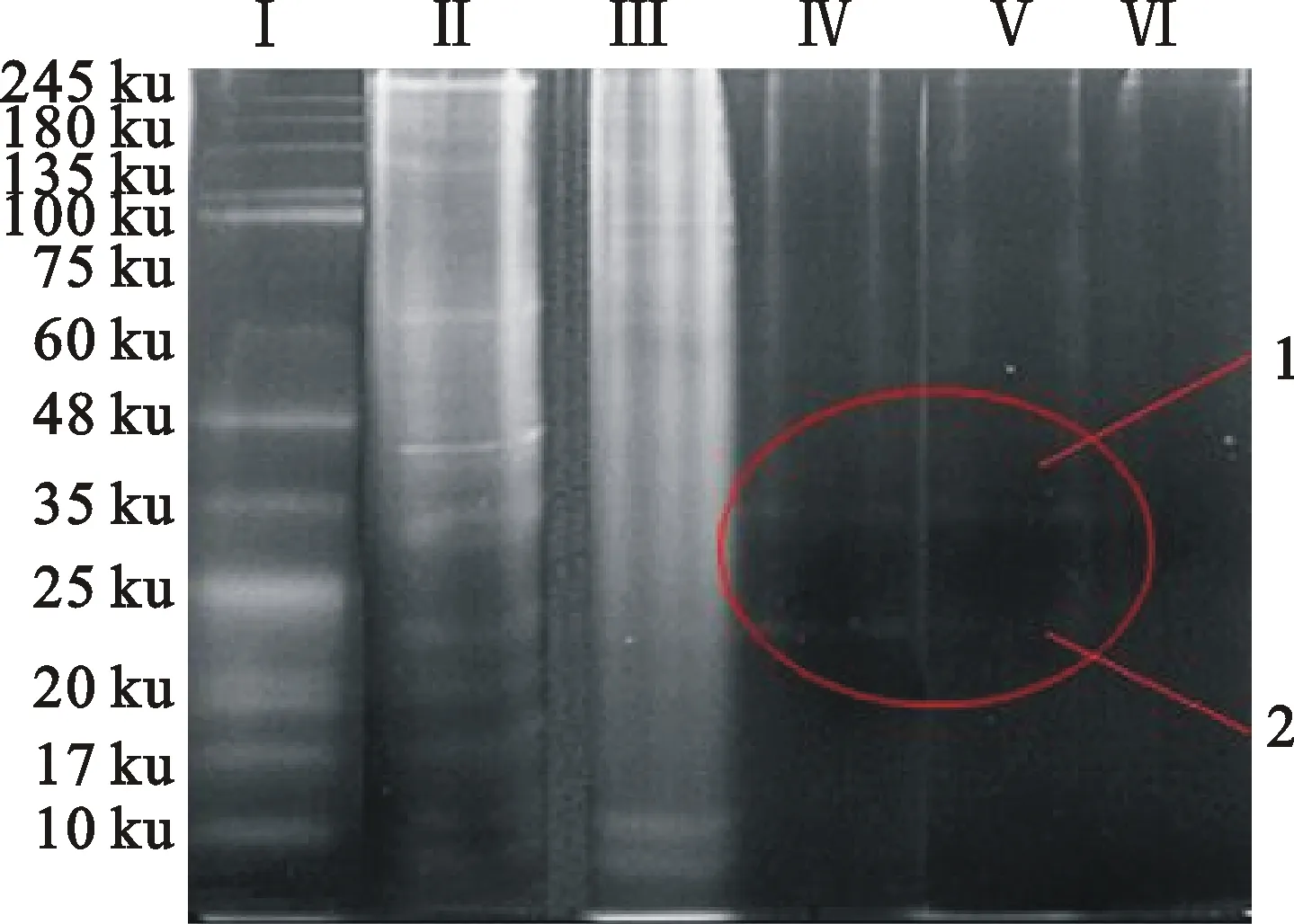
Ⅰ.Marker;Ⅱ.BBMV;Ⅲ.结合的BBMVUnbinding BBMV;Ⅳ.结合蛋白A7 Binding proteins A7;Ⅴ.结合蛋白A8Binding proteins A8;Ⅵ.高盐缓冲液洗脱馏分The eluted fraction with high salt buffer solution
图3离体孵育BBMV差异馏分的SDS-PAGE电泳图
Fig.3SDS-PAGE of different fractions of the BBMV(in vitro)
2.4BBMV中疑似蛋白条带的Q-TOF质谱鉴定
对上述蛋白条带进行Q-TOF质谱分析,对获得的肽段二级质谱数据通过Mascot软件在NCBI数据库中搜索,获得相互匹配的肽段或蛋白,最后把P<0.05的鉴定结果作为最终的鉴定结果(表1)。
经过胶内酶解、肽段提取、肽段对比等步骤鉴定得到5种结合蛋白,与蛋白条带1匹配的蛋白分别是斜纹夜蛾(Spodopteralitura)的类异翅盘蛋白、棉铃虫(HelicoUerpaarmigera)的氨肽酶和苯基贮存蛋白;家蚕(Bombyxmori)的二硫键异构酶、以及Cyphononyxfulvognathus的精氨酸激酶分别与蛋白条带2中的蛋白相对应。

表1 粘虫中肠BBMV中杠柳新苷P结合蛋白鉴定结果
3 讨 论
本试验利用杠柳新苷P与受体蛋白之间的相互作用,初步探究粘虫中肠BBMV中存在的杠柳新苷P结合蛋白。通过LC-MS-MS蛋白质谱技术初步鉴定出5种杠柳新苷P的疑似结合蛋白,分别为类异翅盘蛋白、氨肽酶、二硫键异构酶、苯基贮存蛋白以及精氨酸激酶。
昆虫的中肠作为消化器官是食物消化和养分吸收的主要场所,而中肠BBMV上也存在着大量已知或未知的病毒或杀虫毒素受体[15]。本试验鉴定得到的上述5种蛋白质,在昆虫体内的物质代谢、能量代谢、营养贮存及生长发育等生理过程中承担着重要的角色。类异翅盘蛋白在斜纹夜蛾翅的形成过程以及羽化发育过程起到重要作用,运用RNAi技术表明试虫不能从蛹期正常转变到成虫,影响昆虫变态发育的正常进行[16]。而芳基贮存蛋白只局限存在于大多数完全变态的昆虫的幼虫阶段,对于其功能的理解被认为是一个蛋白质库,其降解的寡肽和氨基酸可以供成虫发育和变态过程利用[17]。这2种蛋白都与粘虫的变态发育相关,而杠柳新苷P是作用于中肠组织进而发挥胃毒作用,与粘虫的变态发育并没有相关的联系。二硫键异构酶(PDI)属于硫氧还蛋白超家族,是一个多功能蛋白。在 N 端具有信号肽,C 端具有内质网定位信号肽可以在内质网中催化新生二硫键形成、蛋白折叠、组装、翻译后修饰以及非正确二硫键的异构[18]。本试验中还检测到精氨酸激酶,精氨酸激酶在鳞翅目昆虫如烟草天蛾中肠中,能够催化ATP和精氨酸中间的磷酸基团进行可逆性交换,之后将能量存储于磷酸精氨酸的高能磷酸键中,或者将磷酸精氨酸分解为ATP,是一个与ATP再生和细胞内能量运转等直接相关的重要激酶,参与能量代谢[19]。通过对上述蛋白的功能性分析并结合杠柳新苷P的作用症状、作用方式以及前期的作用机理研究,推测氨肽酶可能是杠柳新苷P的疑似结合靶蛋白。
氨肽酶是一组肽链端裂解酶,它属于锌依赖性多肽酶家族,具有锌指结构和N端连接的糖基化位点,通过从N端催化切除多肽的中性氨基酸残基而发挥各种各样的细胞代谢调节功能,广泛存在于动物和植物中[20]。研究证实在大多数鳞翅目昆虫的中肠BBMV内,氨肽酶是Bt等毒素的受体蛋白,并且Bt和受体蛋白的结合能力与毒性呈正相关[21]。迄今为止从烟草天蛾(Manducasexta)幼虫、烟芽夜蛾(HeliothisUirescens)幼虫的中肠上鉴定到结合的受体蛋白是120 ku的氨肽酶[22];在舞毒蛾(Lymantriadispar)、小菜蛾(Plutellaxylostella)、家蚕、棉铃虫等鳞翅目昆虫和一些双翅目昆虫幼虫的BBMV上也发现有数种氨肽酶是Cry1A等毒素的受体蛋白[23-26]。
氨肽酶作为Bt毒素的受体蛋白之一,Cry毒素-APN互作的生物相关性已有大量的研究报道,其中Cry 毒素与APN结合后插入昆虫中肠上皮细胞膜形成孔洞的作用机制被广泛接受[27-28]。从症状学观察粘虫幼虫对Bt毒素的中毒典型症状表现为试虫虫体瘫软,而同等条件下杠柳新苷P对粘虫的中毒症状表现为腹部明显肿胀、发黑,不能弯曲,不能爬行,并且对中毒试虫解剖后发现中肠内伴有气泡出现,表明杠柳新苷P与Bt毒素的作用机制完全不同。由于昆虫中肠内种类繁多的受体蛋白、酶蛋白、结构蛋白等均是以相互作用、相互依存的状态存在,协同执行各种功能,共同参与各项生理生化过程,因此,杠柳新苷P是直接作用于氨肽酶发挥作用还是通过氨肽酶介导相关的信号转导途径而产生的杀虫机制,具体的生理生化反应尚不清楚,还有待于进一步的探讨和验证。
Reference:
[1]中国土农药志编辑委员会.中国土农药志[M].北京:科学出版社,1959:123-124.
Editorial Committee of China Zhi-soil pesticide.Chinese Soil Pesticide[M].Beijing:Science Press,1959:123-124(in Chinese).
[2]史清华,马养民,秦虎强.杠柳根皮化学成分及杀虫活性的初步研究[J].西北农业学报,2005,14(6):141-146.
SHI Q H,MA Y M,QIN H Q.Preliminary study on chemical composition and insecticidal activities of root bark fromPeriplocasepium[J].ActaAgricultureBoreali-occidentalisSinica,2005,14(6):141-146(in Chinese with English abstract).
[3]朱九生,乔雄梧,王静,等.杠柳的不同溶剂提取分离物对小菜蛾幼虫的拒食和毒杀作用[J].农药学学报,2004,6(2):48-52.
ZHU J SH,QIAO X W,WANG J,etal.Study on antifeedant and insecticidal activities of extracts and fractions fromPeriplocasepiumBunge againstPlutellaxylostella[J].ChinesePesticideScience,2004,6(2):48-52(in Chinese with English abstract).
[4]朱九生,乔雄梧,王静,等.杠柳根皮乙醇粗提物对菜青虫的拒食作用及其防治效果[J].应用昆虫学报,2004,141(6):548-552.
ZHU J SH,QIAO X W,WANG J ,etal.Antifeedant effect and control efficacy of ethanol crude extracts from the root bark ofPeriplocasepiumagainstPierisrapae[J].ChineseJournalofAppliedEntomology,2004,141(6):548-552(in Chinese with English abstract).
[5]高履桐,陈翠翠,师宝君,等.杠柳新苷T多克隆抗体的制备[J].西北农业学报,2013,41(2):182-188.
GAO L T,CHEN C C,SHI B J,etal.Separation and preparation of polyclonal antibody of periplocosidet[J].ActaAgricultureBoreali-occidentalisSinica,2013,41(2):182-188(in Chinese with English abstract).
[6]赵彦超,师宝君,胡兆农.杠柳毒素NW杀虫活性测定[J].昆虫知识,2008,45(6):950-952.
ZHAO Y CH,SHI B J,HU ZH N.The insecticidal activity of periplocoside NW [J].ChineseBullEntomology,2008,45(6):950-952(in Chinese with English abstract).
[7]赵娟.杠柳毒素NW的分离及对东方粘虫和小地老虎幼虫中肠组织的影响[D].陕西杨凌:西北农林科技大学,2010.
ZHAO J.Study on the separation,ultrastructure effect onMythimnaseparateandAgrotisypsilonof periplocoside NW [D].Yangling Shaanxi:Northwest A&F University,2010(in Chinese with English abstract).
[8]孙文聪.杠柳毒素作用东方粘虫幼虫中肠细胞的免疫定位及其作用靶蛋白分离的基础研究[D].陕西杨凌:西北农林科技大学,2012.
SUN W C.Immuno-electron microscopic localization of periplocoside on midgut of larvale ofMythimmaseparataand preliminary study on separation of target protain [D].Yangling Shaanxi:Northwest A&F University,2012(in Chinese with English abstract).
[9]VADLAMUDI R K,JI T H,BULLA LA J.A specific binding protein fromManducasextafor the insecticidal toxin ofBacillusthuringiensissubsp Berliner [J].JournalofBiologicalChemistry,1993,268(17):12334-12340.
[10]GAHAN L J,GOULD F,HECKEL D G.Identification of a gene associated with Bt resistance inHeliothisvirescens[J].Science,2001,293(5531):857-860.
[11]KNIGHT P J,CRICKMORE N,ELLAR D J.The receptor forBacillusthuringiensisCrylAc delta-endotoxin in the brush border membrane of the lepidopteranManducasextais aminopeptidase N [J].JournalofMolecularBiology,1994,11(3):429-436.
[12]MCNALL R J,ADANG M J.Identification of novelBacillusthuringiensiscrylac binding proteins inManducasextamidgut through proteomic analysis [J].InsectBiochemistryandMolecularBiology,2003,33(10):999-1010.
[13]FENG M X,SHI B J,ZHAO Y CH,etal.Histopathological effects and immunolocalization of periplocoside NW fromPeriplocasepiumBunge on the midgut epithelium ofMythimnaseparataWalker larvae [J].PesticideBiochemistryandPhysiology,2014,10(151):67-72.
[14]WOLFERSBERGER M,LUETHY P,MAURER A,etal.Preparation and partial characterization of amino acid transporting brush border membrane vesicles from the larval midgut of the cabbage butterfly(Pierisbrassicac) [J].ComparativeBiochemistryandPhysiology,1987,86(2):301-308.
[15]BANERJEE S,HESS D,MAJUMDER P,etal.The interactions ofAlliumsativumleaf agglutinin with a chaperonin group of unique receptor protein isolated from a bacterial endosymbiont of the mustard aphid [J].JournalofMolecularBiology,2004,279(22):23782-23789.
[16]MENG X,HU J J,XU X X,etal.Toxic effect of destruxin A on abnormal wing disc-like(SLAWD) inSpodopteraliturafabricius(Lepidoptera:Noctuidae) [J].PlosOne,2013,2(8):1-8.
[17]ROBERT O R,DARRELL R A.Arylphorin fromManducasexta:carbohydrate structure and immunological studies [J].ArchivesofBiochemistryandBiophysics,1985,11(15):115-124.
[18]李燕,王中康,陈环,等.斜纹夜蛾SPLPDI的克隆表达及其对莱氏野村菌的免疫应答分析[J].中国农业科学,2013,46(7):1359-1369.
LI Y,WANG ZH K,CHEN H,etal.Molecular cloning and expression pattern analysis of protein disulfide isomerases(SPLPDI) inSpodopteralitura[J].ScientiaAgriculturaSinica,2013,46(7):1359-1369(in Chinese with English abstract).
[19]ELLINGTON W R.Evolution and physiological roles of phosphagen systems [J].AnnualReviewofPhysiology,2001,63(1):289-325.
[20]常洪雷,梁革梅,于宏坤,等.棉铃虫 Bt毒素受体蛋白-氨肽酶N与抗性的关系[J].植物保护学报,2007,33(1):1-5.
CHANG H L,LIANG G M,YU H K,etal.Relationships between aminopeptidase n-the receptor for bt toxin inHelicoverpaarmigeraand Bt resistance [J].ActaPhytophylacicaSinica,2007,33(1):1-5(in Chinese with English abstract).
[21]HAFINANN C,LUTHY P,PLISKA V.Binding of the delta-endotoxin fromBacillthuringiensisto brush border membrane vesicles of the eabbage butterfly(Pierisbrassieae) [J].EuropeanJournalofMedicinalChemistry,1988,173(1):85-91.
[22]KNIGHT P K,CRIEKMORE N,ELLAR D J.The receptor forBaeillusthurigiensiscryia(e) delta-endotoxin in the brush border membrane of lepidopte-ran manduea sexta is aminopeptidase N[J].MolecularMicrobiology,1994,11(3):429-436.
[23]SHITOMI Y,HAYAKAWA T,HOSSAIN D M,etal.A novel 96-kDa aminopeptidase localized on epithelial cell membranes ofBombyxmorimidgut,which binds to Cry 1 Ac ofBacillusthuringiensis[J].JournalofBiologicalChemistry,2006,139(2):223-233.
[24]VALAITIS A P,LEE M K,RAJAMOHAN F,etal.Brush border membrane aminopeptidase N in the midgut of the gypsy moth serves as the receptor for the Cry1Ae delta endotoxin ofBaeillusthuringiensis[J].InsectBiochemistryandMolecularBiology,1995,25(10):1143-1151.
[25]SALVADORH,BRENDA O,JUAN F.Different meehanisms of resistance toBaeillusthuringierrsistoxins in the indianmeal moth [J].AppliedandEnvironmentalMicrobiology,2001,67(3):1085-1089.
[26]SEHNEPF E,CRICKMORE N,VAN R J,etal.Baeillusthuringiensisand its pestieidal crystal proteins [J].MicrobiologyandMolecularBiology,1998,62(3):775-806.
[27]COOPER M A,CARROLL J,TRAVIS E,etal.BacillusthuringiensisCrylAc toxin interaction withManducasextaaminopeptidase N in a model membrane environment [J].BiochemicalJournal,1998,333:677-683.
[28]JENKINS J,DEAN D H.Binding specificity ofBacillusthuringiensisCrylAa for purified,nativeBombyxmoriaminopeptidase N and cadherin-like receptors[J].BiomedCentraBiochemistry,2001,2:12-18.
Corresponding authorHU Zhaonong,male,Ph.D,professor.Research area:pesticide toxicology.E-mail: huzhaonong@nwsuaf.edu.cn
(责任编辑:成敏Responsible editor:CHENG Min)
Effect of Active Insecticidal Periplocoside P onMythimnaseparataMidgut Cell Binding Proteins
QI Meng1,2, HE Zhenyu1,2, LI Renfeng1,2and HU Zhaonong1,2
(1.Institution of Pesticide Science, Northwest A&F University, Yangling Shaanxi712100, China; 2.Key Laboratory of Botanical Pesticide R&D in Shaanxi Province,Yangling Shaanxi712100,China)
The periplocoside P is a kind of steroidal glycoside compound isolated from the root bark ofPeriplocasepiumBunge, which showed good insecticidal activity toMythimnaseparatalarvae.In order to study the insecticidal mechanism of periplocoside P, and research the suspected action site for the periplocoside P in the midgut ofMythimnaseparate, this paper modified the structure of periplocoside P and then incubated it with the BBMV in vitro.Though the enhanced UV absorption value, the binding protein is separated and purified from the BBMV in the midgut ofMythimnaseparatalarvae.The results showed that suspected binding protein of periplocoside P exists in the BBMV in the midgut ofMythimnaseparatalarvae.After the isolation, purification and identification, five kinds of suspected binding proteins was got, which is abnormal wing disc-like protein, aminopeptidase N, protein disulfide isomerase, arylphorin and arginine kinase-like protein, respectively.Through further analysis, we speculated that aminopeptidase N may be the most likely binding protein of the periplocoside P.In this paper, we preliminary make clear the suspected action site for the periplocoside P in the midgut ofMythimnaseparate,but further validation research still needs.This study provides a foundation and basis for further study on insecticidal mechanism and target location of the periplocosides compounds.
Periplocoside P;Mythimnaseparate; BBMV; Binding protein
2015-04-27Returned2015-05-21
National Natural Science Foundation of China(No.31171868); the Fundamental Research Funds for the Central Universities(No.QN2011058).
QI Meng,male,master student.Research area:pesticide toxicology.E-mail:15753118831@163.com
2015-04-27
2015-05-21
国家自然科学基金(31171868);中央高校基本科研业务费专项资金(QN2011058)。
齐猛,男,硕士研究生,从事农药毒理学研究。E-mail:15753118831@163.com
胡兆农,男,博士,教授,博士生导师,主要从事农药毒理学研究。 E-mail: huzhaonong@nwsuaf.edu.cn
S481+.1
A
1004-1389(2016)08-1250-07
网络出版日期:2016-07-14
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160714.1105.040.html
