结缔组织病相关肺纤维化、未分化结缔组织病相关肺纤维化和特发性肺纤维化特征分析
2016-09-12谢荣华杨西超庞琳烜郑朝晖
谢荣华, 杨西超, 庞琳烜, 郑朝晖, 朱 平
(第四军医大学西京医院临床免疫科,全军风湿病研究所,西安 710032; *通讯作者,E-mail: zhuping@fmmu.edu.cn)
结缔组织病相关肺纤维化、未分化结缔组织病相关肺纤维化和特发性肺纤维化特征分析
谢荣华, 杨西超, 庞琳烜, 郑朝晖, 朱平*
(第四军医大学西京医院临床免疫科,全军风湿病研究所,西安710032;*通讯作者,E-mail: zhuping@fmmu.edu.cn)
目的比较结缔组织病相关肺纤维化(CTD-PF)、未分化结缔组织病相关肺纤维化(UCTD-PF)及特发性肺纤维化(IPF)临床特征。方法收集西京医院2015-01~2015-12诊断为肺纤维化的住院患者,同时排除已知其他原因导致的肺纤维化患者。回顾性分析三组患者临床表现、自身抗体、高分辨胸部CT、血气分析等特征。结果总共纳入414例患者,其中CTD-PF 226例(54.6%),UCTD-PF 50例(12.1%),IPF 138例(33.3%)。三组患者平均年龄分别为54.4岁,57.6岁和66.8岁,女性比率分别为70.8%,62.0%和21.0%。吸烟在IPF患者中更多见。CTD-PF组自身抗体多种阳性,UCTD-PF组中亦可见到较多自身抗体阳性,但是UCTD-PF组各种自身抗体阳性的比率较CTD-PF组低。IPF组可见ANA、抗SSA抗体和抗Ro-52抗体等阳性,其他较少见。CTD-PF和UCTD-PF患者胸部CT以小结节影等炎性表现为主,IPF患者以蜂窝状影、肺大疱、肺气肿等纤维化表现多见。另外,IPF患者并发肺部感染和呼吸衰竭的比率显著高于CTD-PF和UCTD-PF患者。结论CTD-PF、UCTD-PF、IPF三组患者临床特征有相似及重叠之处,但亦各有特点,IPF患者肺部表现更严重。因此,对PF患者常规进行系统评估尤其自身抗体监测,有助于不同PF的鉴别诊断及合理治疗。
肺纤维化;结缔组织病;未分化结缔组织病;特发性肺纤维化
肺纤维化(pulmonary fibrosis,PF)是不同病因导致的一组异质性疾病,主要表现为进行性气短,限制性通气功能障碍、弥散功能减退以及低氧血症,最终导致患者呼吸衰竭甚至死亡,预后较差。胸部CT可表现为磨玻璃影、蜂窝影、肺大疱及支气管扩张等。不同病因导致的PF临床表现、影像学、肺功能及病理具有很多相似及重叠之处,但他们的治疗及预后不尽相同。
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是PF中发病率最高的疾病之一,呈慢性、进行性进展,最终导致肺脏功能丧失,预后极差[1]。IPF的典型影像学及病理学表现为寻常性间质性肺炎(usual interstitial pneumonia,UIP),但是UIP并非IPF所特有,结缔组织病(connective tissue disease,CTD)和矽肺等也可表现为UIP[2]。任何CTD都可能发生PF,发病率和严重程度不尽相同[3],但是结缔组织病相关肺纤维化(CTD-PF)的长期预后较IPF良好[4]。另外,有一些患者虽然具有CTD的一些临床表现和自身抗体异常,但是又不满足某种明确结缔组织病诊断标准,这部分患者称之为未分化结缔组织病(undifferentiated connective tissue disease,UCTD)。UCTD患者的病情一般较轻,但有部分患者会发生PF[5]。另有报道称,UCTD-PF占PF患者的25%[6]。由于不同PF患者临床表现、治疗及预后不尽相同,因此深入了解这些疾病特点,对患者进行正确分类,有助于提高我们对PF的认识及合理诊治。
1 资料与方法
1.1研究对象
西京医院2015-01~2015-12诊断为肺纤维化的住院患者,同时排除掉已知其他原因导致的肺间质纤维化患者。符合美国风湿病学会标准能够诊断为CTD的患者定义为CTD-PF,不满足CTD诊断标准但是具有至少一项临床症状和至少一项血清学阳性提示CTD可能的定义为UCTD-PF,根据美国胸科学会标准来定义IPF[7]。血清学阳性定义为超出参考值范围,而ANA阳性则定义为滴度超过1 ∶160。1.2资料收集
通过检索患者电子住院病历资料,回顾性分析患者临床表现、自身抗体、胸部高分辨CT(high-resolution computed tomography,HRCT)、血气分析等结果。临床表现主要包括与PF相关症状如气短、咳嗽、咳痰以及与CTD相关的症状如皮疹、关节痛等。胸部HRCT包括实变、磨玻璃影、网格状影、蜂窝状影、支气管牵张、肺大疱、肺气肿、斑点/片影、条索影、小结节影、胸膜增厚或胸腔积液等。
1.3统计学分析
2 结果
2.1研究人群
总共有420例患者诊断为肺纤维化,6例患者具有明确的病因被剔除。被剔除的6例患者中1例长期服用胺碘酮,考虑为药物引起的肺纤维化,另5例有长期煤矿或砂石暴露史,考虑尘肺引起的肺纤维化。总共414例患者被纳入该研究,其中226例(54.6%)符合CTD-PF标准,50例(12.1%)符合UCTD-PF标准,138例(33.3%)符合IPF标准。
2.2临床特征
CTD-PF、UCTD-PF和IPF三组患者平均年龄分别为54.4,57.6和66.8岁,女性比率分别为70.8%,62.0%和21.0%,吸烟患者比率分别为19.9%,38.0%,62.3%。IPF组患者平均年龄、男性和吸烟患者比率明显大于CTD-PF和UCTD-PF组患者(P<0.05,见表1)。
咳嗽、咳痰、气短在三组均常见,但是IPF相对于CTD-PF和UCTD-PF更多见(P<0.05)。结缔组织病相关症状在CTD-PF患者普遍多见,在UCTD-PF患者中亦可见多种症状,但皮疹、关节痛、关节肿、雷诺现象、肌痛和吞咽困难在UCTD-PF患者的比率显著低于CTD-PF患者(P<0.05,见表1)。IPF患者中仅偶见皮疹、口眼干、关节痛,其他症状均未见。
发热在三组均常见,但各组发病率间无明显差异。另外,IPF组合并肺部感染患者比率(79.7%)显著高于CTD-PF组(56.7%)和UCTD-PF组(56.0%)(见表1)。
2.3实验室检查
CTD-PF组自身抗体普遍阳性。UCTD组亦可见多种自身抗体阳性,但是除了ANA患者比率高于CTD组,其他均较CTD组低,其中AKA、抗CCP和抗MCV显著低于CTD组(P<0.05,见表2)。IPF患者中ANA、抗SSA、抗Ro-52较多见,其他均较少。
2.4胸部HRCT
所有患者胸部HRCT均显示有肺纹理增多紊乱。CTD-PF和UCTD-PF患者胸部HRCT表现无显著差异。CTD-PF组实变影、小结节影、条索状影、斑P1为CTD-PF与UCTD-PF比较;P2为CTD-PF与IPF比较;P3为UCTD-PF与IPF比较
点/片絮状影比率显著高于IPF组(P<0.05),而IPF组蜂窝状影、肺大疱、肺气肿比率显著高于CTD-PF组(P<0.05)。UCTD-PF组仅小结节影比率显著高于IPF组(P<0.05),肺大疱、肺气肿比率在IPF组显著高于UCTD-PF组(P<0.05)。以上资料显示,IPF患者更多表现为蜂窝状影、肺大疱、肺气肿等,CTD-PF和UCTD-PF患者则以实变、小结节影、斑点/絮状影等较多见(见表3)。
表1CTD-PF、UCTD-PF和IPF三组临床症状比较
Table 1Comparison of clinical features among CTD-PF, UCTD-PF and IPF patients
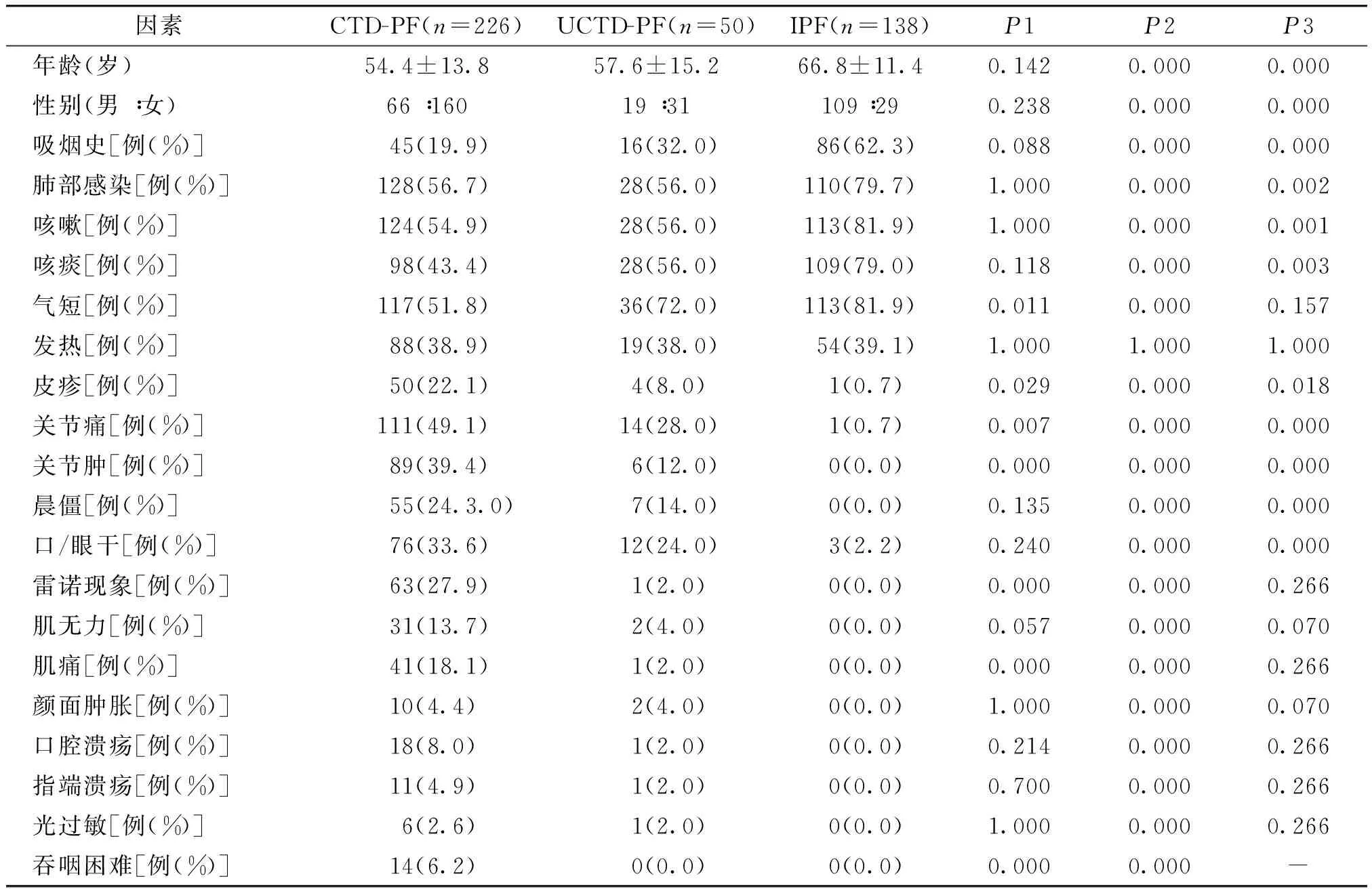
因素CTD-PF(n=226)UCTD-PF(n=50)IPF(n=138)P1P2P3年龄(岁)54.4±13.857.6±15.266.8±11.40.1420.0000.000性别(男∶女)66∶16019∶31109∶290.2380.0000.000吸烟史[例(%)]45(19.9) 16(32.0)86(62.3)0.0880.0000.000肺部感染[例(%)]128(56.7)28(56.0)110(79.7)1.0000.0000.002咳嗽[例(%)]124(54.9)28(56.0)113(81.9)1.0000.0000.001咳痰[例(%)]98(43.4)28(56.0)109(79.0)0.1180.0000.003气短[例(%)]117(51.8)36(72.0)113(81.9)0.0110.0000.157发热[例(%)]88(38.9)19(38.0)54(39.1)1.0001.0001.000皮疹[例(%)] 50(22.1) 4(8.0)1(0.7)0.0290.0000.018关节痛[例(%)]111(49.1) 14(28.0)1(0.7)0.0070.0000.000关节肿[例(%)]89(39.4)6(12.0)0(0.0)0.0000.0000.000晨僵[例(%)] 55(24.3.0) 7(14.0)0(0.0)0.1350.0000.000口/眼干[例(%)] 76(33.6) 12(24.0)3(2.2)0.2400.0000.000雷诺现象[例(%)] 63(27.9) 1(2.0)0(0.0)0.0000.0000.266肌无力[例(%)]31(13.7)2(4.0)0(0.0)0.0570.0000.070肌痛[例(%)]41(18.1)1(2.0)0(0.0)0.0000.0000.266颜面肿胀[例(%)]10(4.4) 2(4.0)0(0.0)1.0000.0000.070口腔溃疡[例(%)]18(8.0)1(2.0)0(0.0)0.2140.0000.266指端溃疡[例(%)]11(4.9)1(2.0)0(0.0)0.7000.0000.266光过敏[例(%)]6(2.6)1(2.0)0(0.0)1.0000.0000.266吞咽困难[例(%)]14(6.2)0(0.0)0(0.0)0.0000.000-
P1为CTD-PF与UCTD-PF比较;P2为CTD-PF与IPF比较;P3为UCTD-PF与IPF比较
表2CTD-PF、UCTD-PF和IPF三组自身抗体比较例(%)
Table 2Comparison of autoantibodies among CTD-PF, UCTD-PF and IPF patients cases(%)

抗体CTD-PF(n=226)UCTD-PF(n=50)IPF(n=138)P1P2P3ANA53(23.5)38(76.0)11(8.0)0.0000.0000.000RF72(31.9)10(20.0)1(0.7)0.1230.0000.000抗ds-DNA14(6.2) 1(2.0)0(0.0)0.3210.0010.266抗RNP37(16.4)5(10.0)3(2.2)0.3830.0000.032抗Sm12(5.3) 0(0.0)1(0.7)0.1320.0211.000抗SSA74(32.7)11(22.0)5(3.6)0.1750.0000.000抗SSB19(8.4) 1(2.0)1(0.7)0.1400.0010.462抗Ro-52100(44.2) 18(36.0)7(5.1)0.3440.0000.000抗Scl-7025(11.1)5(10.0)2(1.4)1.0000.0000.015抗核糖体P蛋白14(6.2) 0(0.0)2(1.4)0.0810.0351.000着丝点B10(4.4) 0(0.0)0(0.0)0.2170.016-抗核小体20(8.8) 1(2.0)3(2.2)0.1390.0131.000抗Jo-115(6.6) 1(2.0)4(2.9)0.3190.1481.000ACL6(2.7)1(2.0)1(0.7)0.6390.2600.462ANCA18(8.0) 2(4.0)1(0.7)0.2140.0020.164AKA27(11.9)0(0.0)0(0.0)0.0000.000-抗CCP48(21.0)2(4.0)0(0.0)0.0070.0000.066抗MCV47(20.8)2(4.0)0(0.0)0.0040.0000.066
2.5血气分析
呼吸衰竭在IPF组显著高于CTD-PF和UCTD-PF组(P<0.05)。低氧血症在IPF组高于CTD-PF和UCTD-PF组,但无统计学差异。三组均1型呼吸衰竭为主,偶见2型呼吸衰竭(见表4)。
表3CTD-PF、UCTD-PF和IPF三组胸部HRCT表现比较例(%)
Table 3Comparison of chest HRCT among CTD-PF, UCTD-PF and IPF patientscases(%)
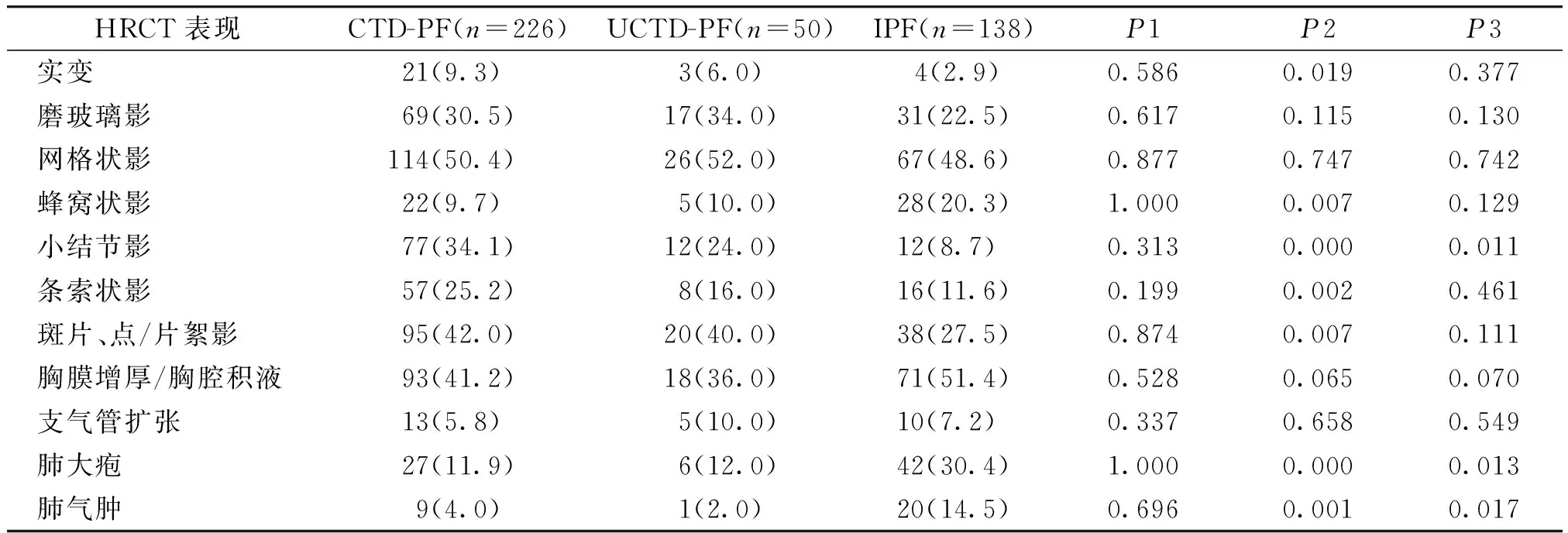
HRCT表现CTD-PF(n=226)UCTD-PF(n=50)IPF(n=138)P1P2P3实变21(9.3) 3(6.0)4(2.9)0.5860.0190.377磨玻璃影69(30.5)17(34.0)31(22.5)0.6170.1150.130网格状影114(50.4) 26(52.0)67(48.6)0.8770.7470.742蜂窝状影22(9.7) 5(10.0)28(20.3)1.0000.0070.129小结节影77(34.1)12(24.0)12(8.7) 0.3130.0000.011条索状影57(25.2)8(16.0)16(11.6)0.1990.0020.461斑片、点/片絮影95(42.0)20(40.0)38(27.5)0.8740.0070.111胸膜增厚/胸腔积液93(41.2)18(36.0)71(51.4)0.5280.0650.070支气管扩张13(5.8) 5(10.0)10(7.2) 0.3370.6580.549肺大疱27(11.9)6(12.0)42(30.4)1.0000.0000.013肺气肿9(4.0)1(2.0)20(14.5)0.6960.0010.017
P1为CTD-PF与UCTD-PF比较;P2为CTD-PF与IPF比较;P3为UCTD-PF与IPF比较
表4CTD-PF、UCTD-PF和IPF三组血气分析比较例(%)
Table 4Comparison of blood gas analysis among CTD-PF,UCTD-PF and IPF patientscases(%)
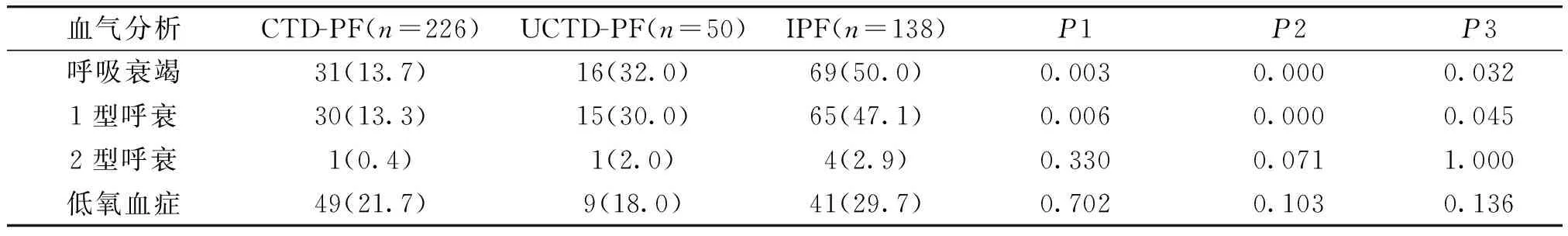
血气分析CTD-PF(n=226)UCTD-PF(n=50)IPF(n=138)P1P2P3呼吸衰竭31(13.7)16(32.0)69(50.0)0.0030.0000.0321型呼衰30(13.3)15(30.0)65(47.1)0.0060.0000.0452型呼衰1(0.4)1(2.0)4(2.9)0.3300.0711.000低氧血症49(21.7)9(18.0)41(29.7)0.7020.1030.136
P1为CTD-PF与UCTD-PF比较;P2为CTD-PF与IPF比较;P3为UCTD-PF与IPF比较
3 讨论
本研究中,我们回顾性分析了414例PF患者,其中CTD-PF患者所占比例最多,其次为IPF患者,UCTD-PF最少,这与Hu等[8]报道基本一致。但Lin等[9]报道三组患者比例相当,Vij等[5]报道UCTD-PF和IPF患者比例高于CTD-PF,此两项研究与本研究均不尽一致。与其他报道不尽一致的原因,一方面可能我们风湿免疫科就诊患者较多,因此能够确诊为CTD-PF的患者较多,另一方面可能一部分外院诊断为UCTD-PF或IPF的患者,经过我院风湿科专科诊断后确诊为CTD-PF。Hu等[8]研究发现,25%患者院外初始就诊时,自身抗体阴性,后来出现自身抗体阳性。该研究中CTD-PF和UCTD-PF患者总共占了66.7%,因此,大部分的PF患者是与自身免疫相关的,这与Lin等[9]研究一致。与自身免疫相关的PF患者激素及免疫抑制剂反应良好,预后相对较好。
本研究中CTD-PF和UCTD-PF患者以女性为主,年龄较IPF轻,少有吸烟史,多伴有关节肿痛等结缔组织病症状,自身抗体广泛阳性,但UCTD-PF较CTD-PF比较,其结缔组织病相关症状及自身抗体均少见。IPF患者以老年男性为主,多有吸烟史,偶见关节痛等症状,自身抗体可见ANA、抗Ro-52和抗SSA阳性,但这些症状及自身抗体特异性较低,正常人群亦可见。由此可见,对于女性、年龄较轻,无吸烟史的PF患者,要注意关节痛、口眼干、雷诺现象等结缔组织病相关症状的病史询问,并常规筛查自身抗体等。
CTD-PF和UCTD-PF胸部HRCT表现无显著差异,提示虽然UCTD的症状和自身抗体表现较CTD少,但其肺纤维化的表现并不比CTD更轻,因此UCTD的肺间质病变不容忽视。IPF患者蜂窝状影、肺大疱、肺气肿及呼吸衰竭较CTD-PF及UCTD-PF患者更多见,提示IPF患者胸部HRCT表现可能更晚期、病变更重。由于IPF起病隐匿,早期多无症状,出现咳嗽、气短等表现时,病情可能已进展多年,胸部HRCT则会呈现蜂窝状、肺大疱等晚期表现,此时病变多已不可逆。2015年美国、欧洲、日本、拉丁美洲等对于IPF的声明中指出,胸部HRCT蜂窝状改变的程度及范围与增高的死亡率有关[7]。CTD-PF和UCTD-PF小结节影等炎性表现较IPF患者多,但缺乏特异性。CTD-PF患者多以关节痛等结缔组织病症状就诊,随着风湿科医生对该病认识加深,患者在住院期间行常规胸部CT检查,此时患者多无咳嗽、气短等呼吸道症状,因此PF诊断相对较早,这也可以解释其胸部CT表现较早、较轻、炎性改变多见的特点。
IPF患者诊断肺部感染的比率明显高于CTD-PF和UCTD-PF。可能的原因有:IPF患者胸部HRCT肺纤维化程度更晚期,肺功能较差,因此伴发肺部感染的风险增高;IPF患者起病隐匿,多在出现呼吸道症状,如咳嗽、咳痰、气短时等就诊,此时伴发肺部感染比率增高。CTD-PF和UCTD-PF患者中有一部分患者病情活动时伴随发热,因此,虽然CTD-PF和UCTD-PF患者肺部感染比率低于IPF,但是发热患者比率相当。
IPF患者5年生存率仅有20%,可从长期稳定到突然恶化[10]。近年来吡非尼酮和尼达尼布在国外批准上市为IPF患者带来希望,但是,IPF仍是一个不可治的疾病。而CTD-PF和UCTD-PF对激素、免疫抑制剂及生物制剂可能有效[11],可以显著延缓患者生存期。虽然UCTD-PF患者其临床特征及胸部HRCT更接近于CTD-PF患者,但是UCTD-PF患者的结缔组织病症状和自身抗体阳性率明显少于CTD-PF患者,容易被忽略及漏诊。因此对于合并不典型CTD的ILD患者,更应提高警惕,考虑UCTD-ILD可能,风湿科和呼吸科医生多学科合作显得异常重要。有文献报道,部分PF患者就诊时自身抗体阴性,在多年后甚至出现自身抗体如ANCA等阳性[12]。因此,对于PF患者需要常规进行自身抗体检测,UCTD-PF和即使自身抗体阴性的患者也要随访监测。
本研究也有一些局限,它是仅在一个医院进行的回顾性研究,而且由于肺脏活检的有创性,风险较大,患者多不接受,所以缺乏活检病理的相关研究。因此,进行多中心、前瞻性研究以及开展创伤更小、更安全的肺部病理活检迫在眉睫。
[1]Spagnolo P,Sverzellati N,Rossi G,etal.Idiopathic pulmonary fibrosis:an update[J].Ann Med,2015,47(1):15-27.
[2]Kreuter M,Bonella F,Wijsenbeek M,etal.Pharmacological treatment of idiopathic pulmonary fibrosis:current approaches,unsolved issues,and future perspectives[J].Biomed Res Int,2015,2015:329481.
[3]Fischer A,du Bois R.Interstitial lung disease in connective tissue disorders[J].Lancet,2012,380(9842):689-698.
[4]Navaratnam V,Ali N,Smith CJ,etal.Does the presence of connective tissue disease modify survival in patients with pulmonary fibrosis?[J].Respir Med,2011,105(12):1925-1930.
[5]Vij R,Noth I,Strek ME.Autoimmune-featured interstitial lung disease:a distinct entity[J].Chest,2011,140(5):1292-1299.
[6]Collard Kinder BW,Shariat C,Collard HR,etal.Undiferentiated connective tissue disease-associated interstitial lung disease:changes in lung function[J].Lung,2010,188(2):143-149.
[7]Raghu G,Rochwerg B,Zhang Y,etal.An official ATS/ERS/JRS/ALAT clinical practice guideline: treatment of idiopathic pulmonary fibrosis.an update of the 2011 clinical practice guideline[J].Am J Respir Crit Care Med,2015,192(2):e3-19.
[8]Hu Y,Wang LS,Wei YR,etal.Clinical characteristics of connective tissue disease-associated interstitial lung disease in 1044 Chinese patients[J].Chest,2016,149(1):201-208.
[9]Pan L,Liu Y,Sun R,etal.Comparison of characteristics of connective tissue disease-associated interstitial lung diseases, undifferentiated connective tissue disease-associated interstitial lung diseases,and idiopathic pulmonary fibrosis in Chinese Han population:a retrospective study[J].Clin Dev Immunol,2013,2013:121578.
[10]Kreuter M,Bonella F,Wijsenbeek M,etal.Pharmacological treatment of idiopathic pulmonary fibrosis:current approaches,unsolved issues,and future perspectives[J].Biomed Res Int,2015,2015:329481.
[11]Carmier D,Diot É,Guilleminault L,etal.Interstitial lung disease in connective tissue disorders[J].Rev Prat,2014,64(7):941-945.
[12]Pineton de Chambrun M,Nunes H,etal.Idiopathic lung fibrosis and anti myeloperoxidase glomerulonephritis:the tree that hides the forest[J].BMC Pulm Med,2015,15:130.
Comparison of characteristics of connective tissue disease-associated pulmonary fibrosis, undifferentiated connective tissue disease-associated pulmonary fibrosis,and idiopathic pulmonary fibrosis
XIE Ronghua, YANG Xichao, PANG Linxuan, ZHENG Zhaohui, ZHU Ping*
(DepartmentofClinicalImmune,XijingHospital,FourthMilitaryMedicalUniversity,PLASpecializedResearchInstituteofRheumatologyandImmunology,Xi’an710032,China;*Correspondingauthor,E-mail:zhuping@fmmu.edu.cn)
ObjectiveTo compare the characteristics of connective tissue disease-associated pulmonary fibrosis(CTD-PF), undifferentiated connective tissue disease-associated pulmonary fibrosis(UCTD-PF) and idiopathic pulmonary fibrosis(IPF).MethodsPatients with pulmonary fibrosis(PF) in Xijing Hospital from January 2015 to December 2015 were selected in this study,and the PF patients with other known causes were excluded. The clinical manifestation, autoantibody serology, chest high resolution CT, blood gas analysis and other characteristics were retrospectively analyzed.ResultsA total of 414 patients were enrolled in this study including 226 cases(54.6%) of CTD-PF, 50 cases(12.1%) of UCTD-PF and 138 cases (33.3%) of IPF. The mean age of CTD-PF, UCTD-PF and IPF was 54.4,57.6 and 66.8 years, respectively. The female accounted for 70.8%,62.0% and 21.0% in CTD-PF, UCTD-PF and IPF patients, respectively. Smoking was more common in IPF patients than in CTD-PF, UCTD-PF patients. Varieties of autoantibodies were seen in CTD-PF group and UCTD-PF group, but the prevalence of each autoantibody in UCTD-PF group was fewer than in CTD-PF group. Only antinuclear antibody, anti-SSA antibody and anti-Ro-52 antibody were found in IPF group, and the other autoantibodies were seldom seen in IPF. The inflammatory nodules were the common features in CTD-PF and UCTD-PF patients, while the honeycomb, pulmonary bulla and emphysema were the most frequent features in IPF group. In addition, the prevalences of pulmonary infection and respiratory failure were higher in IPF patients than in the other patients.ConclusionPatients with CTD-PF, UCTD-PF and IPF have some similar characteristics, but they show distinct features. The lung manifestation may be more serious in IPF patients than those in CTD-PF and UCTD-PF patients. Thus the overall assessment of PF, especially the autoantibodies monitor, will be conducive to the differential diagnosis of PF and proper treatment.
pulmonary fibrosis;connective tissue disease;undifferentiated connective tissue disease;idiopathic pulmonary fibrosis
国家科技重大专项基金资助项目(2014ZX09508002-002)
谢荣华,女,1978-06生, 硕士,主治医师,E-mail: xieronghua1978@126.com
2016-06-03
R563
A
1007-6611(2016)08-0737-05
10.13753/j.issn.1007-6611.2016.08.014
