乌鸡肽对小鼠免疫调节作用影响的实验研究
2016-09-12冯金秋刘文颖朱小语陈晓文范爱琴蔡木易潘兴昌许雅君
冯金秋,刘文颖,许 丹,朱小语,陈晓文,范爱琴,鲁 军,蔡木易,潘兴昌,*,许雅君,*
(1.北京大学公共卫生学院营养与食品卫生学系,北京 100191;2.中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京 100015)
乌鸡肽对小鼠免疫调节作用影响的实验研究
冯金秋1,刘文颖2,+,许丹1,朱小语1,陈晓文1,范爱琴1,鲁军2,蔡木易2,潘兴昌2,*,许雅君1,*
(1.北京大学公共卫生学院营养与食品卫生学系,北京 100191;2.中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京 100015)
目的:观察并探讨乌鸡肽对小鼠免疫功能的影响。方法:以成年ICR雌性小鼠为动物模型,观察不同剂量(0.5、1.0、2.0 g/kg BW)乌鸡肽对小鼠体重、免疫器官相对重量、细胞免疫功能、体液免疫功能的影响,并从组织形态上观察胸腺的微观结构变化。结果:1.0、2.0 g/kg BW乌鸡肽干预组的足趾肿胀度、2.0 g/kg BW乌鸡肽干预组的溶血空斑数的对数转换值显著高于对照组(p<0.05)。与对照组相比,1.0、2.0 g/kg BW乌鸡肽干预组小鼠胸腺皮质的淋巴细胞数量显著增多(p<0.05)。各乌鸡肽剂量组对小鼠体重增长、免疫器官指数以及血清半数溶血值均无显著影响(p>0.05)。结论:乌鸡肽对小鼠的免疫功能有一定的促进作用。
乌鸡肽,细胞免疫,体液免疫,免疫器官
乌鸡,作为我国特有的药用保健鸡种,已经有千余年的饲养与药用的历史。早在《神农本草经》中就有将丹雄鸡列为“上品”的记载:“味甘微温,主女人绷中漏下,赤血沃,补虚,温中,止血”。现代医学研究发现,乌鸡内含丰富的黑色素、蛋白质、B族维生素和18种微量元素等,而胆固醇和脂肪含量却很低。乌鸡肉中粗蛋白含量高达63.79%,比普通大黄鸡高1.52倍。鲜肉中氨基酸含量较高,必需氨基酸齐全,且甲硫氨酸、苯丙氨酸、半胱氨酸含量较高。
近年来,人们已经从多种动物以及植物体内提取出具有免疫调节活性的肽类物质[1-7]。本文以ICR小鼠为模型,研究乌鸡肽对小鼠的免疫功能的影响,以期能够为乌鸡肽的开发与利用提供一定的实验依据。
1 材料与方法
1.1材料与仪器
乌鸡肽干粉由中国食品发酵工业研究院提供,乌鸡肽是由乌鸡蛋白经酶解制得的相对分子量低于1000 u的寡肽混合物。绵羊红细胞(sheep red blood cell,SRBC),补体(豚鼠血清),Hank’s液,SA缓冲液,琼脂糖,RPMI1640培养液,都氏试剂。
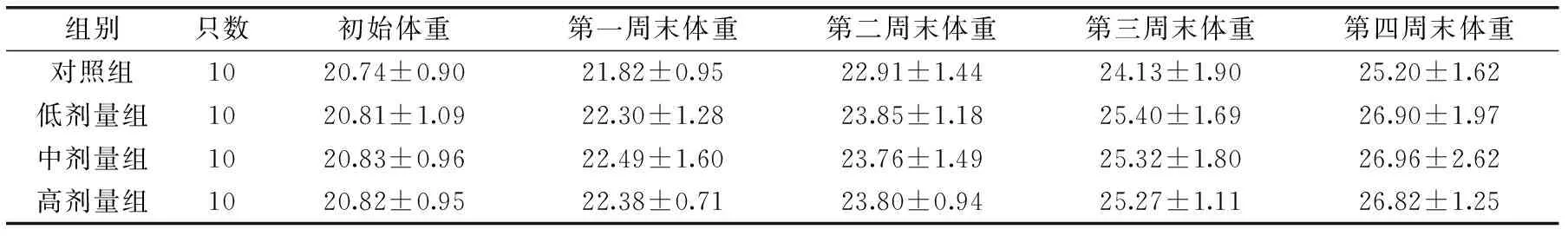
表1 小鼠每周体重情况(g)Table 1 The body weight of mice in every week
SPN3001F电子天平,游标卡尺,离心机,恒温水浴箱,CO2培养箱,DNM-9602G酶标仪。
1.2实验动物
SPF级ICR健康雌性小鼠,初始体重18~22 g,购自北京大学医学部实验动物科学部,合格证号:SCXK(京)2009-0008。饲养于屏障环境,温度范围为22±2 ℃,相对湿度为50%~60%,明暗交替时间为12 h:12 h,自由进食普通饲料、饮水。
1.3实验方法
实验动物适应性喂养3 d后,将实验动物进行分组,分为对照组和乌鸡肽低、中、高实验组,每组10只动物。分别给予对照组酪蛋白2.0 g/kg BW、实验组0.5、1.0、2.0 g/kg BW的乌鸡肽。乌鸡肽干粉用灭菌蒸馏水配制,灌胃给予,灌胃体积为0.1 mL/10 g鼠重,每天1次。每周需要测量体重来重新调整灌胃量。在实验期间,动物自由进食、饮水。连续灌胃4周后,处死动物,进行相应的指标检测。
1.4观察指标
1.4.1脏器指数和胸腺组织形态学观察灌胃4周后,动物禁食过夜,不禁水,第二天晨起对动物进行称重后处死,分离胸腺和脾脏,称重,计算各脏器指数,对各组的结果进行比较并观察有无差异。将称重完毕的各组小鼠胸腺浸泡于40 mL/L甲醛溶液固定24 h,流水浸洗30 min,经过750、850、950、1000 mL/L乙醇依次脱水6 h,甲苯处理3 h,石蜡液浸泡40 min后包埋、切片;将切片以苏木素染色10 min,水洗后以1%盐酸酒精(将1 mL浓盐酸加入99 mL 70%酒精)处理40 s,水洗,5 mL/L氨水处理5 s,伊红染色10 min,再由750、850、950、1000 mL/L乙醇依次脱色,经过甲苯透明15 min后以树脂封片镜检。记录各组胸腺组织结构的变化特点。
1.4.2迟发型变态反应(DTH)采用足跖肿胀法[8]。实验动物灌胃4周后,注射2%(v/v)绵羊红细胞(SRBC)来免疫小鼠。4 d后,用游标卡尺测量左后足跖部的厚度,然后在测量部位皮下注射20%(v/v)SRBC 20 μL(约1×108个SRBC),注射24 h后再次测量左后足跖部的厚度。迟发型变态反应的程度可以通过免疫前后两次足跖部厚度的差值来表示。
1.4.3抗体生成细胞检测采用Jerne改良玻片法[8]。注射2%(v/v)绵羊红细胞(SRBC)来免疫小鼠。4 d后,制备脾细胞悬液,浓度为5×106个/mL。加热溶解表层培养基(1%琼脂糖)后,将其置于45~50 ℃水浴保温,然后与等量的2倍浓度、pH7.2~7.4的Hank’s液进行混合,分装小管,每管0.5 mL。向管内加入50 μL 10% SRBC(v/v)10 μL脾细胞悬液,快速对其进行混匀,倾倒在已涂有0.5%琼脂糖薄层的玻片上。然后将凝固后的玻片扣置于片架上,放入CO2培养箱中孵育。1.5 h后,将SA缓冲液(水杨酸缓冲液)稀释的补体(1∶8)加入玻璃架凹槽内,继续孵育1.5 h。计算每组的溶血空斑数,用空斑数/5×106脾细胞来表示。
1.4.4血清溶血素测定采用半数溶血值法(HC50)法[8]。注射2%(v/v)绵羊红细胞(SRBC)来免疫小鼠,4 d后,通过摘眼球的方法进行取血,分离出血清,用SA缓冲液稀释200倍。取1 mL稀释后的血清于试管中,逐步加入10% SRBC 0.5 mL、1∶8稀释豚鼠补体1 mL。另设不加血清的对照管。放入37 ℃恒温水浴中进行保温,30 min后,冰浴终止反应,进行离心。取1 mL上清,加入3 mL都氏试剂,同时取10% SRBC 0.25 mL加入都氏试剂内至4 mL,充分将其混匀,作为SRBC半数溶血管。各管放置10 min后,在540 nm波长处测定OD值,溶血素的量用HC50来表示。HC50的计算公式如下:HC50=(样品OD值/SRBC半数溶血时OD值)×稀释倍数。
1.5数据统计
通过SPSS 21.0统计软件对数据进行处理,结果以均数±标准差表示。采用单因素方差分析并进行方差齐性检验。若方差齐,则用LSD法;若方差不齐,则使用Tamhane’s T2检验。p<0.05时,认为结果有统计学意义。
2 结果与分析
2.1乌鸡肽对小鼠体重及免疫器官相对重量的影响
通过表1以及表2,可以看出3个实验组的初始体重、每周末体重、脾脏和胸腺脏器指数,与对照组比较差异无统计学意义(p>0.05)。
2.2乌鸡肽对小鼠胸腺组织形态学的影响
如图1所示,对照组和实验组小鼠胸腺组织皮质和髓质界限均十分清楚,皮质较厚,有大量排列紧密的淋巴细胞,使皮质着色较深;而髓质部染色较浅,可见较多上皮网状细胞和少量淋巴细胞。与对照组相比,可见乌鸡肽中剂量组以及高剂量组小鼠胸腺皮质区增厚,淋巴细胞数量显著增多。

表2 乌鸡肽对小鼠体重和免疫器官脏器指数的影响Table 2 Effects of Silky Fowl Peptide on immune organ index of mice
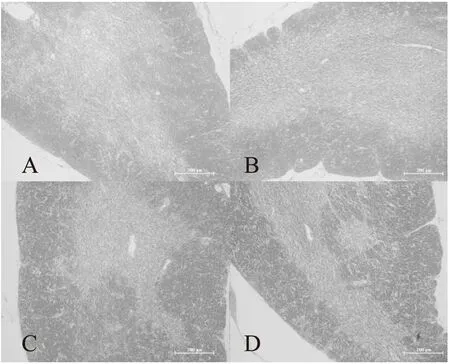
图1 乌鸡肽对小鼠胸腺结构的影响(100×)Fig.1 Effects of Silky Fowl Peptide on the microstructure of thymus in mice(100×)注:A.对照组;B.乌鸡肽低剂量组; C.乌鸡肽中剂量组;D.乌鸡肽高剂量组。
2.3乌鸡肽对小鼠细胞免疫功能的影响
观察表3可知,与对照组相比,乌鸡肽中剂量组和高剂量组的足跖肿胀度均有显著性提高(p<0.05)。乌鸡肽低剂量组与对照组的足跖肿胀度的差异无统计学意义(p>0.05)。

表3 乌鸡肽对小鼠细胞免疫功能的影响Table 3 Effects of Silky Fowl Peptide on cellular immunity in mice
注:*与对照组相比,差异有显著性(p<0.05),表4同。
2.4乌鸡肽对小鼠体液免疫功能的影响
通过表4可以得知,与对照组相比,乌鸡肽高剂量组的抗体生成细胞数有所增加且差异有显著性(p<0.05),而实验组的半数溶血值的差异无统计学意义(p>0.05)。
3 讨论
胸腺是淋巴细胞转化和成熟的重要场所,淋巴样细胞在胸腺经过选择后成熟,并输送到外周发挥免疫调节作用[9]。淋巴细胞参与细胞免疫,具有监视免疫系统和维持免疫系统稳定的作用。脾脏内含有大量的免疫细胞,是全身最大的周围淋巴器官。它还是产生记忆性T、B细胞和血源性抗原发生免疫应答的重要场所[10]。因此,胸腺指数、脾脏指数可从一定角度反映机体的免疫状况。然而在本研究中,乌鸡肽实验组与对照组的胸腺指数、脾脏指数的差异无统计学意义。提示乌鸡肽可能不通过此途径来提高小鼠的免疫功能。

表4 乌鸡肽对小鼠体液免疫的影响Table 4 Effects of Silky Fowl Peptide on humoral immunity in mice
迟发型变态反应可以反映机体的细胞免疫状态[11]。实验结果显示,乌鸡肽中剂量和高剂量能显著促进正常小鼠的迟发型变态反应。说明乌鸡肽可能具有对调节细胞免疫的作用。抗体生成细胞检测及血清溶血素的测定反映了机体的体液免疫状态。实验结果显示,只有乌鸡肽高剂量组能显著提高小鼠的抗体细胞生成数,提示相对于提高小鼠的细胞免疫功能,用乌鸡肽提高小鼠的体液免疫功能可能需要更高的浓度。
镜下观察HE染色病理切片发现,与对照组相比,乌鸡肽中剂量组和高剂量组小鼠胸腺皮质区增厚且淋巴数量显著增多。提示乌鸡肽能促进淋巴细胞的增殖,从而进一步调节机体的免疫力。
综上所述,乌鸡肽可能通过调节细胞免疫、体液免疫以及改善胸腺结构的途径来增强小鼠的免疫功能。本实验为进一步阐明乌鸡肽的免疫调节功效提供了实验依据,为乌鸡肽的开发和使用提供了一定的参考数据。
4 结论
本实验初步探究了乌鸡肽对小鼠免疫功能的影响,结果提示乌鸡肽对小鼠细胞免疫和体液免疫均有一定的调节作用。
[1]刘隆兴,任兴宏,汤禾静,等.羊胎盘免疫活性小分子肽的分离纯化[J].食品科学,2013,34(22):273-276.
[2]Feng Li-na,Liang Chen,Liang Rui-liang,et al.Pilot-scale production of low molecular weight peptides from corn wet milling byproducts and the antihypertensive effectsinvivoandinvitro[J]. Food Chemistry,2011,124(3):801-807.
[3]富校轶,孙茂成,高永欣,等.大豆肽免疫调节作用的研究进展[J].大豆科技,2014,1:38-42.
[4]Hou Hu,Fan Yan,Li Ba-fang,et al.Purificat-ion and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J].Food Chemistry,2012,
134(2):821-828.
[5]富校轶,李博群,张时莹,等.超滤大豆蛋白肽对小鼠免疫功能的影响[J].食品工业科技,2012,33(7):375-378.
[6]代卉,乐国伟,孙进,等.小麦肽对受环磷酰胺免疫抑制小鼠的免疫调节及抗氧化功能[J].生物工程学报,2009,25(4):549-553.
[7]杨睿悦,张召锋,裴新荣,等.海洋蛋白肽对小鼠免疫调节作用的实验研究[J].中国预防医学杂志2008,42(4):221-225.
[8]中华人民共和国卫生部.保健食品检验与评价技术规范.2003.
[9]杨宁波,吴爱勤,陈文,等.慢性心理应激小鼠胸腺免疫细胞凋亡损伤的研究[J].中国行为医学科学,2006,15(11):986-988.
[10]李宗芳,张澎.脾脏的基础研究进展与展望[J].西安交通大学学报(医学版),2008,29(1):1.
[11]罗珍,黄萍,郭重仪,等.猴头菇多糖增强免疫功能的实验研究[J].中国实验方剂学杂志,201l,17(4):182-183.
Study on the immunomodulating effect of Silky Fowl Peptide on mice
FENG Jin-qiu1,LIU Wen-ying2,+,XU Dan1,ZHU Xiao-yu1,CHEN Xiao-wen1,FAN Ai-qin1,LU Jun2,CAI Mu-yi2,PAN Xing-chang2,*,XU Ya-jun1,*
(1.Department of Nutrition and Food Hygiene,School of Public Health,Peking University,Beijing 100191,China;2.Beijing Engineering Research Center of Protein and Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing 100015,China)
Objective:To observe the immunomodulating effect of Silky Fowl Peptide on mice.Methods:Female ICR mice were administered 0.5,1.0 g/kg BW or 2.0 g/kg BW Silky Fowl Peptide for 4 weeks,and then immune organs weight,cell-mediated immune functions,humoral immune functions and structural changes of thymuses were investigated.Results:Toes swelling degree in 1.0 g/kg BW and 2.0 g/kg BW Silky Fowl Peptide intervention groups were significantly increased in comparison with the value in control group(p<0.05).IgM-PFC number of Silky Fowl Peptide high dose group were higher than that in control group(p<0.05).The number of lymphocyte was increased in cortex of thymus compared with the number in control group.No obvious effects on weight increasing,the ratio of immune organ and body weight and the level of serum HC50were observed in Silky Fowl Peptide intervention groups.Conclusion:Silky Fowl Peptide could improve the immune functions in mice.
Silky Fowl Peptide;cell-mediated immune;humoral immune;immune organs
2015-10-30+并列第一作者
冯金秋(1992-),女,硕士在读,研究方向:营养与疾病,E-mail:xwgwbd1992@sina.cn。
刘文颖(1984-),女,硕士研究生,研究方向:食源性低聚肽,E-mail:wenyinglin888@126.com。
潘兴昌(1966-),男,博士,副主任医师,研究方向:食源性低聚肽营养与功能评价,E-mail:nutripan@163.com。
许雅君(1976-),女,博士,教授,研究方向:生命早期营养与疾病,E-mail:xuyajun@bjmu.edu.cn。
国家十二五科技支撑项目(2012BAD33B04-02);国家高科技研究发展计划(863计划)项目(2013AA102205-02);科技北京百名领军人才培养工程项目(Z131110000513026);北京市科委国家现代农业科技城成果惠民科技示范工程项目(Z131100003113010)。
TS201.4
A
1002-0306(2016)09-0349-04
10.13386/j.issn1002-0306.2016.09.060
