一株产聚羟基丁酸(PHB)菌株的筛选及鉴定
2016-09-10张永杰董菲菲邓志伟张婷婷杨生玉
张永杰,董菲菲,邓志伟,张婷婷,杨生玉,*
(河南大学生命科学学院,生物工程研究所,河南开封 475004)
一株产聚羟基丁酸(PHB)菌株的筛选及鉴定
张永杰1,董菲菲2,邓志伟2,张婷婷2,杨生玉1,*
(河南大学生命科学学院,生物工程研究所,河南开封 475004)
以甘油作为碳源,采用尼罗蓝荧光法结合苏丹黑B染色法从污水中筛选到一株产聚羟基丁酸(PHB)的菌株,基于生理生化特性鉴定及16S rDNA基因序列分析,确定该菌属于假单胞菌属(Pseudomonas)pudita,将其命名为PP25。采用次氯酸钠-氯仿法提取聚羟基丁酸,最终通过紫外可见分光光度法、紫外光谱法、傅里叶红外光谱法及核磁共振法确定了一株高产PHB菌株PP25,PHB产量为2.456 g/L。
聚羟基丁酸,假单胞菌,鉴定
聚羟基丁酸(PHB)是一种胞内存储的生物可降解材料,其是大量微生物在碳、氮营养失衡的条件下,作为碳源和能源而储存于细胞内的物质,其物理、化学性质和传统的塑料聚丙烯相似[1]。PHB可以在自然界中被微生物完全的分解利用,且其具有良好的生物相容性,是一种很有应用前景和开发价值的新型环保材料[2-4]。因此对PHB的研究成为生物技术以及新型材料领域的一个热点。
尼罗蓝是一种荧光染料,能特异性地对聚羟基丁酸进行荧光染色[5],起初尼罗蓝仅仅作为PHB荧光检测时的染液使用,且尼罗蓝很容易以悬液的形式渗入细胞内部与PHB结合,因此在菌体细胞生长的同时就能依据荧光现象,方便快捷的挑选出PHB产生菌[6]。目前报道能积累聚羟基丁酸的菌株有真养产碱杆菌(Alcaligeneseutropbus)、圆褐固氮菌和巨大芽孢杆菌等300多种,其中研究最广泛的是真养产碱杆菌[7]。国内也有学者利用葡萄糖、蔗糖、糖蜜作为主要碳源筛选出能够产PHB的性能优良的菌株,但目前利用甘油作为碳源筛选产PHB菌株的研究在国内尚属空白。因此,本文研究以甘油作为碳源筛选出的30株产PHB菌株为基础,以次氯酸钠-氯仿(v∶v=1∶1)法提取PHB,并通过紫外光谱法、傅里叶红外光谱法及核磁共振法进行定性和定量分析[8-10]。最终筛选得到一株性能优良的菌株PP25。
1 材料与方法
1.1材料与仪器
菌株(PseudomonasputidaPP25)由本实验室从污水中筛选分离获得;PHB标准品Sigma公司;KBr色谱纯,尼罗兰Solarbio公司;苏丹黑BAladdin公司;甘油食品级;实验室所用试剂均为分析纯。
UV-1750型紫外-可见光分光光度计日本Shimadzu公司;752N型紫外可见分光光度计上海仪电分析仪器有限公司;傅立叶变换红外光谱仪Spectrum Two,美国PerkinElmer公司;核磁共振波谱仪AVANCE Ⅲ HD 400 MHz,瑞士Bruker Biospin公司。
1.2实验方法
1.2.1培养基富集培养基(g/L):甘油10.0,酵母浸粉10.0,KH2PO410.0 pH自然。筛选培养基(g/L):甘油20.0,(NH4)2SO45.0,K2HPO45.0,MgSO4·7H2O 1.2,柠檬酸2,琼脂20,尼龙兰0.03,pH7.0。斜面保藏培养基(g/L):甘油 5.0,(NH4)2SO45.0,K2HPO45.0,MgSO4·7H2O 1.2,柠檬酸2,pH6.5。发酵培养基:(g/L):甘油20,(NH4)2SO410.0,KH2PO410.0,MgSO4·7H2O 1.2,柠檬酸2,pH7.0。上述培养基均在115 ℃条件下灭菌20 min。每个实验设计4个平行,取平均值并计算误差。
1.2.2菌株的分离与筛选从河南省达利园食品有限公司污水、河南庆安化工(集团)有限公司污水、河南大学实验田土壤取样,取3 g样品加入27 mL富集培养基中(30 ℃,200 r/min)有氧培养24 h。取富集培养液,用生理盐水稀释成一系列浓度梯度。取10-4、10-5、10-6三个梯度0.1 mL稀释液涂布在平板筛选培养基上(每个梯度做4个平行),置于30 ℃恒温培养箱中培养48 h。将平板放在荧光透射仪下照射挑取荧光较强且菌落较大的菌落,苏丹黑B染色镜检观察PHB的黑色颗粒,获得能够产聚羟基丁酸(PHB)的单菌落。选取发出荧光较多的平板,从其上提取菌落较大且荧光较强的接种于发酵培养基,200 r/min,30 ℃有氧培养72 h,离心获取沉淀检测PHB得含量及菌体干重。斜面保藏PHB产量最高的菌株,进行下一步实验。
1.2.3分析方法
1.2.3.1菌体干重测定取发酵液10 mL,8000 r/min离心10 min,水洗3次,真空冷冻干燥称重,得细胞干重。
1.2.3.2PHB含量测定采用Law[11]方法进行定量分析。PHB浓硫酸100 ℃加热条件下会降解为巴豆酸(丁烯酸),巴豆酸在235 nm紫外光谱区有吸收峰,通过紫外可见分光光度仪测定其吸光值,根据 PHB标准曲线计算PHB含量。
1.3胞内PHB颗粒分析
1.3.1PHB的提取与纯化
1.3.1.1PHB的提取从-80 ℃超低温冰箱中取一支甘油管保藏菌接种到30 mL活化培养基中,培养20 h。以6%接种量,接种于种子培养基(50 mL装液量)中,培养8 h。接种于5 L发酵罐中培养(装液量2 L,接种量5%)中,培养60 h。将发酵液以8000 r/min离心15 min,蒸馏水洗涤、离心,然后冷冻干燥备用。取5 g干菌粉与100 mL体积比为1∶1的氯仿-次氯酸钠混合液中,在30 ℃下搅拌2 h。混合液经离心(10000 r/min,10 min)后分为3层,上层是次氯酸钠溶液,中间层是非PHB的细胞物质及未被破胞的细胞,下层为含有PHB的氯仿溶液。用吸管吸取氯仿相,将其加入到正在搅拌的50 mL冷甲醇(4 ℃)中,并在4 ℃冰箱中放置1 h,过滤后将固体物于60 ℃烘24 h备用。
1.3.1.2PHB的纯化将粗提取的PHB固体包于脱脂的滤纸内,放入索氏提取器的提取管内。提取瓶内加入50 mL氯仿,加热提取瓶,氯仿气化,由连接管上升进入冷凝器,凝成液体滴入提取管内,浸提样品中的PHB粗品。待提取管内氯仿液面达到一定高度,溶有PHB的氯仿经虹吸管流入提取瓶。流入提取瓶内的氯仿继续被加热气化、上升、冷凝,滴入提取管内,如此循环往复,纯化2 h,通过旋转蒸发将得到PHB氯仿溶液浓缩为20 mL左右,按照1.3.1.1中的方法处理得到纯化后的PHB样品。
1.3.2紫外吸收光谱分析取3 μg/mL的PHB标准品氯仿溶液、5 μg/mL的PHB样品氯仿溶液及氯仿溶液(空白对照)1 mL于25 mL的比色管中100 ℃水浴50 min,将氯仿充分蒸出,各加入10 mL浓硫酸100 ℃水浴10 min(3个平行),冷却至室温。在波长200~300 nm处测定吸光值。
1.3.3傅里叶变换红外光谱分析取PHB标准品、PHB样品与KBr按照1∶200比例混匀压片,于4000~450 cm-1进行红外光谱扫描检测。
1.3.4核磁共振分析取5 mg PHB标准品及PHB样品于核磁管中,再加入0.5 mL氘代氯仿,加热溶解为澄清溶液,于400 MHz核磁共振波谱检测。
1.4菌种鉴定
1.4.1生理生化特征鉴定根据《伯杰氏手册》和《常见细菌系统鉴定手册》,选取淀粉水解、吲哚生成、柠檬酸盐利用、苯丙氨酸脱氨酶、H2S生成,明胶水解、MR实验、接触酶等特征性生理生化项目进行鉴定[12-15]。
1.4.216S rDNA基因序列分析取平板上的菌体于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164)中变性后离心取上清作为模板。反应条件:80 ℃,15 min;使用TaKaRa 16S rDNA Bacterial Identification PCR Kit(Code No.RR176),进行PCR扩增目的片段;反应体系:上述变性液1 μL、PCR Premix 25 μL、Forward primer(20 pmol/μL)0.5 μL、Reverse primer2(20 pmol/μL)、16S-free H2O 23 μL。反应条件为:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火 1 min,72 ℃延伸1.5 min,72 ℃ 5 min,30个循环;使用Takara MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(Code No.9762)切胶回收目的片段;委托宝生物工程(大连)有限公司进行DNA测序;在NCBI网站上用BLAST检索GenBank中相关菌株的16S rDNA基因序列,用MEGA 6.0软件构建进化树分析,确定该菌的分类地位。
2 结果与讨论
2.1菌种筛选
2.1.1产PHB菌株的筛选与分离根据1.2.2方法采集处理样品,分离纯化菌株,按照1.2.3方法检测菌体干重及菌体中PHB的含量。经过初筛,共获得25株能够产生PHB的菌株,采用摇瓶发酵法对初筛得到的25株菌株进行复筛,并检测菌体干重及菌体中的PHB含量。其中从化工厂污水中分离到的1株菌2-5,菌体干重及PHB含量最高,分别达到4.367,2.456 g/L,将其命名为PP25。

图1 尼罗蓝平板菌落形态Fig.1 Nile blue plate colony morphology

图2 苏丹黑B染色结果Fig.2 Sudan black B dyeing results
2.2胞内PHB颗粒鉴定结果
2.2.1PHB的紫外光谱法分析结果紫外吸收光谱分析:在波长200~300 nm范围内测定光吸收度。由图3可知,采用次氯酸钠-氯仿法提取的PHB样品在235 nm处有强吸收峰,与标准品的峰十分接近,且纯度较高。

图3 PHB样品和标准品的紫外吸收光谱分析结果Fig.3 UV absorption spectra of PHB sample and reference substance
2.2.2傅立叶红外光谱分析为了确定从PP25菌株中提取得到的物质是否为聚羟基丁酸(PHB),对提取的样品进行傅立叶红外光谱分析,鉴定其特征性官能团,结果如图4所示:提取样品在1057、1101、1229、1279、1380、1456、1723、2875 cm-1处均有较大吸收峰。与PHB标准品的红外光谱(图4)进行对比,其主要官能团一致。其中,1057、1101 cm-1是C-OH伸缩振动引起的吸收峰,1229 cm-1是-CH2的摇摆振动引起的吸收峰,1279 cm-1对应于C-O-C的伸缩振动吸收峰,1456 cm-1是-CH2剪式振动吸收峰,1723 cm-1是C=O的伸缩振动吸收峰,2875 cm-1对应于-CH3的反对称伸缩振动吸收峰。由提取样品与标准品红外光谱图对比(图4)可知,提取物质即为聚羟基丁酸且纯度较高。
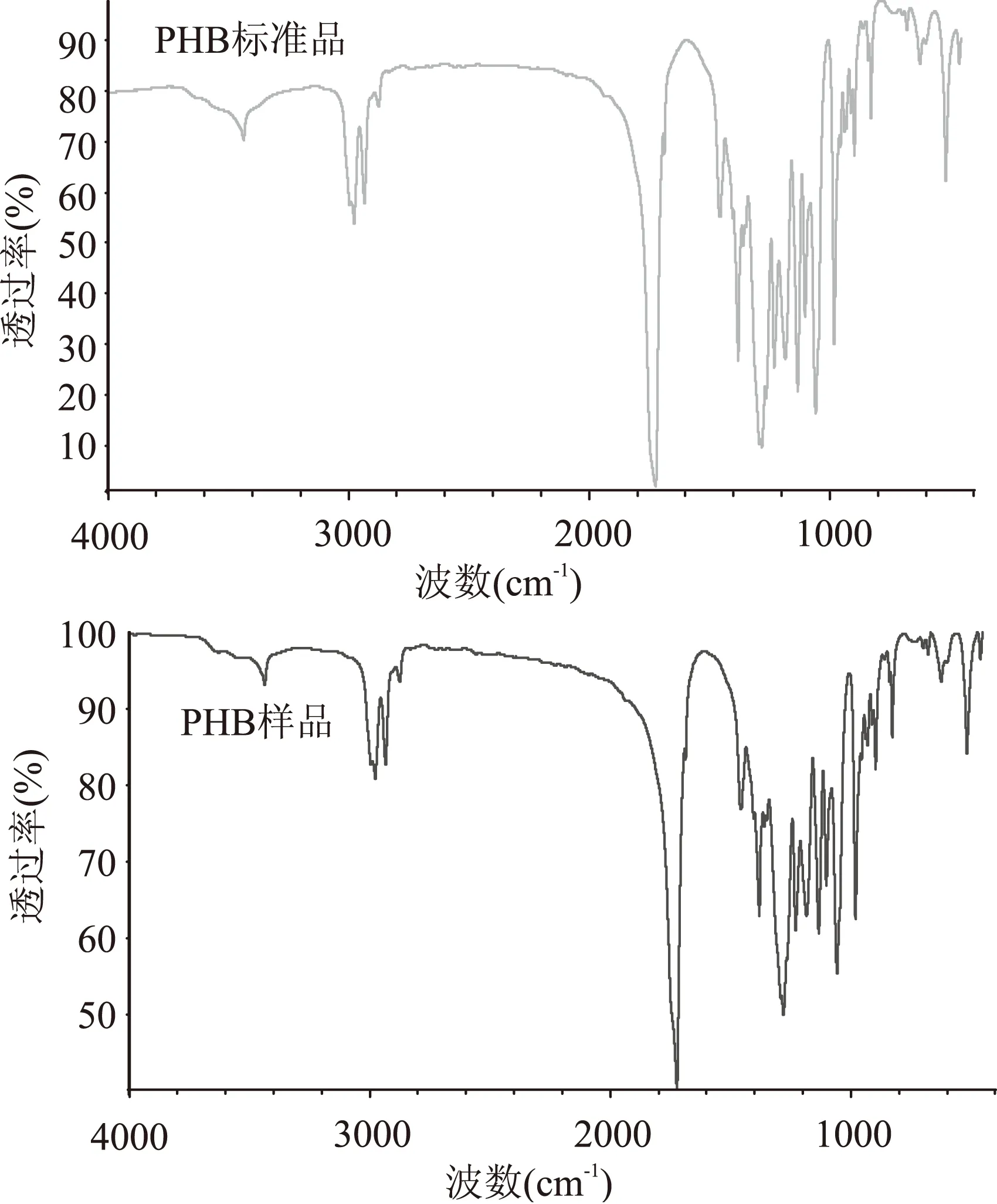
图4 PHB标准品和提取样品的红外光谱分析结果Fig.4 Infrared spectra of PHB reference substance and PHB sample
2.2.3核磁共振分析结果分别对PHB标准品和筛选菌株发酵后提取得到样品进行核磁共振(氢谱)检测,结果如图5所示。
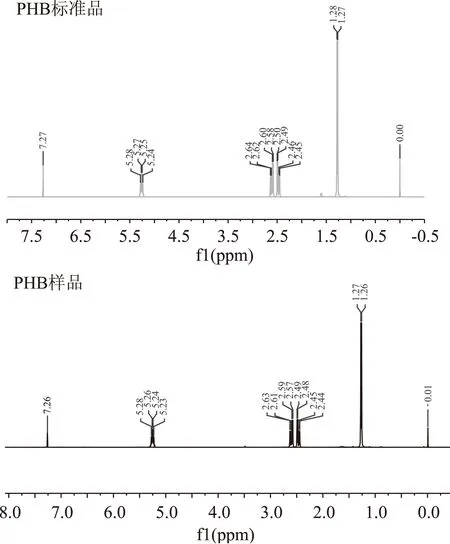
图5 PHB标准品和提取样品的核磁共振氢谱分析结果Fig.5 Nuclear magnetic resonance of PHB reference substance and PHB sample
由图5可知,提取PHB样品与PHB标准品的氢谱中的氢元素数目及元素迁移情况相一致,并且图谱整齐无杂质峰出现,表明从恶臭假单胞菌PP25提取所得的物质为PHB且纯度高。
2.3PHB产生菌的鉴定
2.3.1生理生化鉴定根据革兰氏染色、芽孢染色、氧化酶、明胶液化、产吲哚、淀粉水解、MR、产H2S、苯丙氨酸脱氨酶等属间特征生理生化反应结果及16S rDNA鉴定结果鉴定该菌株属于Pseudomonas属,根据反硝化、柠檬酸盐利用、酯酶、精氨酸双水解等种间生理生化特性鉴定该菌株为Pseadomonasputida。生理生化特征鉴定结果见表1。

表1 菌株PP25生理生化鉴定指标Table 1 Physiological and biochemical characteristicsof strain PP25
注:+:90%或以上的菌株为阳性;-:90%或以上的菌株为阴性。
2.3.2基因序列分析及其系统发育分析经测序,获得16S rDNA 1481 bp长度全序列。将该序列与GenBank中相关数据进行相似性分析,并用MEGA 6.0软件构建进化树(见图6)。通过16S rDNA序列分析和构建进化树分析得到PP25与Pseudomonassp、Pseudomonasputida亲缘关系较近。

图6 基于菌株PP-25和参比菌株的 16S rDNA基因同源性的系统发育树Fig.6 Phylogenetic tree based on 16S rDNA gene sequences similarity of strain PP25 and reference
经鉴定确定该菌属于假单胞菌科、假单胞菌属(Pseudomonas)putida,拟将该菌株命名为PP25。
3 讨论与结论
本文以甘油作为碳源采用尼罗蓝平板法、苏丹黑B染色法同紫外吸收光谱(UV)、傅里叶变换红外光谱(IR)、及核磁共振(NMR)相结合的方法进行PHB产生菌的筛选。通过尼罗蓝平板、苏丹黑同 UV、IR、NMR相结合筛选得到的菌株更加准确。同时通过16S rDNA及生理生化鉴定所筛选的菌株为假单胞菌属(Pseudomonas)pudita。采用氯仿萃取法提取PHB,并对提取得到的PHB固体进行紫外吸收光谱、傅里叶变换红外光谱、及核磁共振分析,并与标准品比较。紫外光谱中无杂质峰且与PHB标准品的吸收峰一致,初步确定该提取物为PHB类似物;进一步通过对PHB标准品及样品的傅里叶变换红外光谱及核磁共振氢谱分析得出,从恶臭假单胞菌内提取的物质为聚羟基丁酸,从而表明所筛选的恶臭假单胞菌为目标菌株。
同时,利用野生型的恶臭假单胞菌培养生产PHB与实际应用及工业化生产还存在较大的差距,但与其他野生菌株相比具有一定优势,其可以利用工业甘油作为碳源合成PHB可以有效地降低生产成本。同时可以采用诱变技术选育优良菌株,或利用基因工程、酶工程定向改造菌株,从而大幅度提高PHB产量,进一步降低生产成本。
[1]Sundaramoorthy Balaji,Kadiyala Gopi,Bhaskaran Muthuvelan. A review on production of poly-β-hydroxybutyrates from cyanobacteria for the production of bio plastics[J]. Algal Research,2013,2:278-285.
[2]Everest A,Tajalli K,Ipsita R. Production of polyhydroxyalkanoates:the future green materials of choice[J]. Journal of Chemical Technology & Biotechnology,2010,85(6):732-743.
[3]Verlinden R A,Hill D J,Kenward M A,et al. Bacterial synthesis of biodegradable polyhydroxyalkanoates[J]. Journal of Applied Microbiology,2007,102(6):1437-1449.
[4]杨丹,刘宏超,黄慧珍. 生物合成聚羟基烷酸酯的研究与开发进展[J].高分子通报,2009(5):42-47.
[5]Ostle A G,Holt J G. Nile Blue A as a fluorescent stain for poly-β-hydroxybutyrate[J]. Applied Environmenyal Microbiology,1982,44(1):238-241.
[6]崔志芳,李爱云,李春露.产聚-β-羟基丁酸酯菌株的筛选及发酵条件的优化[J].生物技术通报,2010(1):103-106.
[7]孙新新,郑家珍,王艳青,等.一株聚β羟基丁酸PHB高产菌株的分离与鉴定[J].安徽农业科学,2015,43(6):8-10.
[8]Hong K,Sun S,Tian W,et al. A rapid method for detecting bacterial polyhydroxyalkanoates in intact cells by Fourier transform infrared spectroscopy[J]. Appl Microbial Biotechnol,1999,51(4):523-563.
[9]Anupama Shrivastav,Sanjiv K Mishra,Sandhya Mishra. Polyhydroxyalkanoate(PHA)synthesis by Spirulina subsalsa from Gujarat coast of India[J]. International Journal of Biological Macromolecules,2010,46:255-260.
[10]Wang Jie,Caihua Ni,Zhang Yanan,et al. Preparation and pH
controlled release of polyelectrolyte complex of poly(L-malic acid-co-D,L-lactic acid)and chitosan[J]. Colloids and Surfaces B:Biointerfaces,2014,115:275-279.
[11]Law John H,Slepecky Ralph A. Assay of poly-β-hydroxybutyric acid[J]. Journal of Bacteriology,1961,82:33-36.
[12]沈萍,陈向东.微生物学实验[M].第4版.北京:高等教育出版社,2007:111-117.
[13]郦和生,张春元,张伟,等.生产聚羟基丁酸酯(PHB)的菌种选育及发酵条件[J].石化技术,1997,4(4):212-215.
[14]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社,2001:138.
[15]布坎南RE,吉本斯NE 编. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译. 伯杰氏细菌鉴定手册[M].北京:科学出版社,1984:325-329.
Screening and identification of a strain producing polyhydroxybutyrate
ZHANG Yong-jie1,DONG Fei-fei2,DENG Zhi-wei2,ZHANG Ting-ting2,YANG Sheng-yu1,*
(Institute of Bioengineering,School of Life Sciences,Henan University,Kaifeng 475004,China)
A polyhydroxybutyrate(PHB)strain was isolated from sewage by Nile blue fluorescence staining combining with Sudan black B,which was based on glycerol as the carbon source. A series of analyses on physiological and biochemical characterization and sequence analysis of 16S rRNA revealed that it belonged to the genusPseudomonaspudita,which namedPseudomonaspuditaPP25. PHB was extracted with sodium hypochlorite- chloroform. Finally,a high yield PHB strain named PP25 was determined by UV spectroscopy,Fourier transform infrared spectroscopy and nuclear magnetic resonance spectroscopy,yield of PHB was 2.456 g/L.
polyhydroxybutyrate;Pseudomonas;identification
2016-01-06
张永杰(1989-),男,在读硕士研究生,研究方向:发酵工程,E-mail:1292365735@qq.com。
杨生玉(1962-),男,本科,教授,研究方向:工业微生物育种和发酵工程,E-mail:yangshengyu@henu.edu.cn。
河南省科技攻关重点项目(152102210254)。
TS201.1
A
1002-0306(2016)14-0223-05
10.13386/j.issn1002-0306.2016.14.037
