螺旋藻规模生产优良藻株的选育
2016-09-10李正娟石光波徐青艳赵肖荣闫卉新李博生
李正娟,常 蓉,石光波,徐青艳,赵肖荣,闫卉新,李博生
(北京林业大学生物科学与技术学院食品科学与工程系,林业食品加工与安全北京市重点实验室(北京林业大学),北京林业大学螺旋藻研究所,北京 100083)
螺旋藻规模生产优良藻株的选育
李正娟,常蓉,石光波,徐青艳,赵肖荣,闫卉新,李博生*
(北京林业大学生物科学与技术学院食品科学与工程系,林业食品加工与安全北京市重点实验室(北京林业大学),北京林业大学螺旋藻研究所,北京 100083)
本研究选用钝顶螺旋藻为出发株,采用毛细吸管显微分离法分离单藻丝,并结合紫外-可见光谱扫描,选育出了2个高产优质的螺旋藻藻株sina032和sina029。sina032和sina029的生物量较出发株分别提高了44.8%和39.4%,其生物活性物质(叶绿素、藻蓝蛋白、类胡萝卜素、β-胡萝卜素(顺式)和蛋白质)含量和出发株基本相同,且藻丝形态良好(藻丝较长、螺旋数约为20个、螺距较大)、上浮性较好。研究结果表明,通过单藻丝分离的方法,可选育出生物量高、生物活性物质含量高的钝顶螺旋藻藻株,在工业化生产中有着重要的实际意义。
钝顶螺旋藻,毛细吸管显微分离法,单藻丝,生物量,生物活性物质
cis-β-carotene and protein)were oughly the same as that of the original strain.They had better filament form(longer filament,about 20 spiral,bigger pitch)and higher flotation activity. These results showed that the method of separation of per algal filament can be used to screenSpirulinastrains with high biomass and high content of bioactivators,which had important and practical significance in the industrial production ofS.platensis.
螺旋藻(Spirulina)是一种属于蓝藻门、蓝藻纲、颤藻目、颤藻科、螺旋藻属的原核藻类[1]。螺旋藻富含蛋白质(约70%)、碳水化合物、脂肪、色素(主要是叶绿素、藻蓝蛋白和类胡萝卜素)、维生素、微量元素以及其他对人体有特殊疗效的生物活性物质等,并含有易于人体消化的八种必需氨基酸,因此具有巨大的商业和经济价值[2-4]。螺旋藻已广泛应用于食品、功能保健品、化妆品和饲料添加等行业。
国内外已知螺旋藻约有39种[5],但用于人工培养和大规模工业化生产的藻种只有钝顶螺旋藻和极大螺旋藻[6],它们原产地分布在非洲乍得湖和墨西哥湖。我国学者“七五”期间就开始引进藻种,并进行研究和驯化。为了提高螺旋藻的产量和质量,国内外许多学者采用了许多物理或化学等手段诱变育种,也选育出了许多新的藻种[7-8]。几十年来,这些藻种在企业间不断传递使用,在其大规模工业化生产中,易受环境条件的变化而出现藻种混杂退化、生长慢、产量低、质量不稳定等问题,严重阻碍了螺旋藻产业化的发展。因此,十分有必要对螺旋藻藻种不断进行分离、纯化及选育,才能实现螺旋藻高产优质的大规模生产。在这方面国内外已采用对单个藻丝体进行分离和培养的方法进行了一些研究[9-10]。在相同的培养条件下,不同的螺旋藻藻种不但生长速度不同,其所含的营养物质也会有一定的差异[11]。因此,本研究以国内螺旋藻养殖面积最大、最为集中的产业化基地(年产量约占全国总产量的40%以上)——内蒙古鄂尔多斯市鄂托克旗螺旋藻园区为依托,对其生产藻种作为出发株,进行单藻丝分离选育,通过各自生物量比较研究和紫外-可见光谱扫描定性研究营养物质的差异,选育出高生物量、高营养的螺旋藻藻株,用于螺旋藻产业化生产。
1 材料和方法
1.1材料与仪器
钝顶螺旋藻S2内蒙古鄂托克旗螺旋藻产业园;Zarrouk培养基[12]所有化学试剂均为分析纯,购于北京科百奥生物科技有限责任公司。
人工气候室德国Binder宾得;HY-8A数显调速多用振荡器江苏省金坛市荣华仪器制造有限公司;H/T16MM台式高速离心机湖南赫西仪器装备有限公司;SCIENTZ-12N冷冻干燥机宁波新芝生物科技股份有限公司;JY92-Ⅱ超声波细胞粉碎机宁波新芝生物科技股份有限公司;UV-2550紫外可见分光光度计日本岛津公司。
1.2实验方法
1.2.1单藻丝分离、培养及逐步扩大培养本实验在人工气候室进行,采用Zarrouk培养基,基本培养条件:温度28~30 ℃,光照强度4500 lux,光照周期L∶D=12 h∶12 h,100 r/min摇床培养。在此条件下培养螺旋藻出发株6 d。
取几滴藻液在显微镜下观察,统计每滴藻液中的藻丝数目,根据藻丝数目添加适量培养液逐步稀释藻液,尽量使藻丝分散于培养液中。取稀释藻液在显微镜下用毛细吸管吸取单根健壮藻丝(藻丝粗壮且较长、螺距较宽、螺旋数较多、颜色正常),转入已加入适量新鲜培养液的试管中进行螺旋藻单株培养(温度25 ℃,光照强度1000 lux)。待藻液变绿后(约培养15 d)转入150 mL三角瓶,加入50 mL新鲜培养液培养30 d(温度25 ℃,光照强度2000 lux)。将藻液转入250 mL三角瓶,加入100 mL新鲜培养液培养10 d,再加入100 mL新鲜培养液培养10 d(温度28 ℃,光照强度4000 lux),重复操作三次,获得大量藻丝群体以进行后续实验。在螺旋藻筛选和培养过程中,每天在显微镜下观察并记录螺旋藻的生长状态。
1.2.2螺旋藻出发株与藻丝群体的生长比较将实验1.2.1藻丝群体和螺旋藻出发株S2接种到已加入300 mL新鲜Z氏培养液的500 mL三角瓶中,接种OD560 nm为0.1,分别设置3个平行。培养条件为温度30 ℃,光照强度4500 lux,光照周期L∶D=12 h∶12 h,100 r/min摇床培养15 d。镜检各藻株的藻丝形态。
1.2.3生物量的测定将实验1.2.2培养的藻液用已恒重的300目滤布过滤,用蒸馏水冲洗掉藻体上附着的盐分后冷冻干燥,称量并减掉滤布重量后,即得到各个藻株的生物量(干重/g)[13]。比较各个藻株生长量之间的差异,筛选出3株生物量较高和3株生长量较低的藻株。
1.2.4紫外-可见光光谱分析分别准确称取实验1.2.3筛选出的藻株和出发株的干粉0.04 g,放入10 mL试管中,加入5 mL 70%乙醇,用超声波细胞破碎仪破碎(600 W,10 min),超声结束后,将其离心(6000 r/min,15 min),然后取2 mL上清液,定容至10 mL。用紫外-可见分光光度计在波长200~800 nm处进行扫描,绘制各藻株的吸收曲线。
1.3数理统计方法
本实验的数据采用Excel 2013进行统计分析。
2 结果与分析
2.1螺旋藻单藻丝的分离和培养
本研究采用毛细吸管显微分离法分离出50根生长状态良好的单藻丝(颜色呈绿色、螺旋数多于6、螺距较大、藻丝粗壮),置于试管中培养。培养15 d后,有42支试管中的藻液颜色变绿。在第15 d分别多次取50支试管中的藻液,在显微镜下观察发现:a.在藻液颜色呈绿色的试管中有4支试管中并没有螺旋藻藻丝,几乎全是杂藻(多为小球藻)。b.在藻液颜色呈绿色的试管中有3支试管中多数为螺旋藻,含少量小球藻。c.在藻液颜色呈绿色的试管中其余35支试管中全是螺旋藻。d.在未有颜色变绿的8支试管中未观察到螺旋藻。
将藻液转入三角瓶后,继续培养,最终有33根藻丝长成藻丝群体。从第16 d开始每天定时在显微镜下观察各三角瓶中螺旋藻的生长状态(藻丝颜色、螺距、螺旋数等)并详细记录。经过长达一个多月的连续观察,分离培养的大部分藻丝体生长状态良好且藻丝形态不易随培养条件的改变而发生变化,在培养过程中比较稳定。
2.2选育藻株生物量和形态特征的比较研究
螺旋藻单藻丝个体差异大,将其培育成群体,测其生物量差异显著,将所分离的藻株命名为sinaX,由表1可知,在相同培养条件、相同培养时间,从出发株S2分离出的33个单藻丝,其生物量按大小排序排在前三名分别是sina029(0.1667 g)、sina032(0.1732 g)、sina017(0.1659 g),其生物量分别比出发株S2(0.1196 g)提高了39.4%、44.8%、38.7%。而生物量按大小排序排在后三名分别是sina005(0.1303 g)、sina006(0.1225 g)、sina011(0.1145 g),与出发株S2相比,sina005和sina006的生物量分别提高了8.9%、2.4%,而sina011生物量则下降了4.3%。其中,生物量最高的藻株是sina032相比于生物量最低的藻株sina011提高了约53.7%,这表明,在相同的培养条件下,不同藻株藻丝个体差异大、生物量差异显著。

表1 螺旋藻各藻株生物量和形态特征的比较Table 1 Comparison of biomass and morphological characteristics of Spirulina strains
注:++表示藻液静置12 h后藻丝几乎全部上浮在液面;+表示藻液静置12 h后藻丝大部分上浮在液面;-表示藻液静置12 h后藻丝大部分沉降。
螺旋藻藻丝形态和其生物量之间有一定的相关系。从表1和图1中可以看出,螺旋藻颜色深绿、藻丝越长、螺旋数越多、螺距越大、上浮性越好,其生物量就越高。其中,sina005、sina006、sina011藻株在培养过程中藻丝形态不太稳定,尤其sina005藻株藻丝形态发生变异,部分藻丝呈直线型(图1)。sina017、sina029、sina032藻株的螺旋数多于15、藻丝长,且藻丝形态较稳定、上浮性好。这使得螺旋藻易于采收,是螺旋藻大规模工业化养殖中重要的性状。藻丝上浮性可以调节其在水体中的位置,是其趋于适宜的环境,有利于螺旋藻的生长,且浮性好的藻丝易于采收[14]。根据上述研究结果发现各藻株藻丝之间个体差异大、生物量差异显著,表明通过单藻丝分离法选育螺旋藻藻种在生产上是可行的。

图1 sina005、sina011、sina029 和sina032的形态比较(100×)Fig.1 Comparison of morphological characteristics of sina005, sina011,sina029 and sina032(100×)
2.3选育藻株间所含营养物质定性研究
根据文献报道,螺旋藻主要生物活性物质的可见和紫外光谱特征吸收波长范围列于表2,该吸收波长范围与图2和图3比较,推断出各藻株主要活性物质存在和差异。如图2和图3所示,选育出的6个藻株和出发株的吸收曲线主要有6个吸收峰,分别位于红光区的666 nm和616~628 nm处、蓝紫光区的475~477 nm和436~444 nm处、近紫外光区的336~339 nm和260~264 nm处。各个藻株的主要生物活性物质的种类相同,分别是叶绿素、藻蓝蛋白(PC)、类胡萝卜素、β-胡萝卜素(顺式)和蛋白质(表2),但各藻株的主要生物活性物质的吸收峰值差异较大。

表2 螺旋藻主要生物活性物质的 可见和紫外光谱特征吸收波长Table 2 Visible and ultraviolet spectrum characteristic absorption wavelength of main bioactivators of Spirulina
图2是生物量较高的3个藻株(sina017、sina029、sina032)与出发株S2的吸收光谱。如2.2所述,sina029、sina032和sina017的生物量分别比出发株S2提高了39.4%、44.8%、38.7%。而由图2可知,sina029、sina032和出发株S2的主要生物活性物质的吸收峰值基本相同,而sina017与S2相比,其叶绿素、藻蓝蛋白(PC)、类胡萝卜素、β-胡萝卜素(顺式)和蛋白质的吸收峰值依次降低了12.9%、9.3%、20.2%、7.9%和10.1%。这表明生物量高的藻株不一定生物活性物质含量高。结合表1所示的sina017、sina029、sina032的藻丝形态特征可以看出,螺旋藻藻丝的螺旋数、颜色、藻丝上浮性与其各主要生物活性物质的含量基本呈正相关。因此,可以通过藻丝形态特征初步比较各藻株的生物量和主要生物活性物质含量。
图3是生长量较低的3个藻株(sina005、sina006、sina011)与出发株S2的吸收光谱。如2.2所述,与出发株S2相比,sina005和sina006的生物量分别提高了8.9%、2.4%,而sina011生物量则下降了4.3%。由图3可知,sina006和sina011生物活性物质的吸收峰值均显著低于S2,而sina5的生物活性物质的吸收峰值含量远远高于S2,其蛋白质、藻蓝蛋白(PC)、β-胡萝卜素(顺式)和类胡萝卜素的吸收峰值分别提高了 43.6%、26.7%、23.7%和12.6%,而叶绿素的吸收峰值稍低于S2。这表明生物量低的藻株不一定生物活性物质含量低。因此,在螺旋藻藻种选育中,生物量低的藻株也值得关注,可以从中筛选出高生物活性物质含量的藻株,用于提取生物活性物质,这与张学成等的报道一致[22]。同时也表明,在螺旋藻藻种选育中,不仅要考虑其生物量,还要考虑生物活性物质含量,这样才可以选育出高产优质的优良藻种。
从图2和图3还可以看出,生物量较高的藻株(sina029、sina032、sina017)的光合色素含量远远高于生物量较低的藻株(sina006、sina011),结合表1中所示藻株的生物量,这表明螺旋藻光合色素含量和生物量之间的关系呈正相关。因此,适当增加光合色素相应吸收波长的光的强度,可以促进螺旋藻的光合作用,提高其产量。
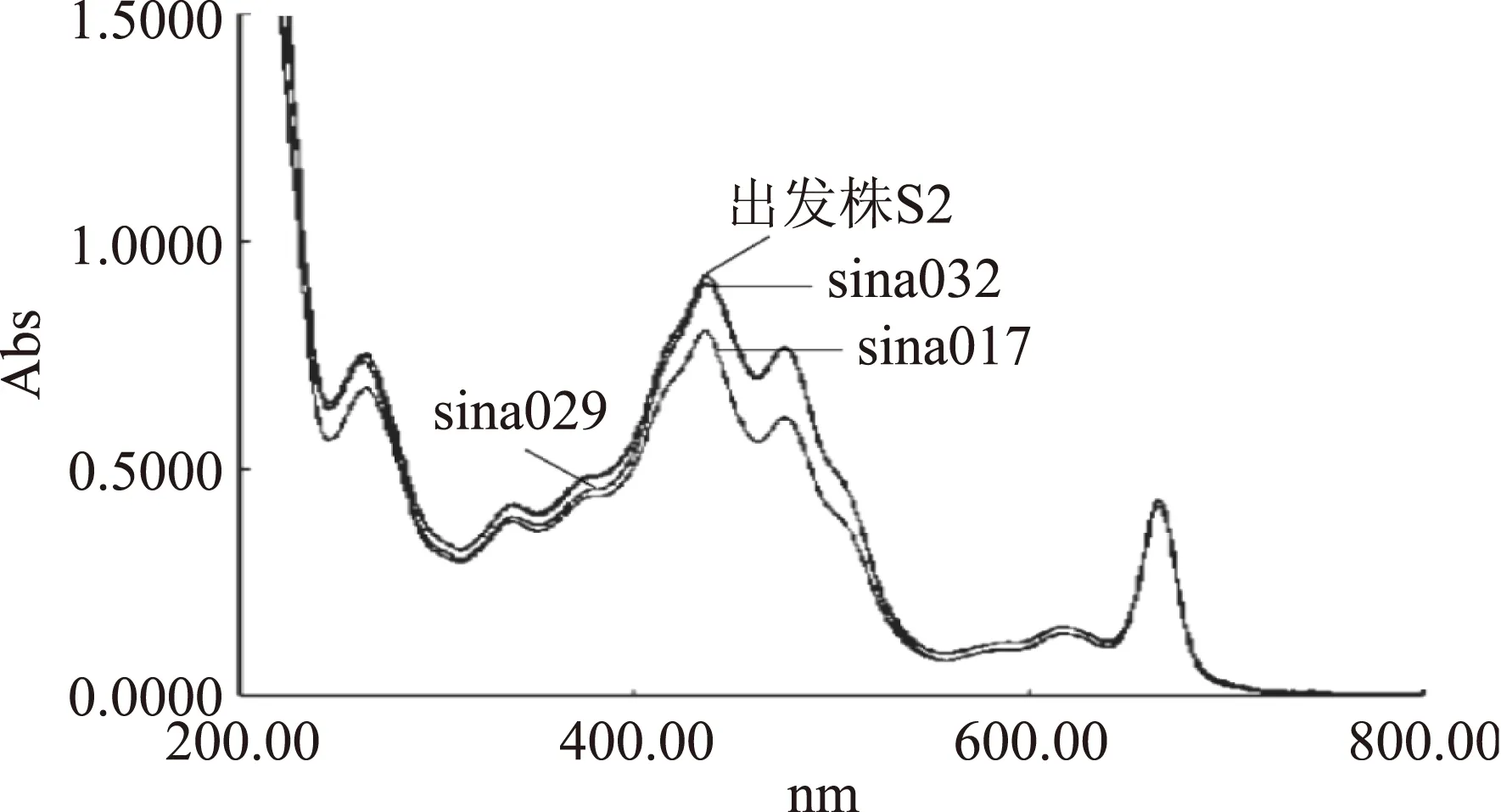
图2 sina017、sina029、sina032与出发株S2的吸收光谱Fig.2 Absorption spectra of sina017, sina029,sina032 and original strain S2
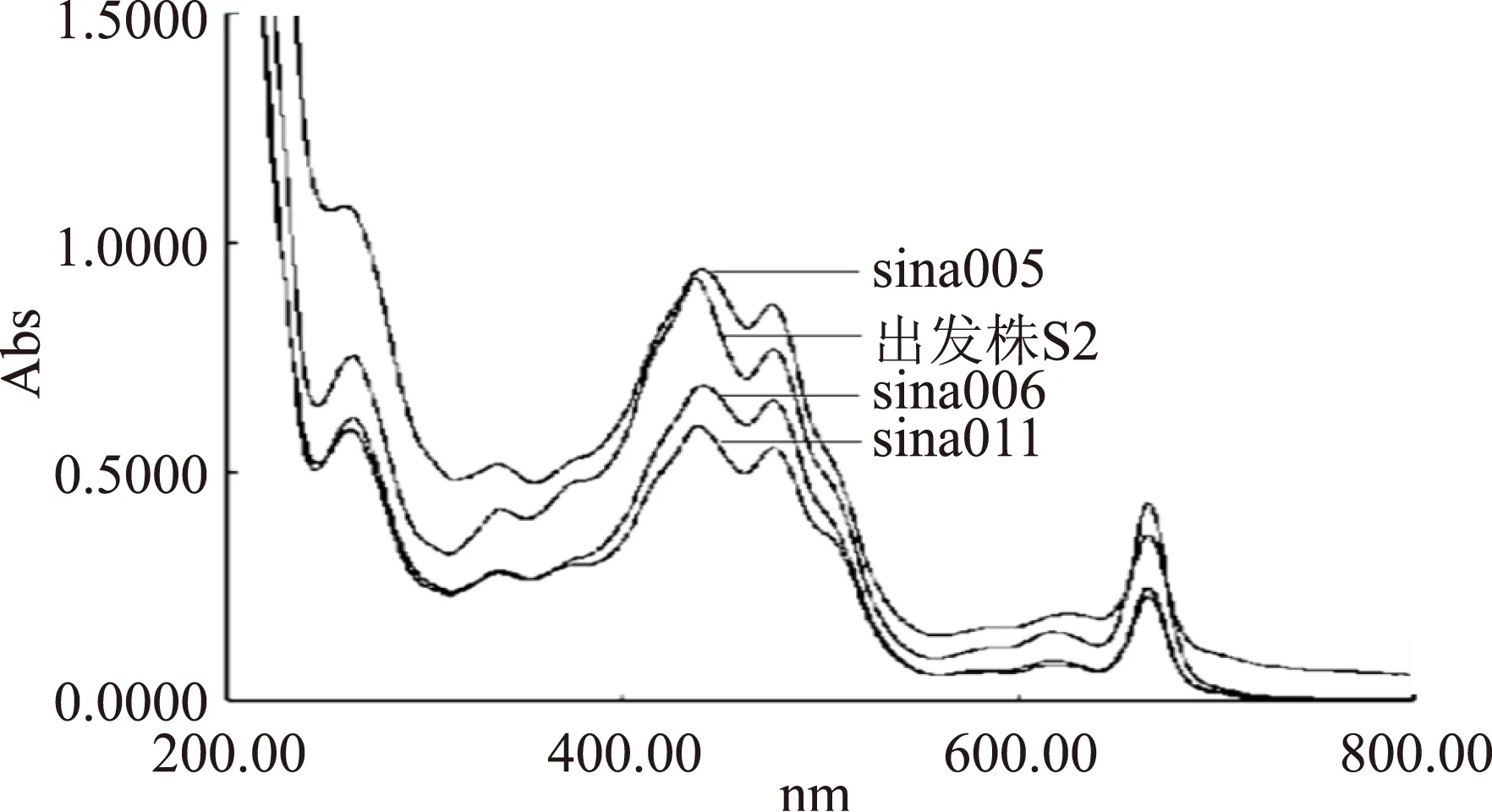
图3 sina005、sina006、sina011与出发株S2的吸收光谱Fig.3 Absorption spectra of sina005, sina006,sina011 and original strain S2
3 结论
在螺旋藻的实际生产中,选育高产优质螺旋藻品种和品系是重要的基础。选育的生产藻种需具有高生物量、高营养、易采收等特性。
本研究对鄂托克旗螺旋藻产业园的生产藻种钝顶螺旋藻S2进行分离纯化,综合考虑各藻株的生物量和生物活性物质的含量,选育出了产量高、生物活性物质含量高、形态良好且稳定、易采收的优良藻株sina029和sina032,其生物量较S2分别提高了39.4%、44.8%,生物活性物质含量和S2基本相同,可直接用于螺旋藻大规模养殖。
在螺旋藻大规模生产中,通过单藻丝分离可以选育出高生物量、高营养的优良藻种,该方法操作简便、易行,便于工作人员掌握,且对纯化的藻丝体具有很强的针对性,这对于螺旋藻的生产实践具有重大意义。
[1]梁象秋.水生生物学(形态和分类)[M].北京:中国农业出版社,1995.
[2]Becker E W.Algae mass cultivation production and utilization[J]. Process Biochem,1981,16:10-14.
[3]Pelizer L H,Danesi E D G,Rangel C D,et al. Influence of inoculum age and concentration inSpirulinaplatensiscultivation[J]. Journal of Food Engineering,2003,56(4):371-375.
[4]Spolaore P,Joannis-Cassan C,Duran E. Commercial applications of microalgae[J]. Journal of Bioscience Bioengineering,2006,101(2):87-96.
[5]周淑荣,李沐森. 螺旋藻的营养保健功能及其开发利用[J]. 特产研究,2001,23(2):63-65.
[6]张潇冉,曹雪琴. “微小”螺旋藻推动“大产业”—记北京林业大学螺旋藻研究所所长李博生教授[J]. 中国高校科技与产业化,2010(10):73-74.
[7]Lanfaloni L,Trinei M,Russo M,et al. Mutagenesis of the cyanobacterium Spirulina platensis by UV and nitrosoguanidine treatment[J]. FEMS Microbiol Lett,1991,83(1):85-90.
[8]刘奇臧,晓楠,张学成. 钝顶节旋藻高产藻株的诱变选育[J]. 中国海洋大学学报,2015,45(4):60-65.
[9]甘旭华,唐欣昀,刘广金,等. 螺旋藻的纯化[J]. 微生物学通报,2005,32(2):1-4.
[10]Giovanna R,Silvio S,Orio C. Production of am ino acids by analog-resistantmutants of the cyanobacterium[J].Spirulina platensis J Bacteriology,1981,147(3):1002-1007.
[11]Fatma T,Sarada R,Verkataraman L V. Evaluation of selection of Spirulinafor their con-stituents[J]. Phykos,1994,33:89-97.
[12]Zarrouk C. Contribution a letude dune cyanophycee:Influence de divers facteurs Physiques et chimiques sur la croissance et phytosynthese de Spirulina maxima geitler[D]. PhD Thesis,University of Paris,1966.
[13]Gao K S,Ma Z L. Photosynthesis and growth of Arthrospira(Spirulina)platensis(Cyanophyta)in response to solar UV radiation,with special reference to its minor variant[J]. Environmental and Experimental Bota-ny,2008,63(1-3):123-129.
[14]Kim S G,Choi A,Ahn C Y,et al. Harvesting of Spirulina platensis by cellular floatation and growth stage determination[J]. Letters in Applide Mierobiology,2005,40(3):190-194.
[15]王镜岩,朱圣庚,徐长法. 生物化学(下册)[M]. 第三版.北京:高等教育出版社,2002:201-202.
[16]张静,韦玉春,王国祥,等. 太湖水体中藻蓝蛋白的紫外-可见吸收光谱特征分析[J]. 光谱学与光谱分析,2014,34(5):1297-1301.
[17]尹兴娟,唐建国,刘继宪,等.藻蓝素的提取及其光学性质研究[J]. 应用化工,2010,39(4):484-490.
[18]周昌芳,吴国荣,陆长梅,等. 铅污染对钝顶螺旋藻生长及其某些生理性状的影响[J]. 湖泊科学,1999,11(2):135-140.
[19]于小华,刘晓华,李纯球,等.β-胡萝卜素口服液的稳定性研究[J]. 海峡药学,2009,21(8):23-25.
[20]Britton G. UV/visiblesPeetroseoPy[M]. Blrkhser,1995.
[21]高德江. 蛋白质的光谱法研究[D]. 长春:吉林大学,2008:124.
[22]张学成,薛命雄. 我国螺旋藻产业的现状和发展潜力[J]. 生物产业技术,2012,2(3):47-53.
Selection and breeding of fineSpirulinastrains of large-scale production
LI Zheng-juan,CHANG Rong,SHI Guang-bo,XU Qing-yan,ZHAO Xiao-rong,YAN Hui-xin,LI Bo-sheng*
(Beijing Forestry University,Department of Food Science and Engineering,College of Biological Sciences and Technology,Beijing Key Laboratory of Forest Food Processing and Safety,Institute of Spirulina,Beijing 100083,China)
This study selectedSpirulinaplatensisas original strain,and two strains sina032 and sina029 with high yeild and quality were obtained by using the method of capillary suction micro separation to separate per algal filament and combining with UV-Vis spectral scan. Compared with the original strain,biomass of the two strains increased by 44.8% and 39.4% respectively.Content of their bioactivators(chlorophyll,phycocyanin,carotenoids,
Spirulinaplatensis;method of capillary suction micro separation;per algal filament;biomass;bioactivator
2016-01-06
李正娟(1989-),女,硕士研究生,研究方向:功能性食品及天然产物,E-mail:lzj028040@163.com。
李博生(1956-),男,教授,研究方向:功能性食品及天然产物,E-mail:Libs7321@126.com。
林业公益性行业科研专项(201304605)。
TS201.1
A
1002-0306(2016)14-0210-05
10.13386/j.issn1002-0306.2016.14.034
