茶花粉黄酮对α-葡萄糖苷酶抑制作用的研究
2016-09-10赖小燕姜泽东彭文君杜希萍肖安风杨远帆
赖小燕,姜泽东,2,倪 辉,2,彭文君,孙 浩,杜希萍,2,肖安风,2,杨远帆,2,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建厦门 361021;3.中国农业科学院蜜蜂研究所,北京 100093)
茶花粉黄酮对α-葡萄糖苷酶抑制作用的研究
赖小燕1,姜泽东1,2,倪辉1,2,彭文君3,孙浩1,杜希萍1,2,肖安风1,2,杨远帆1,2,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建厦门 361021;3.中国农业科学院蜜蜂研究所,北京 100093)
为研究茶花粉黄酮对α-葡萄糖苷酶的抑制作用,以茶花粉为原料,将提取、萃取及大孔吸附树脂处理得到的10个组分分别进行黄酮含量及α-葡萄糖苷酶抑制活性的测定。结果表明,茶花粉粗提物经萃取后黄酮类物质主要在乙酸乙酯中富集,乙酸乙酯萃取相经大孔树脂层析后50%乙醇洗脱相中的黄酮含量最高(180.17 mg RE/g),当该样品浓度为5 mg/mL时,对α-葡萄糖苷酶的抑制率达82.67%,显著高于其它样品(p<0.05);相关性分析表明,茶花粉黄酮含量与α-葡萄糖苷酶抑制活性呈极显著正相关关系(0.867,p<0.01);酶动力学分析显示蜂花粉黄酮提取物对α-葡萄糖苷酶的半抑制浓度为1.27 mg/mL,抑制类型为可逆非竞争型抑制,抑制常数为1.17 mg/mL。该研究结果为蜂花粉黄酮及α-葡萄糖苷酶天然抑制剂的制备提供理论依据。
茶花粉,黄酮,α-葡萄糖苷酶,相关性,抑制类型
茶花粉是指蜜蜂从茶树花药内采集的花粉球,它含有丰富的不饱和脂肪酸、黄酮、多酚、多糖等活性成分[1]。研究表明茶花粉具有多种生理功能,如Zhang[2]等的研究表明茶花粉乙醇提取物对酪氨酸酶单酚酶及酪氨酸酶双酚酶均有明显的抑制效果,能有效防止黑色素的形成,何晓红[3]等的研究表明茶花粉中具有抗衰老作用的超氧化物歧化酶,董亚婷[4]等发现茶花粉具有较强的抗氧化活性,且抗氧化活性与其多酚含量密切相关。刘伟[5]等发现茶花粉多糖能够显著降低糖尿病小鼠的血糖水平。虽然有关蜂花粉的生物活性研究已经取得了长足的进步,但相关研究还不够深入。
α-葡萄糖苷酶抑制剂是一类新型的口服降血糖药物,可有效抑制小肠体内的α-葡萄糖苷酶活性,使摄取的多糖、寡糖和双糖消化变成葡萄糖、果糖等单糖的过程受阻,从而降低血糖水平[6-7],然而,目前用于临床的α-葡萄糖苷酶抑制剂(阿卡波糖、伏格列波糖等)都存在一定的胃肠道副作用,因此,更安全有效的天然α-葡萄糖苷酶抑制剂有待研究开发。
研究表明天然黄酮类物质具有较强的α-葡萄糖苷酶抑制活性,如Kim[8]等发现漆树黄酮提取物浓度50 μg/mL时,对α-葡萄糖苷酶的抑制作用高达98%,Li[9]等的研究发现山楂叶黄酮提取物的α-葡萄糖苷酶抑制活性极强(IC50=7.1 μg/mL),Yao[10]等发现毛菊苣黄酮提取物对α-葡萄糖苷酶的抑制活性与阿卡波糖相当,然而,目前有关茶花粉黄酮抑制α-葡萄糖苷酶活性的研究还未见报道。因此,本文选用茶花粉为原料,研究茶花粉黄酮含量与α-葡萄糖苷酶抑制活性的相关关系,并进一步分析茶花粉黄酮提取物对α-葡萄糖苷酶抑制作用的动力学特征。
1 材料与方法
1.1材料与仪器
茶花粉由北京市华林蜂业有限公司提供,经粉碎后过100目筛,烘干备用。
磷酸氢二钾、磷酸二氢钾、氯化钠、无水碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠、对硝基苯酚、石油醚、乙酸乙酯、正丁醇、乙醇国药集团,以上试剂均为分析纯;芦丁、pNPG、α-葡萄糖苷酶美国Sigma公司。
HH-4数显恒温水浴锅上海精宏实验设备有限公司;LA120S电子分析天平赛多利斯科学仪器厂;FE-20台式酸度测定仪梅特勒-托利多仪器有限公司;WCJ-802磁力加热搅拌器国华电器有限公司;Water Aspirator旋转蒸发器上海亚荣生化仪器厂;WFJ7200紫外可见分光光度计尤尼柯仪器有限公司;Fluosear荧光酶标仪德国BMG LABTECH公司。
1.2实验方法
1.2.1样品的制备茶花粉粗提物及萃取相的制备:取干燥粉碎的茶花粉1 kg,按料液比1∶10(m∶v)的比例添加无水乙醇,于50 ℃水浴条件下浸提6 h,提取3次,合并提取液,离心取上清,40 ℃减压浓缩成浸膏,得茶花粉乙醇提取物;按1∶5比例加入蒸馏水复溶茶花粉提取物浸膏,然后依次用石油醚、乙酸乙酯、正丁醇萃取,每相萃取4次,将各相于50 ℃下减压浓缩干燥,得石油醚相、乙酸乙酯相、正丁醇相和残余水相,均置于4 ℃冷藏备用。
茶花粉黄酮的分离富集:取上述黄酮含量最高的乙酸乙酯相,按1∶5的比例加蒸馏水溶解,加入AB-8型大孔吸附树脂,置于30 ℃ 180 r/min摇床中吸附24 h,将吸附后的树脂装柱,依次用10%、30%、50%、70%、90%的乙醇洗脱,均洗脱5个柱体积,收集各洗脱组分,50 ℃减压浓缩至干,得大孔树脂10%、30%、50%、70%及90%乙醇洗脱相,放置于4 ℃冷藏备用。
1.2.2黄酮含量的测定称取芦丁20.0 mg,用无水乙醇定容至50 mL,得0.4 mg/mL芦丁母液,分别取0、1、2、3、4、5 mL芦丁母液依次加入0~5号25 mL比色管中,蒸馏水稀释体积至10 mL,摇匀,加入1 mL 5%的亚硝酸钠,摇匀,静置6 min;加入1 mL 10%的硝酸铝,摇匀后静置6 min,再加入5 mL 1 mol/mL的氢氧化钠,用无水乙醇定容至25 mL,摇匀,于510 nm下测定吸光值。以芦丁溶液浓度(μg/mL)为横坐标x,吸光值为纵坐标y,绘制标准曲线,测定的标准曲线为:y=0.0102x-0.0019(R2=0.9997)。
1.2.3α-葡萄糖苷酶抑制活性测定取112 μL pH6.8的磷酸盐缓冲液及20 μL 0.2 U/mL的α-葡萄糖苷酶液于96孔板中,分别加入8 μL不同浓度的待测样品,37 ℃恒温10 min后加入2.5 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷(pNPG)20 μL,37 ℃恒温反应15 min。再加入0.2 mol/L的Na2CO3水溶液80 μL,于405 nm波长下测OD值。以阿卡波糖为阳性对照。茶花粉提取物对α-葡萄糖苷酶抑制率为:抑制率(%)=[1-(A1-A2)/(A3-A4)]×100,式中,A1为酶液+样品测得的吸光度值;A2为磷酸盐缓冲液+样品测得的吸光度值;A3为酶液+溶剂测得的吸光度值;A4为磷酸盐缓冲液+溶剂测得的吸光度值,根据不同浓度下的抑制率计算半抑制剂量(IC50)[11]。
1.2.4茶花粉总黄酮含量与α-葡萄糖苷酶抑制活性的相关系数研究由方法1.2.1制备的茶花粉乙醇提取物、石油醚相、乙酸乙酯相、正丁醇相、残余水相及大孔树脂不同浓度乙醇(10%、30%、50%、70%、90%)洗脱相这10个组分的黄酮含量与α-葡萄糖苷酶抑制活性之间的相关关系,采用SPSS 19.0分析软件进行分析。
1.2.5茶花粉黄酮对α-葡萄糖苷酶抑制动力学特征研究固定底物pNPG浓度为2.5 mmol/L,在不添加和添加茶花粉黄酮提取物(0、0.5、1、1.5、2 mg/mL)的情况下,测定不同α-葡萄糖苷酶浓度(0.1,0.2,0.3,0.4,0.5 U/mL)下的酶促反应初速度,以反应初速度对酶浓度作图,判断可逆或不可逆抑制类型。
如果上述抑制类型为可逆抑制,固定α-葡萄糖苷酶浓度为0.2 U/mL,在不添加和添加茶花粉黄酮提取物(0、0.5、1、1.5、2 mg/mL)条件下,测定了不同pNPG浓度下(0.125、0.25、0.5、1、2 mmol/mL)反应体系的反应速率,绘制Lineweaver-Burk曲线并判断其具体抑制类型。
1.2.6数据分析与统计方法实验数据通过SPSS 19.0(IBM公司,美国)分析软件进行处理,数据均采用平均值±标准偏差表示,方差分析采用邓肯法(p<0.05),相关性分析采用pearson法。
2 结果与讨论
2.1茶花粉不同样品黄酮含量及其对α-葡萄糖苷酶抑制活性
2.1.1不同溶剂萃取相黄酮含量及其对α-葡萄糖苷酶的抑制活性将茶花粉乙醇提取物、萃取相及残余水相分别浓缩成浸膏后,测定各浸膏的黄酮含量,结果见表1。根据表1可知,茶花粉乙醇提取物经不同极性溶剂萃取后,各组分中的黄酮含量差异较大,其中乙酸乙酯相和正丁醇相中的黄酮含量分别为80.58 mg RE/g和57.57 mg RE/g,均显著高于其它组分(p<0.05)。黄酮类化合物是在自然界中分布非常广泛的一类天然产物[12],本文茶花粉中黄酮经萃取后主要在乙酸乙酯及正丁醇中富集,即茶花粉黄酮的极性主要与乙酸乙酯及正丁醇相似。孙岩等[13]用不同溶剂萃取油菜蜂花粉中的黄酮发现,油菜蜂花粉黄酮同样主要富集在正丁醇相和乙酸乙酯相中。

表1 茶花粉不同溶剂萃取相总黄酮含量及α-葡萄糖苷酶抑制活性Table 1 Flavonoids content and α-glucosidase inhibitory of different solvent extracts of Camellia bee pollen
注:同一行中不同字母表示数值之间具有有显著性差异(p<0.05),黄酮含量指的是各相提取物浸膏中的黄酮含量,表2同。

表2 AB-8型大孔吸附树脂不同浓度乙醇洗脱相中的黄酮含量及α-葡萄糖苷酶抑制活性Table 2 Flavonoids content and α-glucosidase inhibitory of fractions eluted from columns packed with the AB-8 resins
用无水乙醇将上述样品均复溶为5 mg/mL的溶液,分别测定各溶液对α-葡萄糖苷酶的抑制活性(表1)。结果显示,各样品的活性大小顺序为:乙酸乙酯萃取相>正丁醇萃取相=乙醇提取物>水相>石油醚相(p<0.05),即茶花粉乙醇提取物经萃取后,乙酸乙酯相的活性提高显著,但正丁醇相的活性与乙醇提取物相比没有显著性差异,而残余水相及石油醚相的活性显著低于乙醇提取物(p<0.05)。由于乙酸乙酯相的黄酮含量及α-葡萄糖苷酶抑制活性均高于其他组分,本文进一步对乙酸乙酯相进行大孔吸附树脂层析,并研究大孔树脂分离组分的黄酮含量及α-葡萄糖苷酶抑制活性。
2.1.2大孔吸附树脂分离组分的黄酮含量及其α-葡萄糖苷酶抑制活性乙酸乙酯萃取相经AB-8型大孔吸附树脂吸附后,依次用浓度为10%、30%、50%、70%、90%的乙醇溶液进行洗脱,将各洗脱组分浓缩成浸膏,分别测定各浸膏的黄酮含量,结果表明(表2),随着乙醇浓度的提高,各洗脱相中的黄酮含量先增加后降低,且各洗脱相中的黄酮含量差异显著,其中10%和90%乙醇洗脱相中的黄酮含量最低,而50%乙醇洗脱相中的黄酮含量最高(180.17 mg RE/g),这说明极性较高的低浓度乙醇(10%)和极性相对较低的高浓度乙醇(90%)对茶花粉黄酮的吸附效果均较弱,而极性介于这两者之间的50%乙醇对茶花粉黄酮的吸附效果较佳。
用无水乙醇将各洗脱组分的浸膏均复溶至浓度为5 mg/mL的溶液,测定各溶液的α-葡萄糖苷酶抑制活性。结果表明(表2),50%乙醇洗脱相的α-葡萄糖苷酶抑制活性最大,10%和90%乙醇洗脱相的活性最小(p<0.05)。比较发现,这5个组分的黄酮含量大小与α-葡萄糖苷酶抑制活性大小顺序一致。且表1显示,黄酮含量较高的乙酸乙酯相、正丁醇相的α-葡萄糖苷酶抑制活性也较高,这说明茶花粉黄酮与其α-葡萄糖苷酶抑制活性关系密切。为进一步明确茶花粉黄酮与α-葡萄糖苷酶抑制活性之间的相关关系,将前文研究的茶花粉组分的黄酮含量与α-葡萄糖苷酶抑制活性做相关性研究。
2.2茶花粉黄酮含量与α-葡萄糖苷酶抑制活性的相关系数
将前文研究的10种茶花粉组分(茶花粉乙醇提取物、石油醚相、乙酸乙酯相、正丁醇相、残余水相及大孔树脂10%,30%,50%,70%,90%乙醇洗脱相)的黄酮含量与α-葡萄糖苷酶抑制活性做相关性研究,结果显示(表3),各样品的α-葡萄糖苷酶抑制活性与黄酮含量呈极显著正相关,相关系数为0.867(p<0.01),有研究表明[14],芦丁对α-葡萄糖苷酶的抑制活性随着芦丁浓度的增加而增加,孙岩等[13]研究发现,当油菜蜂花粉提取物中总黄酮含量达到一定程度后,油菜蜂花粉黄酮含量与油菜蜂花粉的α-葡萄糖苷酶抑制作用呈明显正相关关系。本研究结果显示,茶花粉各样品的黄酮含量与α-葡萄糖苷酶抑制活性呈极显著正相关关系,因此可推测茶花粉中对α-葡萄糖苷酶活性起抑制作用的主要活性因子为黄酮类物质。
2.3茶花粉黄酮提取物对α-葡萄糖苷酶的抑制效果
为研究茶花粉黄酮提取物对α-葡萄糖苷酶的抑制效果,本文以黄酮含量最高的大孔树脂50%乙醇洗脱相为进一步研究对象(将其命名为茶花粉黄酮提取物),测定不同浓度的茶花粉黄酮提取物对α-葡萄糖苷酶的抑制活性,结果(图1)表明:在实验质量浓度0.25~2.5 mg/mL,茶花粉黄酮提取物对α-葡萄糖苷酶均具有一定的抑制作用,且其抑制效果与质量浓度之间具有量效关系。经非线性拟合,得茶花粉黄酮提取物对α-葡萄糖苷酶抑制率的回归方程为:y=-0.3775x2+27.122x+13.218(R2=0.9933,式中:y为α-葡萄糖苷酶抑制率,x为茶花粉提取物浓度),根据此方程计算得到茶花粉黄酮提取物对α-葡萄糖苷酶的半抑制浓度为1.27 mg/mL,略低于阿卡波糖(IC50=0.97 mg/mL)。
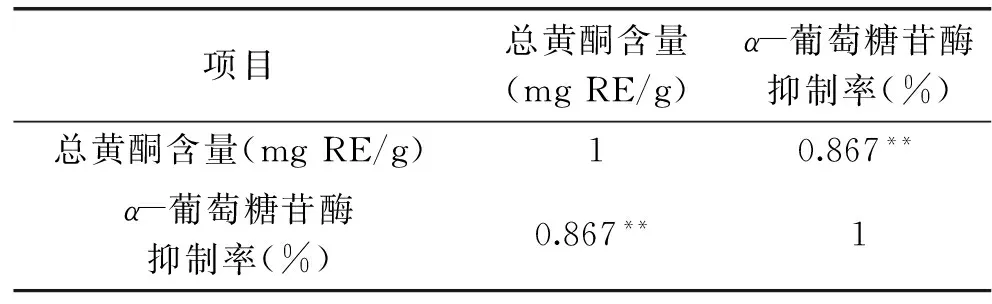
表3 茶花粉总黄酮含量 与α-葡萄糖苷酶抑制活性的相关性Table 3 Correlations between the α-glucosidase inhibitory and flavonoids content of Camellia bee pollen
注:**表示极显著(p<0.01)。
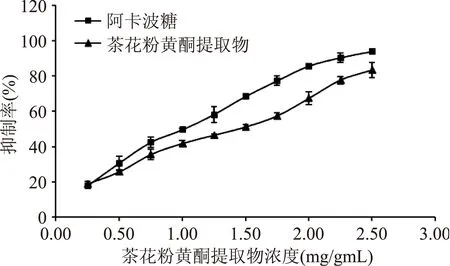
图1 茶花粉黄酮提取物 对α-葡萄糖苷酶的抑制曲线Fig.1 Inhibition curve of flavonoid extract of Camellia bee pollen towards α-glucosidase
2.4茶花粉黄酮提取物抑制α-葡萄糖苷酶的动力学特征
2.4.1抑制类型(可逆或不可逆)的研究茶花粉黄酮提取物对α-葡萄糖苷酶的抑制动力学曲线(图2)表明,在反应体系中加入不同浓度的茶花粉黄酮提取物(0.5,1,1.5,2 mg/mL)后得到四条通过原点但斜率低于未加抑制剂组的直线,且黄酮提取物浓度越大直线的斜率越低,因而茶花粉黄酮对α-葡萄糖苷酶的抑制作用属于可逆抑制类型[15]。
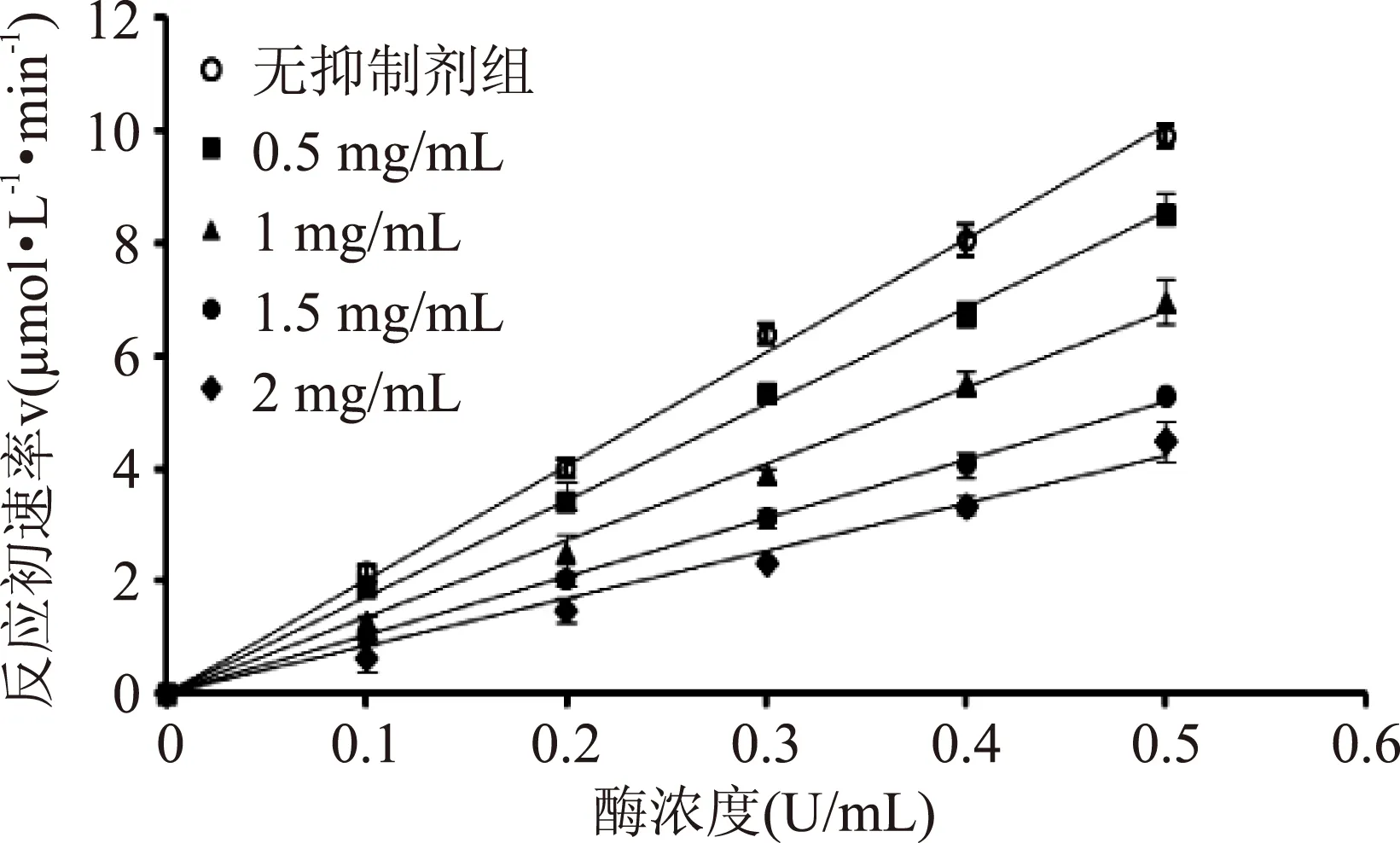
图2 茶花粉黄酮提取物 对α-葡萄糖苷酶抑制动力学曲线Fig.2 Inhibition kinetics curve of flavonoid extract of Camellia bee pollen towards α-glucosidase
2.4.2茶花粉黄酮提取物对α-葡萄糖苷酶的可逆抑制类型利用Lineweaver-Burk作图法研究茶花粉黄酮对α-葡萄糖苷酶的可逆性抑制,由图3可知,在反应体系中加入不同浓度抑制剂(0.5,1,1.5,2 mg/mL)后得到的四条直线与未加抑制剂组的直线相交于横轴,和无抑制剂时相比,当茶花粉黄酮存在时,α-葡萄糖苷酶催化的酶促反应的Vmax变小,但Km(0.294 mmol/L)基本不变,因此推测茶花粉黄酮对α-葡萄糖苷酶为非竞争性抑制类型[16]。根据相关公式可以推出茶花粉黄酮提取物对α-葡萄糖苷酶的抑制常数为1.17 mg/mL。
自然界中,黄酮类化合物广泛存在,但不同来源的黄酮对α-葡萄糖苷酶具有不同的抑制类型,如Phan等[17]的研究表明人参须黄酮对α-葡萄糖苷酶的抑制类型均为混合型,Hlila等[18]的研究表明黄酮类物质为南非山萝卜属植物提取物的主要活性成分,其对α-葡萄糖苷酶的抑制类型为非竞争型。目前国内外尚无茶花粉提取物对α-葡萄糖苷酶抑制类型的研究报道,本实验结果表明茶花粉黄酮对α-葡萄糖苷酶的抑制类型为可逆非竞争型。
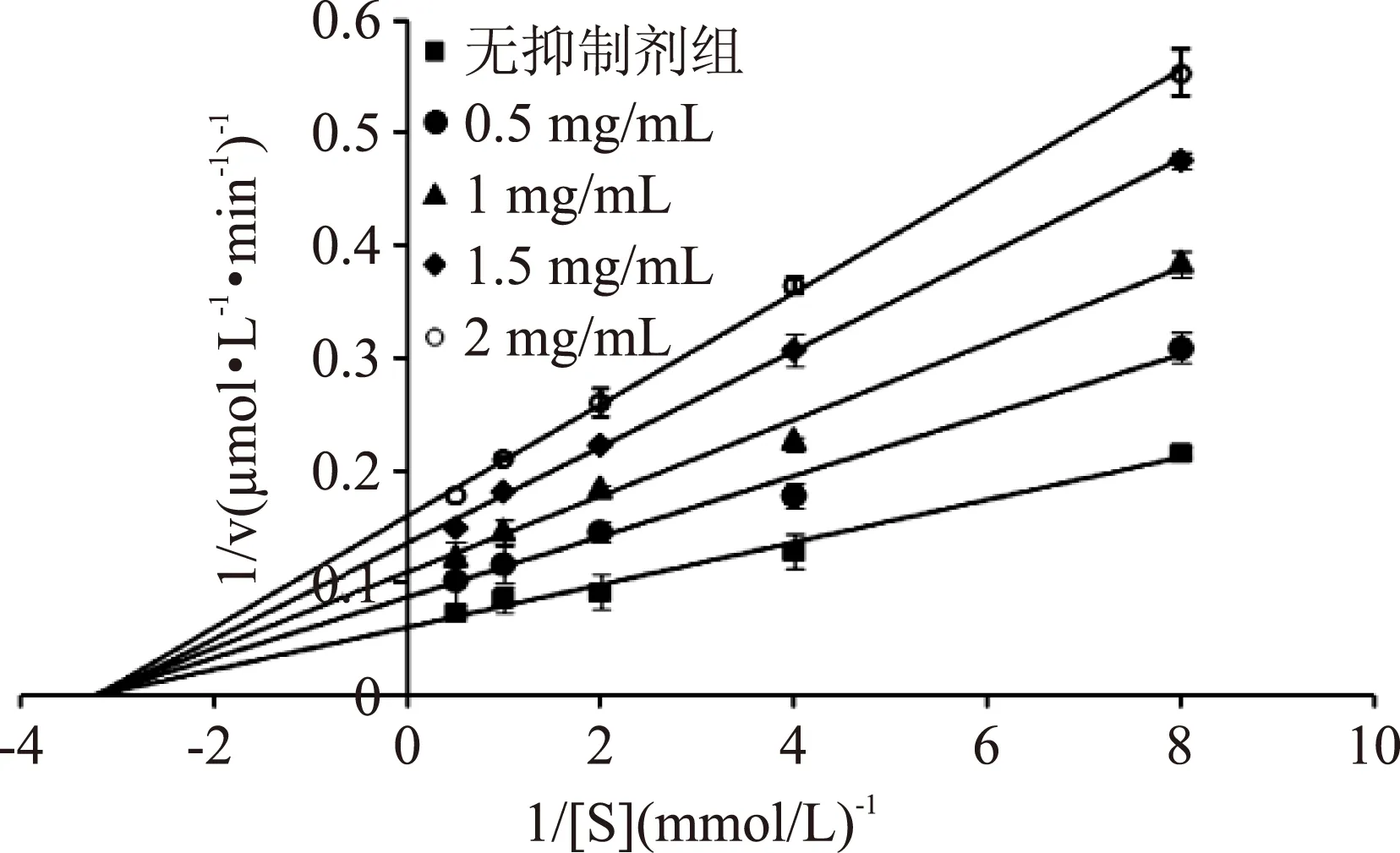
图3 花粉黄酮提取物对α-葡萄糖苷酶 抑制作用的Lineweaver-Burk曲线Fig.3 Lineweaver-Burk plot for inhibition of flavonoid extract of Camellia bee pollen on α-glucosidase
3 结论
通过比较茶花粉提取物、萃取物及大孔吸附树脂洗脱相中的黄酮含量及其α-葡萄糖苷酶抑制活性发现,茶花粉乙醇提取物经不同溶剂萃取后黄酮类物质主要在乙酸乙酯中富集,乙酸乙酯萃取相进一步经大孔树脂层析后,50%乙醇洗脱相中的黄酮含量最高(180.17 mg RE/g),当该样品浓度为5 mg/mL时,对α-葡萄糖苷酶的抑制率达82.67%,显著高于其它样品(p<0.05);相关性分析表明,茶花粉各样品中的黄酮含量与α-葡萄糖苷酶抑制活性呈极显著正相关关系(0.867,p<0.01),酶动力学分析显示,蜂花粉黄酮提取物对α-葡萄糖苷酶半抑制浓度为1.27 mg/mL,抑制类型为可逆非竞争型抑制,抑制常数为1.17 mg/mL。本实验结果说明蜂花粉产品在降血糖等保健产品具有良好的应用前景,同时为开发天然α-葡萄糖苷酶抑制产品提供理论依据。
[1]Krystyjan M,Gumul D,Ziobro R,et al. The fortification of biscuits with bee pollen and its effect on physicochemical and antioxidant properties in biscuits[J]. LWT-Food Science and Technology,2015,63(1):640-646.
[2]Zhang Hongcheng,Wang Xue,Wang Kai,et al. Antioxidant and tyrosinase inhibitory properties of aqueous ethanol extracts from monofloral bee pollen[J]. Journal of Apicultural Science,2015,59(1):119-128..
[3]何晓红,王雪松,陈智博,等. 茶花粉超氧化物歧化酶的性质研究[J]. 食品科学,2006,27(4):85-88.
[4]董亚婷,杨远帆,倪辉,等. 茶花粉酶法破壁工艺提高提取物抗氧化活性及多酚含量[J]. 农业工程学报,2013,29(21):288-294.
[5]刘伟. 山茶蜂花粉多糖的提取及生物活性的研究[D]. 福州:福建农林大学,2008.
[6]Bhandri M R,Jong-anurakkun N,Hong G,et al.α-Glucosidase andα-amylase inhibitory activities of nepalese medicinal herb pakhanbhed(Bergeniaciliata,Haw.)[J]. Food Chemistry,2008,106(1):247-252.
[7]DONG Hua-qiong,LI Mei,ZHU Feng,et al. Inhibitory potential of trilobatin from lithocarpus polystachyus rehd againstα-glucosidase andα-amylase linked to type 2 diabetes[J]. Food Chemistry,2012,130(2):261-266.
[8]Kim J S,Kwon Y S,Chun W J,et al. Rhus verniciflua stokes flavonoid extracts have anti-oxidant,anti-microbial andα-glucosidase inhibitory effect[J]. Food Chemistry,2010,120(2):539-543.
[9]Li H,Song F,Xing J,et al. Screening and structural characterization ofα-glucosidase inhibitors from hawthorn leaf flavonoids extract by ultrafiltration LC-DAD-MS and SORI-CID
FTICR MS[J]. Journal of the American Society for Mass Spectrometry,2009,20(8):1496-1503.
[10]Yao X,Zhu L,Chen Y,et al.Invivoandinvitroantioxidant activity andα-glucosidase,α-amylase inhibitory effects of flavonoids from cichorium glandulosum seeds[J]. Food Chemistry,2013,139(1):59-66.
[11]Li Ting,Zhang Xiaodong,Song Yuwen,et al. A microplate-based screening method for alpha-glucosidase inhibitors[J].Chin J Clin Pharmacol Ther,2005,10(10):1129.
[12]陈丛瑾. 大孔吸附树脂分离纯化黄酮类化合物的研究进展[J]. 化学与生物工程,2011,37(11):1-4.
[13]孙岩,郭庆兴,童群义. 油菜蜂花粉黄酮体外降糖活性研究[J]. 食品工业科技,2015,36(12):122-126.
[14]Yan J,Zhang G,Pan J,et al.α-Glucosidase inhibition by luteolin:kinetics,interaction and molecular docking[J]. International journal of biological macromolecules,2014,64:213-223.
[15]Huang Xiao-hong,Chen Qiong-xi,Wang Qin,et al. Inhibition of the activity of mushroom tyrosinase by alkylbenzoic acids[J]. Food Chemistry,2006,94(1):1-6.
[16]Qian J Y,Bai Y Y,Tang J,et al. Antioxidation andα-glucosidase inhibitory activities of barley polysaccharides modified with sulfation[J]. LWT-Food Science and Technology,2015,64(1):104-111.
[17]Phan M A T,Wang J,Tang J,et al. Evaluation ofα-Glucosidase inhibition potential of some flavonoids from epimedium brevicornum[J]. LWT-Food Science and Technology,2013,53(2):492-498.
[18]Hlila M B,Mosbah H,Majouli K,et al.α-Glucosidase inhibition by tunisian scabiosa arenaria forssk. extracts[J]. International Journal of Biological Macromolecules,2015,77:383-389.
Study onα-glucosidase inhibitory activity of the flavonoids extract fromCamelliabee pollen
LAI Xiao-yan1,JIANG Ze-dong1,2,NI Hui1,2,PENG Wen-jun3,SUN Hao1,DU Xi-ping1,2,XIAO An-feng1,2,YANG Yuan-fan1,2,*
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;2.Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering,Xiamen 361021,China;3.Institute of Apicultural Research,Chinese Academy of Agricultural Sciences,Beijing 100093,China)
In order to investigate theα-glucosidase inhibitory activity ofCamelliabee pollen flavonoids,10 kinds of flavonoid extracts ofCamelliabee pollen prepared by different methods were chosen for flavonoids content andα-glucosidase inhibitory activity tset. The flavonoids content was increased markedly after dispose by AB-8 macroporous resins,the flavonoids content(180.17 mg RE/g)andα-glucosidase inhibitory(82.67%,5 mg/mL)of fractions eluted by 50% ethanol from AB-8 resin were all higher than other fractions. The results of correlation study showed that the correlation between total flavonoids content andα-glucosidase inhibitory activity inCamelliabee pollen was significantly positive(p<0.01)and the correlation coefficient was 0.867. Enzyme dynamic analysis showed that the half-inhibitory concentration(IC50)of flavonoid extract ofCamelliabee pollen onα-glucosidase was determined to be 1.27 mg/mL. The inhibition was detected to belong to noncompetitive reversible inhibition with a inhibition constant(Ki)of 1.17 mg/mL.These results provided a theoretical reference for further comprehensive utilization of flavonoids andα-glucosidase inhibitors from bee pollen.
Camelliabee pollen;flavonoid;α-glucosidase;correlation;inhibition type
2015-08-27
赖小燕(1989-),女,硕士研究生在读,研究方向:食品科学,E-mail:lxy792719953@sina.cn。
杨远帆(1971-),女,博士,副教授,研究方向:食品科学,E-mail:yuanfan@jmu.edu.cn。
国家蜂产业技术体系科研基金项目(30771636);集美大学科研创新团队基金(2010A006)。
TS201.4
A
1002-0306(2016)05-0353-05
10.13386/j.issn1002-0306.2016.05.063
